2. 黑龙江中医药大学中医药教育部重点实验室, 黑龙江 哈尔滨 150040
2. The Ministry of Education(MOE) Key Laboratory of Chinese Medicines, Heilongjiang University of Chinese Medicines, Harbin 150040, China
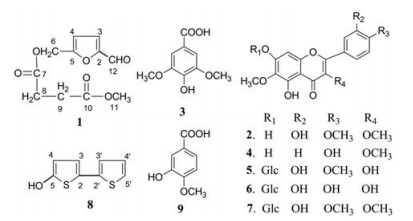
万寿菊(Tagetes erecta L.)为菊科万寿菊属1年生草本植物, 又称非洲金盏花、臭芙蓉等。由于其花具有花形较大、绚丽多彩、易于栽培等特点, 目前已经在世界各地广泛引种。除作为一般观赏花卉外, 该植物的花、叶和根均可入药, 有消热、化痰、补血通经、去淤生新等功效[1]。万寿菊全株提取的精油具有独特香气, 可用于香精、香水的调制, 具有杀菌、消炎和活血通经的功能。其花含有大量的天然色素而受到特别的重视, 目前的研究内容也主要集中在花部, 包括花的挥发油类、黄酮类及噻吩类等化学成分研究。近些年, 多方报道万寿菊作为提取叶黄素的原料种植面积正在不断增大, 万寿菊花作为提取叶黄素的主要部位, 仅占万寿菊全株生物质量的10%左右, 万寿菊的非花部位据报道在农业方面亦有很好的杀虫等生物活性[2], 因此为合理的利用开发生物资源, 从资源学高效利用的角度还是作为将来的天然药物来源之一, 万寿菊其他部位的化学成分研究也必将是建立生物资源效应物质量控制的必然要求。本实验采用硅胶柱色谱、Sephadex LH-20色谱等技术对万寿菊根部进行分离纯化, 并采用波谱法对分离得到的单体化合物进行结构鉴定, 共分离鉴定了9个化合物, 分别鉴定为5-羟甲基糠醛基-甲基-丁二酸酯(1)、5, 7, 3'-三羟基-3, 6, 4'-三甲氧基黄酮(2)、丁香酸(3)、5, 7, 4'-三羟基-3, 6-二甲氧基黄酮(4)、万寿菊素-4'-甲氧基-7-O-β-D-葡萄糖苷(5)、万寿菊苷(6)、5, 3'-二羟基-3, 6, 4'-三甲氧基-黄酮-7-O-β-D-葡萄糖苷(7)、2, 2'-二联噻吩-5-醇(8)和3-羟基-4-甲氧基苯甲酸(9)。其中化合物1为新化合物, 化合物8为首次从天然来源分离得到, 化合物2、4、5、9为首次在该属植物中分离得到(图 1)。通过测定比较不同化合物对大豆胞囊线虫的生物活性及毒力, 发现化合物1~8对大豆胞囊线虫具有毒杀作用, 化合物3和7对大豆胞囊线虫的毒杀作用更强。
|
Figure 1 The chemical structures of some compounds |
化合物1 淡黄色油状, 硅胶TLC检识10%硫酸加热显色呈墨绿色, Molish反应呈阴性; UVλmax = 284 nm, HR-ESI-MS m/z: 279.027 5 [M+K]+(计算值为279.027 1), 提示分子式为C11H12O6, 算得不饱和度为6。在1H NMR (DMSO-d6, 400 MHz)中, δ 9.55 (1H, s, -CHO)处可观察到1个醛基氢质子信号, 7.50 (1H, d, J = 3.5 Hz, H-3)、6.60 (1H, d, J = 3.5 Hz, H-4)分属于2, 5-二取代呋喃环3、4位的氢质子信号, 4.51 (2H, s, 5-CH2O-)为羟甲基质子信号, 未见其他活泼氢质子信号, 因此提示以上为5-羟甲基糠醛而排除了6-amino-1, 2-dihydro-pyridine-3-carbaldehyde基团[3]的存在, 并且其羟甲基有取代; 在3.58 (3H, s, -OCH3)处可观察到一甲氧基氢质子信号, 2.48 (2H, ddd, J = 6.8, 1.8, 0.9 Hz)、2.42 (2H, ddd, J = 6.8, 1.8, 0.9 Hz)处可见两个亚甲基氢质子信号。在13C NMR (DMSO-d6, 100 MHz)中, δ 177.9 (-CHO)、162.2 (C-5)、151.7 (C-2)、124.4 (C-3)、109.6 (C-4)、55.8 (-OCH2-)为5-羟甲基糠醛母核碳信号, 173.6 (C-7)、172.8 (C-10)、28.8 (C-8)、29.2 (C-9)双酯化丁二酸(琥珀酸)的碳信号, 51.3 (-OCH3)为甲酯化甲基碳信号。
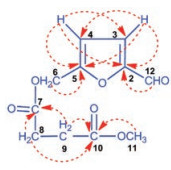
在HMBC中, 可观察到9.55 (1H, s, -CHO)与151.7 (C-2)相关, 提示2位碳为呋喃环上烯碳; 7.50 (1H, d, J = 3.5 Hz, H-3)与162.2 (C-5)、151.7 (C-2)、109.6 (C-4)相关, 6.60 (1H, d, J = 3.5 Hz, 4-H)与162.2 (C-5)、151.7 (C-2)、124.4 (C-3)相关, 提示该部分片段为一对烯碳; 4.51 (2H, s, 5-CH2O)与162.2 (C-5)相关, 提示5位碳为呋喃环上另一烯碳; 3.58 (3H, s, -OCH3)与172.8 (C-10)相关, 提示丁二酸一端甲酯化; 2.48 (2H, ddd, J = 6.8, 1.8, 0.9 Hz)、2.42 (2H, ddd, J = 6.8, 1.8, 0.9 Hz)均与173.6 (C-7)、172.8 (C-10)相关, 提示二者为丁二酸中的亚甲基。具体见图 2。
|
Figure 2 HMBC correlations of compound 1 |
综上, 结合DEPT及其分子式, 化合物1鉴定为5-羟甲基糠醛基-甲基-丁二酸酯(5-hydroxymethylfurfuryl methyl succinate)。具体的NMR数据归属见表 1。
| Table 1 NMR data of compound 1 (400/100 MHz, DMSO-d6) |
通过测定比较不同化合物对大豆胞囊线虫的生物活性及毒力(因化合物9量较少, 故未做活性试验), 结果显示, 化合物1~8对大豆胞囊线虫都具有毒杀作用, 化合物3和7对大豆胞囊线虫的毒杀作用较为显著, EC50均达到了0.008 μg·mL-1。各化合物具体杀虫毒力, 毒力回归方程、95%置信区间等结果见表 2。
| Table 2 Determination of lethality of soybean cyst nematode |
旋转蒸发仪(瑞士BUCHI); ZF-I型三用紫外分析(上海顾村电光仪器厂); SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司); SB-5200D超声波清洗机(宁波新艺生物科技股份有限公司); 柱色谱硅胶、薄层色谱硅胶G/GF254 (青岛海洋化工厂分厂); Sephadex LH-20 (BIOSHARP); 聚酰胺薄膜(浙江省台州市路桥四甲生化塑料厂出品); 二氯甲烷等试剂均为分析纯。
万寿菊原料于2016年6月采自黑龙江省五常市, 经曲中原博士鉴定为菊科万寿菊属植物万寿菊(Tagetes erecta L.), 样品(编号: HLJSD-201706102)保存哈尔滨商业大学药学院。
1 提取与分离万寿菊干燥根G (2.7 kg), 95%乙醇加热回流, 加乙酸乙酯萃取得G1 (16.1 g); 下层水液加水饱和正丁醇萃取得G2 (15.9 g)。取G1采用正相硅胶柱色谱粗分离, 得到5个部分(G1-1~5)。取G1-4部分, 用石油醚-丙酮(5:2)等度洗脱, 得到化合物9 (4.3 mg)。取G1-5部分石油醚-丙酮(5:2)等度洗脱, 得到化合物4 (10.3 mg)。取G1-2依次二氯甲烷、二氯甲烷-甲醇(50:1)梯度洗脱, 得到5个部分。G1-2-4二氯甲烷-甲醇(100:1)等度洗脱, 得3个部分, 其中G1-2-4-2 (1.8 g)中析出黄色沉淀, 为化合物2 (480 mg)。取G1-3, 用二氯甲烷-甲醇(100:1)等度洗脱, 得到4个部分(G1-3-1~G1-3-4), G1-3-2 (1.48 g)用甲醇溶解, 经葡聚糖凝胶LH-20柱色谱分别得到化合物3 (13.6 mg)、化合物8 (9.1 mg)及化合物4 (0.28 g)。取G2以二氯甲烷-甲醇(50:1~20:1)采用正相硅胶柱(200~300目)色谱粗分离, 得到8个部分(G2-1~G2-8)。G2-4中析出沉淀, G2-6二氯甲烷-甲醇(20:1)等度洗脱, 再经葡聚糖凝胶LH-20柱(内径1.5 cm, 柱高95 cm)色谱分离, 得到化合物7 (12.1 mg); G2-7分别用少量甲醇溶解, 经葡聚糖凝胶LH-20柱色谱分离, 得到化合物5 (14.5 mg)、6 (10.6 mg)和1 (7.11 mg)。
2 结构鉴定化合物1 淡黄色油状。UV λmax = 284 nm, HR-ESI-MS m/z: 279.027 5 [M+K]+。1H NMR和13C NMR数据见表 1。
化合物2 淡黄色粉末。HR-ESI-MS m/z: 361.092 7 [M+H]+。1H NMR (DMSO-d6, 400 MHz) δ 7.56 (1H, d, J = 8.4 Hz, H-6'), 7.54 (1H, brs, H-2'), 7.10 (1H, d, J = 8.4 Hz, H-5'), 6.54 (1H, s, H-8), 3.87 (3H, s, 4'-OCH3), 3.79 (3H, s, 3-OCH3), 3.76 (3H, s, 6-OCH3)。13C NMR (DMSO-d6, 100 MHz) δ 155.3 (C-2), 137.6 (C-3), 178.2 (C-4), 152.4 (C-5), 131.1 (C-6), 157.4 (C-7), 93.9 (C-8), 151.5 (C-9), 104.6 (C-10), 122.3 (C-1'), 114.9 (C-2'), 146.3 (C-3'), 150.2 (C-4'), 111.9 (C-5'), 120.3 (C-6'), 59.7 (3-OCH3), 59.9 (6-OCH3), 55.6 (4'-OCH3)。经与文献[4]数据比较, 鉴定化合物2为5, 7, 3'-三羟基-3, 6, 4'-三甲氧基黄酮。
化合物3 无色针晶(MeOH)。ESI-MS m/z: 197.0 [M-H]-。1H NMR (CD3OD, 400 MHz) δ 7.32 (2H, s, H-2, 6), 3.88 (6H, s, -OCH3×2)。13C NMR (CD3OD, 100 MHz) δ 122.6 (C-1), 108.3 (C-2, 6), 148.8 (C-3, 5), 141.5 (C-4), 170.4 (-COOH), 56.8 (-OCH3)。经与文献[5]比较, 鉴定化合物3为丁香酸。
化合物4 淡黄色粉末。HR-ESI-MS m/z: 331.081 4 [M+H]+。1H NMR (DMSO-d6, 400 MHz) δ 7.94 (2H, dd, J = 6.9, 1.9 Hz, H-2', 6'), 6.95 (2H, dd, J = 6.9, 1.9 Hz, H-3', 5'), 6.55 (1H, s, H-8), 3.78 (3H, s, 3-OCH3), 3.76 (3H, s, 6-OCH3)。13C NMR (DMSO-d6, 100 MHz) δ 155.6 (C-2), 137.2 (C-3), 178.1 (C-4), 152.4 (C-5), 131.1 (C-6), 157.2 (C-7), 93.9 (C-8), 151.5 (C-9), 104.6 (C-10), 120.6 (C-1'), 130.1 (C-2', 6'), 115.6 (C-3', 5'), 160.1 (C-4'), 60.6 (3-OCH3), 60.3 (6-OCH3)。经与文献[6]比较, 鉴定化合物4为5, 7, 4'-三羟基-3, 6-二甲氧基黄酮。
化合物5 淡黄色粉末。ESI-MS m/z: 507.1 [M-H]-。1H NMR (DMSO-d6, 400 MHz) δ 7.71 (1H, d, J = 2.2 Hz, H-2'), 7.65 (1H, dd, J = 8.5, 2.2 Hz, H-6'), 6.96 (1H, s, H-8), 6.95 (1H, d, J = 8.5 Hz, H-5'), 5.13 (1H, d, J = 7.6 Hz, Glc-1), 3.86 (3H, s, -OCH3), 3.78 (3H, s, -OCH3)。13C NMR (DMSO-d6, 100 MHz) δ 147.2 (C-2), 136.1 (C-3), 176.2 (C-4), 146.1 (C-5), 129.6 (C-6), 151.4 (C-7), 93.9 (C-8), 149.5 (C-9), 105.0 (C-10), 123.3 (C-1'), 115.4 (C-2'), 147.1 (C-3'), 151.1 (C-4'), 111.7 (C-5'), 119.8 (C-6'); Glc: 100.1 (C-1), 73.2 (C-2), 76.6 (C-3), 69.5 (C-4), 77.2 (C-5), 60.6 (C-6), 60.3 (-OCH3), 55.6 (-OCH3)。经与文献[7]比较, 鉴定化合物5为万寿菊素-4'-甲氧基-7-O-β-D-葡萄糖苷。
化合物6 淡黄色粉末。ESI-MS m/z: 493.2 [M-H]-。1H NMR (DMSO-d6, 400 MHz) δ 7.72 (1H, d, J = 2.2 Hz, H-2'), 7.55 (1H, dd, J = 8.4, 2.2 Hz, H-6'), 6.93 (1H, d, J = 8.4 Hz, H-5'), 6.89 (1H, s, H-8), 5.12 (1H, d, J = 7.6 Hz, Glc-1), 3.76 (3H, s, H-OCH3)。13C NMR (DMSO-d6, 100 MHz) δ 147.7 (C-2), 129.6 (C-3), 176.1 (C-4), 151.3 (C-5), 131.7 (C-6), 156.3 (C-7), 93.8 (C-8), 151.0 (C-9), 104.9 (C-10), 115.5 (C-2'), 145.0 (C-3'), 147.9 (C-4'), 115.3 (C-5'), 119.9 (C-6'); Glc: 100.1 (C-1), 73.2 (C-2), 76.7 (C-3), 69.5 (C-4), 69.5 (C-5), 60.6 (C-6), 60.3 (-OCH3)。经与文献[8]比较, 鉴定化合物6为万寿菊苷。
化合物7 淡黄色粉末。HR-ESI-MS m/z: 523.146 7 [M+H]+。1H NMR (DMSO-d6, 400 MHz) δ 7.57 (1H, s, H-2'), 7.55 (1H, dd, J = 8.8 Hz, H-6'), 7.12 (1H, d, J = 8.8 Hz, H-5'), 6.97 (1H, s, H-8), 5.13 (1H, d, J = 7.2 Hz, Glc-1), 3.87 (3H, s, 4'-OCH3), 3.80 (3H, s, 3-OCH3), 3.76 (3H, s, 6-OCH3)。13C NMR (DMSO-d6, 100 MHz) δ 156.5 (C-2), 137.9 (C-3), 178.3 (C-4), 152.0 (C-5), 132.2 (C-6), 156.0 (C-7), 94.1 (C-8), 151.3 (C-9), 106.2 (C-10), 122.2 (C-1'), 115.1 (C-2'), 146.3 (C-3'), 150.3 (C-4'), 111.9 (C-5'), 120.4 (C-6'); Glc: 100.1 (C-1), 73.2 (C-2), 77.2 (C-3), 69.5 (C-4), 76.6 (C-5), 60.6 (C-6), 60.3 (6-OCH3), 59.7 (3-OCH3), 55.6 (4'-OCH3)。经与文献[9, 10]对比, 鉴定化合物7为5, 3'-二羟基-3, 6, 4'-三甲氧基-黄酮-7-O-β-D-葡萄糖苷。
化合物8 淡黄色油状。ESI-MS m/z: 164.0 [M-H2O]-。1H NMR (DMSO-d6, 400 MHz) δ 7.58 (1H, dd, J = 1.0, 5.1 Hz, H-5'), 7.52 (1H, d, J = 3.8 Hz, 4-H), 7.42 (1H, dd, J = 1.0, 3.6 Hz, H-3'), 7.28 (1H, d, J = 3.8 Hz, H-3), 7.12 (1H, dd, J = 3.6, 5.1 Hz, H-4')。13C NMR (DMSO-d6, 100 MHz) δ 141.2 (C-2), 124.2 (C-3), 132.3 (C-4), 163.0 (C-5), 135.9 (C-2'), 12, 5.1 (C-3'), 128.5 (C-4'), 126.5 (C-5')。经与文献[11]对比, 鉴定化合物8为2, 2'-二联噻-5-醇([2, 2'-biththiophen]-5-ol)。
化合物9 无色针晶(MeOH), mp 248~250 ℃。ESI-MS m/z: 167.0 [M-H]-。1H NMR (CD3OD, 400 MHz) δ 7.53 (1H, dd, J = 2.1, 8.4 Hz, H-6), 7.43 (1H, d, J = 2.1 Hz, H-2), 6.97 (1H, d, J = 8.4 Hz, H-5), 3.90 (3H, s, 4-OCH3)。13C NMR (CD3OD, 100 MHz) δ 124.4 (C-1), 117.3 (C-2), 153.3 (C-3), 147.3 (C-4), 111.7 (C-5), 123.7 (C-6), 56.4 (-OCH3), 169.9 (-COOH)。经与文献[12]对比, 鉴定化合物9为3-羟基-4-甲氧基苯甲酸。
3 化合物对大豆胞囊线虫的毒杀作用通过测定比较不同化合物对大豆胞囊线虫的生物活性及毒力。化合物溶液用线虫J2悬浮液稀释, 24 h后观察记录线虫J2的死亡率。化合物9由于量较少, 未做杀虫活性评价。结果显示化合物1~8化合物对大豆胞囊线虫都具有毒杀作用, 化合物3和7对大豆胞囊线虫的毒杀作用较为明显。
| [1] | Tan MW, Li GY, Lv XY, et al. Review of Tagetes erecta L. on the components and pharmacological action[J]. Inf Tradit Chin Med (中医药信息), 2017, 34: 138–141. |
| [2] | Hu ZF. Study on insecticidal and antibacterial activity of marigold[J]. Bull Biol (生物学通报), 2017, 52: 52–54. |
| [3] | Wang QH, Han JJ, Bao BYMQ, et al. Structure elucidation and NMR assignments of an alkaloid from Ixeris chinensis Nakai[J]. Nat Prod Res, 2017, 31: 159–162. DOI:10.1080/14786419.2016.1224866 |
| [4] | Lu P, Wu JM, Chen LJ, et al. Chemical constituents from Laggera pterodonta[J]. J Chin Med Mater (中药材), 2014, 37: 816–819. |
| [5] | Zhang YJ, Nie H, Zhou DX, et al. Chemical constituents of Mallotus conspurcatu[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 2172–2176. |
| [6] | Meng FT, Tan CY, Bolaiti MK, et al. Study on chemical constituents of Echinops integrifolius[J]. Chin Pharm J (中国药学杂志), 2014, 49: 539–542. |
| [7] | Li RT, Ding ZH, Ding JW. Chemical constituents form Eupatorium adenophorum[J]. Acta Bot Yunnan (云南植物研究), 1997, 19: 96–100. |
| [8] | Zhang M, Liu WL, Gao X, et al. Study on chemical constituents from Eupatorium adenophorum Spreng[J]. J Trop Subtrop Bot (热带亚热带植物学报), 2015, 23: 697–702. |
| [9] | Wang XY, Chen GR, Deng ZY, et al. Studies on chemical constituents of Bidens pilosa[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 1838–1844. |
| [10] | Xiao CY, Li WY, Zhai XX, et al. Prenylated flavonoids from the roots of Artocarpus heterophyllus[J]. Acta Pharm Sin (药学学报), 2018, 53: 592–597. |
| [11] | Wang Y, Li X, Meng DL, et al. Thiophenes from Echinops latifolius[J]. J Asian Nat Prod Res, 2006, 8: 585–588. DOI:10.1080/10286020500176724 |
| [12] | Chen YP, Wang ZP, Zheng HH, et al. A new caffeate compound from Nardostachys chinensis[J]. Acta Pharm Sin (药学学报), 2016, 51: 100–104. |
 2019, Vol. 54
2019, Vol. 54


