2. 解放军302医院全军中医药研究所, 北京 100039;
3. 解放军302医院非感染性肝病诊疗与研究中心, 北京 100039;
4. 解放军302医院中西医结合诊疗与研究中心, 北京 100039
2. China Military Institute of Chinese Medicine, 302 Military Hospital, Beijing 100039, China;
3. Treatment and Research Center for Non-infectious Liver Diseases, 302 Military Hospital, Beijing 100039, China;
4. Integrative Medicine Center, 302 Military Hospital, Beijing 100039, China
药物性肝损伤(drug-induced liver injury, DILI)为临床常见的严重药物不良反应之一, 其中约有15%~20%会进展为慢性化DILI[1, 2], 而慢性化DILI (chronic drug-induced liver injury, CH-DILI)往往0.5~1年内即可发展为重度肝硬化[3], 临床预后较差。慢性药物性肝损伤相关肝硬化(drug-induced liver cirrhosis, LC-DILI)尚无特效治疗, 关键在于早期诊断和发现。然而, 临床上缺乏早期诊断LC-DILI的方法, 极大地限制了临床医生对LC-DILI的早期发现和有效治疗。早期药物性肝硬化患者由于肝脏的代偿作用, 可无症状或症状轻微, 与慢性药物性肝损伤较难区分。目前肝硬化的早期诊断主要依靠超声影像诊断联合实验室生化指标, 但超声诊断肝硬化仍存在灵敏度不足、准确性不高等局限, 同时实验室指标不具有特征性, 组间差异不明显。肝硬化诊断的金标准是肝脏穿刺病理, 但该诊断方法为有创检查, 并且部分患者因禁忌证不适合做肝脏穿刺病理检查。肝脏穿刺病理检查也不适合作为动态监测和早期筛查LC-DILI的方法。因此, LC-DILI早期诊断发现已成为当前临床药物安全性评价和肝病领域亟需解决的疑难问题之一, 亟待寻找更为简易快速的诊断方法, 监测慢性药物性肝病的进展情况, 为临床早期发现和确诊DILI发展阶段提供辅助诊断参考。为此, 本文采用代谢组学的方法系统表征LC-DILI的代谢组特征谱, 通过筛查LC-DILI与CH-DILI的差异特征生物标志物, 为早期发现有肝硬化倾向的DILI患者提供辅助参考, 指导医生及时干预, 避免患者不必要的身体损伤和经济损失。
材料与方法一般资料 病例样本来源:检索中国人民解放军第302医院2015年10月~2017年5月非感染科药物性肝损伤病例数据库, 依据中华医学会肝病学分会药物性肝病学组发布的《药物性肝损伤诊治指南》[4]和中华中医药学会《中草药相关肝损伤临床诊疗指南》[5]对病例进行评价入组。其中纳入的肝硬化患者经肝脏穿刺病理检查确诊。采用回顾性分析进行统计分析, 共49例样本纳入本研究。所有研究对象皆签署知情同意书, 研究方案通过医院伦理委员会批准。
仪器与试剂 美国Agilent Technology 1290 Infinity HPLC高效液相色谱仪; Agilent Technology iFunnel 6550 Q-TOF LC/MS四级杆串联飞行时间质谱; 1290二极管阵列检测器(G4212A); Agilent Masshunter工作站(美国Agilent公司)。甲醇(色谱级, 德国Merck公司); 冷冻离心机(德国Sigma公司); 涡旋混匀器(HYQ 2121A)。
色谱条件 色谱柱: Agilent ZORBAX 300 SB-C18 column (2.1 mm×100 mm, 1.8 μm)。检测波长:全波长扫描190~400 nm; 柱温: 30 ℃; 样品温度: 4 ℃; 流动相A:乙腈(0.1%甲酸), 流动相B:水(0.1%甲酸+5%乙腈), 流速: 0.30 mL·min-1; 进样量: 4 μL。色谱梯度洗脱条件: 0~1 min, 5% (A); 1~9 min, 5%~40% (A); 9~19 min, 40%~90% (A); 19~21 min, 90%~100% (A); 21~25 min, 100% (A)。
质谱条件 采用电喷雾电离(ESI)离子源, 在负离子模式下数据采集范围m/z 50~1 200, 采集模式: ESI Continuum模式。毛细管电压2.2 kV (正离子2.5 kV), 锥孔电压40 V, 源温130 ℃, 脱溶剂气温度: 350 ℃, 锥孔气流量50 L·h-1, 脱溶剂气流量800 L·h-1, 质量数校正:亮氨酸脑啡肽(正离子模式下m/z 121.050 9和922.009 8;负离子模式下m/z 112.985 587和1033.988 109), 质量浓度100 pg·mL-1, 流速10 mL·min-1, 采样频率每次10 s。质量轴校正:甲酸钠溶液(质量精度误差 < 5 ppm); 正离子条件同负离子。
临床标本的处理 将存放于-80 ℃冰箱中DILI血清样品, 4 ℃复融, 精密吸取200 μL置于EP管中, 加入3倍量预冷的甲醇稀释, 涡旋混匀, 在4 ℃下以12 000 r·min-1离心10 min, 用1 mL注射器吸取上清液, 过0.22 μm微孔滤膜, 即为备用样品; 质控样品(QC)是从每个待分析的样本取10 μL混匀制备所得。
数据处理统计学分析 所有数据均由安捷伦Masshunter Profinder软件进行预处理, 并根据分子特征选取峰高超过300的化合物, 以CSV格式导入MetaboAnalyst 3.0在线分析软件进行进一步数据过滤和归一化处理, 将归一化得到数据导入SIMCA-P 13.0软件进行主成分分析(PCA)和正交校正偏最小二乘法-判别分析(OPLS-DA), PCA作为一种无监督的模式识别方法, 通过将分散在变量中的信息集中到主成分上来描述数据内部结构, 得到PCA得分图直观显示不同组别生物体代谢模式的变化, 具有相同或相似状态的样本处于相近的位置。筛选出具有显著性差异的化合物(P < 0.05且fold change > 1.5), 结合VIP和|p(corr)|筛选, 将正负离子筛选出的差异代谢物在Human Metabolome Database和Mass Hunter PCDL Manager (MHPM)等生物学数据库进行比对筛查鉴定和代谢通路富集分析。
采用IBM SPSS Statistics 21.0进行统计分析, 符合正态分布的计量资料用x± s表示, 组间比较采用独立样本T检验; 不符合正态分布的计量资料用M (Q1, Q3)表示, 组间比较采用非参数检验。
结果 1 临床特征分析病例分析(表 1)显示:入组的49例慢性化DILI患者的年龄分布为19~79岁, 平均年龄51.0岁, 男女比例为1:5, 其中慢性药物性肝损伤未肝硬化组(chronic-DILI, CH-DILI) 34例, 慢性药物性肝损伤相关肝硬化组(liver cirrhosis-DILI, LC-DILI) 15例。在肝功能生化指标中, LC-DILI较CH-DILI在总胆红素(total bilirubin, TBil)、直接胆红素(direct bilirubin, DBil)、免疫球蛋白A (immunoglobulin A, IgA)、国际标准化比值(international normalized ratio, INR)显著升高(P < 0.05)。因为肝脏是胆红素代谢的主要器官, 肝硬化导致的肝细胞损伤进而影响胆红素的摄取、分泌和排泄, 进而导致血清胆红素增高。INR反映凝血时间的长短, 肝硬化患者往往INR较高, 凝血功能较差。两组患者年龄均集中在40~60岁, 女性居多。
| Table 1 Clinical characteristics of chronic drug-induced liver injury (CH-DILI) and liver cirrhosis-drug-induced liver injury (LC-DILI) groups. *The positive rate of autoantibodies, which including antinuclear antibody, smooth muscle antibody, antimitochondrial antibodies, anti-parietal cell antibody; P value: CH-DILI vs LC-DILI |
在本研究中, 主要采用非靶向代谢组学研究。代谢分析方法的细节, 包括样品制备、LC/MS分析和代谢数据提取等见上述方法学部分。PCA分析(图 1A、B)所示, 在正、负离子共同模式下, QC样本聚集在得分矩阵投影图中间附近位置, 显示样本分析过程稳定。另外, 可观察到在正离子模式下, CH-DILI组和LC-DILI组能较好地区分, 表明两组之间存在较明显的代谢水平差异。通过OPLS-DA模型的分析, 在正离子模式下R2X = 0.507, 模型预测能力Q2Y = 0.776, 样本符合模型判别; 在负离子模式下, R2X = 0.534, Q2Y = 0.467, 表明拟合模型的准确度和预测度均良好。寻找两组之间的差异性变量(图 1C、D), 选出具有显著性差异的代谢物作为生物标志物(P≤0.05且fold change > 1.5), 结合VIP > 1和|p(corr)| > 0.5筛选, 将差异代谢物在总离子流图中标注, 得到代谢特征谱(图 1E)。
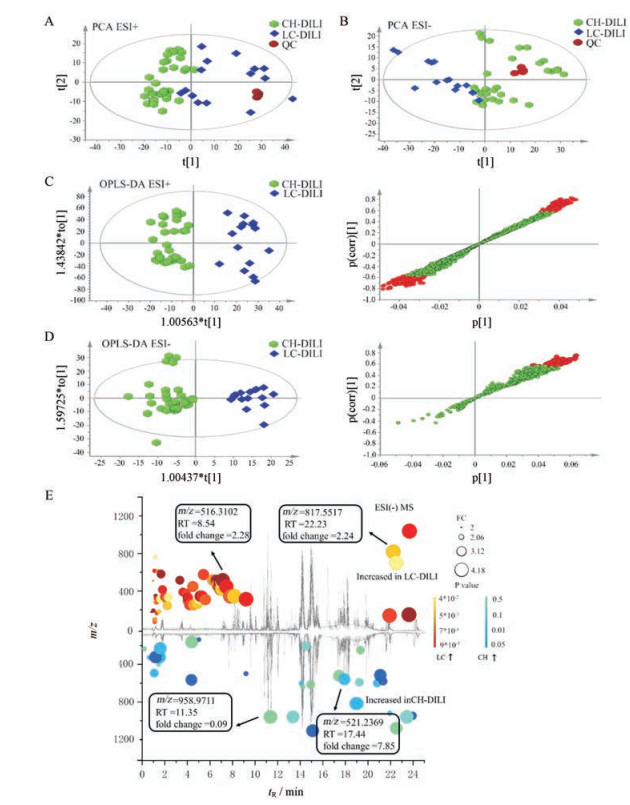
|
Figure 1 Metabolomic analysis of chronic drug-induced liver injury. A, B: PCA score plots of different groups in ESI+ mode or ESI- mode; C, D: OPLS-DA scores plot and S-plot of plasma metabolic profiles using the date from significantly changed metabolites among CH-DILI group vs LC-DILI group; E: Cloud plot showing metabolite features (represented by bubbles) whose level vary significantly between CH-DILI and LC-DILI serum (P < 0.05, fold change > 1.5). The fold change is used as radius scale of each bubble. Darker color of the bubble indicates lower P-value |
将正负离子筛选出的差异代谢物在Human Metabolome Database和Mass Hunter PCDL Manager(MHPM)等生物学数据库进行比对筛查, 质量误差限定为15 ppm[6, 7], 共找到35个差异代谢物。将鉴定出的差异代谢物通过Metaboanalyst进行通路富集, 通路富集结果见图 2A。为了探讨差异代谢物之间的潜在联系, 根据皮尔森公式计算代谢物之间相关系数, 根据相关系数值大于0.6, 筛选出高度相关的差异代谢物, 通过Cytoscape软件构建了相关系数代谢通路网络图(图 2B)。综合来看, CH-DILI与LC-DILI的差异代谢物主要富集在初级胆汁酸代谢、脂质代谢等代谢通路上, 其中, 胆汁酸代谢、糖代谢和氨基酸代谢等在LC-DILI组表现为代谢上调。
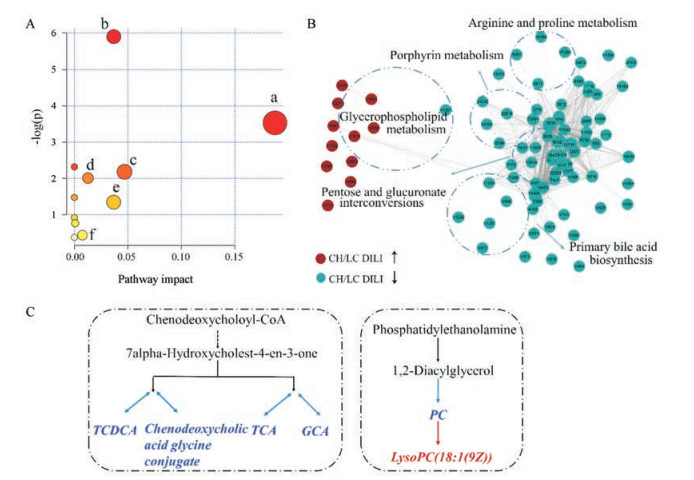
|
Figure 2 Metabolic pathway analysis. A: Schematic diagram of the disturbed metabolic pathway related to CH-DILI and LC-DILI. Pathway a indicated pentose and glucuronate interconversions; Pathway b indicated primary bile acid biosynthesis; Pathway c indicated glycerophospholipid metabolism; Pathway d indicated porphyrin metabolism; Pathway e indicated arginine and proline metabolism; Pathway f indicated tryptophan metabolism; B: Correlation coefficient network diagram of metabolic pathways; C: Differential metabolic pathways of bile acids and lipids |
通过对代谢通路中的候选生物标志物(表 2)进行热图分析, 发现部分差异代谢物能较好地区分CH-DILI和LC-DILI (图 3A), 结果提示对药物性肝硬化有一定的辅助诊断功能, 同时在某种程度上也可以解释慢性DILI机制差异。将这些差异代谢物进行ROC曲线分析, 有5个差异代谢物对于两组区分效果较好(AUC > 0.6), 分别是磷脂酰胆碱(phosphatidylcholine, PC)、肌酸(creatine)、牛磺鹅去氧胆酸(taurochenodeoxycholic acid, TCDCA)、牛磺胆酸(taurocholic acid, TCA)和lysoPC (18:1 (9Z)) (图 3B)。此外, 结果可见磷脂代谢物的区分效果最好。为了进一步提高生物标志物临床区分诊断LC-DILI的适用性, 避免不同实验室仪器差异及样本处理过程的操作误差, 本研究采用相对定量的方法(图 3D), 将差异代谢物的峰面积做比值进行相对定量, 结果发现磷脂类代谢物峰面积比值的区分效果较好, 即磷脂酰胆碱与其下游代谢产物溶血卵磷脂lysoPC (18:1 (9Z))进行峰面积比值相对定量, 相较于单独的磷脂酰胆碱和溶血卵磷脂, 相对定量区分CH-DILI和LC-DILI效果更好, AUC为0.867 (图 3E)。
| Table 2 Identification biomarkers for CH/LC DILI pathway. FC: Fold change |
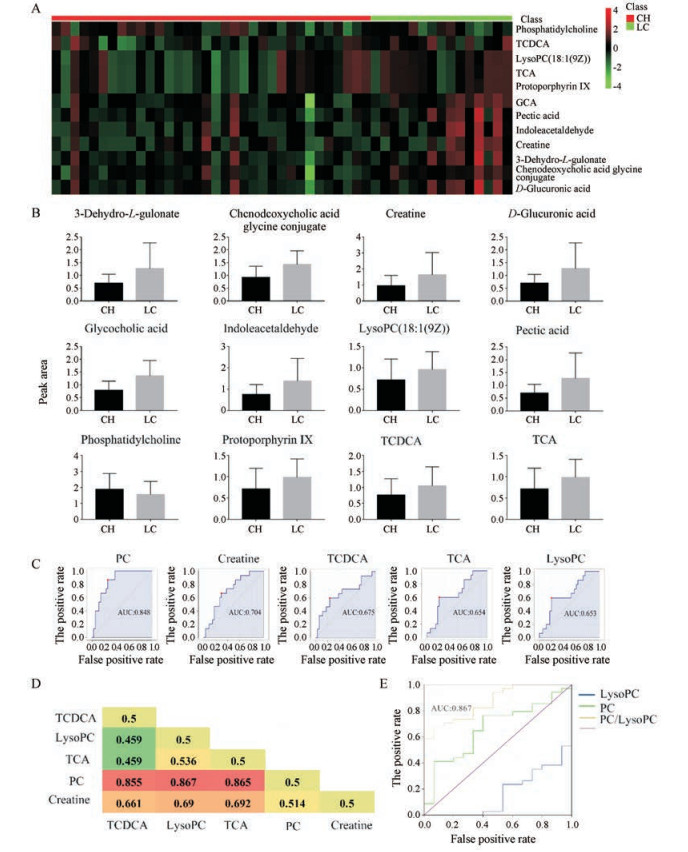
|
Figure 3 Analysis of related metabolites in pathway. A: Clustered heat map analysis of differential metabolites in CH-DILI and LC-DILI, the colors represent the contents in each of differentially expressed; B: Histogram of metabolites content; C: The ROC curve of potential metabolites biomarkers associated with CH-DILI and LC-DILI (AUC > 0.6); D: AUC of the metabolites peak area ratio; E: AUC of the relative ratio of the phospholipid metabolites area |
肝硬化是药物性肝损伤从肝脏急性炎症反应和损伤阶段进入慢性化并最终发展为终末期阶段。而由于肝脏具有较强的功能代偿能力, 处在代偿期的慢性DILI肝硬化患者(LC-DILI)与未肝硬化的慢性DILI患者(CH-DILI)具有类似的临床特征, 个别生化指标差异对于区分两种疾病阶段不具有临床意义, 结果可能导致出现早期代偿期肝硬化转变为失代偿期肝硬化的后果, 临床预后很差。肝脏穿刺病理检查是肝硬化诊断的金标准, 但是肝脏穿刺病理检查与患者依从性及患者禁忌证有关, 临床往往难以实施; 并且由于是有创检查, 难以作为LC-DILI的动态监测及早期诊断方法。因此, 亟需一种无创、准确的方法以筛查慢性DILI可能出现肝硬化的患者。代谢组学能够反映机体对病理、生理及基因改变引起的代谢变化, 在疾病诊断、病理学、药物安全性评价等临床研究方面显示出明显的优势。患者血清样本在检测转氨酶等生化指标的同时, 少量血清样本即可用来检测代谢组学生物标志物, 对于早期发现和辅助诊断LC-DILI和动态监测DILI进展具有重要临床价值。通过本实验研究发现CH-DILI与LC-DILI的代谢组学特征谱存在较大差异(图 1E), 说明LC-DILI存在特定的代谢模式。为了寻找两组间的差异, 将筛选出的差异化合物与HMDB、METLIN数据库对比分析, 结果显示差异代谢物主要为脂质、胆汁酸、糖类、原卟啉, 将这些代谢物通过MetaboAnalyst数据库进行代谢通路富集分析, 显示差异代谢通路为初级胆汁酸代谢、脂质代谢等代谢通路, 其中, LC-DILI较CH-DILI在胆汁酸、糖类代谢等代谢通路水平上调, 溶血卵磷脂代谢下调(图 2B)。
有研究表明, 肝硬化与脂代谢密切相关, 慢性肝病会导致机体内脂质轮廓的改变, 肝脏纤维化会导致脂质组成的改变, 造成肝脏功能的紊乱[8, 9]。在LC-DILI患者中发现胆汁酸含量相对CH-DILI升高。代谢组学进一步研究表明, 急性失代偿肝硬化患者血清中牛磺胆酸、甘氨胆酸、牛磺鹅脱氧胆酸等胆汁酸均明显高于对照组代偿性肝硬化患者血清, 同时发现牛磺胆酸是肝硬化中变化最大的胆汁酸[10-12]。胆汁淤积在肝硬化晚期很常见, 胆汁淤积可引起血清胆汁酸升高[13, 14], 胆汁酸诱导肝细胞凋亡和坏死, 导致肝硬化或肝功能衰竭[15]。相对于CH-DILI组, LC-DILI组的肌酸水平显著升高(表 2), 一些研究认为肝细胞内肌酸积累导致肝毒性损伤及明显的肝炎性病变[16, 17], 肝细胞内肌酸积累导致细胞内毒性物质的生成, 如甲醛和甲胺[18-20]。LC-DILI组较CH-DILI组的原卟啉IX (PPIX)水平升高, 在正常生理条件下, 肝内PPIX快速进行生物转化或转运, 其在肝脏中的浓度非常低; 而一旦肝损伤发生, 肝脏对PPIX的清除进一步受到损害, 血浆和红细胞中PPIX的水平可逐渐增加, 胆汁成分发生改变[21], PPIX在肝脏积累会导致进一步的炎症, 加速对肝细胞和胆管细胞的损害, 可引起胆汁淤积性肝损伤, 肝中PPIX的积累也会诱导氧化应激, 增加肝损伤的风险[22]。
由此可见, 代谢组学筛选发现的上述差异代谢物与慢性DILI相关肝硬化的发生机制密切相关, 从中进一步筛选可能具有辅助诊断能力的生物标志物, 对于早期发现慢性化DILI肝硬化患者具有较好的前景和现实意义。为此, 通过ROC曲线对代谢物的区分效果进行预测, 发现有5个差异代谢物的区分效果较好(AUC均大于0.6)。其中, 脂质能更好地区分DILI的两种疾病阶段, 如phosphatidylcholine AUC为0.848。然而, 在临床上应用生物标志物区分诊断疾病时如采用绝对定量, 则需要高度纯化的代谢物作为对照品, 获得难度和成本较高; 此外, 生物标志物绝对定量的实验结果往往受仪器和操作等因素影响, 对不同实验室检测结果的重现性要求较高。因此, 本研究考虑可采用两个代谢物的峰面积比值进行相对定量, 以期提高候选生物标志物的可应用性和稳健性。通过对所发现的5个代谢物进行两两组合构建峰面积比值后ROC分析(图 3D), 结果显示卵磷脂(上调)与溶血卵磷脂(下调)的峰面积比值AUC最高(达0.867), 区分CH-DILI与LC-DILI能力比两个代谢物单独应用的效果更好, 同时还可以更好地避免因仪器和操作不稳定等实验因素造成的系统误差, 具有更稳健的临床应用价值, 因此可以将两个脂质相对定量作为临床上辅助诊断CH-DILI与LC-DILI的生物标志物组合。后续将在更大样本临床队列中对所发现的候选生物标志物进行验证。
| [1] | Stine JG, Chalasani N. Chronic liver injury induced by drugs: a systematic review[J]. Liver Int, 2015, 35: 2343–2353. DOI:10.1111/liv.12958 |
| [2] | Church RJ, Kullakublick GA, Aubrecht J, et al. Candidate biomarkers for the diagnosis and prognosis of drug-induced liver injury: an international collaborative effort[J]. Hepatology, 2019, 69: 760–773. DOI:10.1002/hep.29802 |
| [3] | Fontana RJ, Hayashi PH, Barnhart H, et al. Persistent liver biochemistry abnormalities are more common in older patients and those with cholestatic drug induced liver injury[J]. Am J Gastroenterol, 2015, 110: 1450–1459. DOI:10.1038/ajg.2015.283 |
| [4] | Yu YC, Mao YM, Chen CW, et al. Study of Drug Induced Liver Disease of Chinese Medical Association. Diagnosis and treatment guideline on drug-induced liver injury[J]. J Clin Hepatol (临床肝胆病杂志), 2015, 31: 1752–1769. |
| [5] | Guo YM, Wang JB, Zhu Y, et al. Interpretation on guideline for diagnosis and treatment of herb-induced liver injury[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 3551–3559. |
| [6] | Wei Z, Xi J, Gao S, et al. Metabolomics coupled with pathway analysis characterizes metabolic changes in response to BDE-3 induced reproductive toxicity in mice[J]. Sci Rep, 2018, 8: 5423–5439. DOI:10.1038/s41598-018-23484-2 |
| [7] | Li CY, Tu C, Gao D, et al. Metabolomic study on idiosyncratic liver injury induced by different extracts of Polygonum multiflorum in rats integrated with pattern recognition and enriched pathways analysis[J]. Front Pharmacol, 2016, 7: 483–494. |
| [8] | Schmitz G, Ruebsaamen K. Metabolism and atherogenic disease association of lysophosphatidylcholine[J]. Atherosclerosis, 2010, 208: 10–18. DOI:10.1016/j.atherosclerosis.2009.05.029 |
| [9] | Tu C, He Q, Zhou YY, et al. Metabolomic study on the hepatotoxic or hepatoprotective effects of rhubarb to normal or hepatic fibrosis rats[J]. Acta Pharm Sin (药学学报), 2018, 53: 1139–1147. |
| [10] | Horvatits T, Drolz A, Roedl K, et al. Serum bile acids as marker for acute decompensation and acute-on-chronic liver failure in patients with non-cholestatic cirrhosis[J]. Liver Int, 2017, 37: 224–231. DOI:10.1111/liv.13201 |
| [11] | Liu Z, Zhang Z, Huang M, et al. Taurocholic acid is an active promoting factor, not just a biomarker of progression of liver cirrhosis: evidence from a human metabolomic study and in vitro experiments[J]. BMC Gastroenterol, 2018, 18: 112–121. DOI:10.1186/s12876-018-0842-7 |
| [12] | Li CY, He Q, Tang JF, et al. Metabolomic study on immunological stress-mediated hepatotoxicity of Polygonum multiflorum and its processed products of nine times steaming and nine times sunning[J]. Acta Pharm Sin (药学学报), 2017, 52: 57–64. |
| [13] | Wang X, Xie G, Zhao A, et al. Serum bile acids are associated with pathological progression of hepatitis B-induced cirrhosis[J]. J Proteome Res, 2016, 15: 1126–1134. DOI:10.1021/acs.jproteome.5b00217 |
| [14] | Jüngst C, Berg T, Cheng J, et al. Intrahepatic cholestasis in common chronic liver diseases[J]. Eur J Clin Invest, 2013, 43: 1069–1083. DOI:10.1111/eci.12128 |
| [15] | Zhou C, Jia HM, Liu YT, et al. Metabolism of glycerophospholipid, bile acid and retinol is correlated with the early outcomes of autoimmune hepatitis[J]. Mol Biosyst, 2016, 12: 1574–1585. DOI:10.1039/C6MB00092D |
| [16] | Wyss M, Schulze A. Health implications of creatine: can oral creatine supplementation protect against neurological and atherosclerotic disease?[J]. Neuroscience, 2002, 112: 243–260. DOI:10.1016/S0306-4522(02)00088-X |
| [17] | Clayton TA, Lindon JC, Everett JR, et al. Hepatotoxin-induced hypercreatinaemia and hypercreatinuria: their relationship to one another, to liver damage and to weakened nutritional status[J]. Arch Toxicol, 2004, 78: 86–96. DOI:10.1007/s00204-003-0515-2 |
| [18] | Poortmans JR, Kumps A, Duez P, et al. Effect of oral creatine supplementation on urinary methylamine, formaldehyde, and formate[J]. Med Sci Sports Exerc, 2005, 37: 1717–1720. DOI:10.1249/01.mss.0000176398.64189.e6 |
| [19] | Yu PH, Deng Y. Potential cytotoxic effect of chronic administration of creatine, a nutrition supplement to augment athletic performance[J]. Med Hypotheses, 2000, 54: 726–728. DOI:10.1054/mehy.1999.0938 |
| [20] | Lima-Cabello E, García-Mediavilla MV, Miquilena-Colina ME, et al. Enhanced expression of pro-inflammatory mediators and liver X-receptor-regulated lipogenic genes in non-alcoholic fatty liver disease and hepatitis C[J]. Clin Sci, 2011, 120: 239–250. DOI:10.1042/CS20100387 |
| [21] | Meerman L, Koopen NR, Bloks V, et al. Biliary fibrosis associated with altered bile composition in a mouse model of erythropoietic protoporphyria[J]. Gastroenterology, 1999, 117: 696–705. DOI:10.1016/S0016-5085(99)70464-6 |
| [22] | Lee RG, Avner DL, Berenson MM. Structure-function relationships of protoporphyrin-induced liver injury[J]. Arch Pathol Lab Med, 1984, 108: 744–746. |
 2019, Vol. 54
2019, Vol. 54


