目前癌症已成为影响公众健康的主要因素[1], 其中肾癌位居世界上泌尿系统恶性肿瘤第三位, 约占人类癌症的3%, 其转移率及死亡率高, 严重威胁人类生命[2]。由于肾癌对化疗、放疗等治疗措施不敏感, 目前临床上的治疗药物多为索拉非尼(sorafenib)、依维莫司等小分子靶向药物, 但由于随之产生的耐药性和不良反应, 常影响这些药物的治疗效果[3]。中药作为中国传统药物与化疗药物联合使用后, 可同时作用于多个通路, 在增强化疗药的抗肿瘤药效的同时, 还可减轻化疗药物的不良反应及避免耐药性的产生, 因此中药联合索拉非尼等靶向药物治疗癌症具有广阔的应用前景[4]。黄芪包含黄芪皂苷、黄芪总黄酮和黄芪多糖等多种成分, 其中异鼠李素是黄芪总黄酮的成分之一[5, 6], 目前关于异鼠李素(isorhsmnetin)治疗肿瘤的研究较少, 本文主要是探讨异鼠李素与索拉非尼联合后对小鼠肾癌的抑制作用及作用机制。
材料与方法细胞 人肾癌细胞株A498、人肾癌细胞株Caki-1、人肾癌细胞株786-O、人肾癌细胞株786-P和小鼠肾癌Renca细胞由Teh Bin Tean教授(DUKE-NUS Medical School Singapore)馈赠。
动物 雄性BABL/c小鼠, 体重16.0~18.0 g, 购自北京华阜康生物科技股份有限公司, 许可证号: SCXK (京) 2014-0004。
药物 异鼠李素(成都克洛玛生物科技有限公司, 批号: CHB160712), 索拉非尼(上海蓓琅生物科技有限公司, 批号: 284461-73-0)。
试剂与仪器 DMEM培养基、胰酶购自Gibco公司, RPMI-1640培养基由北京钮因华信科技发展有限公司提供, 胎牛血清购自北京元享圣马生物技术研究所。青霉素钠盐及硫酸链霉素购自华北制药股份有限公司。乙二胺四乙酸钠(EDTA)、二甲基亚砜(DMSO)、无水甲醇、异丙醇由北京化工厂生产。十二烷基磺酸钠(SDS)、过硫酸铵、聚丙烯酰胺、Tween-20、焦碳酸二乙酯、苯甲基磺酰氟(PMSF)、琼脂糖、甘氨酸购自美国Sigma公司。溴化四氮唑蓝(MTT)、RIPA组织/细胞裂解液、BCA蛋白浓度测定试剂盒及溴酚兰购自北京索莱宝科技有限公司。牛血清白蛋白(BSA)购自美国Amresco公司。抗体购于美国Cell Signaling Technology公司; 辣根过氧化物酶标记的山羊抗兔和山羊抗鼠二抗由中杉金桥生物技术有限公司提供。ECL超敏显色剂由北京普利莱公司提供。WD-2102A型酶标仪购自北京六一仪器厂; IX70倒置显微镜购自OLYMPUS公司; 生物分子成像仪LAS4000购自美国GE公司。
分组与模型制备 无菌条件下剥离接种于小鼠腋下的Renca肿瘤, 剔除筋膜, 匀浆研磨, 按1:5比例用无菌生理盐水稀释成每毫升5.0×107个的细胞悬液, 每只小鼠腋下注射0.2 mL, 次日进行称重分组[5]。实验共分为16组, 分别为溶剂对照组、索拉非尼给药组(20.0 mg·kg-1)、黄芪各成分(芒柄花素、异鼠李素、山奈酚、紫云英苷、黄芪甲苷、环黄芪醇和黄芪多糖)给药组, 剂量均为50.0 mg·kg-1; 以及7个成分(50.0 mg·kg-1)分别与索拉非尼(20.0 mg·kg-1)联合给药组。
给药方法 溶剂对照组小鼠灌胃20% PEG400 0.4 mL/20.0 g, 每天1次; 索拉非尼组、单药组小鼠灌胃药物0.4 mL/20.0 g, 每天1次; 联合给药组小鼠分别灌胃索拉非尼和单药各0.4 mL/20.0 g, 每天1次, 接种后给药12天。索拉非尼用水、蓖麻油、无水乙醇按1:1:6比例配制, 黄芪各成分用20% PEG400配制。
MTT法测定肿瘤细胞增殖变化 取对数生长期的肿瘤细胞用胰酶消化, 配成每毫升3×104个的细胞悬液, 每孔100 μL加入96孔板中, 24 h后每孔分别加入100 μL不同浓度的异鼠李素或索拉非尼及合用药物, 溶剂对照组加入对应的培养基, 每个浓度设置3个平行孔, 37 ℃培养120 h后弃上清, 每孔加入0.5 mg·mL-1 MTT溶液100 μL, 37 ℃培养4 h后弃上清, 每孔加入200 μL DMSO, 震荡均匀后570 nm测定吸光度值(OD570)。以加入培养基的肿瘤细胞为溶剂对照组, 按以下公式计算异鼠李素和索拉非尼对肿瘤细胞增殖的抑制作用, 并计算IC50。抑制率(%) = (OD溶剂对照组-OD给药组)/ OD溶剂对照组×100%。以上实验重复3次。联合效应采用“一带一线法”的联合指数(CI)方法进行评价[6]。
小鼠Renca肾癌移植瘤实验 实验结束后处死小鼠, 称体重, 剥离肿瘤组织并称重, 根据肿瘤重量计算肿瘤生长抑制率(%), 用均值±标准差(x ± s)表示, 并进行各给药组与溶剂对照组之间、联合给药组与索拉非尼组之间的t检验, 肿瘤组织置于-80 ℃保存用于后续实验需要[7]。所有的动物实验均严格遵循中国医学科学院药物研究所动物实验中心标准操作规程, 减少动物实验对动物造成的伤害。
Western blot实验检测蛋白变化 取小鼠Renca肾癌移植瘤实验中-80 ℃冰箱保存的肿瘤组织, 每组3只(溶剂对照组、索拉非尼给药组、异鼠李素给药组、异鼠李素和索拉非尼联合给药组), 匀浆研磨, 称重后按1:10比例加入组织裂解液, 冰上裂解1 h后12 000 r·min-1离心15 min, 取上清于-80 ℃保存备用。蛋白按4:1体积比例加入loading buffer于95 ℃加热25 min后进行SDS-聚丙烯酰胺凝胶电泳及蛋白电转移。将含有蛋白的PVDF膜在含有5%脱脂奶粉的TBST (0.1% Tween-20, 10 mmol·L-1 Tris-HCl, pH 7.5, 150 mmol·L-1 NaCl)中室温封闭非特异结合位点1 h。将膜与稀释的指定的一抗4 ℃孵育过夜, 次日TBST洗膜3次, 每次10 min。将膜转入二抗中(用TBST液按1:5 000稀释HRP标记的二抗), 室温反应1 h。TBST洗膜3次, 每次10 min, 加入化学发光底物反应液, ECL照相系统中显影照相。
小鼠体内淋巴细胞增殖实验 将各药物处理组小鼠颈椎脱位处死后, 无菌取出小鼠脾脏, 将脾在研钵中磨碎, 将细胞悬液移入塑料离心管; 2 000 r·min-1离心5 min, 用1 mL RPMI-1640培养基混匀后计数; 调整细胞浓度至每毫升1×107个, 以每孔100 μL加入96孔细胞培养板中[含刀豆蛋白A (ConA) 3.0 μg·mL-1, 或者脂多糖(LPS) 5.0 μg·mL-1]。将96孔细胞培养板放入细胞培养箱, 37 ℃、5% CO2继续培养48 h。培养结束前4 h, 以每孔50 μL加入MTT稀释液(2.0 mg·mL-1), 继续培养至48 h。3 000 r·min-1, 离心10 min使淋巴细胞沉淀, 轻轻倾去细胞培养液。加入DMSO, 每孔150 μL。充分振荡后, 在检测波长570 nm条件下测定光密度值(OD)。
统计学方法 采用Excel 2010软件分析处理实验数据, 计量资料用均值±标准差(x ± s)表示, 进行单因素方差分析, 以P < 0.05为差异有统计学意义。
结果 1 黄芪各成分及联合索拉非尼对小鼠肾癌移植瘤Renca的生长抑制作用采用小鼠移植瘤模型研究黄芪各成分及联合索拉非尼后对Renca肾癌的生长抑制作用, 结果表明黄芪各成分可较弱地抑制小鼠Renca肾癌生长; 其中50.0 mg·kg-1异鼠李素对Renca肾癌抑制率为26.9%, 20.0 mg·kg-1索拉非尼对小鼠Renca肾癌生长抑制率为40.0% (P < 0.05), 而50.0 mg·kg-1异鼠李素与20.0 mg·kg-1索拉非尼联合时抑制率达到60.7% (P < 0.05, 与单独使用索拉非尼组相比), 表明异鼠李素与索拉非尼具有协同作用, 异鼠李素可增强索拉非尼对小鼠Renca肾癌的生长抑制作用, 而黄芪中其他成分与索拉非尼联合使用后对肾癌生长抑制作用不如异鼠李素明显。见图 1, 表 1。

|
Figure 1 Antitumor activity of compounds of Astragalus combined with sorafenib on the tumor growth in mouse Renca xenograft model |
| Table 1 The effect of compounds of Astragalus combined with sorafenib on the tumor growth in mouse Renca xenograft model. *P < 0.05, **P < 0.01 vs control; △P < 0.05 vs sorafenib. IR: Inhibition rate |
鉴于异鼠李素联合索拉非尼抑制小鼠肾癌移植瘤生长的作用强于其他成分, 故本研究将对异鼠李素及异鼠李素与索拉非尼联合应用抗肾癌的作用及机制进行研究。采用MTT检测120 h后异鼠李素对肾癌细胞的生长抑制作用, 结果显示异鼠李素对肾癌细胞A498、786-O和Renca细胞株的生长具有一定的抑制作用, IC50分别是(31.7 ± 15.2)、(28.8 ± 2.8)、(106.0 ± 5.7) μmol·L-1, 而对Caki-1和786-P的抑制作用较弱。见表 2。
| Table 2 The effect of isorhamnetin and sorafenib on the prolife-ration of renal cancer cells |
用异鼠李素、索拉非尼及不同浓度的二者联合作用于将Renca细胞, 用Origin 8.5软件中的Logistic程序拟合单药和联合用药生长曲线, 并用“一带一线法”进行分析[8], 发现异鼠李素与索拉非尼联合时会增加索拉非尼对Renca细胞株的增殖抑制作用, 索拉非尼对Renca细胞株的IC50由(26.1 ± 4.6) μmol·L-1降至(12.0 ± 0.6) μmol·L-1。从图 2可以看出在低剂量范围内曲线低于曲带, 表明异鼠李素与索拉非尼呈现拮抗效应; 在中剂量范围内曲线在曲带内, 表明两化合物呈现相加效应; 在高剂量范围内曲线高于曲带, 表明两化合物呈现协同效应。具体计算见表 3, [f (S+SI)表示以索拉非尼为目标药时通过等效剂量兑换得到的索拉非尼与异鼠李素联合的预期相加效应, g (I+IS)表示以异鼠李素为目标药时通过等效剂量兑换得到的索拉非尼与异鼠李素联合的预期相加效应]。
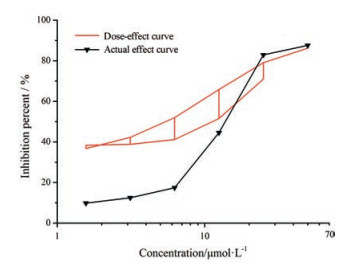
|
Figure 2 Expected additive effect curve and actual effect curve of isorhamnetin combined with sorafenib on Renca cells |
| Table 3 Combination index (CI) of isorhamnetin combined with sorafenib. (3) and (4) was calculated by "One Belt and One Line Method"[8], (5) was observed by the MTT assay, (6): (5)/(3); (7): (5)/(4); "-" represented no value. f (S+SI): The expected addictive effect of isorhamnetin combined with sorafenib by the equivalent dose conversion when the sorafenib was the target drug; g (I+IS): The expected addictive effect of isorhamnetin combined with sorafenib by the equivalent dose conversion when the isorhamnetin was the target drug |
索拉非尼作为多靶点抑制剂, 主要通过抑制AKT/mTOR和c-Raf/MEK/ERK信号通路来影响肿瘤细胞增殖和侵袭[9]。为探讨异鼠李素联合索拉非尼后对肾癌的作用机制, 本文采用Western blot方法检测药物作用后组织中蛋白水平的变化。AKT/mTOR信号通路在肿瘤的发展过程中与细胞的增殖代谢和血管生成密切相关[10], 因此先检测该通路中相关蛋白变化, 结果表明50.0 mg·kg-1异鼠李素可显著降低肿瘤组织中AKT、mTOR和S6K的磷酸化水平, 对AKT总蛋白水平影响不明显, 但显著降低mTOR总蛋白的表达, 且对AKT、mTOR、S6K蛋白表达的影响强于索拉非尼组; 50.0 mg·kg-1异鼠李素和20.0 mg·kg-1索拉非尼联合使用时可增强索拉非尼对蛋白表达的抑制作用, 联合给药组中p-AKT、p-mTOR和p-S6K的表达都低于单独使用索拉非尼组。进一步检测肾癌组织中HIF-1α和VEGF的变化[11], 结果显示异鼠李素降低HIF-1α蛋白水平, 且降低程度强于索拉非尼组, 与索拉非尼联合后可增加索拉非尼对HIF-1α的抑制作用, 而异鼠李素对VEGF的抑制作用与索拉非尼相当, 联合后抑制作用并未增加, 提示异鼠李素与索拉非尼联合后通过增加对AKT/mTOR信号通路的抑制作用来加强索拉非尼对肾癌细胞增殖抑制作用, 并通过抑制HIF-1α和VEGF的表达抑制肿瘤血管生成, 见图 3。
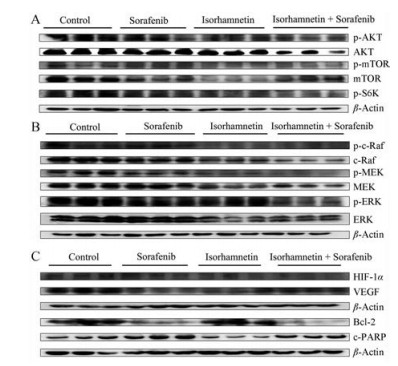
|
Figure 3 The effect of isorhamnetin combined with sorafenib on the related protein expression in Renca cells xenograft tumors by Western blot analysis. A: AKT/mTOR signaling pathway; B: c-Raf/MEK/ERK signaling pathway; C: The proteins related to the cell apoptosis and angiogenesis |
c-Raf/MEK/ERK信号通路影响肿瘤细胞增殖和细胞凋亡, 在肿瘤的发展中发挥至关重要作用[12], 因此进一步检测异鼠李素及与索拉非尼联合后肾癌组织中此通路相关蛋白变化。异鼠李素可抑制c-Raf、MEK的磷酸化, 作用强于索拉非尼, 且c-Raf和MEK总蛋白水平也降低, 异鼠李素与索拉非尼联合后对p-c-Raf, p-MEK和p-ERK均具有一定的抑制作用。进一步检测Bcl-2和c-PARP等凋亡相关蛋白变化[13], 异鼠李素不引起凋亡蛋白的明显变化, 索拉非尼可降低Bcl-2水平, 上调c-PARP水平, 而异鼠李素与索拉非尼联合后蛋白表达的趋势与索拉非尼相似, 即Bcl-2表达降低, c-PARP表达升高, 表明异鼠李素与索拉非尼联合后协同索拉非尼抑制c-Raf/MEK/ERK信号通路的作用, 影响凋亡蛋白表达, 抑制肾癌细胞增殖。见图 3。
4 异鼠李素及联合索拉非尼对小鼠Renca肾癌中淋巴细胞增殖影响采用淋巴细胞增殖实验观察异鼠李素及联合后对肾癌中淋巴细胞增殖影响[14]。实验结束时无菌取出异鼠李素、索拉非尼及二者联合给药组小鼠的脾脏, 进行体内淋巴细胞增殖实验。未刺激时, 与溶剂对照组相比, 异鼠李素组脾细胞增殖增加(P < 0.001), 异鼠李素与索拉非尼联合给药组缓解索拉非尼对淋巴细胞增殖的抑制作用(P < 0.001, 与索拉非尼组相比); 对于ConA刺激后的脾淋巴细胞, 与溶剂对照组相比, 异鼠李素组小鼠脾淋巴细胞增殖增加(P < 0.001), 异鼠李素与索拉非尼联合给药组仍显示出促进其细胞增殖的作用(P < 0.001, 与索拉非尼组相比); 对于LPS刺激的脾淋巴细胞, 与溶剂对照组相比, 异鼠李素组刺激后的脾淋巴细胞增殖增多(P < 0.001), 异鼠李素与索拉非尼联合给药组可减缓索拉非尼对LPS刺激后的脾淋巴细胞的抑制(P < 0.001, 与索拉非尼组相比)。结果表明, 异鼠李素可促进脾淋巴细胞增殖, 与索拉非尼联合后改善索拉非尼对脾淋巴细胞增殖的抑制作用。见图 4。

|
Figure 4 The effect of isorhamnetin combined with sorafenib on the lymphocytes proliferation. *P < 0.05, **P < 0.01, ***P < 0.001 vs control; △△△P < 0.001 vs sorafenib |
肾癌是泌尿系统最常见的恶性肿瘤, 大部分肾癌易发生转移且存活率低, 手术切除是治疗肾癌的常用手段, 但切除术对大多数转移型肾癌无效[13]。目前临床上使用索拉非尼治疗肾癌取得一定成果, 但索拉非尼容易产生耐药性, 加大用药剂量患者又会出现不良反应, 为了提高肾癌患者的生活质量和存活率, 采用药物与索拉非尼联合治疗可能是更有效的选择[15]。中药具有免疫调节作用和抗肿瘤活性, 不良反应少, 与抗肿瘤药物联合使用会降低肿瘤治疗过程中的毒性反应[16], 黄芪作为传统中药治疗疾病具有两千多年历史, 其中的黄芪皂苷、总黄酮和多糖成分抗肿瘤活性强, 近几年用于治疗各种癌症[17], 异鼠李素是黄芪的总黄酮成分之一, 该成分的抗肾癌作用研究较少, 因此研究异鼠李素及联合索拉非尼对肾癌的作用机制具有重要价值。
异鼠李素与索拉非尼联合后能够增加索拉非尼对小鼠肾癌的抑制作用, 且其增效作用强于黄芪中的其他成分。而异鼠李素单独使用时抗肿瘤活性均较弱。其与索拉非尼联合使用时可降低索拉非尼的IC50, 在高浓度时与索拉非尼产生协同效应。本研究的结果提示, 异鼠李素能促进淋巴细胞增殖, 与索拉非尼联合后减少索拉非尼对淋巴细胞增殖的抑制作用, 因此推断在肾癌中, 异鼠李素在增加索拉非尼抗肿瘤活性的同时, 可减弱索拉非尼所造成的免疫抑制[18, 19]。
异鼠李素可降低肾癌组织中AKT的磷酸化水平, 进而抑制mTOR磷酸化, 抑制作用强于索拉非尼, 并且与索拉非尼联合后会抑制AKT及mTOR磷酸化, 进而抑制下游HIF和VEGF的表达。AKT/mTOR信号通路与细胞增殖代谢及血管生成相关, 因此异鼠李素可能是通过抑制AKT磷酸化, 协同索拉非尼阻滞AKT/mTOR信号转导通路, 下调血管生成相关蛋白水平, 起到抑制肿瘤细胞增殖与肿瘤血管生成的作用, 与索拉非尼联合后协同索拉非尼抑制此通路发挥抗肿瘤活性。异鼠李素可降低肾癌组织中p-c-Raf水平, 进一步抑制MEK和ERK磷酸化, 作用较索拉非尼明显, 但对c-PARP和Bcl-2等凋亡相关蛋白无明显影响。异鼠李素与索拉非尼联合后加强索拉非尼对c-Raf/MEK/ERK信号转导通路的抑制作用, 且联合后促进c-PARP表达, 降低Bcl-2水平, 推断异鼠李素协同索拉非尼抑制c-Raf/MEK/ERK信号通路, 进而影响凋亡相关蛋白的表达, 促进肿瘤细胞凋亡, 抑制肿瘤细胞增殖。
本研究初步表明, 异鼠李素可通过影响AKT/mTOR和c-Raf/MEK/ERK信号转导通路, 与索拉非尼联合后协同增强对两条通路的抑制作用, 最终抑制肿瘤血管生成和细胞增殖, 促进肿瘤细胞凋亡。异鼠李素与索拉非尼联合使用显著抑制肾癌生长的同时改善索拉非尼对淋巴细胞增殖的抑制作用。索拉非尼作为多激酶抑制剂, 主要通过影响AKT/mTOR和c-Raf/MEK/ERK信号通路来影响肿瘤细胞增殖和转移[20]。这两条通路是肿瘤发生过程中最容易突变的信号通路, 持续抑制mTOR磷酸化会引起AKT和c-Raf/MEK/ERK信号通路激活, 也是索拉非尼易产生耐药性的原因之一, 因此c-Raf/MEK/ERK信号通路抑制剂和mTOR抑制剂联合使用在肿瘤治疗中是更合理的选择[21]。异鼠李素能同时阻滞AKT/mTOR和c-Raf/MEK/ERK信号通路, 其与索拉非尼联合使用能减弱索拉非尼对AKT/mTOR信号通路的激活, 因此异鼠李素可能会减少索拉非尼因激活AKT/mTOR通路而产生的耐药, 且异鼠李素协同增强索拉非尼对肾癌的生长抑制作用, 但其免疫调节机制还有待进一步研究, 期望经过课题组的努力使异鼠李素或其衍生物可应用于临床治疗, 尽早造福肿瘤患者。
| [1] | Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115–132. DOI:10.3322/caac.21338 |
| [2] | Oh JJ, Lee JK, Do SB, et al. Accurate risk assessment of patients with pathologic T3aN0M0 renal cell carcinoma[J]. Sci Rep, 2018, 8: 13914. DOI:10.1038/s41598-018-32362-w |
| [3] | Xu FJ. The Effect of sorafenib in the treatment of patients with advanced renal cell carcinoma and the adverse effects of observation[J]. J Guide Chin Med (中国医药指南), 2017, 15: 8–9. |
| [4] | Li H, Shen KK. Research progress of drug combination of Chinese materia medica on antitumor[J]. Acta Univ Tradit Med Sin Pharmacol Shanghai (上海中医药大学学报), 2017, 31: 90–94. |
| [5] | Wu J, Wang C. Research progress on the pharmacological effect of Astragalus membranaceus[J]. J Xinxiang Med Coll (新乡医学院学报), 2018, 35: 755–760. |
| [6] | Lin Q, Li Y, Tang XM, et al. Simultaneous determination of formononetin, calycosin and isorhamnetin from Astragalus mongholicus in rat plasma by LC-MS /MS and application to pharmacokinetic study[J]. J Chin Med Mater (中药材), 2013, 36: 589–593. |
| [7] | Liu CX, Huang LL, Yan C, et al. The anti-tumor activity and mechanisms of a GLI1 inhibitor FL18 in suppression of glioblastoma growth[J]. Acta Pharm Sin (药学学报), 2018, 53: 1113–1121. |
| [8] | Yuan SJ. Establishment of new method for quantitatively calculating synergistic, additive and antagonistic effect in multiple drug combination[J]. Chin J Pharmacol Toxicity (中国药理学与毒理学杂志), 2016, 30: 1316–1332. |
| [9] | Rosenberg L, Yoon CH, Sharma G, et al. Sorafenib inhibits proliferation and invasion in desmoid-derived cells by targeting Ras/MEK/ERK and PI3K/AKT/mTOR pathways[J]. Carcinogenesis, 2018, 39: 681–688. DOI:10.1093/carcin/bgy038 |
| [10] | Edlind MP, Hsieh AC. PI3K-AKT-mTOR signaling in prostate cancer progression and androgen deprivation therapy resistance[J]. Asian J Androl, 2014, 16: 378–386. DOI:10.4103/1008-682X.122876 |
| [11] | Mao LY, Chen QY, Gong K, et al. Berberine decelerates glucose metabolism via suppression of mTOR dependent HIF1α protein synthesis in colon cancer cells[J]. Oncol Rep, 2018, 39: 2436–2442. |
| [12] | Cui SX, Shi WN, Song ZY, et al. Des-gamma-carboxy prothrombin antagonizes the effects of sorafenib on human hepatocellular carcinoma through activation of the Raf/MEK/ERK and PI3K/AKT/mTOR signaling pathways[J]. Oncotarget, 2016, 7: 36767–36782. |
| [13] | Zeng YZ, Tian XF, Wang Q, et al. Attenuation of everolimus-induced cytotoxicity by a protective autophagic pathway involving ERK activation in renal cell carcinoma cells[J]. Drug Des Devel Ther, 2018, 12: 911–920. DOI:10.2147/DDDT.S160557 |
| [14] | Chen XL, Yang HF, Zhai JW, et al. Effect of different mulberry leaf extracts on spleen lymphocyte proliferation in mice[J]. Chin Anim Husb Vet Med (中国畜牧兽医), 2017, 44: 3598–3604. |
| [15] | Zheng W, Shou JZ, Ma JH. Research status of sorafenib for patients with renal cell carcinoma[J]. Clin Med J (临床药物治疗杂志), 2012, 10: 19–23. |
| [16] | Kuo CC, Chen JJ, Tsai JY, et al. Effects of Chinese herbal medicine in combination with mitomycin C on gastric cancer cells[J]. Biomark Res, 2014, 2: 26. DOI:10.1186/s40364-014-0026-8 |
| [17] | Zhou RJ, Chen HJ, Chen JP, et al. Extract from Astragalus membranaceus inhibit breast cancer cells proliferation via PI3K/AKT/mTOR signaling pathway[J]. BMC Complement Altern Med, 2018, 18: 83. DOI:10.1186/s12906-018-2148-2 |
| [18] | Chen YC, Duda DG. Targeting immunosuppression after standard sorafenib treatment to facilitate immune checkpoint blockade in hepatocellular carcinoma - an auto-commentary on clinical potential and future development[J]. Oncoimmunology, 2015, 4: e1029703. DOI:10.1080/2162402X.2015.1029703 |
| [19] | Zhao W, Gu YH, Song R, et al. Sorafenib inhibits activation of human peripheral blood T cells by targeting LCK phosphorylation[J]. Leukemia, 2008, 22: 1226–1233. DOI:10.1038/leu.2008.58 |
| [20] | Nishida N, Kitano M, Sakurai T, et al. Molecular mechanism and prediction of sorafenib chemoresistance in human hepatocellular carcinoma[J]. Dig Dis, 2015, 33: 771–779. DOI:10.1159/000439102 |
| [21] | Liu C, Lee WC, Huang BM, et al. 16-Hydroxycleroda-3, 13-dien-15, 16-olide inhibits the proliferation and induces mitochondrial-dependent apoptosis through AKT, mTOR, and MEK-ERK pathways in human renal carcinoma cells[J]. Phytomedicine, 2017, 36: 95–107. DOI:10.1016/j.phymed.2017.09.021 |
 2019, Vol. 54
2019, Vol. 54


