2. 中国人民武装警察部队武警后勤学院卫生勤务系, 天津 300309;
3. 天津市职业与环境危害防制重点实验室, 天津 300309
2. Department of Health Service, Logistics University of PAP, Tianjin 300309, China;
3. Tianjin Key Laboratory for Biomarkers of Occupational and Environmental Hazard, Tianjin 300309, China
人类免疫缺陷病毒(HIV)感染引起的艾滋病(AIDS)仍是严重威胁人类健康和社会安全稳定的致命性传染病。目前AIDS尚不能根治, 药物治疗是临床抗AIDS的主要手段, 现已有6大类31种上市的单靶点抗HIV药物可供选择, 包括10种蛋白酶抑制剂(PIs)、9种核苷类逆转录酶抑制剂(NRTIs)、5种非核苷类逆转录酶抑制剂(NNRTIs)、4种整合酶链转移抑制剂(INSTIs)、2种融合抑制剂(FIs)和1种CCR5受体拮抗剂(CRIs)[1-3]。然而, HIV的高度变异性使单靶点药物的疗效不理想, 目前临床上治疗AIDS所使用的高效抗逆转录病毒疗法已将AIDS转化成一种慢性可控疾病, 但存在需终生用药、治疗费用高、服药依从性差、不良反应大及交叉耐药等缺点[4]。因此, 运用新的药物设计思想研发增强疗效、改善安全性且经济适用的新型抗HIV药物仍具有重大意义。
HIV核糖核酸酶H (ribonuclease H, RNase H)和整合酶(integrase, IN)同属于核苷酸转移酶, RNase H和IN催化核心区域的三维结构研究表明, 二者具有极其相似的折叠方式和活性位点的几何构象, 且两个酶活性中心均包含保持酶催化活性所必需的双二价金属离子, 功能上先后催化降解病毒DNA合成时RNA/DNA杂合链中的RNA和将合成的双链DNA整合到宿主细胞DNA中, 均为病毒生命周期中的关键酶, 故RNase H和IN一直是抗HIV药物研发的重要靶标[5]。RNase H作为逆转录酶(reverse transcriptase, RT)上具有独立酶催化功能的结构域, 目前无RNase H抑制剂(RNase H inhibitors, RNHIs)上市, 且在此区域尚未发现临床上出现的主要耐药HIV突变体[6], 因此开发RNHIs可为临床抗AIDS提供新的选择方案。由于在人体内无HIV IN的功能类似物, 以其为靶标开发低毒高效的抗HIV药物一直是被关注的热点, 目前第一代INSTIs雷格特韦(raltegravir, RAL)、埃替格韦(elvitegravir, EVG)和第二代的多替格韦(dolutegravir, DTG)、比特拉韦(bictegravir, BIC)已被FDA批准上市。然而, HIV的高度变异性使其极易对单靶点RNHIs和INSTIs产生耐药性, 导致药物的疗效降低或无效。
随着系统生物学及网络药理学的发展, 人们逐渐认识到, 同时作用于同一疾病多个靶点的单组分多靶点药物相比单靶点药物在功能失调类疾病的治疗过程中优势明显[4, 5]。单组分多靶点药物在设计时需均衡对不同靶标的生物活性, 以便在体内相同血浆(或脑组织)浓度下, 对每个靶点的作用能调节到合适的强度, 从而提供较好的疗效和较低的不良反应[7]。通常作用于不同靶点的药效团高度兼容, 药效学和药动学性质好, 相对分子质量小, 结构简单且活性均衡度好的单一化学实体分子是人们寻找的理想单组分多靶点药物[7]。在抗HIV药物研究领域, 相比于单靶点RNHIs和INSTIs, 基于IN和RNase H的家族同源性、结构相似性、功能连续性以及双二价金属离子介导的酶催化机制, 开发HIV IN/RNase H双靶点抑制剂具有提高药物的抗耐药性, 延缓病毒耐药的速度, 减少服药剂量, 提高患者的依从性以及减轻患者经济负担等优点。近年来, 人们通过合理药物设计和筛选途径已发现了多种结构类型的HIV IN/RNase H双靶点抑制剂。本文重点对化学合成类HIV IN/RNase H双靶点抑制剂的研究进展作简要介绍。
1 HIV IN和RNase H的结构与功能 1.1 HIV IN的结构与功能HIV IN是由病毒pol基因编码的分子质量为32 kDa的蛋白质, 包含288个氨基酸残基, 其结构分为N-端结构域(N-terminal domain, NTD)、催化核心区域(catalytic core domain, CCD)及C-端结构域(C-terminal domain, CTD)[8]。其中, NTD横跨第1~49位氨基酸残基, 包含4个α螺旋, 该区域包含保守的锌指结构基序, 在功能上能稳定蛋白质的折叠构象并参与IN的多聚化; CCD横跨第50~212位氨基酸残基, 包含6个α螺旋和5个β折叠, α螺旋非对称地分布于β折叠的两侧, 该区域包含酸性氨基酸残基Asp64、Asp116和Glu152组成的保守DDE基序, 经与保持酶催化活性所必需的2个Mg2+发生配位进而发挥活性; CTD横跨第213~288位氨基酸残基, 具有完整的SH3折叠, 该区域保守性最低, 在功能上参与病毒和宿主DNA的结合[8]。
HIV IN以多聚体形式催化前病毒DNA整合到宿主细胞的DNA中, 其整合过程分为3'-加工(3'-processing, 3'-P)和链转移(strand transfer, ST)阶段[4]。3'-P阶段在胞浆内完成, IN以二聚体形式结合并水解切割掉病毒DNA 3'-末端的2个核苷酸GT, 产生3'-CAOH末端; ST阶段在细胞核内完成, IN以四聚体形式结合并切割宿主细胞DNA的5'-末端, 产生间隔5个碱基的交错切口, 继而与病毒DNA的3'-CAOH末端形成新的磷酸二酯键, 从而将病毒DNA整合到宿主细胞的DNA中, 因此抑制整合过程的3'-P或ST能发挥抗IN活性[4, 8]。
1.2 HIV RNase H的结构与功能HIV RT是由p66和p51亚基组成的不对称异源二聚体酶[9]。在结构上, p66亚基包括聚合酶活性位点和RNase H区域, 其中聚合酶活性位点位于p66亚基的N端区域(占据2/3), 形状类似于人的右手, 分为手指、手掌、拇指及连接域, 而RNase H区域位于p66亚基的C端区域(占据1/3)[9]。尽管p51亚基与p66亚基的前440个氨基酸残基序列相同, 但p51亚基由于缺乏RNase H区域而无催化活性, 主要发挥稳定p66亚基结构的作用。
RNase H区域横跨第427~560位氨基酸残基, 距聚合酶活性位点约60Å ,包含4个α螺旋和5个β折叠, α螺旋非对称地分布在β折叠的两侧[10]。RNase H的活性位点包含由酸性氨基酸残基Asp443、Glu478、Asp498、Asp549组成的保守DEDD基序, 该基序通过与2个Mn2+发生配位进而发挥催化活性[10]。在功能上, RNase H通过对磷酸酯键进行亲核取代, 催化RNA/DNA杂合链中RNA的选择性水解, 在HIV的复制中发挥重要作用[10]。
2 化学合成类HIV IN和RNase H双靶点抑制剂Morphy等[11]阐述了单组分多靶点药物的设计思想, 即具有活性相关的多个药效团的单一化学实体分子能同时作用于同一疾病多个靶点或单一靶点的多个结构域。根据药效团重叠程度的不同, 单组分多靶点药物一般分为药效团连接型、融合型和并合型[5]。药效团连接型多靶点药物是通过可裂解或不可裂解的连接基将不同的作用片段连接而成, 但大多存在结构较为复杂, 分子量较大, 药动学性质较差及结构修饰困难等缺点; 药效团融合型和并合型多靶点药物是充分利用分子结构的相似性, 将相似的结构片段整合到同一分子中, 因此能克服上述缺点, 在多靶点药物的研发领域体现出更为明显的优势[5, 11]。
目前发现融合型或并合型HIV IN/RNase H双靶点抑制剂的主要途径有两种:一种是通过定向筛选获得具有双重活性的苗头化合物, 继而对其进行结构衍生化, 以发现均衡抑制活性更好的化合物; 另一种是通过结构的合理设计得到。
2.1 基于定向筛选及结构衍生化途径发现的HIV IN/RNase H双靶点抑制剂 2.1.1 Madurahydroxylactone (MHL)衍生物类MHL (1)属于苯并[a]萘并萘醌类抗生素家族, 是土壤细菌Nonomuraea rubra的次级代谢产物[12]。鉴于MHL具有广谱生物活性, Marchand等[12]对MHL进行结构修饰及高通量筛选, 得到了3种系列MHL衍生物类IN/RNase H双靶点抑制剂(图 1), 发现其抗RNase H活性的IC50值在0.3~22.4 μmol·L-1之间, 但对IN的抑制活性差异较大。MHL的五元羟基内酯环被替换为哒嗪酮的第一系列衍生物抗RNase H活性在微摩尔水平; 哒嗪酮上苯基取代的衍生物2抗IN活性最强, 而为其他取代基团的衍生物抗IN活性下降。MHL的五元羟基内酯环分别被替换为羧基和五元内酰胺环与其他杂环, 得到了以3和4为代表的其余两类衍生物, 这两个系列衍生物抗IN活性几乎无明显规律可循。此研究表明, MHL可作为开发IN/RNase H双靶点抑制剂的基本母核, 同时也证实了结构衍生化和高通量筛选在多靶点抗HIV药物发现中的可行性。

|
Figure 1 Structures and activities of madurahydroxylactone (MHL) derivatives |
Budihas等[13]通过高通量筛选发现羟基托酚酮类化合物5和6属于选择性HIV RNHIs, Chung等[14]报道化合物5的衍生物7也具有抗RNase H活性。Semenova等[15]发现此类化合物对IN的ST (INST)阶段的抑制活性高于3'-P (IN3'-P), 并能与二价金属离子发生配位, 但对Mg2+配位的选择性强于Mn2+。
Diderjean等[16]对2, 3, 7-三羟基托酚酮(8)进行结构修饰得到了一系列新类型衍生物(图 2), 其对HIV的聚合酶、RNase H、IN3'-P以及INST具有不同程度的抑制活性。C-4位以及C-4/C-6位结构修饰的衍生物9和10对聚合酶、RNase H、IN3'-P和INST的抑制活性与化合物8相当或略强, 且优于其他结构修饰类型。相比于化合物8, 羟基的乙酰化衍生物12对聚合酶、RNase H、IN3'-P和INST的抑制活性下降显著, 而C-7位衍生物11和羟基的甲基化衍生物13失去抑制活性, 表明母核羟基是此类化合物发挥活性的药效特征基团。虽然羟基托酚酮类化合物对聚合酶、RNase H、IN3'-P和INST具有较好的抑制活性, 但细胞水平测试发现该类化合物具有细胞毒性, 这导致其进一步的开发和利用受到限制。

|
Figure 2 Structures and activities of hydroxylated tropolones |
2-羟基异喹啉-1, 3-二酮(14)属于IN/RNase H双靶点抑制剂[17]。此类化合物中N-羟基环二酰亚胺片段的3个氧原子与IN和RNase H的2个二价金属离子都具有最佳的配位距离, 使其对这两个酶均表现出抑制活性。Billamboz等[18-22]通过对先导化合物14的结构修饰及定向筛选, 得到了3种系列衍生物(图 3)。

|
Figure 3 Structures and activities of 2-hydroxyisoquinoline-1, 3-(2H, 4H)-diones |
对14的C-4位进行结构修饰得到第一系列衍生物, 不同取代基对IN和RNase H抑制活性的影响较大, 烷基、芳烷基取代产物抗IN和RNase H活性大幅度下降, 但取代苯甲酰胺衍生物(如15a)活性有明显提高, 而甲酸甲酯衍生物15b抗RNase H活性达0.061 μmol·L-1, 对IN抑制活性也比14略高, 且细胞水平的抗HIV活性显著(EC50=13.44 μmol·L-1)。
在14的C-6位引入取代苄基或联苯甲基得到第二系列衍生物, 其抗RNase H活性增强, 不同取代基对IN抑制活性的影响较大, 氯、环丙基、磺酰胺基等取代产物活性略有提高, 其中4-磺酰胺联苯甲基衍生物16b对RNase H和IN抑制活性最好, IC50值分别为0.4和3.6 μmol·L-1。
对14的C-7位进行衍生化得到第三系列衍生物, 此类化合物的IN抑制活性变化趋势与前两个系列基本一致, 卤素、取代苯基、酰胺等取代产物活性增强, 其中苯乙酰氨基衍生物17b活性达到了0.09 μmol·L-1, 但RNase H抑制活性明显下降。
上述研究表明, 2-羟基异喹啉-1, 3-二酮是开发IN/RNase H双靶点抑制剂的重要结构骨架, 但由于此类化合物的细胞毒性较大, 在今后研究需对其进行结构优化以降低细胞毒性。
2.1.4 3-羟基嘧啶-2, 4-二酮类化合物3-羟基嘧啶-2, 4-二酮(18)作为开发抗HIV药物的重要结构母核, 由于能特异性地与包含2个二价金属离子的酶活性中心结合, 使其衍生物具有抗IN和RNase H双重活性的潜力[23]。Tang等[24, 25]以18为结构母核, 开发了3-羟基嘧啶-2, 4-二酮类IN/RNase H双靶点抑制剂(图 4)。

|
Figure 4 Structures and activities of 3-hydroxypyrimidine-2, 4-diones |
对18的C-6位进行结构衍生化, 得到的第一系列衍生物抗RNase H活性基本相当, 在微摩尔水平(IC50=0.19~2.3 μmol·L-1), 但对IN抑制活性在亚微摩尔水平, 且不同取代基对IN抑制活性的影响较为显著, 其中2, 4-二甲氧基取代产物19活性最好(IC50=1.2 μmol·L-1)。
在18的C-5位和C-6位分别引入N-苄基甲酰胺和烷氨基得到第二系列衍生物, 其对RNase H和INST的抑制活性均在低纳摩尔水平。在C-5位苯环上引入氟、氯、甲基等取代基可略微增强衍生物的抗RNase H活性, 但其对INST的抑制活性存在差异, 其中2-氟-3-氯取代产物20抗RNase H和INST活性高, IC50值分别为0.029和0.021 μmol·L-1, 且对两个靶点的均衡活性较好。此类衍生物抗INST活性高于RAL, 与DTG相当, 对RAL耐药突变体Y143C、N155H、G140S/Q148H及G140S/Y143H/Q148H的抑制活性与DTG相似, 而且相比RAL和DTG无抗RNase H活性, 他的RNase H抑制活性十分显著。
总之, 3-羟基嘧啶-2, 4-二酮可作为开发IN/RNase H双靶点抑制剂的结构母核, 由于此类化合物结构简单, 易化学合成, 理化性质好, 无细胞毒性, 安全性较好, 具有广阔的研究前景, 特别是化合物20进一步研究的潜力最大。
2.1.5 二酮酸类化合物二酮酸(diketo acid, DKA)类化合物是经典的HIV INSTIs, 能与金属离子配位的DKA基团和与其相连的疏水芳香基团是此类化合物的药效特征基团[5]。近年来, 人们还发现DKA类化合物具有抗RNase H活性, 其中部分化合物对IN和RNase H显示出双重抑制活性。
吡咯基二酮酸类化合物 6-[1-(4-氟苯基)甲基-1H-吡咯-2-基]-2, 4-二氧-5-己烯酸乙酯(RDS1643, 21)属于选择性HIV RNHIs, 对INST的抑制活性较弱[26]。Costi等[27]用氟、氯、甲基、甲氧基、氰基等替换RDS1643中4-氟苄基的氟原子, 得到了以22为代表的系列衍生物(图 5)。该系列大部分化合物抗INST活性在低纳摩尔水平, 但RNase H抑制活性略低在微摩尔水平, 细胞水平的抗HIV活性在0.2~26.3 μmol·L-1, 且选择性指数很高。在此基础上, Cuzzucoli等[28]以RDS1643为先导物进行了构效关系探索, 发现新衍生物酶水平的IN和RNase H抑制活性及细胞水平的抗HIV活性的变化规律与Costi等[27]研究结果基本一致。值得一提的是, RDS1643的N-1位苯基取代衍生物23对INST和RNase H的均衡抑制活性最好, IC50值分别为1.2和1.8 μmol·L-1, 进一步研究的潜力较大。总之, 吡咯基二酮酸可作为开发IN/RNase H双靶点抑制剂的结构骨架, 具有广阔的研究前景。目前通过结构优化以提高抗RNase H活性的研究正在进行中。

|
Figure 5 Structures and activities of pyrrolyl diketo acid derivatives |
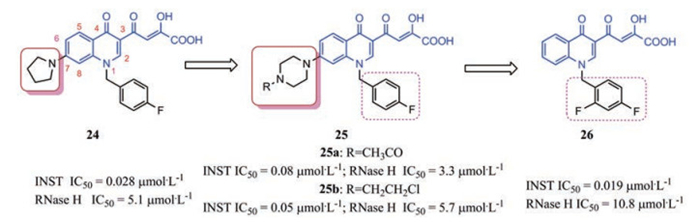
喹诺酮基二酮酸类化合物 喹诺酮基二酮酸类化合物作为选择性HIV INSTIs较早就引起了人们的关注, 代表性化合物24抑酶活性达到了28 nmol·L-1[29, 30]。根据IN和RNase H催化位点的结构相似性, Costi等[31]通过对先导物24的衍生化及定向筛选, 发现了喹诺酮基二酮酸类IN/RNase H双靶点抑制剂(图 6)。此类衍生物酶水平的INST抑制活性在低纳摩尔水平, 而RNase H活性略低在微摩尔水平。在此基础上, Pescatori等[32]移除衍生物25a的C-7位4-乙酰哌嗪基, 在其N-1位引入取代苄基、烷基或杂环芳烷基, 进行了新的探索。发现结构修饰结果并不令人满意, 新的衍生物INST抑制活性水平与前述相当, 但抗RNase H活性显著下降甚至完全消失, 其中26为最好的衍生物, 表明C-7位应保持引入的含氮碱性基团。此系列部分衍生物抗INST活性与RAL和EVG相当, 且对RNase H抑制活性在微摩尔水平, 总之, 喹诺酮基二酮酸可作为开发IN/RNase H双靶点抑制剂的先导化合物, 今后研究可继续对其进行结构优化以改善其抗RNase H活性。
|
Figure 6 Structures and activities of quinolinonyl diketo acid derivatives |
Kawasuji等[33]发现3-羟基吡啶-4-酮是一种新的金属离子螯合骨架, 其C-6位引入取代甲酰胺的衍生物27是HIV INSTIs。受此启发, Mohammadpour等[34]合成了5-羟基吡啶-4-酮类衍生物, 代表性化合物为28和29 (图 7), 其细胞水平的抗HIV活性在微摩尔水平。为探明此类化合物的具体作用靶点, Sirous等[35]将其分别与IN和RNase H进行了分子对接研究, 发现分子的5-羟基吡啶-4-酮片段均能与IN和RNase H形成关键的金属离子螯合作用, C-2位芳基能与两个靶点产生关键的强疏水相互作用, 证实5-羟基吡啶-4-酮类化合物可作为IN/RNase H双靶点抑制剂的先导物。目前, 对此类化合物的结构优化及定向活性筛选正在进行中。

|
Figure 7 Structures of 5-hydroxypyridine-4-one derivatives |
羟基吡啶羧酸骨架被证实能通过金属离子螯合作用抑制HIV IN和流感病毒内切核酸酶活性[36, 37]。考虑到金属离子螯合作用也是HIV RNHIs发挥抑酶活性的关键作用, Kankanala等[38]在羟基吡啶羧酸母核的N-1位引入苄基或二芳甲基, 合成了羟基吡啶羧酸类IN/RNase H双靶点抑制剂(图 8)。活性测试结果显示, 相比于N-1位苄基取代衍生物, 二芳甲基取代的系列衍生物(如30和31)抗IN和RNase H活性更强, 在微摩尔至亚微摩尔水平, 且细胞水平的抗HIV活性较为显著达10 μmol·L-1, 值得进一步研究。

|
图 8 Structures and activities of hydroxypyridone carboxylic acids |
Korolev等[39]发现硝基苯并噁二唑及其N-氧化物32和33 (图 9)是选择性HIV INSTIs, 此类化合物中的硝基是其发挥抑制活性的药效特征基团。在此基础上, Korolev等[40]合成了以34和35为代表的目标产物(图 9), 并对其进行了抗IN和RNase H定向活性测试, 结果显示此类化合物具有抗IN和RNase H双重活性, 有进一步研究的价值。

|
Figure 9 Structures and activities of nitrobenzofuroxane derivatives |
N'-酰腙类化合物属于HIV RNHIs[41]。Sanchez等[42]报道此类化合物能抑制人类晶状体上皮衍生生长因子(LEDGF/p75)与IN之间的相互作用。在此基础上, Carcelli等[43]合成了一系列N'-酰腙类化合物(图 10), 发现其酶水平的IN和RNase H抑制活性均处于微摩尔水平至低纳摩尔水平, 且细胞水平的抗HIV活性在微摩尔水平。构效关系研究表明, 相比于苯基上羟基的单或二取代衍生物, 三取代衍生物抗IN和RNase H活性更强, 表明苯环上三羟基为最佳的取代模式, 其中3, 4, 5-三羟基取代衍生物36c对IN和RNase H的均衡抑制活性最好, IC50值分别为0.165和0.18 μmol·L-1, 有进一步研究的价值。部分N'-酰腙类化合物不仅抗IN活性与RAL相当, 而且对RNase H的抑制活性在低纳摩尔水平, 可作为IN/RNase H双靶点抑制剂的先导化合物。

|
Figure 10 Structures and activities of N'-acylhydrazone derivatives |
N-羟基尿嘧啶是具有金属配位性质的多功能结构母核, Tumey等[44]报道其衍生物37 (图 11)通过金属配位作用抑制核酸内切酶FEN-1活性。鉴于HIV IN、RNase H与核酸内切酶FEN-1的结构相似性, Kankanala等[45]采用生物电子等排体替换策略, 用噻吩环替换化合物37中的苯基, 得到N-羟基噻吩并嘧啶-2, 4-二酮类IN/RNase H双靶点抑制剂(图 11)。大部分化合物INST抑制活性在微摩尔水平, 但抗RNase H活性稍高在微摩尔至低纳摩尔水平, 其中衍生物39抑酶活性高, 抗HIV活性好(EC50=7.4 μmol·L-1), 且无细胞毒性(CC50 > 100 μmol·L-1), 可作为进一步研究的先导化合物。

|
Figure 11 Structurse and activities of N-hydroxythienopyrimidine-2, 4-diones |
1-羟基-1, 8-萘啶-2(1H)-酮类化合物40是一类HIV RNHIs, 与喹诺酮基二酮酸类双靶点抑制剂的发现思路类似, Williams等[46]通过对先导物40进行衍生化及定向筛选, 发现了1-羟基-1, 8-萘啶-2(1H)-酮类IN/RNase H双靶点抑制剂(图 12), 其抗INST活性在微摩尔水平, RNase H抑制活性在微摩尔至低纳摩尔水平。在新的衍生物中, C-4位苯环上引入氨甲基可增强其抗RNase H和INST活性, 不同位置取代的活性顺序为:对位取代(41c) > 间位取代(41b) > 邻位取代(41a), 表明苯环对位是引入氨甲基的最佳位置。今后结构优化可重点尝试在苯环对位引入给电子取代基作进一步探究。

|
Figure 12 Structures and activities of 1-hydroxy-1, 8-naphthyridin-2(1H)-one derivatives |
根据大量IN/RNase H抑制剂中包含共平面的金属离子螯合基团和与其相连呈“T”构型的二芳基团的观察结果提示[22, 25, 38], Sun等[47]通过骨架跳跃策略开发了5-羟基吡啶并[2, 3-b]吡嗪-6(5H)-酮类IN/RNase H双靶点抑制剂(图 13), 其IN和RNase H抑制活性均处于微摩尔水平, 其中4-氰基联苯基取代产物42对两个靶点的均衡抑制活性最好, IC50值分别为1.18和1.77 μmol·L-1。总之, 5-羟基吡啶并[2, 3-b]吡嗪-6(5H)-酮可作为开发IN/RNase H双靶点抑制剂的结构母核, 也证实了骨架跳跃策略在多靶点抗HIV药物开发中的可行性。

|
Figure 13 Structures and activities of 5-hydroxypyrido[2, 3-b]pyrazin-6(5H)-one derivatives |
基于药效团的并合设计策略, Velthuisen等[48]将化合物44与45的药效特征基团进行并合, 得到了新类型衍生物(图 14)。酶水平的INST和RNase H定向活性测试结果表明, 此类化合物抗RNase H活性在0.01~0.501 μmol·L-1之间, 但对INST抑制活性相对较低(IC50=0.5~15.9 μmol·L-1)。构效关系研究表明, 苯基对位引入疏水芳香基团(苯环或吡啶环)可提高衍生物的抗INST和RNase H活性。由于易化学合成, 吡啶并嘧啶类化合物是开发IN/RNase H双靶点抑制剂极具吸引力的结构骨架, 也证实了并合设计策略用于发现多靶点抗HIV药物的可行性。

|
Figure 14 Structures and activities of pyridopyrimidinone inhibitors |
综上所述, 近年来基于定向筛选及合理药物设计策略已发现了多类HIV IN/RNase H双靶点抑制剂, 极大地推动了多靶点抗HIV药物的研发进程, 但大多存在均衡抑制活性较差的缺点。相比于其他结构类型的HIV IN/RNase H双靶点抑制剂, 3-羟基嘧啶-2, 4-二酮类HIV IN/RNase H双靶点抑制剂抗IN和RNase H活性均在低纳摩尔水平, 且对两个靶点的均衡活性较好, 细胞水平的抗HIV活性也在低纳摩尔水平, 细胞毒性低, 安全性较好, 结构简单, 易化学合成, 同时具有很好的理化性质和体外药动学性质, 进一步结构优化的空间广阔, 是最有价值的有待进一步研究的双靶点抑制剂。尽管此类化合物尚未进入临床研究阶段, 但是其为设计更有效的多靶点抗HIV药物提供了结构骨架, 值得进一步探索。
| [1] | Yao C, Zhu PP, Xie D. Advances in antiretroviral therapy and drug development for AIDS[J]. Prog Pharm Sci (药学进展), 2018, 42: 84–98. |
| [2] | Markham A. Bictegravir: first global approval[J]. Drugs, 2018, 78: 601–606. DOI:10.1007/s40265-018-0896-4 |
| [3] | Jones J, Taylor BS, Tieu HV, et al. CROI 2017: advances in antiretroviral therapy[J]. Top Antivir Med, 2017, 25: 51–67. |
| [4] | Kang JX, Zhu J, Li AX, et al. Advances on chemically synthesized dual inhibitors of HIV-1 reverse transcriptase and integrase[J]. J Log Univ PAP (Med Sci) (武警后勤学院学报·医学版), 2018, 27: 169–176. |
| [5] | Liu H, Zhan P, Liu XY. Research progress of dual inhibitors targeting HIV-1 reverse transcriptase and integrase[J]. Acta Pharm Sin (药学学报), 2013, 48: 466–476. |
| [6] | Tatiana I, Krystal LB, Sarafianos SG, et al. Inhibitors of HIV-1 reverse transcriptase-associated ribonuclease H activity[J]. Biology, 2012, 1: 521–541. DOI:10.3390/biology1030521 |
| [7] | Guo YS, Guo ZR. Design of multiple targeted drugs[J]. Acta Pharm Sin (药学学报), 2009, 44: 276–281. |
| [8] | Shen XB, Ye J, Yang LL, et al. Research progress of HIV-1 integrase and its inhibitors[J]. Chin J Cell Biol (中国细胞生物学学报), 2013, 35: 1514–1524. |
| [9] | Zhou ZX, Sun L, Kang DW, et al. Progress on HIV-1 RT inhibitors with novel mechanism of action[J]. Acta Pharm Sin (药学学报), 2018, 53: 691–700. |
| [10] | Deng LB, Li AX, Jin YR. Advances in the study on inhibitors of RNase H, a novel anti-HIV drug target[J]. J China Pharm Univ (中国药科大学学报), 2011, 42: 578–584. |
| [11] | Morphy R, Rankovic Z. Designed multiple ligands. An emerging drug discovery paradigm[J]. J Med Chem, 2005, 48: 6523–6543. DOI:10.1021/jm058225d |
| [12] | Marchand C, Beutler JA, Wamiru A, et al. Madurahydroxylactone derivatives as dual inhibitors of human immunodeficiency virus type 1 integrase and RNase H[J]. Antimicrob Agents Chemother, 2008, 52: 361–364. DOI:10.1128/AAC.00883-07 |
| [13] | Budihas SR, Gorshkova I, Gaidamakov S, et al. Selective inhibition of HIV-1 reverse transcriptase-associated ribonuclease H activity by hydroxylated tropolones[J]. Nucleic Acids Res, 2005, 33: 1249–1256. DOI:10.1093/nar/gki268 |
| [14] | Chung S, Himmel DM, Jiang JK, et al. Synthesis, activity, and structural analysis of novel α-hydroxytropolone inhibitors of human immunodeficiency virus reverse transcriptase-associated ribonuclease H[J]. J Med Chem, 2011, 54: 4462–4473. DOI:10.1021/jm2000757 |
| [15] | Semenova EA, Johnson AA, Marchand C, et al. Preferential inhibition of the magnesium-dependent strand transfer reaction of HIV-1 integrase by α-hydroxytropolones[J]. Mol Pharmacol, 2006, 69: 1454–1460. DOI:10.1124/mol.105.020321 |
| [16] | Didierjean J, Isel C, Querre F, et al. Inhibition of human immunodeficiency virus type 1 reverse transcriptase, RNase H, and integrase activities by hydroxytropolones[J]. Antimicrob Agents Chemother, 2005, 49: 4884–4894. DOI:10.1128/AAC.49.12.4884-4894.2005 |
| [17] | Klumpp K, Hang JQ, Rajendran S, et al. Two-metal ion mechanism of RNA cleavage by HIV RNase H and mechanism-based design of selective HIV RNase H inhibitors[J]. Nucleic Acids Res, 2003, 31: 6852–6859. DOI:10.1093/nar/gkg881 |
| [18] | Billamboz M, Suchaud V, Bailly F, et al. 4-Substituted 2-hydroxyisoquinoline-1, 3(2H, 4H)-diones as a novel class of HIV-1 integrase inhibitors[J]. ACS Med Chem Lett, 2013, 4: 606–611. DOI:10.1021/ml400009t |
| [19] | Billamboz M, Bailly F, Lion C, et al. Magnesium chelating 2-hydroxyisoquinoline-1, 3(2H, 4H)-diones, as inhibitors of HIV-1 integrase and/or the HIV-1 reverse transcriptase ribonuclease H domain: discovery of a novel selective inhibitor of the ribonuclease H function[J]. J Med Chem, 2011, 54: 1812–1824. DOI:10.1021/jm1014692 |
| [20] | Billamboz M, Bailly F, Lion C, et al. 2-Hydroxyisoquinoline-1, 3(2H, 4H)-diones as inhibitors of HIV-1 integrase and reverse transcriptase RNase H domain: influence of the alkylation of position 4[J]. Eur J Med Chem, 2011, 46: 535–546. DOI:10.1016/j.ejmech.2010.11.033 |
| [21] | Billamboz M, Bailly F, Barreca ML, et al. Design, synthesis, and biological evaluation of a series of 2-hydroxyisoquinoline-1, 3(2H, 4H)-diones as dual inhibitors of human immunodeficiency virus type 1 integrase and the reverse transcriptase RNase H domain[J]. J Med Chem, 2008, 51: 7717–7730. DOI:10.1021/jm8007085 |
| [22] | Vernekar SK, Liu Z, Nagy E, et al. Design, synthesis, biochemical, and antiviral evaluations of C6 benzyl and C6 biarylmethyl substituted 2-hydroxylisoquinoline -1, 3-diones: dual inhibition against HIV reverse transcriptase-associated RNase H and polymerase with antiviral activities[J]. J Med Chem, 2015, 58: 651–664. DOI:10.1021/jm501132s |
| [23] | Vernekar SKV, Tang J, Wu B, et al. Double-winged 3-hydroxypyrimidine-2, 4-diones: potent and selective inhibition against HIV-1 RNase H with significant antiviral activity[J]. J Med Chem, 2017, 60: 5045–5056. DOI:10.1021/acs.jmedchem.7b00440 |
| [24] | Tang J, Liu F, Nagy E, et al. 2-Hydroxypyrimidine-2, 4-diones as selective active site inhibitors of HIV reverse transcriptase-associated RNase H: design, synthesis, and biochemical evaluations[J]. J Med Chem, 2016, 59: 2648–2659. DOI:10.1021/acs.jmedchem.5b01879 |
| [25] | Wu B, Tang J, Wilson DJ, et al. 3-Hydroxypyrimidine-2, 4-dione-5-N-benzylcarboxamides potently inhibit HIV-1 integrase and RNase H[J]. J Med Chem, 2016, 59: 6136–6148. DOI:10.1021/acs.jmedchem.6b00040 |
| [26] | Tramontano E, Esposito F, Badas R, et al. 6-[1-(4-Fluorophenyl)methyl-1H-pyrrol-2-yl)]-2, 4-dioxo-5-hexenoic acid ethyl ester a novel diketo acid derivative which selectively inhibits the HIV-1 viral replication in cell culture and the ribonuclease H activity in vitro[J]. Antivir Res, 2005, 65: 117–124. DOI:10.1016/j.antiviral.2004.11.002 |
| [27] | Costi R, Métifiot M, Esposito F, et al. 6-(1-Benzyl-1H-pyrrol-2-yl)-2, 4-dioxo-5- hexenoic acids as dual inhibitors of recombinant HIV-1 integrase and ribonuclease H, synthesized by a parallel synthesis approach[J]. J Med Chem, 2013, 56: 8588–8598. DOI:10.1021/jm401040b |
| [28] | Cuzzucoli Crucitti G, Métifiot M, Pescatori L, et al. Structure-activity relationship of pyrrolyl diketo acid derivatives as dual inhibitors of HIV-1 integrase and reverse transcriptase ribonuclease H domain[J]. J Med Chem, 2015, 58: 1915–1928. DOI:10.1021/jm501799k |
| [29] | Di Santo R, Costi R, Roux A, et al. Novel bifunctional quinolonyl diketo acid derivatives as HIV-1 integrase inhibitors: design, synthesis, biological activities, and mechanism of action[J]. J Med Chem, 2006, 49: 1939–1945. DOI:10.1021/jm0511583 |
| [30] | Di Santo R, Costi R, Roux A, et al. Novel quinolinonyl diketo acid derivatives as HIV-1 integrase inhibitors: design, synthesis, and biological activities[J]. J Med Chem, 2008, 51: 4744–4750. DOI:10.1021/jm8001422 |
| [31] | Costi R, Métifiot M, Chung S, et al. Basic quinolinonyl diketo acid derivatives as inhibitors of HIV integrase and their activity against RNase H function of reverse transcriptase[J]. J Med Chem, 2014, 57: 3223–3234. DOI:10.1021/jm5001503 |
| [32] | Pescatori L, Métifiot M, Chung S, et al. N-Substituted quinolinonyl diketo acid derivatives as HIV integrase strand transfer inhibitors and their activity against RNase H function of reverse transcriptase[J]. J Med Chem, 2015, 58: 4610–4623. DOI:10.1021/acs.jmedchem.5b00159 |
| [33] | Kawasuji T, Johns BA, Yoshida H, et al. Carbamoyl pyridone HIV-1 integrase inhibitors. 2. Bi- and tricyclic derivatives result in superior antiviral and pharmacokinetic profiles[J]. J Med Chem, 2013, 56(1124): 1135. |
| [34] | Mohammadpour M, Sadeghi A, Fassihi A, et al. Synthesis and antioxidant evaluation of some novel ortho-hydroxypyridine-4-one iron chelators[J]. Res Pharm Sci, 2012, 7: 171–179. |
| [35] | Sirous H, Zabihollahi R, Aghasadeghi MR, et al. Docking studies of some 5-hydroxypyridine-4-one derivatives: evaluation of integrase and ribonuclease H domain of reverse transcriptase as possible targets for anti-HIV-1 activity[J]. Med Chem Res, 2015, 24: 2195–2212. DOI:10.1007/s00044-014-1289-1 |
| [36] | Fujishita T, Mikamiyama M, Kawai M, et al. Substituted 3-hydroxy-4-pyridone derivative: US, US8835461[P]. 2014-09-16. |
| [37] | Johns BA, Kawasuji T, Weatherhead JG, et al. Carbamoyl pyridone HIV-1 integrase inhibitors 3. A diastereomeric approach to chiral nonracemic tricyclic ring systems and the discovery of dolutegravir (S/GSK1349572) and (S/GSK1265744)[J]. J Med Chem, 2013, 56: 5901–5916. DOI:10.1021/jm400645w |
| [38] | Kankanala J, Kirby KA, Liu F, et al. Design, synthesis and biological evaluations of hydroxypyridone carboxylic acids as inhibitors of HIV reverse transcriptase-associated RNase H[J]. J Med Chem, 2016, 59: 5051–5062. DOI:10.1021/acs.jmedchem.6b00465 |
| [39] | Korolev SP, Kondrashina OV, Druzhilovsky DS, et al. Structural-functional analysis of 2, 1, 3-benzoxadiazoles and their N-oxides as HIV-1 integrase inhibitors[J]. Acta Nat, 2013, 5: 63–72. DOI:10.32607/20758251-2013-5-1-63-72 |
| [40] | Korolev SP, Pustovarova MA, Starosotnikov AM, et al. Nitrobenzofuroxane derivatives as dual action HIV-1 inhibitors[J]. Biomed Khim, 2016, 62: 725–728. DOI:10.18097/pbmc20166206725 |
| [41] | Gong Q, Menon L, Ilina T, et al. Interaction of HIV reverse transcriptase ribonuclease H with an acylhydrazone inhibitor[J]. Chem Biol Drug Des, 2015, 77: 39–47. |
| [42] | Sanchez TW, Debnath B, Christ F, et al. Discovery of novel inhibitors of LEDGF/p75-IN protein-protein interactions[J]. Bioorg Med Chem, 2013, 21: 957–963. DOI:10.1016/j.bmc.2012.12.012 |
| [43] | Carcelli M, Rogolino D, Gatti A, et al. Chelation motifs affecting metal-dependent viral enzymes: N'-acylhydrazone ligands as dual target inhibitors of HIV-1 integrase and reverse transcriptase ribonuclease H domain[J]. Front Microbiol, 2017, 8: 440–450. |
| [44] | Tumey LN, Bom D, Huck B, et al. The identification and optimization of a N-hydroxy urea series of flap endonuclease 1 inhibitors[J]. Bioorg Med Chem Lett, 2005, 15: 277–281. DOI:10.1016/j.bmcl.2004.10.086 |
| [45] | Kankanala J, Kirby KA, Huber AD, et al. Design, synthesis and biological evaluations of N-hydroxy thienopyrimidine-2, 4-diones as inhibitors of HIV reverse transcriptase-associated RNase H[J]. Eur J Med Chem, 2017, 141: 149–161. DOI:10.1016/j.ejmech.2017.09.054 |
| [46] | Williams PD, Staas DD, Venkatraman S, et al. Potent and selective HIV-1 ribonuclease H inhibitors based on a 1-hydroxy-1, 8-naphthyridin-2(1H)-one scaffold[J]. Bioorg Med Chem Lett, 2010, 20: 6754–6757. DOI:10.1016/j.bmcl.2010.08.135 |
| [47] | Sun L, Gao P, Dong G, et al. 5-Hydroxypyrido[2, 3-b]pyrazin-6(5H)-one derivatives as novel dual inhibitors of HIV-1 reverse transcriptase-associated ribonuclease H and integrase[J]. Eur J Med Chem, 2018, 6: 714–724. |
| [48] | Velthuisen EJ, Johns BA, Gerondelis P, et al. Pyridopyrimidinone inhibitors of HIV-1 RNase H[J]. Eur J Med Chem, 2014, 83: 609–616. DOI:10.1016/j.ejmech.2014.06.061 |
 2019, Vol. 54
2019, Vol. 54


