2. 中国医学科学院药物研究所, 北京 100050
2. Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China
衰老是生命过程中的一种自然现象, 其本质是生物机体细胞、组织和器官等的结构和功能在内外众多因素刺激下, 随着年龄的增长所发生的循序渐进的自然退化过程[1]。近年来, 由衰老引发的糖尿病、脂质代谢异常等代谢性疾病及阿尔茨海默症、帕金森病等与认知相关的功能性障碍疾病发病率不断攀升, 已经严重影响人们的生活, 成为危害人类生命健康的主要挑战之一[1, 2]。随着科技的飞速发展, 人们物质生活条件改善, 医疗水平不断发展, 人类平均寿命延长, 人口老龄化不断加剧, 所带来的养老负担及高发率的老年病对我国的社会、经济等方面的发展产生了一些负面影响, 已成为我国亟待解决的问题之一[3]。现阶段, 国内外科研工作者对抗衰老和具有抗衰老活性的天然产物的研究还远远不够。因此, 积极探索和开发抗衰老药物对提高老年人的生命质量、减缓社会人口老龄化具有重要意义[4]。
黄酮类化合物(flavonoids)是一类在多种天然植物中广泛存在的酚类化合物, 其结构中含有C6-C3-C6的基本骨架, 且大多数以2-苯基色原酮结构为基本母核, 具有广泛的药理活性, 如抗氧化、抗衰老、抗肿瘤、抗菌、抗炎、抗癌和调节血管渗透等[5, 6], 其在药品、化妆品及保健品中具有广阔的市场前景。近年来, 在黄酮类化合物抗衰老作用的研究方面, 许多科研工作者发现这类活性成分能够延缓神经系统、免疫器官、生殖系统、肝脏和皮肤等组织的衰老[7], 但由于衰老过程本身所具有的复杂性及不确定性, 目前对于这类物质抗衰老的作用机制尚未完全清楚。因此, 本文将以现代衰老学说为基础, 从细胞信号转导通路和代谢通路两方面探讨中药黄酮类化合物的抗衰老作用及其涉及的作用机制。
1 基于现代衰老学说的中药黄酮类化合物抗衰老作用的研究现代科研工作者提出了诸多衰老学说, 但由于衰老是机体内外多因素共同刺激而引起的生物学过程, 其具有的复杂性及不确定性使其不能用单一机制进行阐释[8], 至目前为止, 仍没有一种学说能完整清楚地解释黄酮类物质抗衰老的作用机制, 可能是多途径的协同作用, 必须进行多方面、多层次的深入探索。
1.1 自由基学说在大量实验证据的基础上, 现代衰老学说中自由基学说最受重视。该学说指出, 机体细胞在正常代谢过程中产生较多的活性氧自由基(reactive oxygen species, ROS), 适量的自由基有利于机体抗炎、灭菌和抑制肿瘤等作用[9], 随着衰老的发生, 超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)和过氧化氢酶(catalase, CAT)等内源性抗氧化酶活性降低, 清除自由基能力减弱, 使得体内ROS积累。ROS作为强氧化剂会引起蛋白质、核酸变性和脂质过氧化, 其代谢产物丙二醛(malondialdehyde, MDA)含量增加, 进而增强氧化应激损伤细胞和组织, 导致或加速衰老[10]。其中, 细胞衰老过程是借助于细胞信号转导通路实现的, 这些通路中涉及的关键因子、蛋白发生变化, 细胞的增殖凋亡过程也会受到影响[11]。机体内某些氨基酸, 如牛磺酸、谷氨酸等均会减缓机体氧化应激延缓衰老。黄酮类化合物的抗衰老作用与机体自由基的清除能力及抑制脂质过氧化密切相关。已有研究[12]证明抗氧化剂通过清除自由基预防不同机制引起的自由基损伤。黄芩[13]、草豆蔻[14]、红景天[15]和淫羊藿[16]等中药中含有的黄酮类活性成分可作为优良的活性氧清除剂及脂质抗氧化剂, 能直接通过结构中的酚羟基阻断自由基链反应, 减少自由基的产生; 还可通过增强内源性抗氧化酶的活性, 促进机体内积聚的自由基分解, 清除过多的自由基, 并抑制脂质过氧化, 减缓过氧化脂质和MDA等代谢物对机体的伤害, 进而发挥抗衰老的功效。
近年来, 不断有研究发现中药黄酮类化合物通过清除过多的自由基, 减缓氧化应激, 保护衰老机体的脑、肝、睾丸和皮肤等组织, 与自由基学说密切相关, 支持这一学说的实验证据也最丰富。脑组织是高耗氧器官, 在代谢过程中产生较多的ROS, 衰老机体内酶活性降低, 自由基清除能力减弱引起氧化应激损伤, 进而使神经细胞死亡, 最终导致脑衰老, 影响机体学习记忆能力。研究发现如淫羊藿总黄酮[2]、柿叶黄酮[17]、苦参总黄酮[18]和大豆黄酮[19]等黄酮类化合物均可以保护神经细胞免受ROS的攻击, 提高脑组织中SOD和GSH-Px的活性, 增强清除自由基的能力, 降低脑内MDA含量, 减弱其对脑组织的损伤, 改善学习记忆能力, 延缓衰老。肝脏作为机体最大的代谢器官, 具有很强的新陈代谢能力, 容易受到氧自由基的攻击, 可用于探讨衰老机制和药效评价分析。曹瑞珍等[20]发现连续6周每日给予0.375 g·mL-1地锦草总黄酮可明显降低肝脏组织的MDA含量, 增强SOD和GSH-Px的活性, 提高衰老大鼠肝脏的抗氧化能力。侯广月等[21]发现黄芩中含有的黄酮成分可以提高肝组织总抗氧化能力进而保护肝脏, 此外, 草豆蔻总黄酮[14]、苦丁茶黄酮[22]、铁筷子总黄酮[23]和红景天总黄酮[24]等均能干预衰老机体中肝脏的抗氧化酶活性, 保护肝脏延缓衰老。睾丸组织出现退行性变化是机体衰老的一个特征, 韩贵芳等[25]发现, 给药4个月淫羊藿总黄酮能够改善衰老大鼠的睾丸损伤, 减轻炎症反应, 能明显保护睾丸组织; 曹瑞珍等[26]发现, 连续8周每日给予0.25 g·mL-1地锦草总黄酮能提高D-半乳糖(D-galactose, D-gal)致衰老小鼠性腺组织的SOD活性, 降低MDA含量, 提高睾丸组织的抗氧化能力, 延缓衰老。皮肤是衰老最易察觉的组织器官, 陈慧等[27]发现欧亚旋覆花总黄酮可提高D-gal致衰老小鼠皮肤组织中SOD、CAT和GSH-Px的活性并降低MDA含量, 抑制脂质过氧化延缓皮肤组织衰老; 谭文波等[28]发现木瓜黄酮能增加老年小鼠的皮肤指数及皮肤组织中羟脯氨酸和SOD含量, 降低MDA和脂褐质含量, 维持皮肤正常的形态、结构和功能, 具有明显的抗皮肤衰老作用。
1.2 免疫学说免疫学说是近年来的研究热点, 该学说认为免疫功能减弱是衰老的原因之一[29]。随着衰老的发生, 免疫器官胸腺会萎缩, 机体内免疫细胞如T细胞数量减少, B细胞产生抗体的活性也减弱, 使机体免疫力降低[24]。中药黄酮类成分能改善衰老生物免疫器官的萎缩, 促进免疫细胞的增殖分化, 增强细胞内抗氧化能力来提高机体免疫功能, 延缓免疫系统的衰老。段亚平等[23]发现, 连续3周每日分别给予高、低(0.5、0.25 g·kg-1)剂量铁筷子总黄酮均可以增加给予6周D-gal致衰老小鼠脾脏、胸腺的脏器指数, 减缓器官萎缩, 提示铁筷子总黄酮抗衰老的作用途径之一可能是增强免疫; 曾满红等[24]发现, 连续给药6周红景天总黄酮可以提高衰老大鼠脾、胸腺指数及T、B淋巴细胞增殖能力, 改善免疫器官的萎缩, 增强免疫功能从而延缓衰老。
1.3 炎性学说炎性学说的提出则为衰老发生机制的研究提供了一个新的领域。有研究[30]发现老年人血清中炎症因子如白细胞介素-6 (interleukin-6, IL-6)和肿瘤坏死因子α (tumor necrosis factor-alpha, TNF-α)等含量升高, 而这与冠心病、糖尿病及认知障碍性疾病等衰老相关疾病相关。马莹娟等[17]发现, 柿叶黄酮类化合物能够明显降低亚急性衰老小鼠脑组织中TNF-α、白细胞介素1β (interleukin-1 beta, IL-1β)的表达, 降低脑内炎症水平, 改善衰老小鼠的学习记忆能力, 具有延缓脑衰老的作用。ROS激活可诱导炎症因子TNF-α、IL-1β和IL-6等的表达[17]。此外, 衰老的自由基学说与炎性学说之间存在着联系。衰老机体的三羧酸循环会发生紊乱, 细胞中的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)的数量减少, 这一过程导致机体氧化应激反应增加, 机体代谢异常, 伴随着细胞信号的功能衰退, 炎性反应增加, 最终加速衰老相关疾病的发生[31]。中药黄芩主要活性成分为黄酮类物质, 高光武等[32]发现中药黄芩通过抑制MDA的生成进而影响炎症介质的产生与释放, 发挥其抗炎的作用。
综上所述, 黄酮类化合物抗衰老作用与现代衰老学说中的自由基学说、免疫学说及炎性学说有关, 3种学说相辅相成、互相联系, 关系如图 1所示。黄酮类活性物质可以通过清除衰老机体中过多的自由基, 减缓氧化应激, 提高免疫能力, 影响炎症因子生成等多方面发挥抗衰老的作用。
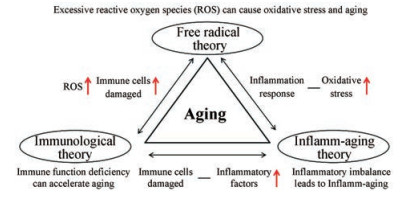
|
Figure 1 The relationship among free radical theory, inflamm-aging theory and immunological theory |
衰老是一个动态的变化过程, 现阶段的研究水平不能完全解决对衰老的认识及有效成分抗衰老作用机制研究的相关问题, 人们发现包括黄酮在内的活性物质会影响细胞的衰老过程, 为了更好地了解这类活性物质抗衰老的机制, 将在现代衰老学说的基础上, 从细胞信号转导通路[33]及代谢通路两方面进行探讨。
2.1 基于信号通路的中药黄酮类化合物抗衰老作用的研究衰老细胞的数量在不同组织器官中均会随着年龄的增长而增加[34]。在自由基学说的基础上, 衰老机体内抗氧化酶活性降低, 体内积聚的ROS会作为强氧化剂, 引起蛋白质和核酸变性等, 增强氧化应激损伤细胞, 加速衰老。在炎性学说的基础上, 衰老机体的氧化应激反应增加, 细胞信号功能衰退, 炎性反应增加, 最终加速衰老及相关疾病的产生。目前研究[35]发现中药黄酮类物质抗衰老涉及的相关信号通路主要有:哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路、NF-κB (nuclear factor kappa-B, NF-κB)信号通路、沉默信息调控因子2相关酶1 (silent mating type information regulation 2 homolog-1, SIRT1)信号通路、磷酸酰肌醇激酶/丝氨酸激酶(phosphoinositide 3-kinase/Akt, PI3K/Akt)信号转导通路、腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)信号通路和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路等。
2.1.1 基于MAPK信号通路的中药黄酮类化合物抗衰老作用的研究丝裂原活化蛋白激酶(MAPKs)是丝氨酸/苏氨酸蛋白激酶, 是重要的信号转导酶, 参与调节细胞凋亡、细胞增殖分化和衰老等[36]。任意激活MAPK信号通路中由关键因子氨基末端激酶(Jun N-terminal kinase, JNK)、细胞外信号调节激酶(extracellular signal-regulated kinase, ERK1/2)或p38丝裂原活化蛋白激酶(p38MAPK)介导的3条途径之一, 均会促进炎症因子的产生, 活化NF-κB信号通路进而加剧炎症反应[2]。黄酮类活性成分能够抑制该信号通路的激活, 减少炎症反应, 发挥抗衰老作用, 这与现代衰老学说中的炎性学说密切相关。杨晓露等[37]发现, 甘草总黄酮能显著抑制细胞中炎症因子的表达, 下调激活MAPK信号通路中磷酸化的ERK (p-ERK)蛋白表达, 通过调控ERK/MAPK通路发挥抗炎、抗氧化作用, 延缓衰老。此外, MAPK信号通路可能与mTOR、NF-κB等信号通路结合共同发挥抗衰老作用。Sun等[38]发现, 汉黄芩苷能调节p-ERK和p-p38的表达, 参与MAPK信号通路的表达, 抑制激活mTOR, 通过MAPK-mTOR途径诱导自噬而部分抑制细胞生长; 宋来新等[2]发现, 给予不同剂量(10、20 mg·kg-1)的淫羊藿总黄酮均可降低衰老大鼠脑细胞中磷酸化的JNK、ERK1/2、p38MAPK蛋白表达及与NF-κB相关炎症因子的表达, 通过抑制MAPK/NF-κB信号通路延缓脑衰老; Sahu等[39]发现, 黄芩素阻断了肾细胞中ERK、JNK和p38的活化, 同时显著抑制TNF-α和IL-6等促炎因子的释放, 抑制IκB激酶(inhibitor of nuclear factor kappa-B kinase, IKK)磷酸化和NF-κB抑制蛋白(inhibitor of nuclear factor kappa-B-α, IκB-α)降解减弱NF-κB活化, 通过抑制MAPK/NF-κB信号通路改善肾脏炎症, 延缓肾衰老。
2.1.2 基于NF-κB信号通路的中药黄酮类化合物抗衰老作用的研究NF-κB是炎症信号通路的分子开关, 介导先天免疫细胞和淋巴T细胞的增殖分化[40, 41], 失调的NF-κB信号通路会增加机体内炎症因子TNF-α、IL-1β、环氧化酶2 (cyclooxygenase-2, COX-2)等产生, 以及p21基因、Bcl-2和Bcl-2相关蛋白(Bcl-2-associated X protein, Bax)等的表达, 进而加速炎性衰老。该信号通路与现代衰老学说中炎性衰老学说和免疫学说有一定的联系。研究发现, 如淫羊藿总黄酮[2]和红景天总黄酮[24]等黄酮类化合物能降低机体内炎性因子及相关蛋白的表达, 通过抑制NF-κB表达, 减轻氧化应激诱导的细胞损伤, 改善组织炎症反应, 发挥抗衰老作用。Zhang等[42]发现, 汉黄芩苷能降低小鼠肺组织NF-κB p65和IκB的蛋白磷酸化表达, 通过抑制NF-κB信号通路发挥抗炎作用, 改善肺损伤。Sahu等[39]发现黄芩素显著抑制TNF-α、IL-6等促炎因子的释放, 抑制IKK磷酸化和IκB-α降解, 减弱NF-κB活化, 改善肾脏炎症, 延缓肾衰老。NF-κB信号转导通路调节T淋巴细胞的增殖作用, 反映了免疫衰老[40]。夏世金等[43]发现, 淫羊藿总黄酮通过增强衰老大鼠脾淋巴细胞NF-κB的活性及p65蛋白表达来降低淋巴细胞凋亡率, 参与调节免疫衰老发生作用。
2.1.3 基于PI3K/Akt信号通路的中药黄酮类化合物抗衰老作用的研究PI3K/Akt信号转导通路是细胞内重要的通路之一, 参与调控细胞分化、增殖和凋亡等多种生理活动, 常与转录因子NF-E2相关因子2 (nuclear factor erythroid 2-related factor 2, Nrf2)共同作用调节氧化应激造成的细胞损伤, 激活该通路可延缓机体衰老[44], 与衰老学说中自由基学说存在着一定联系。Zhang等[45]发现, 连续8周每日给予50 mg·kg-1柚皮素能提高Nrf2、磷酸化的PI3K (p-PI3K)和磷酸化的Akt (p-Akt)的表达, 并诱导其下游蛋白血红素加氧酶1 (heme oxygenase 1, HO-1)和NAD(P) H-醌氧化还原酶1 [NAD(P)H-quinone oxidoreductase1, NQO1]的表达, 通过激活PI3K/Akt/Nrf2信号通路, 改善衰老小鼠的认知功能障碍和神经损伤; 赖文芳等[46]发现红景天苷干预病变大鼠脑组织后, 激活PI3K/Akt信号通路, 促进Akt的磷酸化, 激活Nrf2的核转录, 促进HO-1的表达, 进而抑制神经细胞凋亡, 改善神经功能; 张金平等[47]发现红景天苷可能通过激活PI3K/Akt进而调控缺氧诱导因子-1α (hypoxia inducible factor-1α, HIF-1α)的稳定表达来抑制心肌细胞凋亡, 延缓组织衰竭; Zhang等[48]发现紫铆黄酮能激活PI3K/Akt信号通路, 进而影响Nrf2介导的Mn SOD基因表达, 上调SOD蛋白表达, 从而减弱线粒体氧化应激反应; Ali等[49]发现花青素通过激活PI3K/Akt/Nrf2信号转导通路进而降低ROS水平, 减轻氧化应激引起的细胞损伤及阿尔茨海默病小鼠的神经退行性改变, 延缓衰老。此外, 黄酮类物质还可调控PI3K/Akt信号通路与其他信号通路结合共同发挥作用。有研究[47]表明红景天苷通过调节HIF-1α的表达, 抑制ROS的生成, 上调mTOR活性及下游分子, 进而激活PI3K/Akt信号通路对抗氧化损伤。
2.1.4 基于SIRT1信号通路的中药黄酮类化合物抗衰老作用的研究沉默信息调节因子2相关酶1 (SIRT1)是一种依赖NAD+的去乙酰化酶, 参与细胞增殖、代谢和凋亡等生理活动, 是沉默信息调节因子2 (SIR2)的同源物[50]。有研究[51]表明, 激活SIRT1信号通路能延长生物寿命, 可直接调节NF-κB信号通路参与调控衰老进程, 也可通过调控线粒体功能和减少氧化应激损伤延缓衰老, 这与现代衰老学说中涉及的自由基学说及炎性学说有一定的联系。已有多项研究表明, 中药黄酮类物质能够激活SIRT1信号通路, 并可能与其他通路结合共同发挥抗衰老作用。陈慧等[27]发现, 连续6周每日给予0.5 mL不同剂量(100、200和400 mg·kg-1)的欧亚旋覆花总黄酮能提高衰老小鼠皮肤组织中SIRT1和细胞周期蛋白D1 (Cyclin D1)的表达, 推测该黄酮可能调控SIRT1的表达, 延缓衰老; Gao等[52]发现, 红景天苷可以上调衰老大鼠海马组织中SIRT1的表达, 下调TNF-α、IL-1β的表达, 对海马组织产生保护作用, 推测衰老引发的记忆障碍和炎症反应与SIRT1/NF-κB信号通路有关; 李靳等[53]发现, 单给淫羊藿总黄酮后, 细胞内SIRT1、SIRT3和PPARγ共激活因子-1α (PPARγ coactivator-1α, PGC-1α)蛋白表达升高, 延缓心肌细胞衰老, 推测其抗衰老机制与调节SIRT1/PGC-1α和SIRT3信号通路相关。
2.1.5 基于mTOR信号通路的中药黄酮类化合物抗衰老作用的研究mTOR是细胞内的一种丝氨酸/苏氨酸蛋白激酶, 是细胞内生理病理过程的关键调控分子, 参与调节细胞自噬过程[54], 其可形成两种不同蛋白质复合物的催化亚基mTOR复合物1 (mTORC1)和2 (mTORC2), 在维持细胞线粒体能量稳态中发挥重要的作用, 其中mTORC1控制几种转录因子的活性, 调节细胞氧化应激, 与自由基学说存在一定联系, mTORC2信号传导下游的主要信号传导途径[55]。mTOR信号通路失调与许多衰老相关疾病的发生密切相关, 抑制mTOR的活性能诱导自噬并抑制细胞生长, 可以延缓衰老[56]。李平等[57]发现, 连翘黄酮通过下调mTOR的蛋白水平, 上调Bax及细胞自噬因子等的表达水平, 促进细胞自噬性死亡, 进而抑制胃癌细胞的增殖; Sun等[38]推测汉黄芩苷是通过调节MAPK信号通路的表达抑制mTOR的激活, 诱导自噬而抑制癌细胞生长; 冯海一等[58]发现, 珍珠梅黄酮能显著降低肝癌细胞中p-Akt和p-mTOR蛋白表达, 诱导细胞凋亡, 作用机制可能与抑制Akt/mTOR信号通路有关。因mTOR过度活化与衰老、肿瘤等的发生密切相关[59], 黄酮类化合物在mTOR信号通路抗衰老的具体作用机制仍需进一步研究。
2.1.6 基于AMPK信号通路的中药黄酮类化合物抗衰老作用的研究AMPK是细胞能量代谢的关键分子, 机体内腺苷一磷酸/腺苷三磷酸(AMP/ATP)比值升高能够激活AMPK信号通路, 该通路能延缓衰老的原因可能在于磷酸化后的AMPK可激活下游靶分子参与调节糖代谢、氨基酸代谢和脂质代谢等能量代谢过程[60, 61]。升高AMP/ATP比值, 主要采取两种方式:一是减少ATP的消耗, 主要表现为抑制糖原、脂肪和胆固醇的合成等, 二是增加AMP的产生, 主要表现为促进脂肪酸氧化、糖酵解等[61]。此外, 自噬基因Lc3Ⅱ和Beclin1的表达量可反映自噬的发生水平, AMPK是一种常见的自噬诱导剂, 通过调节细胞自噬延缓衰老。陈静等[62]发现, 淫羊藿总黄酮能升高自然衰老大鼠小肠p-AMPK、Lc3Ⅱ和Beclin1的表达, 活化AMPK信号通路, 通过上调AMPK介导的自噬, 改善衰老大鼠肠道黏膜屏障功能障碍。AMPK还会与其他信号通路结合共同发挥抗衰老作用。如AMPK能增加NAD+浓度进而激活SIRT1, SIRT1随即激活其下游分子, 其中NAD+浓度增加会减缓氧化应激反应, 减弱炎性反应从而干预衰老进程, 该通路与炎性学说及自由基学说存在联系。韩贵芳等[25]发现, 淫羊藿总黄酮可促进AMPK磷酸化, 上调SIRT1表达, 抑制NF-κB活性, 减少炎症因子的表达, 推测其通过AMPK/SIRT1/NF-κB信号通路减轻自然衰老大鼠睾丸组织的炎症反应。
细胞衰老与机体衰老密切相关。综上所述, 中药黄酮类物质主要通过调节细胞中关键因子及相关蛋白表达, 进而调控信号通路, 如激活AMPK、SIRT1和PI3K/Akt信号通路, 抑制mTOR、MAPK和NF-κB信号通路等, 参与免疫、炎症反应等过程, 保护细胞发挥抗衰老作用。本文中涉及的中药黄酮类化合物调节相关细胞信号转导通路如图 2所示。
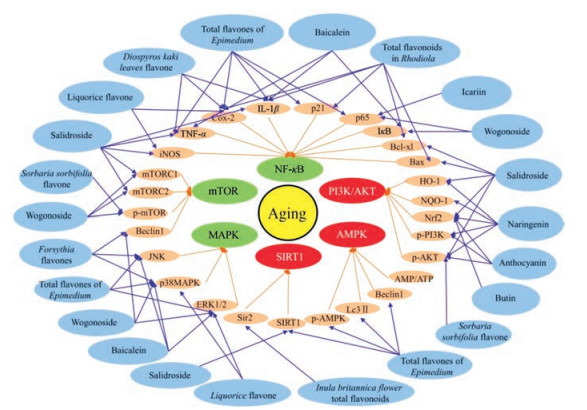
|
Figure 2 Several cellular signaling pathways influenced by flavonoids in traditional Chinese medicine. Signaling pathways in red and green respectively represent significant activated and inhibited by flavonoids, which could activate adenosine monophosphate-activated protein kinase (AMPK), silent mating type information regulation 2 homolog-1 (SIRT1), phosphoinositide 3-kinase/Akt (PI3K/Akt) signaling pathways, and inhibit mammalian target of rapamycin (mTOR), mitogen-activated protein kinase (MAPK) and nuclear factor kappa-B (NF-κB) signaling pathways |
自由基学说认为, 由于机体自由基代谢失衡, 导致组织器官结构和功能发生紊乱, 机体氨基酸代谢及能量代谢紊乱, 引起机体衰老[25]。代谢组学能从整体水平揭示中药活性成分治疗疾病时生物体内代谢物及代谢通路的改变[63]。目前基于代谢组学的中药黄酮类化合物抗衰老机制的研究对象常以衰老模型的尿液、血液和组织等为主, 通过监测衰老机体代谢物的变化, 寻找涉及的代谢通路, 为进一步研究这类活性成分的作用机制提供新的思路和方法。通过对找到的潜在差异代谢物进行通路分析, 发现黄酮类成分干预衰老主要涉及以下几种通路:三羧酸循环、丙酮酸代谢、牛磺酸和亚牛磺酸代谢、谷氨酸与谷氨酰胺代谢等, 其中三羧酸循环和丙酮酸代谢主要发生在线粒体。
2.2.1 三羧酸循环三羧酸循环(tricarboxylic acid cycle, TCA)是进行有氧呼吸的生物体内普遍存在的代谢途径, 也是糖类、脂类和氨基酸代谢的最终代谢通路。其中, 柠檬酸、α-酮戊二酸和草酰乙酸等是重要的中间产物, 也可作为其他代谢途径的前体[64]。如草酰乙酸与天冬氨酸的合成有关, 草酰乙酸会影响丙酮酸的合成进而影响丙氨酸的合成。研究[4]发现, 与对照组相比, D-gal诱导的衰老模型大鼠体内与三羧酸循环相关的柠檬酸、α-酮戊二酸含量均明显降低, 说明随着机体的衰老, 三羧酸循环中间代谢物含量降低, 能量代谢水平也会受到影响。肖瀛等[65]发现, 原花青素B2能回调衰老大鼠血浆中柠檬酸、α-酮戊二酸的含量, 表明原花青素B2调节糖酵解, 使三羧酸循环趋于正常, 从而延缓衰老; 常艳芬等[66]发现, 黄芩提取物可回调三羧酸循环中间产物柠檬酸、α-酮戊二酸等代谢物的含量, 延缓衰老, 提示衰老与能量代谢相关; Aerzuya等[67]发现罗勒总黄酮可使动脉粥样硬化小鼠血清中柠檬酸水平升高, 表明其能逆转三羧酸循环的抑制过程, 调节机体正常的物质代谢与能量代谢。
2.2.2 丙酮酸代谢乙酰辅酶A (acetyl coenzyme A, CoA)是连接糖酵解和三羧酸循环的重要环节, 丙酮酸是糖酵解的产物, 在线粒体中氧化脱羧生成CoA而参与三羧酸循环, 丙酮酸代谢异常说明糖酵解和三羧酸循环发生紊乱[68]。多项研究表明衰老模型组体内丙酮酸含量较对照组明显增多, 说明参与能量代谢的丙酮酸减少, 因其主要发生在线粒体中, 提示衰老大鼠线粒体内能量代谢异常, 可能会影响到线粒体的功能, 促进老化[69]。常艳芬等[66]发现黄芩提取物能降低衰老大鼠尿液中丙酮酸含量, 表明黄芩的活性成分可能促进丙酮酸转化CoA, 使糖酵解和三羧酸循环代谢向正常恢复, 从而延缓衰老; 肖瀛等[65]发现原花青素B2能降低血浆中丙酮酸含量, 提示其可能通过保护线粒体, 促进丙酮酸转化为CoA, 调节糖酵解和三羧酸循环趋于正常, 从而延缓衰老。另外, 研究发现原花青素B2[65]、罗勒总黄酮[67]、黄芩素[70]、甘草水提物[71]和榅桲总黄酮[72]等均能回调乳酸。宋钟娟等[73]发现老年大鼠血浆中乳酸水平降低而葡萄糖含量显著升高, 可能是衰老机体对葡萄糖等营养物质的摄取利用不足而引起能量缺乏, 乳酸被氧化成丙酮酸而进入三羧酸循环, 以提供能量, 从而引起大鼠乳酸降低。丙酮酸也能在乳酸脱氢酶的作用下转化为乳酸, 衰老机体内参与能量代谢的丙酮酸含量降低, 乳酸含量也会受到影响。
2.2.3 谷氨酸与谷氨酰胺代谢谷氨酸是中枢神经系统中广泛存在的兴奋性氨基酸, 具有调节神经递质释放、学习记忆能力等生理功能; 但若谷氨酸浓度过高, 则会产生兴奋毒性, 导致神经元细胞退化、衰老及死亡[74]。此外, 谷氨酸是合成神经递质谷氨酰胺的重要前体, 谷氨酰胺参与能量代谢、生物合成以及细胞信号转导等重要生理过程, 还可通过维持组织中谷胱甘肽的储备, 保护细胞、组织免受自由基损伤, 提高机体抗氧化能力[75], 这与现代衰老学说中自由基学说相关。有研究表明衰老机体内的谷氨酰胺含量异常, 影响谷胱甘肽合成, 进而加重氧化损伤, 而谷氨酸含量明显升高, 产生兴奋毒性, 加速细胞衰老, 黄酮类活性成分通过干预谷氨酸与谷氨酰胺代谢通路延缓衰老[70, 76]。王珂欣等[70]研究发现, 在衰老大鼠的血清样本中, 谷氨酰胺含量降低, 给予黄芩素后出现回调; 宋佳等[76]对衰老大鼠的谷氨酰胺和谷氨酸含量进行测定, 发现衰老大鼠氨基酸代谢紊乱, 而黄芩花中的有效成分可以调节该代谢; Nuerhumaer等[72]发现, 榅桲总黄酮也能回调模型组血清中的谷氨酰胺水平, 推测黄酮类可能通过改善谷氨酸代谢, 增强机体抗氧化水平, 延缓衰老; 宋钟娟等[73]发现, 老年大鼠血浆中谷氨酰胺水平较青年大鼠降低, 给予沙棘提取物以后, 谷氨酰胺含量回调, 能在一定程度上逆转氨基酸代谢紊乱, 具有延缓衰老的作用。
2.2.4 牛磺酸和亚牛磺酸代谢牛磺酸对神经系统发育、学习记忆、脂质代谢和免疫功能以及维持细胞渗透压等都具有重要意义[77]。牛磺酸代谢与现代衰老学说中提及的自由基学说密切相关, 牛磺酸具有抗氧化性, 可以减缓氧化应激[78], 谷氨酰胺是体内牛磺酸的前体, 合成的牛磺酸可提高机体抗氧化能力, 减缓组织和器官的自由基损伤[67], 延缓衰老。衰老机体内谷氨酰胺含量降低, 因而牛磺酸的含量也会受到影响。若牛磺酸和亚牛磺酸含量变化、代谢异常, 则会影响记忆能力和认知能力, 加速神经元的衰老。研究发现, 中药黄酮类物质可以回调牛磺酸的含量, 参与调节牛磺酸和亚牛磺酸代谢而延缓衰老。赵凡凡等[79]研究发现, 牛磺酸代谢途径与D-gal诱导的大鼠的衰老过程有关, 并对该通路的相关蛋白进行验证, 与对照组相比, 衰老大鼠的血清和尿样中的牛磺酸含量显著降低, 而给予甘草水提物后均出现回调。Aerzuya等[67]发现, 罗勒总黄酮能增加模型组小鼠血清中谷氨酰胺和牛磺酸含量, 可增强机体抗氧化能力, 减轻自由基损伤。
2.2.5 其他代谢研究[66, 70, 71]发现, 衰老机体内氨基酸代谢紊乱, 还可能涉及以下几个代谢通路:缬氨酸、亮氨酸和异亮氨酸的生物合成; 丙氨酸、天门冬氨酸和谷氨酸代谢; 甘氨酸、丝氨酸和苏氨酸代谢; 苯丙氨酸、酪氨酸和色氨酸的生物合成等。因衰老生物体内蛋白质和激素等合成速度降低, 肠道菌群代谢活动紊乱, 所以可能吸收缬氨酸、亮氨酸、异亮氨酸和苯丙氨酸等必需氨基酸利于自身合成蛋白, 进而导致这些氨基酸的含量下降, 影响机体正常代谢循环, 加剧组织及器官的衰老[71]。支链氨基酸包括缬氨酸、亮氨酸和异亮氨酸, 在调节蛋白质合成、能量代谢等方面具有重要的作用, 其中缬氨酸在体内酶作用下分解产生的琥珀酰辅酶A可作为三羧酸循环的底物参与反应[80], 随着衰老的发生, 机体能量代谢紊乱, 可能降低缬氨酸的含量。常艳芬[35]发现, 黄芩提取物可回调衰老大鼠的血清中异亮氨酸的含量, 表明衰老与支链氨基酸的降解与合成关系密切; 赵凡凡等[71]发现, 给予甘草水提物后衰老大鼠肝组织中的缬氨酸含量升高, 表明甘草水提物能够提高衰老机体对缬氨酸的吸收与利用。刘阿娜等[80]发现, 黄芪黄酮可以回调体内发生变化的氨基酸水平, 进而间接调控三羧酸循环。
在衰老过程中, 不同的代谢途径发挥着不同的作用, 通过一些中间产物的联系, 各种代谢通路之间形成相互联系、相互协调和相互制约的代谢网络, 共同调节生理机能, 如图 3所示。中药黄酮类化合物能干预一些中间产物的代谢, 进而影响机体的氨基酸代谢、脂质代谢和糖代谢等过程。因此, 尽可能多地寻找黄酮干预后样本中的潜在差异代谢物, 找到衰老的代谢通路, 对探讨中药黄酮类物质延缓衰老的作用机制具有重要意义。

|
Figure 3 Schematic diagram of the perturbed metabolic pathways regulated by flavonoids in traditional Chinese medicine. Metabolites in red and blue represent significant increase and decrease in aging levels, respectively, compared with control. Arrows (" ↑↓" ) represent the notable increase or decrease of metabolites regulated by flavonoids in traditional Chinese medicine |
综上所述, 国内外研究者为中药黄酮类物质抗衰老作用研究已经做了大量工作, 对其抗衰老作用的机制探讨涉及其自身结构抗氧化、能量代谢和信号转导通路等多个方面。主要是通过提高机体内抗氧化酶活性增强清除过多自由基的能力、调控相关蛋白和基因的表达进而作用于相关信号通路、影响细胞凋亡蛋白来抑制机体脂质过氧化, 从而发挥抗衰老作用。
虽然代谢组学为中药黄酮类抗衰老的作用机制提供了新的技术和思路, 但目前仍存在一些问题: ①现有技术能指认的差异代谢物有限, 不能完全分析代谢物谱图, 且无法剔除中药成分对内源性代谢物的干扰; ②大部分研究属于非靶标代谢组学, 需要通过靶标代谢组学及分子生物学手段, 对找到的差异代谢物和代谢通路进行定量验证, 以证明代谢通路的准确性。
含有黄酮类成分的中药分布非常广泛, 其在药品、化妆品及保健品中具有广阔的市场前景。对这类化合物进行抗衰老的作用及机制深入研究, 有利于探索和开发抗衰老药物进而提高老年人的生命质量、减缓社会人口老龄化。因此, 对其深度开发与利用具有重要意义。
| [1] | Tang MW, Hu F. Research progress on the role of mTOR signaling pathway in the occurrence of aging related metabolic diseases[J]. Geriatr Health Care (老年医学与保健), 2017, 23: 458–462. |
| [2] | Song LX, Zhang CC, Wang T, et al. Total flavonoids of Epimedium attenuate aging-related inflammation in rat brain by inhibiting MAPK/NF-κB signaling pathway[J]. Chin Pharmacol Bull (中国药理学通报), 2017, 33: 84–90. |
| [3] | Li L, Yao JP, Feng YM. Advances in senescence related signaling pathways and TCM research[J]. Guangming J Chin Med (光明中医), 2017, 32: 1214–1218. |
| [4] | Chen P, Chen FC, Wu Y, et al. Screening and metalizing pathway of biomarkers of urinary metabonomics in D-galactose induced aging rats intervened by ellagicacid[J]. Chin J Hosp Pharm (中国医院药学杂志), 2018, 38: 923–929. |
| [5] | González-Gallego J, García-Mediavilla MV, Sánchez-Campos S, et al. Anti-inflammatory and immunomodulatory properties of dietary flavonoids[M]//Watson RR, Preedy VR, Zibadi S. Polyphenols in Human Health and Disease. New York: Academic Press, 2014: 435-452. |
| [6] | Guan LP, Liu BY. Antidepressant-like effects and mechanisms of flavonoids and related analogues[J]. Eur J Med Chem, 2016, 121: 47–57. DOI:10.1016/j.ejmech.2016.05.026 |
| [7] | Si JZ, Wang S, Zhou XL, et al. Research progress on the anti-aging effect of flavonoids in traditional Chinese medicine[J]. World J Integr Tradit West Med (世界中西医结合杂志), 2015, 10: 734–736. |
| [8] | Lu CX, Yang SJ, Tao HZ, et al. Research progress of the anti-ageing mechanism[J]. Chin J Gerontol (中国老年学杂志), 2018, 38: 248–250. |
| [9] | Ademowo OS, Dias HKI, Burton DGA, et al. Lipid (per) oxidation in mitochondria: an emerging target in the ageing process?[J]. Biogerontology, 2017, 18: 859–879. DOI:10.1007/s10522-017-9710-z |
| [10] | Gu RS, Fan HY, Wang YC, et al. Effects of soybean isoflavon on the aging in rats induced by D-galactose[J]. J Jilin Med College (吉林医药学院学报), 2013, 34: 161–164. |
| [11] | Liu C, Li N, Jing S, et al. Improvement effect of Schisandrae Chinensis Fructus-Epimedii Wushanensis Folium extract on learning-memorizing ability in D-galactose induced brain aged mice[J]. Chin J ExpTradit Med Formul (中国实验方剂学杂志), 2017, 23: 147–152. |
| [12] | Chanput W, Krueyos N, Ritthiruangdej P, et al. Anti-oxidative assays as markers for anti-inflammatory activity of flavonoids[J]. Int Immunopharmacol, 2016, 40: 170–175. DOI:10.1016/j.intimp.2016.08.038 |
| [13] | Song HR, Cheng JJ, Miao H, et al. Scutellaria flavonoid supplementation reverses ageing-related cognitive impairment and neuronal changes in aged rats[J]. Brain Inj, 2009, 23: 146–153. DOI:10.1080/02699050802649670 |
| [14] | Wu Z, Chen YS, Wang QB. Antioxidant activity of total flavonoids from Alpiniakatsumadai Hayata in vitro and in vivo[J]. Her Med (医药导报), 2011, 30: 1406–1409. |
| [15] | Xu H, Yin WW, Ding D. Experimental study on the function of Mountain Crenulin Saponins delaying aging[J]. Zhejiang Chin Med Univ (浙江中医药大学学报), 2011, 35: 248–249, 252. |
| [16] | Li J, Zhang CC, Yang L, et al. Protective effect of total flavonoids of Epimedium on D-galactose-induced senescence in H9c2 cells[J]. J Chin Med Mater (中药材), 2014, 37: 2255–2258. |
| [17] | Ma YJ, Shang YY, Wang DJ, et al. Neuroprotective effects of flavonoids extracted from the leaves of Diospyros kakiin D-galactose induced aging mice by attenuating oxidative stress and neuroinflammation[J]. Fudan Univ J Med Sci (复旦学报医学版), 2015, 42: 7–12, 30. |
| [18] | Fan HY, Gu RS, Ren K, et al. Effect of flavonoids from Sophora flavescensin aging mice induced by D-galactos[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 4240–4244. |
| [19] | Cai JL, Shan Q, Lu J, et al. Regulation of daidzein on oxidative damage levels in the brain of aged mice[J]. J Tianjin Univ Sci Technol (天津科技大学学报), 2012, 27: 18–22. |
| [20] | Cao RZ, Wei YC, Zhang GW, et al. Antioxidant effects of total flavonoids from Euphorbiae humifusae willd on D-galactose aging model mice[J]. J Hyg Res (卫生研究), 2007, 36: 387. |
| [21] | Hou GY, Zheng Z, Song FR, et al. Investigation on inhibitory capacities of seventeen herbal extracts on oxidative stress using ultraviolet and fluorescence spectroscopy[J]. Spectrosc Spect Anal (光谱学与光谱分析), 2015, 35: 680–683. |
| [22] | Zhao X, Yi RK, Sun P, et al. Improvement effects of Kuding tea flavonoids extracts on D-galactose induced mice aging[J]. Sci Technol Food Ind (食品工业科技), 2017, 38: 303–308. |
| [23] | Duan YP, Li Y, Li SZ. The anti-aging effect of total flavonoids from Chimonanthus praecoxon aging mice induced by D-galactose[J]. West China J Pharm Sci (华西药学杂志), 2013, 28: 456–458. |
| [24] | Zeng MH, Huang QS, Zhang DX. Effect of total flavonoids fromrhodiola on antioxidant and immune function of natural aging rats[J]. Anat Res, 2012, 34: 135–137. |
| [25] | Han GF, Zhang CC, Chen Q, et al. Total flavonoids of Epimedium reduce inflammatory reaction via AMPK/SIRT1/NF-κB signaling pathway in testes of natural aging rats[J]. Nat Prod Res Dev (天然产物研究与开发), 2018, 30: 1489–1493. |
| [26] | Cao RZ, Wei YC, Zhang GW, et al. Effects of total flavonoids from Herba Euphorbiae Humifusae on telomerase expression in senescent mice[J]. West China J Pharm Sci (华西药学杂志), 2011, 26: 189–190. |
| [27] | Chen H, Long YY, Guo L. Anti-aging effect of Inula britannica flower total flavonoids on mice in D-galactose induced aging model[J]. J Chongqing Med Univ (重庆医科大学学报), 2016, 41: 1010–1015. |
| [28] | Tan WB, Lu YH, Tan G. The anti-aging effect of papaya flavonoids[J]. Chin J Gerontol (中国老年学杂志), 2012, 32: 5218–5219. |
| [29] | Fulop T, Witkowski JM, Pawelec G, et al. On the immunological theory of aging[J]. Interdiscip Top Gerontol, 2014, 39: 163–176. DOI:10.1159/000358904 |
| [30] | Singh T, Newman AB. Inflammatory markers in population studies of aging[J]. Ageing Res Rev, 2011, 10: 319–329. DOI:10.1016/j.arr.2010.11.002 |
| [31] | Liu CL, Wang JH. Progress of metabolic in senescence research[J]. China Med Herald (中国医药导报), 2019, 16: 57–60. |
| [32] | Gao GW, Li L. Study on the anti-inflammatory effect and mechanism of the extract of Scutellaria baicalensis Georgi[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2014, 30: 550–552. |
| [33] | Zhao FF, Zhou YZ, Gao L, et al. Advances in the study of the rat model of aging induced by D-galactose[J]. Acta Pharm Sin (药学学报), 2017, 52: 347–354. |
| [34] | Shan TJ, Sun J, Liang HH, et al. Progress in the study of association between cellular senescence and organ fibrosis[J]. Acta Pharm Sin (药学学报), 2019. DOI:10.16438/j.0513-4870.2019-0017 |
| [35] | Chang YF. 1H NMR Based Metabonomic Study of the Anti-aging Effects of Scutellariabaicalensis Georgi (基于代谢组学的黄岑抗衰老作用评价及机制研究)[D].Taiyuan: Shanxi University, 2016. |
| [36] | Kim EK, Choi EJ. Pathological roles of MAPK signaling pathways in human diseases[J]. Biochim Biophys Acta, 2010, 1802: 396–405. DOI:10.1016/j.bbadis.2009.12.009 |
| [37] | Yang XL, Liu D, Bian K, et al. Study on in vitro anti-inflammatory activity of total flavonoids from Glycyrrhizae Radix et Rhizoma and its ingredients[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 99–104. |
| [38] | Sun YJ, Zou MJ, Hu C, et al. Wogonoside induces autophagy in MDA-MB-231 cells by regulating MAPK-mTOR pathway[J]. Food Chem Toxicol, 2013, 51: 53–60. DOI:10.1016/j.fct.2012.09.012 |
| [39] | Sahu BD, Kumar JM, Sistla R. Baicalein, a bioflavonoid, prevents cisplatin-induced acute kidney injury by up-regulating antioxidant defenses and down-regulating the MAPKs and NF-κB pathways[J]. PLoS ONE, 2015, 10: e0134139. DOI:10.1371/journal.pone.0134139 |
| [40] | Liu T, Zhang LY, Joo D, et al. NF-κB signaling in inflammation[J]. Signal Transduct Target Ther, 2017, 2: 17023. DOI:10.1038/sigtrans.2017.23 |
| [41] | Hoesel B, Schmid JA. The complexity of NF-κB signaling in inflammation and cancer[J]. Mol Cancer, 2013, 12: 86. DOI:10.1186/1476-4598-12-86 |
| [42] | Zhang L, Ren Y, Yang CL, et al. Wogonoside ameliorates lipopolysaccharide induced acute lung injury in mice[J]. Inflammation, 2014, 37: 2006–2012. DOI:10.1007/s10753-014-9932-z |
| [43] | Xia SJ, Shen ZY, Liu XY, et al. Regulatory function of nuclear factor-κB on spleen lymphocyte apoptosis in aged rats and effect of Epimedium total flavonoids[J]. Chin J Gerontol (中国老年学杂志), 2008, 28: 105–108. |
| [44] | Zhuang S, Yu RY, Zhong J, et al. Rhein from Rheum rhabarbarum inhibits hydrogen-peroxide-induced oxidative stress in intestinal epithelial cells partly through PI3K/Akt-mediated Nrf2/HO-1 pathways[J]. J Agric Food Chem, 2019, 67: 2519–2529. DOI:10.1021/acs.jafc.9b00037 |
| [45] | Zhang Y, Liu B, Chen X, et al. Naringenin ameliorates behavioral dysfunction and neurological deficits in a D-galactose induced aging mouse model through activation of PI3K/Akt/Nrf2 pathway[J]. Rejuv Res, 2017, 20: 462–472. DOI:10.1089/rej.2017.1960 |
| [46] | Lai WF, Hong HM, Zhang XQ, et al. Inhibitive effect of salidroside on nerve cell apoptosis in MACO rat through an activation of PI3K/Akt/Nrf2 pathway[J]. Chin J Tradit Chin Med Pharm (中华中医药杂志), 2016, 31: 1883–1886. |
| [47] | Zhang JP, Chen JZ, Liu AH, et al. Protective effect of salidroside on cardiomyocyte against apoptosis induced by activating HIF-1 expression via PI(3)K/Akt pathway[J]. Chin J Cell MolImmunol (细胞与分子免疫学杂志), 2008, 24: 406–408. |
| [48] | Zhang R, Chae S, Lee JH, et al. The cytoprotective effect of butin against oxidative stress is mediated by the up-regulation of manganese superoxide dismutase expression through a PI3K/Akt/Nrf2-dependent pathway[J]. J Cell Biochem, 2012, 113: 1987–1997. DOI:10.1002/jcb.24068 |
| [49] | Ali T, Kim T, Rehman SU, et al. Natural dietary supplementation of anthocyanins via PI3K/Akt/Nrf2/HO-1 pathways mitigate oxidative stress, neurodegeneration, and memory impairment in a mouse model of Alzheimer's disease[J]. Mol Neurobiol, 2018, 55: 6076–6093. DOI:10.1007/s12035-017-0798-6 |
| [50] | Yang X. The relationship between SIRTl oxidative stress pathways and disease[J]. Med J West China (西部医学), 2015, 27: 1275–1278. |
| [51] | Tang BL. Sirt1 and the mitochondria[J]. Mol Cells, 2016, 39: 87–95. DOI:10.14348/molcells.2016.2318 |
| [52] | Gao J, Zhou R, You XT, et al. Salidroside suppresses inflammation in a D-galactose-induced rat model of Alzheimer's disease via SIRT1/NF-κB pathway[J]. Metab Brain Dis, 2016, 31: 771–778. DOI:10.1007/s11011-016-9813-2 |
| [53] | Li J, Deng LL, Zhou ZY, et al. Protective effect of total saponins of Panax Notoginseng combined with total flavonoids of Epimedium on D-galactose-induced senescence of H9c2 cell[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 555–561. |
| [54] | Cai ZY, Chen GH, He WB, et al. Activation of mTOR: a culprit of Alzheimer's disease?[J]. Neuropsychiatr Dis Treat, 2015, 11: 1015–1030. |
| [55] | Yoon MS. The role of mammalian target of rapamycin (mTOR) in insulin signaling[J]. Nutrients, 2017, 9: 1176. DOI:10.3390/nu9111176 |
| [56] | Saxton RA, Sabatini DM. mTOR signaling in growth, metabolism, and disease[J]. Cell, 2017, 168: 960–976. DOI:10.1016/j.cell.2017.02.004 |
| [57] | Li P, Zhang GP, Hu JR, et al. Effects of total flavonoids from Forsythia suspense on the proliferation of gastric cancer cell MGC80-3[J]. Biotechnol Bull (生物技术通报), 2018, 34: 199–203. |
| [58] | Feng HY, Zhang X, Meng FP, et al. Studies on inducing apoptosis of hepatocellular carcinoma cells by inhibiting Akt/mTOR signaling pathway[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2018, 29: 39–41. |
| [59] | Xu SH, Cai Y, Wei YH. mTOR signaling from cellular senescence to organismal aging[J]. Aging Dis, 2014, 5: 263–273. |
| [60] | Xu W, Luo FJ. The relationship of AMPK signaling pathways and aging[J]. Chem Life (生命的化学), 2016, 36: 645–649. |
| [61] | Carling D. AMPK signalling in health and disease[J]. Curr Opin Cell Biol, 2017, 45: 31–37. DOI:10.1016/j.ceb.2017.01.005 |
| [62] | Chen J, Guo YH, Feng WM, et al. The regulation of total flavonoids in Epimedium on intestinal barrier function in naturally aged rats was studied by AMPK-mediated autophagy[J]. J Chin Med Mater (中药材), 2017, 40: 1714–1717. |
| [63] | Zhao QJ, Qiu L, Li MH, et al. Application of metabolomics in traditional Chinese medicine[J]. Hunan J Trad Chin Med (湖南中医杂志), 2018, 34: 228–230. |
| [64] | Mailloux RJ, Bériault R, Lemire J, et al. The tricarboxylic acid cycle, an ancient metabolic network with a novel twist[J]. PLoS ONE, 2007, 2: e690. DOI:10.1371/journal.pone.0000690 |
| [65] | Xiao Y, Wu QG, Yin ZT, et al. Metabonomics study on anti-aging effect of procyanidin B2 in D-galactose-induced aging in mice[J]. Food Sci (食品科学), 2018, 39: 134–139. |
| [66] | Chang YF, Gong WX, Zheng YH, et al. Urinary metabolomics study of the effects of Scutellaria Baicalensis Georgiethanol extract on D-galactose-induced rats[J]. Acta Pharm Sin (药学学报), 2016, 51: 86–92. |
| [67] | Aerzuya D, Ainiwaer W, Nuerhumaer K, et al. Serum metabonomic analysis of ApoE-/- mice treated by Ocimum Basilicum L. flavonoids based on 1H-NMR spectroscopy[J]. J Xinjiang Med Univ (新疆医科大学学报), 2018, 41: 875–878, 882. |
| [68] | Zierhut ML, Yen YF, Chen AP, et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice[J]. J Magn Reson, 2010, 202: 85–92. DOI:10.1016/j.jmr.2009.10.003 |
| [69] | Kauppila TES, Kauppila JHK, Larsson NG. Mammalian mitochondria and aging: an update[J]. Cell Metab, 2017, 25: 57–71. DOI:10.1016/j.cmet.2016.09.017 |
| [70] | Wang KX, Gao L, Duan DD, et al. Effects of baicalein on D-galactose-induced aging rats based on 1H-NMR metabonomics[J]. Chin Tradit Herb Drugs (中草药), 2016, 48: 511–518. |
| [71] | Zhao FF, Li X, Gao L, et al. Liver metabolomics study of effects of Glycyrrhizae Radix et Rhizoma extracts on D-galactose-induced rats[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 3545–3553. |
| [72] | Nuerhumaer K, Zhou WT, Aerzuya D, et al. 1H-NMR based metabolomics approach toevaluate the effect of Cydonia Oblanga Miller flavonoids on atherosclerosis ApoE-/- mice[J]. Xinjiang Med Univ (新疆医科大学学报), 2018, 41: 870–874. |
| [73] | Song ZJ, Zhou HF, Gao NZ, et al. Metabolomics mechanism of anti-aging effect of Hippophaerhamnoides L.[J]. Chin J Clin Pharm (中国临床药学杂志), 2015, 24: 9–12. |
| [74] | Nakajima Y, Iguchi H, Kamisuki S, et al. Low doses of the mycotoxin citrinin protect cortical neurons against glutamate-induced excitotoxicity[J]. J Toxicol Sci, 2016, 41: 311–319. DOI:10.2131/jts.41.311 |
| [75] | Sonnewald U, Schousboe A. Introduction to the glutamate-glutamine cycle[M]//Schousboe A, Sonnewald U. The Glutamate/GABA-Glutamine Cycle: Amino Acid Neurotransmitter Homeostasis. Cham: Springer, 2016: 1-7. |
| [76] | Song J, Pang YY, Gao L, et al. Effects of Scutellariabaicalensis Georgi flowers on D-galactose induced aging in rats based on serum metabolomics[J]. Acta Pharm Sin (药学学报), 2019, 54: 533–539. |
| [77] | El Idrissi A, Shen CH, L'Amoreaux WJ. Neuroprotective role of taurine during aging[J]. Amino Acids, 2013, 45: 735–750. DOI:10.1007/s00726-013-1544-7 |
| [78] | Aydın AF, oban J, Doğan-Ekici I, et al. Carnosine and taurine treatments diminished brain oxidative stress and apoptosis in D-galactose aging model[J]. Metab Brain Dis, 2016, 31: 337–345. DOI:10.1007/s11011-015-9755-0 |
| [79] | Zhao FF, Gao L, Qin XM, et al. The intervention effect of licorice in D-galactose induced aging rats by regulating the taurine metabolic pathway[J]. Food Funct, 2018, 9: 4814–4821. DOI:10.1039/C8FO00740C |
| [80] | Liu AN, Zhao WX, Gong LL, et al. Plasma metabonomics research of Astragalus flavonoids intervention on rats of dampness stagnancy due to spleen deficiency[J]. Chin J Anal Chem (分析化学), 2017, 45: 537–544. |
 2019, Vol. 54
2019, Vol. 54


