糖尿病肾病(diabetic kidney disease, DKD)是糖尿病患者临床常见而难治的慢性微血管并发症, 是导致终末期肾病(end-stage renal disease, ESRD)的主要原因。世界卫生组织(WHO)预估, 直至2030年, 糖尿病患者将增至4.39亿人, 而临床上超过1/3的糖尿病患者发展为DKD患者, 是糖尿病患者致残和致死的重要原因[1]。早期DKD的主要病理特征包括肾小球膜扩张、肾小球滤过率增高、微量白蛋白尿、足细胞损失、基底膜厚度增加、肾小球和肾小管细胞损伤, 继而导致肾小球硬化和间质纤维化, 最终演变为肾衰竭。因此, 针对DKD的发病机制研究以及开发新型治疗药物, 已经成为国内外医药领域研究的热点。
丹参是临床常用的活血化瘀中药, 研究表明, 丹参对肾脏具有抗肾纤维化、减轻肾脏细胞损害、调整炎症状态、改善血液流变学、缓解肾缺血再灌注损伤等作用。临床用于心脑疾病、肾功能衰竭、保肝、过敏性疾病、小儿肺炎等方面[2]。其主要活性成分为水溶性的酚酸类和脂溶性的二萜醌类成分, 药理活性评价表明丹参还具有抗肿瘤、抗菌消炎、抗雄性激素、抑制皮脂腺增生、抗肝硬化、抗纤维化、促进组织修复和再生等多种药理活性[3]。现就糖尿病肾病的发病机制以及丹参酚酸和丹参酮干预糖尿病肾病的作用机制进行归纳和总结, 以期为进一步深入研究和药物开发提供科学依据。
1 糖尿病肾病的发病机制研究概况糖尿病肾病的病理变化为早期特征性的肾小球超滤过和后期组织结构和超微结构进展性受损, 包括细胞外基质累积、肾小球膜基底膜电荷屏障受损。临床表现包括早期微量白蛋白尿, 后期进展为大量白蛋白尿。估算肾小球滤过率也随之下降, 出现慢性肾脏病(chronic kidney diseases, CKD), 最终进展为ESRD。其发病机制与多种因素密切相关, 糖基化终末产物积聚、血流动力学改变、糖代谢紊乱、氧化应激、炎性反应及细胞因子、自噬等参与了其发生、发展。研究证明基质金属蛋白酶(MMP)中, MMP-3和MMP-12与DKD的遗传变异之间存在联系。证明糖尿病肾病有遗传基础, 常染色体显性遗传是2型糖尿病常见的特征, 并且遗传因素导致了肾功能的变异[4, 5]。糖尿病肾病的发病机制见图 1。
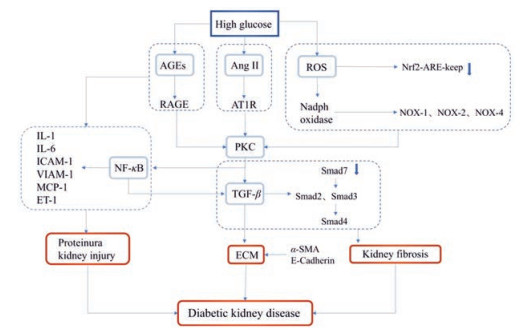
|
Figure 1 Part of the pathologic molecular mechanism of diabetic kidney disease. AGEs: Advanced glycation end products; ROS: Oxidative stress; PKC: Protein kinase C; RAGE: Receptor of advanced glycation end products; ECM: Extracellular matrix; ICAM-1: Intercellular cell adhesion molecule-1 |
在非酶条件下, 蛋白质和脂质等大分子物质的游离氨基与还原糖的醛基经过缩合、重排、裂解、氧化修饰后产生的一组稳定的终末产物[6]。在高血糖或氧化条件下, 该过程开始于可逆希夫碱加合物的转化, 然后转化为更稳定的共价结合的阿马多利重排产物[7]。这些早期糖基化产物经历进一步的反应和重排, 成为不可逆交联的荧光蛋白衍生物, 称为AGEs。研究表明, AGEs及其受体(the receptor of advanced glycation end products, RAGE)相互作用引起氧化应激反应、炎症反应和血栓的形成, 从而参与肾脏血管衰老和损伤[8]。AGEs与RAGE结合后导致肾脏的氧化应激增强, 产生自由基, 导致氧化损伤、血管收缩、促凝血状态, 促进糖尿病肾病的发生和发展[9]。
AGEs诱导的肾小球系膜细胞凋亡可能部分地导致肾小球过滤功能障碍和糖尿病的早期肾功能损伤。此外, AGEs可刺激肾小球系膜细胞中单核细胞趋化蛋白-1 (monocyte chemotactic protein-1, MCP-1)的表达[10], 且有研究表明, AGEs会引发多种促炎细胞因子和趋化因子的产生, 导致细胞的氧化应激、促炎症反应及促凝血基因的表达[11]。AGEs诱导的转化生长因子-β (TGF-β)表达在DKD的肾小球硬化和肾小管间质性纤维化的发病机制中起重要作用。研究发现, 与敲除RAGE的糖尿病小鼠相比, RAGE过表达的糖尿病小鼠具有肾功能障碍和肾小球硬化[12]。AGEs和RAGE表达在糖尿病肾脏中呈现增强的趋势, 且阻断AGE-RAGE的相互作用可减少足细胞血管内皮生长因子(vascular endothelial growth factor, VEGF)表达和蛋白尿, 其与肾小球中炎性细胞数量减少和TGF-β表达降低相关[13]。AGEs的形成和积累在DKD的血管损伤中起核心作用。抑制AGEs的形成, 阻断AGE-RAGE系统及限制食物来源的AGEs可能成为DKD新型的治疗策略。
1.2 肾脏氧化应激增加氧化应激(oxidative stress)反应是体内活性氧(ROS)产生与降解比例的不平衡, 即ROS的产生超过了局部抗氧化能力。在高糖状态下, 细胞内ROS产生的最重要的因素是单个细胞类型处理葡萄糖的能力。暴露于高糖时的细胞能够降低葡萄糖通过质膜运输到细胞质中, 以维持细胞内的葡萄糖稳态[14]。实际上, 已在糖尿病状态下的肾脏组织内的许多细胞群体中发现了葡萄糖摄取的增加[15], 包括肾小球上皮细胞、肾小球膜细胞和近端肾小管上皮细胞。血糖水平增加引起的氧化应激反应激活了五大经典途径参与了DKD的发病机制:多元醇途径、AGEs的形成增加及其活化受体表达增加、葡萄糖氧化磷酸化、蛋白激酶C (protein kinase C, PKC)的活化和己糖胺途径的过度活化。通过这些途径, 细胞内增加的ROS引起血管局部缺血反应, 激活多种促炎症途径, 并导致长期持续的表观遗传变化, 促进血糖正常化后促炎基因的持续表达(“高血糖记忆”)[16]。
除此之外, 还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)氧化酶及其亚型Nox4等因素也会诱导肾脏ROS的过度产生[17]。Nox4是糖尿病肾脏组织中ROS的主要来源。研究表明, Nox4产生的ROS参与血管紧张素Ⅱ (Ang Ⅱ)诱导的肾小球系膜细胞肥大[18]。最新研究表明, 过度激活或过度抑制机体内各类氧化剂的活性都可能加速DKD的进展, 表明氧化应激在DKD发展进程中可能是一把双刃剑, 维持其动态平衡可能是最佳选择[19]。
1.3 慢性炎症反应研究表明, DKD是一种炎症过程, 免疫细胞可能参与其病理过程[20]。糖尿病状态下, 游离脂肪酸(free fatty acid, FFA)、高血糖和肥胖等均可通过PKC和ROS途径激活NF-κB (nuclear factor-κB)[21]。NF-κB被激活后, 可上调炎症介质以及相关酶类如内皮素-1、血管细胞黏附蛋白-1、细胞间黏附分子-1、白介素-6和肿瘤坏死因子-α表达。从DKD初始阶段开始, 巨噬细胞和T细胞在肾小球和肾小管间质中积聚。高血糖诱导巨噬细胞积聚和激活可使肾小球免疫复合物沉积, 增加趋化因子产生和纤维化。研究表明, NLRP3/caspase-1/IL-1β途径对DKD起到有利的作用, 提示IL-22可能具有治疗DKD的潜力[22]。
1.4 肾素-血管紧张素系统异常肾素-血管紧张素系统(RAS)在血压控制的生理学和高血压的病理生理学中起着基本作用, 对血管紧张、钠滞留、氧化应激、纤维化、交感神经紧张和炎症均有影响。研究表明, 肾小球和近端小管内RAS可能会被高血糖激活, 刺激局部AngⅡ的产生, 这可能引发抑制全身肾素的释放。反应一旦形成, 肾内Ang Ⅱ通过与存在于肾小球、肾小管、脉管系统和间质细胞中的大量血管紧张素Ⅱ1型受体(angiotensin Ⅱ type 1 receptor, AT1R)结合, 发挥其血管紧张作用。AT1R活化可增加血管阻力, 减少肾血流量, 并刺激肾小球膜和肾小管间质细胞外基质的产生[23]。研究表明, 血管紧张素转换酶(ACE)抑制剂和AT1拮抗剂阻滞了DKD进展[24, 25]。然而一些证据表明, 糖尿病肾内RAS的激活[26]和RAS组分的肾脏表达以及肾内Ang Ⅱ的来源及其与炎症的潜在关系尚不明确。Ang Ⅱ是通过调节NF-κB和相关基因(如细胞因子、黏附分子和趋化因子MCP-1)、调控活化正常T细胞表达和分泌, 从而来参与肾脏炎症反应的一种细胞因子[27]。基于以上研究表明, Ang Ⅱ和AT1拮抗剂为DKD治疗的基石。
2 丹酚酸、丹参酮类成分干预糖尿病肾病的分子机制丹参酚酸可通过抑制TGF-β1和MCP-1来延缓肾小球纤维化发挥对DKD患者肾脏功能的保护作用, 通过调控TGF-β超家族的多功能生长和分化因子、肾小管间质激活素A (Act-A)而延缓肾脏发生纤维化。丹参酮可减轻大鼠肾小管坏死、细胞凋亡和氧化应激以及HK2细胞的氧化应激, 降低高糖状态下产生过多的ROS来减轻肾组织的损伤。丹参酮可以抑制蛋白酪氨酸磷酸酶1B (protein-tyrosine phosphatase 1B, PTP1B)的活性。而胰岛β细胞中的EphA5是PTP1B底物, 所以抑制PTP1B与胰岛β细胞的增殖、凋亡以及胰岛素的分泌有着密切联系。丹酚酸和丹参酮对糖尿病肾病的抑制作用见图 2。
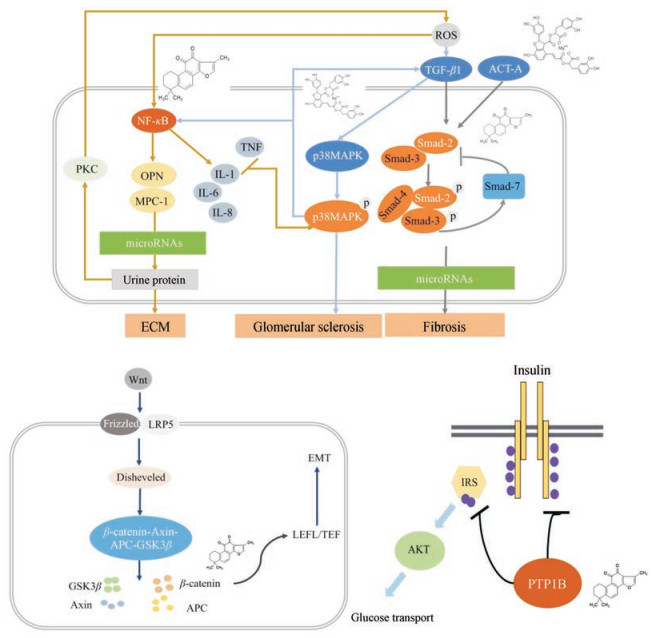
|
Figure 2 Schematic diagram of action mechanism of molecular signal pathway regulated by salvianolic acid and salvianone. OPN: Osteopontin; ACT-A: Activin-A; p38MAPK: p38 mitogen activated protein kinase; AKT: Protein kinase B; PTP1B: Protein-tyrosine phosphatase 1B; EMT: Epithelial-mesenchymal transition; IRS: Insulin receptor substrate; APC: Adenomatous polyposis coil |
Act-A又称免疫抑制因子P, 属于TGF-β超家族的多功能生长和分化因子。激活素对细胞的生理过程起到调控作用, 特别是对细胞增殖、凋亡以及代谢等的调控[28, 29], 同时也参与了多种炎症的临床发生发展过程。激活素可能影响上皮导管中的胰岛细胞的增殖及分化。激活素在调节成人α细胞及β细胞中的作用相反, 通过增加摄取或者降低葡萄糖合成以有利于糖尿病症候的缓解。激活素能够降低α细胞系、体外培养的人类胰岛细胞中葡萄糖基因的表达, 可以抑制通过抑制合成剂-ARX培育的α细胞系的增殖能力[30]。
研究证实, Act-A有在体外刺激3T3细胞增殖的能力, 表明其在纤维化方面具有一定的调节作用。Act-A的过量分泌可以引起肾脏肾小管发生纤维化, 进而引起肾脏肌纤维化, 最终引起肾脏的损害[31], 而糖尿病本身处于多种因子的刺激下, Act-A可能在肾脏的损害中起到促进作用。研究发现, 丹酚酸可以明显降低糖尿病大鼠肾脏组织中Act-A蛋白的表达, 组织炎症反应和增生反应明显减轻, 其机制可通过调控Act-A蛋白表达而实现。尽管丹参多酚酸并不是一种有效的降糖药物, 但对降低大鼠24 h尿蛋白排泄、改善肾小管间质损伤和增生具有良好效果, 这可能与其抑制Act-A表达, 进而延缓肾脏发生纤维化有关[32]。
2.2 丹酚酸对TGF-β1和MCP-1的影响TGF-β1参与细胞外基质的代谢, 是细胞外基质强有力的促合剂; 也可上调蛋白酶抑制因子, 下调基质降解蛋白酶, 还能促进细胞表面细胞外基质(extracellular matrix, ECM)受体整合素表达, 使得细胞表面基质增加, ECM聚集; 还可调节细胞增殖和分化, 参与炎症反应、组织修复、胚胎发育和免疫调节等。同时TGF-β1的过量生成则与肾脏的慢性纤维化有关。MCP-1属于趋化因子C-C亚家族, 其受体为CCR2。MCP-1在生理状态下呈低表达, MCP-1可以通过TGF-β途径促进肾小球纤维化, 导致肾脏病变。
研究表明, 丹参多酚酸盐注射液治疗患者血清和尿液中TGF-β水平明显下降, 且尿液中MCP-1水平与对照组相比明显降低, 因此丹参多酚酸盐注射液可通过调节TGF-β1和MCP-1水平发挥对DKD患者肾脏功能的保护作用[33]。
2.3 丹参酮对糖尿病肾病大鼠肾组织氧化应激水平的影响高糖状态下产生过多的ROS对肾组织的损伤是DKD病变发展的主要机制之一。丹参酮ⅡA磺酸钠对糖尿病大鼠肾脏具有明显的抗氧化作用, 并呈剂量依赖的方式。同时丹参酮ⅡA磺酸钠可调节糖尿病大鼠脂质代谢紊乱, 降低尿蛋白排泄率, 缓解糖尿病肾脏损害。丹参酮ⅡA磺酸钠可恢复血浆ET、TXB2、6-keto-PGF1α水平, 而保护内皮细胞功能。同时发现丹参酮IIA磺酸钠预处理能逆转SIRT1蛋白低表达, 并抑制肾脏乙酰化FoxO1蛋白表达而减少糖尿病肾病损害[34]。
丹参酮ⅡA减轻大鼠肾小管坏死、细胞凋亡和氧化应激以及HK2细胞的氧化应激。此外, 丹参酮ⅡA激活Nrf2, 并在体内和体外上调HO-1表达, 导致氧化应激降低。丹参酮ⅡA可通过增强Nrf2/ARE活化来预防对比剂肾病[35]。丹参酮由于其潜在的抗氧化特性而降低丙二醛水平和增加超氧化物歧化酶SOD水平, 表明丹参酮抑制氧化应激介导葡萄糖诱导的肾损伤。
2.4 丹参酮对PTP1B活性的表达影响PTP1B广泛存在于体内各组织中, 它通过催化磷酸酪氨酸(pTyr)的去磷酸化反应, 与蛋白酪氨酸激酶(PTKs)共同维持蛋白酪氨酸的磷酸化水平。蛋白酪氨酸磷酸酶是一种负调节因子, 在许多信号通路中起重要作用, 尤其是与胰岛素抵抗相关的信号通路。PTP1B与胰岛素结合后, 胰岛素受体(IR)细胞质部分的受体酪氨酸激酶(RTK)域会被激活, 随后受体的多个Tyr残基及下游胰岛素受体底物1 (insulin receptor substrate 1, IRS1)磷酸化, 进而激活PI3K-AKT通路, 导致4型葡萄糖转运蛋白转移至细胞表面, 促进葡萄糖的摄取。蛋白激酶B (protein kinase B, AKT)也可通过抑制GSK3活性刺激糖原合成[36]。PTP1B促使磷酸化的IR和IRS1脱去磷酸, 进而终止IR信号, 抑制细胞对葡萄糖的摄取, 产生胰岛素抵抗。研究显示, 丹参酮对PTP1B活性有抑制作用[37]。
3 丹酚酸、丹参酮类成分调控的分子信号通路丹酚酸可明显抑制糖尿病肾病引起的肾脏组织细胞外信号调节激酶1/2 (extracellular signal regulated kinase, ERK1/2)蛋白的表达, 以重新构建肾小球细胞外基质。丹参酮可通过调控Wnt/β-catenin信号通路的活性来抑制高糖诱导的肾小管上皮细胞转分化过程, 改变TGF-β/Smad和NF-κB通路的表达来抑制肾间质纤维化和炎症反应。
3.1 丹酚酸对丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)信号通路的影响在引起糖尿病肾脏损害的多项因子中, 丝裂原活化蛋白激酶信号通路是其中重要途径之一[38], MAPK在体内的作用主要为调节细胞生长和细胞凋亡, 而ERK1/2作为其中一个重要亚型, 又与肾脏细胞密切相关, 其可能在肾脏微血管病变以及凋亡过程中发挥着重要促进作用。MAPK信号通路参与能量代谢的众多环节, 在胰岛素抵抗以及调节糖转运方面具有重要的作用。一般而言ERK1/2蛋白在体内分泌较少, 但当其被激活或过量分泌, 将引起肾小球中的胶原蛋白分泌增多, 进而参与了肾小球细胞外基质的重新构建。
研究发现, 丹参多酚酸可明显地抑制糖尿病肾病引起的肾脏组织ERK1/2蛋白的表达, 结合组织病理学、肾功能的改善, 提示丹参多酚酸对糖尿病肾脏损害具有较好的改善作用[39]。
3.2 丹参酮对TGF-β/Smad和NF-κB信号通路的影响研究表明, 丹参酮ⅡA通过改变肾脏中TGF-β/Smad和NF-κB通路的表达来抑制肾纤维化和炎症, 故丹参酮ⅡA作为减缓CKD进展的新治疗剂具有较好的潜力[40]。丹参酮ⅡA显著降低大鼠肾组织中TGF-β1、NF-κB p65 mRNA表达及蛋白表达水平, 从而延缓DKD的肾纤维化进展[41]。
丹参酮ⅡA磺酸钠注射液对2型糖尿病大鼠进行干预治疗, 结果显示, 虽然血糖下降不明显, 但胰岛素、总胆固醇明显下降, 肾功能好转, 且近曲小管上皮细胞胞浆中α-SMA、vimention、TGF-β1表达水平降低, 提示丹参酮ⅡA磺酸钠注射液对DKD的作用可以不依赖于降低血糖[42]。丹参酮ⅡA对肾间质纤维化的抑制作用可能与其对肾间质成纤维细胞TGF-β-Smads信号通路的阻断作用有关。丹参酮ⅡA预处理可以剂量依赖性下调纤连蛋白和p-Smad2/3表达[43]。
3.3 丹参酮对Wnt/β-catenin信号通路的影响肾小管上皮细胞向充质细胞转分化(epithelial-mesenchymal transition, EMT)是肾小管间质纤维化的重要原因之一[44-47], 而肾小管间质纤维化是糖尿病肾病进展为慢性肾功能衰竭的病理基础。EMT过程首先是肾小管上皮细胞丧失上皮细胞黏附特性, 即上皮细胞标志性蛋白表皮黏附分子E-钙黏蛋白(E-cadherin)的表达的下降, 同时出现间充质细胞标志性蛋白α-平滑肌肌动蛋白(α-SMA)的表达, 因此E-cadherin与α-SMA成为判断转分化过程的重要指标[48, 49]。
β-连环蛋白(β-catenin)作为细胞骨架蛋白, 与E-cadherin、α-连环蛋白(α-catenin)等共同参与细胞连接的构建; 同时也是Wnt途径的核心分子, β-catenin的异位表达, 即在胞质内聚集并进入胞核是Wnt途经发挥生物学作用的关键步骤[50, 51]。Wnt/β-连环蛋白信号通路参与高糖诱导的肾小管上皮细胞转分化。丹参酮IIA可通过下调Wnt/β-catenin信号通路的活性来抑制转分化过程, 从而进一步发挥对肾脏功能的保护作用。
4 结语与展望DKD是终末期肾功能衰竭的主要原因, 也是糖尿病患者致残和致死的重要因素。临床研究表明, 强化血糖控制可减缓DKD的发生和发展; 阻断RAS系统也是调节DKD代谢和血液动力学紊乱的重要靶标。
临床应用实践已证实, 丹参对糖尿病肾病临床防治效果显著而明确, 其主要有效成分为丹参酚酸类和丹参酮类物质[52], 其中丹参酚酸可通过调控Act-A蛋白表达, 调节TGF-β1和MCP-1水平, 减轻肾纤维化进程; 通过抑制MAPK信号通路, 减少ECM的产生, 进而减轻糖尿病肾病的症状。丹参酮通过抑制肾脏中的TGF-β/Smad和NF-κB通路的表达, 从而抑制肾纤维化和炎症; 抑制PTP1B改善T2DM患者中胰岛β细胞分泌功能; 通过下调Wnt/β-catenin信号通路的活性来抑制肾小管上皮细胞向充质细胞转分化过程, 从而发挥对肾脏功能的保护作用。丹酚酸和丹参酮均可通过调节TGF-β1来减缓糖尿病肾病的进程, 减轻临床患者的半胱氨酸、尿蛋白排泄率、白细胞介素-6、血管紧张素等。
综上, 丹酚酸和丹参酮类成分具有明确的改善糖尿病肾病的病理特征和临床应用实践, 是具有良好临床应用前景和开发价值的有效组分。但丹酚酸与丹参酮两类有效物质之间的相互作用、与机体的作用特点与优势以及相互作用机制等问题尚待进一步深入细致的研究, 以期为DKD的新型药物研发和有效治疗手段提供科学依据和重要支撑。
| [1] | Stenvinkel P. Chronic kidney disease: a public health priority and harbinger of premature cardiovascular disease[J]. J Intern Med, 2010, 268: 456–467. DOI:10.1111/j.1365-2796.2010.02269.x |
| [2] | Dai XX, Su SL, Guo S, et al. Research progress on biological activity and application development of tanshinones[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 1442–1448. |
| [3] | Cai HD. Study on Improvement Effect and Mechanism of Salvia Miltiorrhiza Stem-Leaf on Chronic Renal Function Injury (丹参茎叶对慢性肾功呢损伤的改善作用及机制研究)[D]. Nanjing: Nanjing University of Chinese Medicine (南京中医药大学), 2017. |
| [4] | Krolewski AS, Poznik GD, Placha G, et al. A genome-wide linkage scan for genes controlling variation in urinary albumin excretion in type Ⅱ diabetes[J]. Kidney Int, 2006, 69: 129–136. DOI:10.1038/sj.ki.5000023 |
| [5] | Vardarli I, Robert L, Hanson RL, et al. Gene for susceptibility to diabetic nephropathy in type 2 diabetes maps to 18q22.3-23[J]. Kidney Int, 2002, 62: 2176–2183. DOI:10.1046/j.1523-1755.2002.00663.x |
| [6] | Arsov S, Graf R, van Oeveren W, et al. Advanced glycation end-products and skin autofluorescence in end stage renal disease: a review[J]. Clin Chem Lab Med, 2014, 52: 11. |
| [7] | Prasad K, Tiwari S. Therapeutic interventions for advanced glycation-end products and its receptor-mediated cardiovascular disease[J]. Curr Pharm Des, 2017, 23: 937–943. DOI:10.2174/1381612822666161006143032 |
| [8] | Yamagishi S, Matusui T. Role of ligand of receptor for advanced glycation end products (RAGE) in peripheral artery disease[J]. Rejuvenation Res, 2018, 21: 456–463. DOI:10.1089/rej.2017.2025 |
| [9] | Liu F, Fu Y, Wei C, et al. The expression of GPR109A, NF-κB and IL-1β in peripheral blood leukocytes from patients with type 2 diabetes[J]. Ann Clin Lab Sci, 2014, 44: 443–448. |
| [10] | Saulnier PJ, Wheelock KM, Howell S, et al. Advanced glycation end-products predict loss of renal function and correlate with lesions of diabetic kidney disease in American Indians with type 2 diabetes[J]. Diabetes, 2016, 65: 3744–3753. DOI:10.2337/db16-0310 |
| [11] | Ren X, Ren L, Wei Q, et al. Advanced glycation end-products decreases expression of endothelial nitric oxide synthase through oxidative stress in human coronary artery endothelial cell[J]. Catdiovasc Diabetol, 2017, 16: 52. DOI:10.1186/s12933-017-0531-9 |
| [12] | Zhao PM, Wang JQ, Ling YJ. Role of endothelial cells injury in the pathogenesis of diabetic nephropathy[J]. Chin J Diabetes (中国糖尿病杂志), 2016, 24: 669–672. |
| [13] | Niu S, Bian Z, Tremblay A, et al. Broad infiltration of macrophages leads to a proinflammatory state in streptozotocin-induced hyperglycemic mice[J]. J Immunol, 2016, 197: 3293–3301. DOI:10.4049/jimmunol.1502494 |
| [14] | Stief T. Glucose initially inhibits and later stimulates blood ROS generation[J]. J Diabetes Mellitus, 2013, 3: 5–21. |
| [15] | Flemming NB, Gallo LA, Forbes JM. Mitochondrial dysfunction and sign in diabetic kidney disease: oxidative stress and beyond[J]. Semin Nephrol, 2018, 38: 101–110. DOI:10.1016/j.semnephrol.2018.01.001 |
| [16] | Giacco F, Brownlee M. Oxidative stress and diabetic complications[J]. Circ Res, 2010, 107: 1058–1070. DOI:10.1161/CIRCRESAHA.110.223545 |
| [17] | Gorin Y, Block K. Nox4 and diabetic nephropathy: with a friend like this, who needs enemies?[J]. Free Radic Biol Med, 2013, 61: 130–132. DOI:10.1016/j.freeradbiomed.2013.03.014 |
| [18] | Yao M, Gao F, Wang X, et al. Nox4 is involved in high glucose-induced apoptosis in renal tubular epithelial cells via Notch pathway[J]. Mol Med Rep, 2017, 15: 4319–4325. DOI:10.3892/mmr.2017.6516 |
| [19] | Sagoo MK, Gnudi L. Diabetic nephropathy: is there a role for oxidative stress?[J]. Free Radic Biol Med, 2018, 20: 50–63. |
| [20] | Navarrogonzález JF, Morafernández C, Murosd FM, et al. Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J]. Nat Rev Nephrol, 2011, 7: 327–340. DOI:10.1038/nrneph.2011.51 |
| [21] | Chen JS, Lee HS, Jin JS, et al. Attenuation of mouse mesangial cell contractility by high glucose and mannitol: involvement of protein kinase C and focal adhesion kinase[J]. J Biomed Sci, 2004, 11: 142–151. DOI:10.1007/BF02256557 |
| [22] | Wang S, Li Y, Fan J, et al. Interleukin-22 ameliorated renal injury and fibrosis in diabetic nephropathy through inhibition of NLRP3 inflammasome activation[J]. Cell Death Dis, 2017, 8: e2937. DOI:10.1038/cddis.2017.292 |
| [23] | Liu JF, Liu SY, Zhao ZG, et al. The role of the renin-angiotensin-aldehyde sterol system in the pathogenesis of nephropathy[J]. Chin J Gerontol (中国老年学杂志), 2017, 37: 2327–2331. |
| [24] | Yang KK, Mou XJ, Shen J, et al. Renin-angiotensin system blockade in correction of glucose metabolic disturbance in uninephrectomized rats[J]. Acad J Second Mil Med Univ (第二军医大学学报), 2015, 36: 761–766. DOI:10.3724/SP.J.1008.2015.00761 |
| [25] | Yang KK. Remnant Kidney Impairments and Metabolic Disorders Induced by Rennin-angiotensin System (肾素-血管紧张素系统介导的残留肾改变和代谢异常)[D]. Guilin: Guilin Medical University (桂林医学院), 2015. |
| [26] | Burns KD. Angiotensin Ⅱ and its receptors in the diabetic kidney[J]. Am J Kidney Dis, 2000, 36: 449–467. DOI:10.1053/ajkd.2000.16192 |
| [27] | Ruiz-Ortega M, Ruperez M, Lorenzo O, et al. Angiotensin Ⅱ regulates the synthesis of proinflammatory cytokines and chemokines in the kidney[J]. Kidney Int, 2002, 62: S12–S22. DOI:10.1046/j.1523-1755.62.s82.4.x |
| [28] | O'Donnell MP. The genetic information nondiscrimination Act-A wake-up call: great intentions, but a setback for health impact and cost-effectiveness of workplace health promotion[J]. Am J Health Promot, 2010, 24: 4–5. |
| [29] | Chen XX. Inhibitory Effects of Activin A on the Proliferation of Neuro-2a Cells and Its Mechanism (激活素A对Neuro-2a细胞增殖抑制作用及其机制)[D]. Jinlin: Jinlin University (吉林大学), 2018. |
| [30] | Mamin A, Philippe J. Activin A decreases glucagon and arx gene expression in alpha cell lines[J]. Mol Endocrinol, 2007, 21: 259–273. DOI:10.1210/me.2005-0530 |
| [31] | Ueland T, Aukrust P, Aakhus S, et al. Activin A and cardiovascular disease in type 2 diabetes mellitus[J]. Diab Vasc Dis Res, 2012, 9: 234–237. DOI:10.1177/1479164111431171 |
| [32] | Wang L, Wu QF. Effects of Danshen polyphenolic acid on expression of activin A of kidney tube interstitial in type 2 diabetic nephropathy rats[J]. Global Tradit Chin Med (环球中医药), 2017, 10: 1312–1317. |
| [33] | Xu Y. Protective effect of salvianolic acid injection on diabetic nephropathy and its effects on TGF-β-1 and MCP-1[J]. Mod J Integr Tradit Chin Western Med (现代中西医结合杂志), 2014, 23: 2083–2084. |
| [34] | Wang Q, Wu X, Cao Z, et al. The effects of tanshinone ⅡA on oxidative stress of kidneys of rats with diabetic nephropathy[J]. Chin J Clin (中华临床医师杂志), 2015, 9: 1149–1151. |
| [35] | Wu X, Liu L, Xie H, et al. Tanshinone ⅡA prevents uric acid nephropathy in rats through NF-κB inhibition[J]. Planta Med, 2012, 78: 866–873. DOI:10.1055/s-0031-1298487 |
| [36] | Yuan Z, Chen Z, Li QB, et al. Advances in research of protein tyrosine phosphatase 1B and its inhibitors[J]. J China Pharm Univ (中国药科大学学报), 2018, 49: 1–9. |
| [37] | Kim DH, Paudel P, Yu T, et al. Characterization of the inhibitory activity of natural tanshinones from Salvia miltiorrhiza roots on protein tyrosine phosphatase 1B[J]. Chem Biol Interact, 2017, 276: 65–73. DOI:10.1016/j.cbi.2017.02.006 |
| [38] | Wang LH, Wu GL, Lin J, et al. Effect of mitogen-activated protein kinase phosophatase-1 in extracellular matrix reconstruction of renal tissues in rats with diabetes mellitus[J]. Med Pharm J Chin PLA (解放军医药杂志), 2018, 30: 9–14. |
| [39] | Wang L, Wu QF. Effects of salvianolic acid on exoression of extracellular ERK1/2 in diabetic nephropathy rats[J]. Chin J Tradit Med Sci Technol (中国中医药科技), 2018, 25: 197–201. |
| [40] | Lin X, Zha Y, Zeng XZ, et al. Role of the Wnt/β-catenin signaling pathway in inducing apoptosis and renal fibrosis in 5/6-nephrectomized rats[J]. Mol Med Rep, 2017, 15: 3575–3582. DOI:10.3892/mmr.2017.6461 |
| [41] | Chen GY, Tang SF, Su BL, et al. Effect of tanshinone ⅡA on renal tumor growth factor-beta 1 and nuclear factor-kappa B in diabetic nephropathy rats[J]. J Guangzhou Univ Tradit Chin Med (广州中医药大学学报), 2015, 32: 891–895, 974. |
| [42] | Zhou RB, Liu MH, He HX. Protective effect of sulfotanshinone sodium injection on diabetic rat kidney[J]. China Pharm (中国药业), 2008, 17: 7–8. |
| [43] | Tang J, Zhan C, Zhou J. Effects of tanshinone ⅡA on transforming growth factor beta1-Smads signal pathway in renal interstitial fibroblasts of rats[J]. J Huazhong Univ Technolog Med Sci, 2008, 28: 539–542. DOI:10.1007/s11596-008-0511-0 |
| [44] | Liu S, Xi Y, Bettaieb A, et al. Disruption of protein tyrosine phosphatase 1B expression in the pancreas affects β-cell function[J]. Endocrinology, 2014, 155: 3329–3338. DOI:10.1210/en.2013-2004 |
| [45] | Yigitturk G, Acara AC, Erbas O, et al. The antioxidant role of agomelatine and gallic acid on oxidative stress in STZ induced type I diabetic rat testes[J]. J Cardiovasc Pharmacol, 2015, 66: 584–592. DOI:10.1097/FJC.0000000000000308 |
| [46] | Phillips AO, Steadman R. Diabetic nephropathy: the central role of renal proximal tubular cells in tubulointerstitial injury[J]. Histol Histopathol, 2002, 17: 247–252. |
| [47] | Phillips AO. The role of renal proximal tubular cells in diabetic nephropathy[J]. Curr Diabetes Rep, 2003, 3: 491–496. DOI:10.1007/s11892-003-0013-1 |
| [48] | Javelaud D, van Kempen L, Alexaki VI, et al. Efficient TGF-beta/Smad signaling in human melanoma cells associated with high c-SKI/SnoN expression[J]. Mol Cancer, 2011, 10: 2. DOI:10.1186/1476-4598-10-2 |
| [49] | Liu Y, Quan Y. Relationship between inflammatory microenvironment and epithelial-mesenchymal transition and its significance in pancreatic carcinoma[J]. Chin J Clin Res (中国临床研究), 2018, 31: 1619–1623. |
| [50] | Brembeck FH, Rosario M, Birchmeier W. Balancing cell adhesion and Wnt signaling, the key role of beta-catenin[J]. Curr Opin Genet Dev, 2006, 16: 51–59. DOI:10.1016/j.gde.2005.12.007 |
| [51] | He W, Dai C, Li Y, et al. Wnt/beta-catenin signaling promotes renal interstitial fibrosis[J]. J Am Soc Nephrol, 2009, 20: 765–776. DOI:10.1681/ASN.2008060566 |
| [52] | Song JY, Luo HM, Li CF, et al. Salvia miltiorrhiza as medicinal model plant[J]. Acta Pharm Sin (药学学报), 2013, 48: 1099–1106. |
 2019, Vol. 54
2019, Vol. 54


