2. 北京大学药学院 国家仿生药物与天然药物重点实验室, 北京 100191
2. State Key Laboratory of Natural and Biomimetic Drugs, School of Pharmaceutical Sciences, Peking University, Beijing 100191, China
色胺酮类化合物属于吲哚喹唑啉类生物碱, 最初由产蓝植物及部分微生物中分离提取得到。该类化合物具有很强的抗疟原虫活性, 对疟原虫引起的疟疾有明显的治疗作用, 其中效果较好的化合物IC50可达到0.43~10 ng·mL-1[1]。研究者通过色胺酮类化合物的核磁共振氢谱、X-射线结晶、红外吸收光谱和分子模型研究其抗疟机制, 发现其能够与血红素发生弱的π型相互作用, 从而抑制血红素聚合, 导致疟原虫死亡[2]。色胺酮类化合物的抗肿瘤作用也在研究中被证实[3], 其在体外对多种人体白血病细胞有杀伤作用, 并对乳腺癌、Lewis肺癌具有一定的抑制作用[4, 5]。但色胺酮及其衍生物水溶性不佳。以色胺酮为例, 其在磷酸盐缓冲溶液(PBS, pH 7.4)中的溶解度仅为5.4 μmol·L-1 (1.339 μg·mL-1)[6]。难溶性大大地限制了色胺酮类化合物的抗肿瘤作用机制的研究, 也限制了其在临床上的发展。
铁死亡是一种依赖于脂质过氧化反应驱动的非凋亡性细胞死亡方式, 其发生过程需要细胞内含有可利用的铁。2012年, “铁死亡”这一新型细胞死亡方式首次被提出[7]。细胞发生铁死亡时, 线粒体变小而线粒体膜密度增大, 线粒体嵴减少或消失, 线粒体外膜破裂。同时细胞内谷胱甘肽耗竭, 谷胱甘肽过氧化物酶4 (GPX4)活性下降, 进而影响脂质氧化物经GPX4催化的谷胱甘肽还原反应而代谢, 使得胞内的二价铁离子以类似芬顿反应(Fenton reaction)的方式氧化脂质而产生大量活性氧, 促使细胞死亡[8]。
色胺酮类化合物的潜在作用靶点是特异性结合亚铁血红素中的亚铁(Fe2+)离子[2]。而亚铁血红素不仅是血红蛋白的组成部分, 也是细胞色素C (cytochrome C, Cyt-C)的组成部分之一。细胞色素C在线粒体呼吸链中传递电子, 参与细胞呼吸过程。因此, 以亚铁血红素为靶点的药物可能会影响细胞色素C的正常合成与功能, 并对铁的利用和代谢过程产生影响, 进而抑制细胞正常增殖。因此, 推测色胺酮类化合物诱导细胞死亡的机制可能与铁死亡有关。但目前, 尚未见色胺酮类化合物诱导细胞铁死亡的相关报道。
CY-1-4是北京大学药学院孟祥豹教授课题组设计并合成的色胺酮类化合物(图 1)[9], 其水溶性不佳, 本实验采用纳米化技术改善其水溶性, 并研究了其在黑色素瘤B16-F10细胞上诱导铁死亡的现象。

|
Figure 1 Structure of CY-1-4 |
试剂 PEG3000-b-PCL2500 (加拿大Advanced Polymer Materials公司); 聚己内酯[poly(caprolactone), PCL, 相对分子质量5 800, 济南岱罡生物工程有限公司]; CY-1-4 (由北京大学药学院化学生物学系孟祥豹教授课题组合成并提供); PBS (pH 7.4, 北京迈晨生物科技有限公司); 泊洛沙姆188 (Pluronic F68, F68, 北京华中海威基因科技有限公司); 丙酮、无水乙醇(北京化工厂); 乙腈(色谱纯, 美国Thermo Fisher Scientific公司); 微孔滤膜(0.8 μm, 北京拜尔迪生物技术有限公司); DMEM培养基(含高糖、丙酮酸钠、L-谷胺酰氨和25 mmol·L-1 HEPES, 北京中科迈晨科技有限公司); 胎牛血清(fetal bovine serum, 北京华美兰博生物科技有限公司); Cell Counting Kit-8试剂盒、活性氧检测试剂盒(上海碧云天生物技术有限公司); 去铁胺(DFO, T1637)、ferrostatin-1 (Fer-1, T6500)、原卟啉(protoporphyrin Ⅸ, PPIX, T1192) (TargetMol, 上海陶素生化有限公司); Erastin (美国Selleck Chemicals公司); 超滤管(3 000 Da, 4 mL, Merck-millipore, 上海默克密理博实验室设备有限公司)。
仪器 BT-25S电子分析天平(德国Sartorius公司); Malvern Zetasizer Nano-ZS型激光粒度仪(英国Marvern Instruments公司); JEM-200CX型透射电子显微镜(日本JEOL公司); RE53CS-1旋转蒸发器、SHZ-Ⅲ型循环水真空泵、B-260恒温水浴锅(上海亚荣生化仪器厂); LC-20AT高效液相色谱仪、SIL-20A自动进样器、LCsolution色谱工作站(日本岛津公司); ZORBAX Eclipse XDB-C18色谱柱(250 mm×4.6 mm, 5 μm, 美国Agilent公司); 细胞培养箱(美国Thermo Electron公司); IX51荧光显微镜(日本Olympus公司); 酶标仪(美国Thermo-Fisher公司); Calibur流式细胞仪(美国BD公司)。
细胞株 小鼠皮肤黑色素瘤细胞B16-F10 (Mus musculus skin melanoma)购自中国典型培养物保藏中心。
CY-1-4的溶解度及紫外吸收曲线 首先探究了CY-1-4在不同常用有机溶剂中的溶解性质, 然后称取适量CY-1-4并加入乙腈溶解制得储备液, 稀释至适当浓度后于紫外-分光光度计下扫描, 测量其在波长200~450 nm内的紫外吸收曲线和最大吸收波长。
CY-1-4 NPs的制备 采用纳米沉淀法制备载药纳米粒。基本步骤如下:配制浓度为0.5 mg·mL-1的CY-1-4溶液备用。溶剂采用丙酮:乙醇(9:1)混合溶液, 现用现配。分别称取聚乙二醇-聚己内酯(PEG-PCL) 0.5 mg和PCL 5.0 mg, 加入到0.75 mL 0.5 mg·mL-1 CY-1-4溶液中, 充分溶解后, 得到化合物和聚合物材料的混合溶液。在37 ℃水浴条件下, 使用2 mL注射器缓慢匀速地向装有10 mL 0.1 mg·mL-1 F68溶液的茄型烧瓶中滴加混合溶液, 滴加完毕后, 均匀搅拌15 min。随后, 在37 ℃水浴条件下, 使用真空旋转蒸发仪旋转蒸发10 min, 直到茄形瓶中无气泡出现为止, 以除尽其中的有机溶剂。将制备好的纳米粒溶液通过0.8 μm的微孔滤膜, 除去未包载的CY-1-4, 最终得到CY-1-4 NPs溶液。
形态观察 采用透射电子显微镜观察其形态。常温下, 取适量CY-1-4 NPs胶体溶液滴于铜网上, 静置10 min后用滤纸吸干, 再滴加2.0%磷钨酸溶液于铜网上负染3 min后, 自然挥干, 用透射电子显微镜(TEM)观察并摄制照片。
平均粒径、粒径分布及zeta电位 采用动态光散射法测定纳米粒的粒径、多分散指数(PDI)及zeta电位。设定粒度测定仪入射光与散射光束的夹角为90°, 测定温度为25 ℃, 每个样品测定循环数为自动。3个参数均取3批制剂的平均值(n = 3)并计算SD。
包封率和载药量的测定 使用截留分子质量为3 000 Da的超滤离心管, 在摆角转子3 500 r·min-1条件下离心10 min后, 取下层液体100 μL作为纳米粒中的游离药物样品待用; 将未离心的纳米粒溶液取100 μL于EP管中, 加入1 mL乙腈溶液破坏纳米粒(振摇), 再取破乳后的100 μL溶液作为药物加入总量的样品待用。CY-1-4浓度采用高效液相色谱法(HPLC)测定, 其色谱条件如下:色谱柱: ZORBAX Eclipse XDB-C18色谱柱(250 mm×4.6 mm, 5 μm); 流动相:恒定比例流动相, 乙腈-水溶液(50:50, v/v); 流速: 1 mL·min-1; 检测波长: 254 nm; 柱温: 25 ℃; 进样量: 20 μL。包封率和载药量计算见公式(1)和(2):
| ${\rm{包封率(\% ) = }}\left( {{\rm{药物加入总量 - 游离药物含量}}} \right)/{\rm{药物加入总量}} \times {\rm{100\% }} $ | (1) |
| ${\rm{载药量(\% ) = }}\left( {{\rm{药物加入总量 - 游离药物含量}}} \right)/\left({\rm{脂材质量+药物质量}}\right) \times {\rm{100\% }} $ | (2) |
CY-1-4 NPs的细胞毒作用 采用CCK-8法考察了CY-1-4 NPs对B16-F10细胞的细胞毒作用。将细胞用胰酶消化后吹打均匀, 然后用台盼蓝染色、计数, 分别接种至96孔板, 每孔5×103个细胞。在CO2恒温培养箱中培养12 h。分别设置空白组(PBS)和不同浓度药物纳米粒组(0.25、0.5、0.75、1、2、3和5 μmol·L-1)。加药完成后继续培养24 h, 除去培养基, 加入含10 μL CCK-8溶液的完全培养基110 μL, 37 ℃条件下继续避光孵育1~3 h, 随后使用酶标仪在450 nm处进行测定, 计算各组细胞存活率和IC50值。此外, 用相同方法考察相同浓度梯度下原料药组的细胞毒作用。由于CY-1-4难溶, 因此通过DMSO将CY-1-4溶解为1 mg·mL-1的储备液再逐级稀释至合适的给药浓度。
CY-1-4 NPs对B16-F10细胞产生活性氧的影响 使用活性氧检测试剂盒中的荧光探针DCFH-DA检测不同浓度CY-1-4 NPs对B16-F10细胞活性氧(ROS)水平的影响。细胞以5×104个细胞铺至12孔板, 在CO2恒温培养箱中培养12 h后, 分别设置空白组(PBS)、不同浓度药物纳米粒组(0.25、0.5和1 μmol·L-1)和不同浓度原料药组(0.25、0.5和1 μmol·L-1)。不同浓度原料药组的制备方法是将CY-1-4溶解于DMSO (10 mg·mL-1), 用完全培养液逐级稀释到所需浓度。用无血清培养液稀释DCFH-DA使其终浓度为10 μmol·L-1。加药完成后继续培养24 h, 随后收集细胞, 悬浮于稀释的DCFH-DA中, 37 ℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀一下, 使探针和细胞充分接触。用无血清细胞培养液洗涤细胞3次, 以充分去除未进入细胞内的DCFH-DA。随后使用流式细胞仪上机检测不同组ROS水平。
B16-F10细胞被诱导铁死亡的验证 为了考察B16-F10细胞是否对铁死亡敏感, 为后续实验打下基础, 首先考察了铁死亡阳性对照试剂erastin对B16-F10细胞的细胞毒性作用。然后考察了铁螯合剂DFO、脂质活性氧抑制剂ferrostatin-1对erastin诱导铁死亡的修复作用以及原卟啉对erastin诱导铁死亡的促进作用。参考文献[7]方法, 在给予erastin (5 μmol·L-1)的同时, 分别加入DFO (100 μmol·L-1)、ferrostatin-1 (5 μmol·L-1)和PPIX (20 μmol·L-1), 然后采用CCK-8试剂盒测定细胞毒。
DFO对CY-1-4 NPs细胞毒的修复作用 将B16-F10细胞以5×103个细胞/孔接种至96孔板过夜后, 给予CY-1-4 NPs (3 μmol·L-1)的同时, 参照文献[10]方法, 设置给予不同浓度DFO的实验组(10、50和100 μmol·L-1), 给药8 h后, 采用CCK-8法, 分别考察其对CY-1-4 NPs导致的细胞毒的抑制效果并计算细胞存活率, 同时考察最大给药浓度(100 μmol·L-1) DFO对B16-F10的细胞毒。
Ferrostatin-1对CY-1-4 NPs细胞毒的修复作用 操作方法同上, 将B16-F10细胞铺板至96孔板过夜后, 给予CY-1-4 NPs (3 μmol·L-1)的同时, 设置给予不同浓度ferrostatin-1的实验组(2、3和5 μmol·L-1), 给药8 h后, 考察其对CY-1-4 NPs导致的细胞毒的抑制效果, 同时考察了最大给药浓度ferrostatin-1 (5 μmol·L-1)对B16-F10的细胞毒。
原卟啉对CY-1-4 NPs细胞毒的增强作用 参考文献[11]方法, 将B16-F10细胞铺板至96孔板过夜后, 给予CY-1-4 NPs (1 μmol·L-1)的同时, 设置给予不同浓度PPIX的实验组(2.5、7.5和20 μmol·L-1), 给药24 h后, 考察其对CY-1-4 NPs导致细胞毒的增强效果, 同时考察最大给药浓度PPIX (20 μmol·L-1)对B16-F10的细胞毒。
DFO、ferrostatin-1和原卟啉对CY-1-4 NPs造成B16-F10的损伤的形态观察 B16-F10细胞以5×104个细胞铺至12孔板过夜贴壁。分别设置CY-1-4 NPs (3 μmol·L-1)组、CY-1-4 NPs (1 μmol·L-1)组、CY-1-4 NPs (3 μmol·L-1)+DFO (100 μmol·L-1)组、CY-1-4 NPs (3 μmol·L-1)+ferrostatin-1 (5 μmol·L-1)组、CY-1-4 NPs (1 μmol·L-1)+PPIX (20 μmol·L-1)组及空白组。给药24 h后, 使用荧光显微镜明场观察细胞形态。
统计学方法 使用Graphpad Prism软件版本6 (GraphPad Software Corporation, San Diego, CA, USA)的单因素方差分析进行实验组间的统计分析, P < 0.05被认为具有统计学意义。
结果 1 CY-1-4的溶解性及紫外吸收首先考察了CY-1-4在常用的、与水互溶的有机溶剂中的溶解度。结果显示, CY-1-4在丙酮、无水乙醇中的溶解度均小于0.1 mg·mL-1, 在乙腈中溶解度约为0.5 mg·mL-1, 在丙酮:乙醇体积比为9:1时约为0.5 mg·mL-1。将CY-1-4用乙腈溶解后进行紫外吸收光谱扫描, 如图 2A所示, CY-1-4在254 nm处有最大吸收峰。由于后续纳米粒制备过程中需要旋转蒸发仪蒸发除去有机溶剂, 故选用沸点更低的丙酮和乙醇混合溶液作为溶剂。图 2B~D分别展示了CY-1-4游离药、空白纳米粒和含药纳米粒的HPLC图谱, 结果显示, 在该条件下CY-1-4峰形对称性良好, 且能与杂质有效分离, 具有良好的专属性。
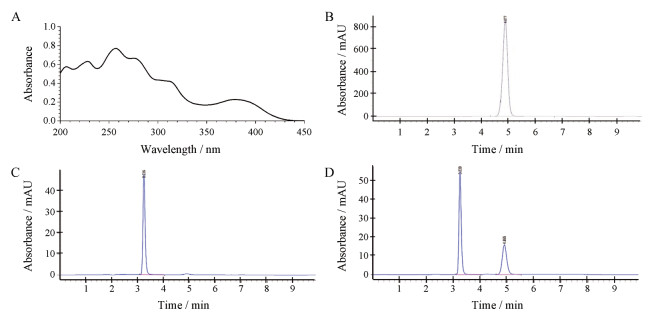
|
Figure 2 UV wavelength of CY-1-4 (A) and representative HPLC chromatogram of CY-1-4 (B), blank poly(ethylene glycol)-co-poly(ε-caprolactone)/poly(caprolactone) (PEG-PCL/PCL) nanoparticles (C), nanoparticles encapsulated CY-1-4 (CY-1-4 NPs) (D) |
CY-1-4 NPs溶液澄清略带乳光, 呈黄绿色, 为CY-1-4化合物本身的颜色。其电镜下形态如图 3A所示, 呈较规则、大小均一的圆球形。图 3B为动态光散射测定的粒径和粒度分布图, 其粒径为116.5 ± 2.12 nm, PDI为0.205 ± 0.03, zeta电位为-18 ± 1.21 mV。
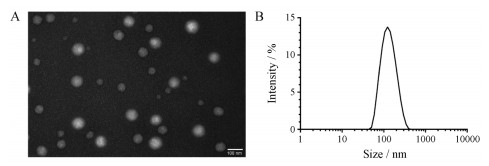
|
Figure 3 The morphology of CY-1-4 NPs determined by transmission electron microscope (A) and the size and size distribution of CY-1-4 NPs determined by dynamic light scattering (B). Scale bar, 100 nm |
用上述HPLC方法测得包封率为(83.72 ± 3.49)%, 载药量为(4.80 ± 0.35)%, 可以满足后续研究。
4 CY-1-4 NPs的细胞毒作用CCK-8法测定CY-1-4 NPs在B16-F10细胞上的细胞毒结果如图 4所示, CY-1-4 NPs的IC50值为1.559 μmol·L-1, 原料药CY-1-4的IC50值为0.842 μmol·L-1, 后者小于前者, 可能是其溶解状态造成的。原料药中的CY-1-4以游离分子状态存在, 由于其疏水性, 易于进入细胞, 因此体现出较强的细胞毒性。此外, 在后续实验中, 分别选择3和1 μmol·L-1作为细胞毒作用较强和较弱的给药浓度去评价DFO和ferrostatin-1对CY-1-4 NPs诱发细胞毒的修复作用和PPIX对CY-1-4 NPs诱发细胞毒的促进作用。
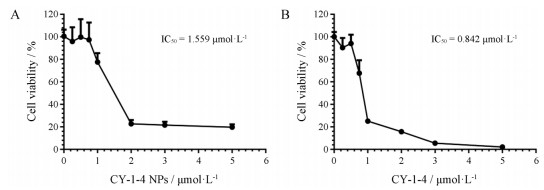
|
Figure 4 Cell viability of B16-F10 cells after incubation with CY-1-4 NPs (A) and CY-1-4 (B) at the concentration of 0.25, 0.5, 0.75, 1, 2, 3, 5 μmol·L-1 for 24 h. n = 6, x ± s |
铁死亡是一种铁和脂质活性氧依赖的死亡途径。如图 5所示, 相比于空白组, 随着CY-1-4 NPs浓度增加, ROS水平呈浓度依赖性增加, 当纳米粒给药浓度达到1 μmol·L-1时, ROS水平最高; 随着CY-1-4游离药浓度增加, ROS水平在低浓度时几乎没有明显变化, 给药浓度为1 μmol·L-1时, ROS水平出现增加。给药浓度为0.5和1 μmol·L-1时, 纳米粒组导致的ROS升高水平分别显著高于相同浓度的CY-1-4游离药组。
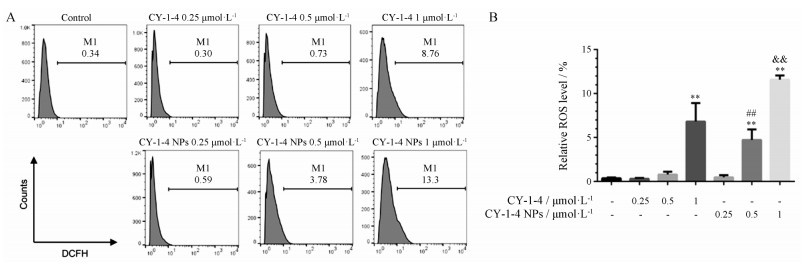
|
Figure 5 Cells were treated with CY-1-4 and CY-1-4 NPs at different concentrations. After incubation of 24 h, reactive oxygen species (ROS) level were estimated by flow cytometry. Representative flow cytometry dot plots in different groups (A); quantitive analysis of relative ROS level in different groups (B). n = 3, x ± s. **P < 0.01vs control group; ##P < 0.01 vs 0.5 μmol·L-1 CY-1-4; & & P < 0.01 vs 1 μmol·L-1 CY-1-4 |
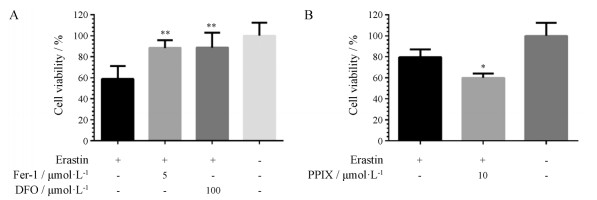
由于肿瘤细胞对铁死亡的敏感性存在差异, 且未见文献报道B16-F10细胞上铁死亡的现象, 因此首先评价了B16-F10细胞被erastin诱导铁死亡的能力, 并使用铁螯合剂DFO、脂质活性氧抑制剂ferrostatin-1和可增加亚铁血红素合成的PPIX对其铁死亡效果进行干预。如图 6所示, 当给予erastin (5 μmol·L-1)后, 细胞存活率为58%, 说明erastin具有一定的细胞毒性。经过ferrostatin-1处理后的细胞存活率达到88%, 经过DFO处理后的细胞存活率为89%, 均与erastin处理的细胞存活率存在显著性差异, 表明ferrostatin-1和DFO可以修复erastin的细胞毒作用。在另一组实验中, 当给予erastin (5 μmol·L-1)和PPIX后, 细胞的存活率从80%降低至60%, 表明通过增加细胞内亚铁血红素的合成, B16-F10细胞对erastin的敏感性增强, 细胞毒性增加。以上结果说明B16-F10细胞可以被经典的铁死亡诱导剂诱导铁死亡现象, 用于后续评价CY-1-4 NPs诱导铁死亡的细胞系。
|
Figure 6 The effect of iron chelator deferoxamine (DFO), ferrostatin-1 (Fer-1) (A) and protoporphyrin (PPIX) (B) on B16-F10 cell viability when treated with erastin at the concentration of 5 μmol·L-1.n = 6, x ± s. *P < 0.05, **P < 0.01 vs erastin treated group |
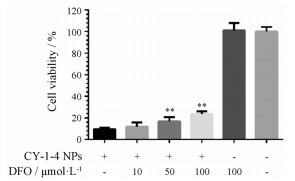
为了探究CY-1-4 NPs诱导细胞铁死亡的效果及铁螯合剂DFO是否对其细胞毒作用有抑制作用, 在给予CY-1-4 NPs (3 μmol·L-1)后, 再分别给予10、50和100 μmol·L-1 DFO。图 7显示继续培养8 h后的细胞毒。在单独给予DFO最大浓度时, DFO本身未产生细胞毒, 排除了与CY-1-4 NPs共同给药时DFO可能诱发的毒性。在仅给予CY-1-4 NPs的实验组中, 细胞存活率为10%, 而在同时给予不同浓度DFO后, 细胞存活率提高到20%左右, 且具有一定的浓度依赖性, 说明DFO对CY-1-4 NPs造成的细胞毒具有缓解作用。同时, 说明CY-1-4 NPs导致细胞死亡的机制与铁代谢有关。
|
Figure 7 The effect of DFO in various concentrations on B16-F10 cell viability when treated with CY-1-4 NPs at the concentration of 3 μmol·L-1. n = 3, x ± s. **P < 0.01vs CY-1-4 NPs treated group |
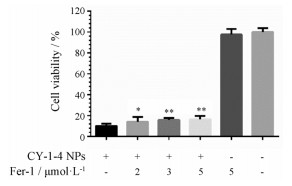
为了进一步验证CY-1-4 NPs诱导细胞铁死亡的效果以及ferrostatin-1是否对其细胞毒有抑制作用, 在给予CY-1-4 NPs (3 μmol·L-1)后分别给予不同浓度的ferrostatin-1。培养8 h后, 如图 8所示, 仅给予CY-1-4 NPs的实验组中, 细胞存活率仅为10%左右; 而给予2、3和5 μmol·L-1 ferrostatin-1溶液后, 细胞存活率均达到约15%, 且与仅CY-1-4 NPs给药组的细胞存活率有显著性差异。同时, 单独给予最大浓度的ferrostatin-1并无明显细胞毒, 排除了与CY-1-4 NPs共同给药时细胞存活率与ferrostatin-1的毒性的关系。这个结果表明了一定浓度ferrostatin-1对CY-1-4 NPs造成的细胞毒有一定程度的缓解作用。
|
Figure 8 The effect of ferrostatin-1 in various concentrations on B16-F10 cells when treated with CY-1-4 NPs at the concentration of 3 μmol·L-1.n = 3, x ± s. *P < 0.05, **P < 0.01 vs CY-1-4 NPs treated group |
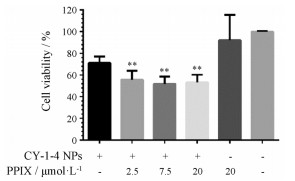
原卟啉是细胞内亚铁血红素合成的重要组成部分之一。在人为增加原卟啉后, 会增加细胞内亚铁血红素的合成, 进而增加CY-1-4与亚铁血红素特异性结合的数量。在给予CY-1-4 NPs (1 μmol·L-1)后, 分别给予2.5、7.5和20 μmol·L-1 PPIX溶液。培养24 h后, 如图 9所示, 在仅给予CY-1-4 NPs的实验组中, 细胞存活率为73%左右, 而给予2.5、7.5和20 μmol·L-1 PPIX溶液后, 细胞存活率均降低到了50%左右, 这个结果表明了一定浓度PPIX对CY-1-4 NPs造成的细胞毒性具有一定程度的增强作用。同时, 在单独给予PPIX最大浓度的实验组中, 未体现出细胞毒性, 排除了PPIX本身毒性对实验产生干扰的可能。
|
Figure 9 The effect of PPIX in various concentrations on B16-F10 cells when treated with CY-1-4 NPs at the concentration of 1 μmol·L-1.n = 3, x ± s. **P < 0.01vs CY-1-4 NPs treated group |
如图 10所示, 空白组细胞形态呈梭状, 排列紧密, 状态良好; 在仅给予CY-1-4 NPs的实验组中, 随着浓度增加, 细胞增殖减少且形状皱缩, 其中, 1 μmol·L-1给药组细胞增殖减缓; 3 μmol·L-1给药组细胞几乎全部变圆飘起而死亡。在给予铁死亡抑制剂的实验组中, ferrostatin-1和DFO的加入均可以部分缓解CY-1-4 NPs (3 μmol·L-1)给药所造成的细胞死亡, 细胞部分皱缩变圆, 仍有部分保持良好形态贴壁生长。在给予PPIX增加细胞中亚铁血红素的合成后, 1 μmol·L-1给药组中细胞增殖明显受阻, 细胞数量减少。
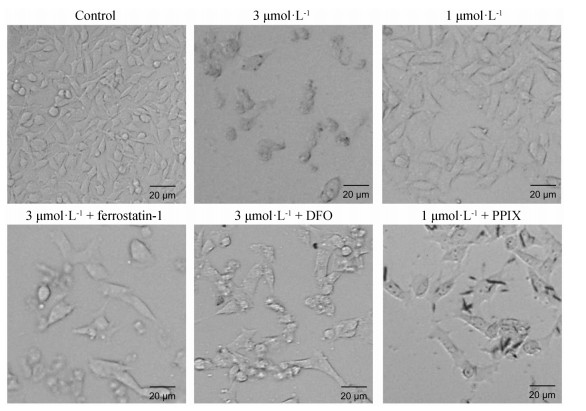
|
Figure 10 Morphology change of B16-F10 cells when treated with CY-1-4 NPs in different concentrations and the effect of ferrostatin-1, DFO and PPIX on cells. Scale bar, 20 μm |
CY-1-4在水中溶解性差。作者首先以PCL和PEG-PCL为载体材料, 通过纳米沉淀法制备了载CY-1-4的纳米粒。PCL的疏水性可以通过疏水相互作用力将难溶性药物负载于其中。PEG具有良好的亲水性, 无抗原性或免疫原性, 可以对纳米载体的体内转运起到有效的保护作用。通过以上方法, 提高了药物的溶解性与利用率, 并为后续研究CY-1-4 NPs诱导细胞死亡的机制提供了基础。
文献[3]报道, 在低剂量时, 色胺酮可增强U-937和HL-60中细胞分化标志物(CD11b和CD14等)的表达; 而高剂量时, 色胺酮在作用24 h后可导致细胞质形成空泡及线粒体的破坏, 作用48 h后细胞可通过caspase-3或Fas抗原途径诱导细胞凋亡从而引起细胞死亡。近年来, 杨青课题组[5]报道称色胺酮类化合物具有吲哚胺2, 3-双加氧酶(indoleamine 2, 3-dioxygenase, IDO)的抑制活性。IDO作为一种带有亚铁血红素结构域的双加氧酶(heme-containing dioxygenase), 是体内色氨酸转化为犬尿氨酸过程中的限速步骤和第一步。IDO的过表达引起色氨酸的耗竭与犬尿氨酸及其代谢产物的累积, 被认为与肿瘤免疫耐受与免疫逃逸密切相关。但实验结果显示, 作为潜在的IDO抑制剂, 该系列色胺酮类化合物毒性较大。在MTT实验中, 即使在96孔板中接种了5×104个细胞/孔, 在人非小细胞肺癌A549细胞上IC50也达到了8.77 μmol·L-1 [12]。本研究以鼠源黑色素瘤B16-F10细胞作为研究对象, 探究了纳米化色胺酮类化合物CY-1-4 NPs抑制细胞增殖的作用及其潜在的诱导细胞铁死亡的抗肿瘤效应。CCK-8实验结果表明, CY-1-4 NPs对B16-F10细胞增殖具有显著的抑制作用, 且具有浓度依赖性, IC50约为1.559 μmol·L-1。ROS实验结果也表明, CY-1-4 NPs可以有效地增加细胞内ROS, 这为细胞铁死亡的机制验证提供了一定基础。
铁死亡是最近被发现的新的程序性细胞死亡机制。Dolma等[13]在2003年发现了新化合物erastin能选择性杀伤表达RASV12蛋白的肿瘤细胞, 是一种RAS选择性杀伤(RAS-selective lethal, RSL)化合物。Erastin诱导的细胞死亡在作用分子、效应形态和生化特征等方面与凋亡、坏死、自噬等其他细胞死亡方式不同[14], 无细胞核形态变化、DNA片段化及caspase-3的活化。随后研究发现, 这种死亡形式可被DFO所抑制, 且伴有ROS的增多[15, 16]。2012年, Dixon等[7]通过大量基础研究, 将这种死亡方式命名为铁死亡(ferroptosis)。Erastin作为经典的铁死亡诱导剂[7], 其作用靶点之一是电压依赖性阴离子通道(VDAC)。据报道, 它可以与BJeLR细胞中的VDAC2/3直接结合[16]。其次, erastin可以通过直接抑制胱氨酸/谷氨酸转运体系统Xc (system Xc)的活性从而减少谷胱甘肽水平, 激活内质网压力响应[17], 这一过程会在铁死亡过程中加速ROS的积累。
铁死亡是脂质活性氧和铁依赖的死亡途径, 可通过多种途径被抑制或增强。Ferrostatin-1是第一代ferrostatin, 它可以特异性抑制脂质过氧化ROS累积, 从而修复erastin诱导的铁死亡; DFO作为铁代谢抑制剂和铁螯合剂, 能通过细胞内吞作用堆积于细胞溶酶体[18], 与溶酶体发生作用, 截取溶酶体中本应转运至其他部位的铁离子, 从而阻止脂质活性氧的生成[19], 同时可以参与Fenton反应, 减少铁的利用, 从而抑制铁死亡[8]; PPIX作为亚铁血红素合成的原料, 可增加在细胞内的亚铁血红素的含量, 进而增加铁死亡诱导剂所导致的细胞毒[11]。因此, 通过细胞毒是否可以被脂质活性氧抑制剂ferrostatin-1或铁螯合剂DFO等抑制, 以及是否可以被PPIX等增强来评价细胞有无铁死亡现象发生。为了便于观察结果, 选择了细胞毒较大的浓度(3 μmol·L-1)进行铁死亡抑制的功能实验, 而细胞毒较小的浓度(1 μmol·L-1)用于铁死亡促进功能的实验。
肿瘤细胞系对铁死亡的敏感性高度不同[8], 但目前未见文献报道其在B16-F10细胞上诱导铁死亡的效果。本实验结果表明, DFO和ferrostatin-1可以一定程度上逆转erastin导致的细胞死亡, PPIX也可以促进erastin的细胞毒作用, 说明B16-F10细胞可以用于铁死亡机制的研究。
有些肿瘤与铁死亡的关系密切。胰腺癌致死率高, 其肿瘤细胞对细胞凋亡具有耐受能力, 而抗疟药物青蒿素衍生物青蒿琥酯被报道可以通过激活胰腺癌细胞发生铁死亡而发挥抗肿瘤作用[20]; 二氢青蒿素也被发现可诱导铁死亡和凋亡的发生, 用于治疗头颈癌[21]; 亚铁血红素是这类药物可能的作用靶点之一[11, 22, 23]。CY-1-4在前期作为抗疟活性化合物的报道中, 被认为可以特定的方向与亚铁血红素结合并阻止亚铁血红素自身聚合, 其IC50达到4 μmol·L-1, 进而产生毒性导致疟原虫死亡[2]。因此, CY-1-4与亚铁血红素之间的特定方向结合, 可能是其发挥抗肿瘤作用的靶点之一, 其机制则可能与铁死亡有关。DFO和ferrostatin-1可一定程度上逆转CY-1-4 NPs导致的细胞铁死亡, 同时, PPIX加入也可促进CY-1-4 NPs诱导的细胞铁死亡。因此, 铁死亡是纳米化色胺酮类化合物CY-1-4 NPs诱导细胞死亡的机制之一, 其诱导肿瘤细胞发生铁死亡从而抑制肿瘤生长可能成为治疗肿瘤的新靶点, 但铁死亡在肿瘤的进程中的确切作用机制尚需进一步研究。
另外, 色胺酮类化合物除了诱导铁死亡作用外, 其IDO抑制作用也与亚铁血红素有关。亚铁血红素中的Fe2+是IDO作为“加氧酶”发挥作用的关键作用位点[24]。因此, CY-1-4 NPs也可能通过与IDO中亚铁血红素结构域的Fe2+结合而发挥抑制作用, 但相关机制尚需实验验证。
| [1] | Pitzer KK, Scovill JP, Kyle DE, et al. Indolo 2, 1-B quinazole-6, 12-dione antimalarial compounds and methods of treating malaria therewith: US, EP1032574 [P]. 1999-09-28. |
| [2] | Hicks RP, Nichols DA, Ditusa CA, et al. Evaluation of 4-azaindolo[2, 1-b]quinazoline-6, 12-diones' interaction with hemin and hemozoin: a spectroscopic, X-ray crystallographic and molecular modeling study[J]. Int Electr J Mol Design, 2005, 4: 751–764. |
| [3] | Kimoto T, Hino K, Koya-Miyata S, et al. Cell differentiation and apoptosis of monocytic and promyelocytic leukemia cells (U-937 and Hl-60) by tryptanthrin, an active ingredient of Polygonum Tinctorium Lour[J]. Pathol Int, 2001, 51: 315–325. DOI:10.1046/j.1440-1827.2001.01204.x |
| [4] | Jun KY, Park SE, Liang JL, et al. Benzo[b]tryptanthrin inhibits MDR1, topoisomerase activity, and reverses adriamycin resistance in breast cancer cells[J]. ChemMedChem, 2015, 10: 827–835. DOI:10.1002/cmdc.201500068 |
| [5] | Yang SS, Li XS, Hu FF, et al. Discovery of tryptanthrin derivatives as potent inhibitors of indoleamine 2, 3-dioxygenase with therapeutic activity in Lewis lung cancer (LLC) tumor-bearing mice[J]. J Med Chem, 2013, 56: 8321–8331. DOI:10.1021/jm401195n |
| [6] | Hwang JM, Oh T, Kaneko T, et al. Design, synthesis, and structure-activity relationship studies of tryptanthrins as antitubercular agents[J]. J Nat Prod, 2013, 76: 354–367. DOI:10.1021/np3007167 |
| [7] | Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149: 1060–1072. DOI:10.1016/j.cell.2012.03.042 |
| [8] | Xie Y, Hou W, Song X, et al. Ferroptosis: process and function[J]. Cell Death Differ, 2016, 23: 369–379. DOI:10.1038/cdd.2015.158 |
| [9] | Meng XB, Chen Y, Li ZJ, et al. Nitrogen heterocyclic tryptamine ketone derivative and application as IDO1 and/or TDO inhibitor: WO, WO2017173973A1 [P]. 2017-10-12. |
| [10] | Ou WJ, Mulik RS, Anwar A, et al. Low-density lipoprotein docosahexaenoic acid nanoparticles induce ferroptotic cell death in hepatocellular carcinoma[J]. Free Radic Biol Med, 2017, 112: 597–607. DOI:10.1016/j.freeradbiomed.2017.09.002 |
| [11] | Zhang SM, Gerhard GS. Heme mediates cytotoxicity from artemisinin and serves as a general anti-proliferation target[J]. PLoS One, 2009, 4: e7472. DOI:10.1371/journal.pone.0007472 |
| [12] | Yang SS, Du LS, Ri HN, et al. Screening of tryptanthrin derivatives of indoleamine 2, 3-dioxygenase (IDO) inhibitor and their antitumor activity in vitro[J]. Fudan Univ J Med Sci (复旦学报(医学版)), 2014, 41: 149–155. |
| [13] | Dolma S, Lessnick SL, Hahn WC, et al. Identification of genotype-selective antitumor agents using synthetic lethal chemical screening in engineered human tumor cells[J]. Cancer Cell, 2003, 3: 285–296. DOI:10.1016/S1535-6108(03)00050-3 |
| [14] | Zhao Z, Bao XQ, Zhang D. Mechanisms of ferroptosis and its involvement in Parkinson's disease[J]. Acta Pharm Sin (药学学报), 2019, 54: 399–406. |
| [15] | Yang WS, Stockwell BR. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells[J]. Chem Biol, 2008, 15: 234–245. DOI:10.1016/j.chembiol.2008.02.010 |
| [16] | Yagoda N, von Rechenberg M, Zaganjor E, et al. RAS-RAF-MEK-dependent oxidative cell death involving voltage-dependent anion channels[J]. Nature, 2007, 447: 864–868. |
| [17] | Dixon SJ, Patel DN, Welsch M, et al. Pharmacological inhibition of cystine–glutamate exchange induces endoplasmic reticulum stress and ferroptosis[J]. eLife, 2014, 3: e02523. DOI:10.7554/eLife.02523 |
| [18] | Barradas MA, Jeremy JY, Kontoghiorghes GJ, et al. Iron chelators inhibit human platelet aggregation, thromboxane A2 synthesis and lipoxygenase activity[J]. FEBS Lett, 1989, 245: 105–109. DOI:10.1016/0014-5793(89)80201-7 |
| [19] | Zhou WB, Kong CF, Qin GW, et al. Research progresss on mechanism of ferroptosis[J]. Prog Biochem Biophys (生物化学与生物物理进展), 2018, 45: 16–22. |
| [20] | Eling N, Reuter L, Hazin J, et al. Identification of artesunate as a specific activator of ferroptosis in pancreatic cancer cells[J]. Oncoscience, 2015, 2: 517–532. DOI:10.18632/oncoscience |
| [21] | Lin RY, Zhang ZH, Chen LF, et al. Dihydroartemisinin (DHA) induces ferroptosis and causes cell cycle arrest in head and neck carcinoma cells[J]. Cancer Lett, 2016, 381: 165–175. DOI:10.1016/j.canlet.2016.07.033 |
| [22] | Huang XJ, Ma ZQ, Zhang WP, et al. Dihydroartemisinin exerts cytotoxic effects and inhibits hypoxia inducible factor-1α activation in C6 glioma cells[J]. J Pharm Pharmacol, 2010, 59: 849–856. |
| [23] | Disbrow GL, Baege AC, Kierpiec KA, et al. Dihydroartemisinin is cytotoxic to papillomavirus-expressing epithelial cells in vitro and in vivo[J]. Cancer Res, 2005, 65: 10854–10861. DOI:10.1158/0008-5472.CAN-05-1216 |
| [24] | Yan DJ, Lin YW, Tan XS. Heme-containing enzymes and inhibitors for tryptophan metabolism[J]. Metallomics, 2017, 9: 1230–1240. DOI:10.1039/C7MT00105C |
 2019, Vol. 54
2019, Vol. 54


