牛蒡子为菊科植物牛蒡Arctium lappa L.的干燥成熟果实, 具有疏散风热、宣肺透疹、解毒利咽的功效[1], 是维C银翘片主要成分之一。牛蒡子的化学成分种类丰富, 主要有木脂素类、挥发油、脂肪酸类、萜类及酚酸类化合物等[2], 其中木脂素类成分牛蒡苷(C27H34O11)是牛蒡子药材的有效成分及指标性成分, 《中国药典》2015版规定牛蒡苷不得少于5.0%。牛蒡子具有抗肿瘤、抗炎解热、抗糖尿病等药理作用[3]。本课题组前期对于牛蒡子化学成分、真伪鉴定等进行了研究报道[4-7]。
激光显微切割技术作为精确取材技术, 可以在显微镜下利用激光束直接从不同组织快速切割、分离相关组织、细胞及微量组分, 成为细胞和分子生物学研究中常用技术[8]。UFLC-MS/MS结合了液相色谱高分离能力和质谱提供结构信息的功能, 具有高灵敏度、高选择性的特点[9]。目前液质联用技术已成为分析中药化学成分的工具之一[10-12]。
本实验首次建立牛蒡子取材-冰冻制片-显微切割-液质联用分析的新方法, 研究牛蒡苷动态积累规律。通过激光显微切割技术对5个不同发育时期牛蒡子主要组织细胞胚薄壁细胞和内果皮石细胞进行精确收集, 利用液质联用技术对所收集的样品中牛蒡苷等化学成分进行定量分析, 分析牛蒡苷如何在牛蒡子中进行大量积累, 揭示牛蒡苷大量积累的生长时期。
本研究建立在牛蒡子药材显微结构观察基础上, 参考利用激光显微切割技术与液质联用技术相结合对人参[13]、肉桂[14]显微结构中化学成分分析, 对牛蒡子细胞样品进行定量分析。选取咖啡酸、牛蒡苷、牛蒡苷元等3种成分, 以UFLC-MS/MS为检测平台, 利用多反应选择性检测(MRM)的方法进行检测, 建立定量检测方法。分析牛蒡子胚薄壁细胞和内果皮石细胞中牛蒡苷、牛蒡苷元在5个不同发育时期合成与积累情况。
材料与方法材料 按牛蒡子发育过程, 分5个生长阶段采集样品, 包括花蕾期(Ⅰ stage), 初花期(Ⅱ stage), 盛花期(Ⅲ stage), 花末期(Ⅳ stage)和成熟期(Ⅴ stage); 样品采集于辽宁中医药大学百草园。
花蕾期(Ⅰ stage), 花隐藏在总苞之中, 此时花冠为白色, 长度约7 mm, 成闭合状态, 雌蕊长度约为7 mm, 雄蕊花药五枚连合; 子房长约2 mm, 宽约1.5 mm, 白色; 初花期(Ⅱ stage), 头状花序外侧最先开花, 花冠伸长并开花, 其最上端为淡粉色, 花冠长度为11 mm, 雌蕊包围在雄蕊之中伸出花冠, 长度约12 mm, 子房长约3.7 mm, 宽1.6 mm; 盛花期(Ⅲ stage), 头状花序完全开花, 整体为紫红色, 有白色的雌蕊伸出, 花冠长度为14 mm, 花冠上端颜色为紫红色, 雌蕊已不被雄蕊包围, 伸出花冠, 长度约为17 mm, 子房长约为5.5 mm, 宽约为3 mm; 花末期(Ⅳ stage), 总苞仍为绿色, 但花期已过, 枯萎。子房长约为6.4 mm, 宽为3 mm, 倒长卵形或偏斜倒长卵形体积与成熟牛蒡子相近, 没有脱水, 果皮与胚颜色为乳白色; 成熟期(Ⅴ stage), 牛蒡子完全成熟, 子房长约6.5 mm, 宽约3 mm, 倒长卵形或偏斜倒长卵形, 浅褐色, 有多数细脉纹, 有深褐色的色斑。对以上5个不同发育时期进行原位取材, 制作冰冻切片, 对内果皮石细胞和胚薄壁细胞进行激光显微切割, 富集细胞样品。
仪器 三重四级杆质谱仪(Triple QuadTM 4500, 美国AB SCIEX公司), UFLC超快速液相色谱仪(日本岛津公司); BSA 224S电子天平, Arium 611VF超纯水机(德国Satoruis公司); KH-100DB数控超声波清洗器(昆山禾创超声仪器有限公司); TGL-16M台式高速离心机(上海安亭科学仪器厂)。
试剂 甲醇(色谱纯, 德国TEDIA公司), 超纯水自制, 其余试剂均为分析纯。牛蒡苷(批号1120K015)、牛蒡苷元(批号1028F023)、咖啡酸(批号1015H110), 均购自北京索莱宝科技有限公司。
色谱条件 色谱柱: Aglient C18 (4. 6 mm×150 mm, 5 μm); 流动相:甲醇(A)-流动相0.2%甲酸水(B), 梯度洗脱: 0~4 min, 20%~30% A, 4~10 min, 30%~40% A, 10~14 min, 40%~50% A, 14~20 min, 50%~90% A, 20 min~22 min, 90%~20% A; 流速0.6 mL·min-1, 柱温为25 ℃, 进样量10 μL。
质谱条件 离子源: Turbo V, 电离模式: (ESI-); 采集方式:多反应监测模式(MRM); 离子化温度(TEM): 650 ℃。离子化电压: 5 500 V; 雾化气(GS1): 40 L·min-1; 辅助气(GS2): 40 L·min-1; 气帘气(CUR): 35 L·min-1。3个成分的质谱分析参数见表 1。
| Table 1 Mass spectrometry analysis parameters of three compounds |
对照品溶液制备 分别取咖啡酸、牛蒡苷和牛蒡苷元对照品适量, 精密称定, 置于50 mL量瓶中, 加甲醇溶解并定容至刻度, 配制成3种成分浓度均为0.250 0 mg·mL-1对照品储备液。分别精密吸取各对照品储备液0.100 mL, 置10 mL量瓶中, 加甲醇稀释至刻度, 制成咖啡酸、牛蒡苷和牛蒡苷元浓度分别为2.500、2.500和2.500 μg·mL-1的对照品溶液。
供试品溶液制备 将激光显微切割收集的样品离心管以12 000 r·min-1离心5 min, 然后加入甲醇100 μL, 涡旋1 min, 再将离心管以12 000 r·min-1离心10 min取上清液90 μL, 备用。
方法学考察线性关系 分别取各对照品溶液或储备液适量置10 mL量瓶中, 加甲醇至刻度, 制成系列混合标准溶液。咖啡酸系列标准浓度分别为2.500、7.500、25.00、75.00、200.0和500.0 ng·mL-1, 牛蒡苷系列标准浓度分别为2.500、12.50、50.00、200.0、500.0和2 000 ng·mL-1和牛蒡苷元系列标准浓度分别为2.500、5.000、12.50、25.00、50.00和100.0 ng·mL-1。以0.22 μm微孔滤膜滤过, 供分析用。将系列混合标准溶液按上述色谱条件进样测定。
定量限与检测限 将混合对照品溶液逐步稀释并进行检测, 以信噪比10和3时各对照品的浓度作为定量限(LOQ)和检测限(LOD)。
精密度 精密吸取同一混合对照品溶液10 μL, 连续进样6次, 记录峰面积。
重复性 取牛蒡成熟期(Ⅴ stage)的胚薄壁细胞, 共6份, 按上述“供试品溶液制备”方法制备供试品溶液, 分别精密吸取10 μL进样测定。
准确度 将系列混合标准溶液, 分别加入空白基质(空白的覆膜载玻片进行切割, 作为空白基质)中, 按上述“供试品溶液制备”方法制备成质控溶液, 测定。用标准曲线计算各点浓度。根据计算结果, 另配制含咖啡酸、牛蒡苷、牛蒡苷元浓度均为5.000 ng·mL-1的混合对照品, 按上述方法制备质控溶液共6份, 测定。
基质效应 将已知浓度的混合对照品溶液(均为12.5 ng·mL-1), 加入样品溶液A5, 计算其回收率。
样品测定 将供试品溶液注入UFLC-MS/MS中, 按上述条件测定样品中3种化学成分含量。当样品浓度超过标准曲线上限浓度时, 采用倍量稀释将浓度控制在标准曲线范围内, 然后测定。
结果 1 方法学考察 1.1 色谱条件与质谱条件按上述色谱条件与质谱条件测定。对照品与样品典型选择离子色谱图见图 1。
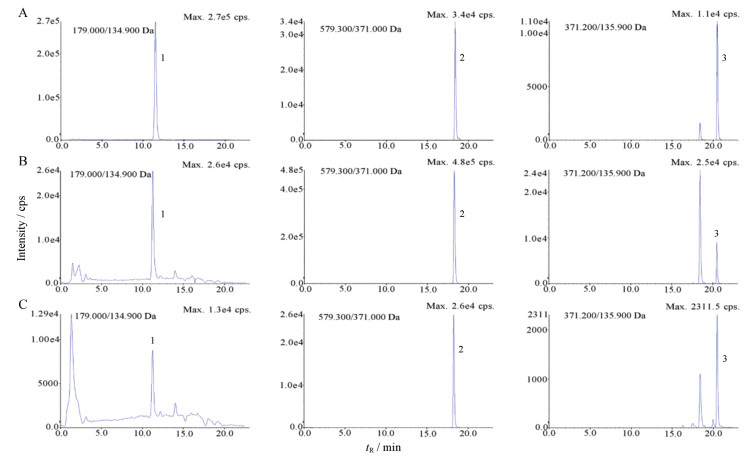
|
Figure 1 Extracted ion chromatograms (XIC) of reference substances (A). XIC of three compounds in embryonic parenchyma cells (B) and in endocarp stone cells (C). 1: Caffeic acid; 2: Arctiin; 3: Arctigenin |
以各对照品浓度(X, ng·mL-1)为横坐标, 以峰面积(Y)为纵坐标, 绘制标准曲线, 得线性方程(表 2)。
| Table 2 Linear results of three compounds |
咖啡酸、牛蒡苷和牛蒡苷元定量限分别为0.078、0.417和2.08 ng·mL-1, 检测限分别为0.018、0.097和0.38 ng·mL-1。
1.4 精密度计算咖啡酸、牛蒡苷和牛蒡苷元的峰面积RSD值分别为1.49%、1.77%和1.93%, 表明仪器的精密度良好。
1.5 重复性计算供试品中咖啡酸、牛蒡苷和牛蒡苷元含量分别为0.310 0、3 261.7和29.40 ng/106 μm2, RSD值分别为4.52%、4.74%、3.92%, 表明方法重复性可接受。
1.6 准确度计算咖啡酸6个浓度回收率均在98.2%~102.9%, 牛蒡苷除2.500 ng·mL-1, 其余5个浓度回收率均在100.2%~103.2%, 牛蒡苷元除2.500 ng·mL-1, 其余5个浓度回收率均在99.7%~104.7%;当咖啡酸、牛蒡苷和牛蒡苷元浓度均为5.000 ng·mL-1时, 计算其回收率均在98.5%~104.1%。各浓度点回收率RSD均小于5%。当咖啡酸样品浓度在2.500~500.0 ng·mL-1、牛蒡苷浓度在5.000~2 000 ng·mL-1和牛蒡苷元浓度在5.000~100.0 ng·mL-1时, 可根据标准曲线准确计算其浓度。
1.7 基质效应计算3个成分的回收率均在102.3%~103.9%, 误差小于5%, 可见基质对测定结果的影响可以忽略。
2 数据分析| Table 3 Contents of three compounds in embryonic parenchyma (Ep) cells and endocarp stone (Es) cells of Arctii Fructus at five growth stages. n = 2. Ep cells are embryonic parenchyma cells and Es cells are endocarp stone cells. Growth stage 1-5 are flower bud stage, early flowering stage, flowering stage, late flowering stage and mature stage. " -" stands for no detection |
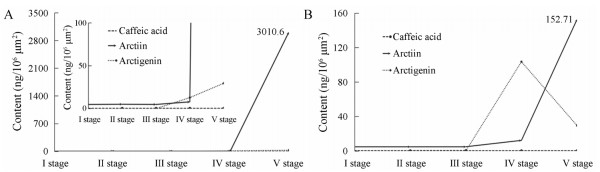
|
Figure 2 Accumulation trends of three compounds in embryonic parenchyma cells (A) and in endocarp stone cells (B) of Arctii Fructus at five growth stages |
预实验通过LC-TOF-MS对激光显微切割富集的细胞样品进行检测, 共得到6种化学成分, 其中包括牛蒡苷、牛蒡苷元。结果表明厚度30 μm, 总面积106 μm2的激光显微切割样品, 通过100 μL甲醇涡旋提取作为供试品, 进行液质分析可以达到检测样品中主要化学成分的目的, 该条件作为测定牛蒡子内果皮石细胞和胚薄壁细胞中3种化学成分的实验依据。在已有文献根茎类药材人参[13]、肉桂[14]冰冻切割样品厚度为40 μm, 果实类药材山茱萸[15]冰冻切割样品厚度为20 μm。虽然激光显微切割的细胞非常微小, 但UFLC-MS/MS技术具有高准确性和高灵敏度的特点。可以进行咖啡酸、牛蒡苷、牛蒡苷元3种成分定量分析, 对空白的覆膜载玻片进行切割, 作为定量分析的空白对照, 实验样品按面积进行积累, 但由于冰冻切割样品厚度、切割面积、细胞组织间隙等因素可能会对含量测定造成一定的误差。
结果表明, 牛蒡子胚薄壁细胞在花末期至成熟期产生和积累大量牛蒡苷。在成熟期内果皮石细胞中, 牛蒡苷也有一定积累, 但远小于胚薄壁细胞中的牛蒡苷含量。牛蒡子内果皮石细胞, 在花末期含有牛蒡苷元, 但花末期至成熟期牛蒡苷元含量有所减少, 成熟期牛蒡子内果皮石细胞中只含有少量牛蒡苷元。牛蒡子胚薄壁细胞与内果皮石细胞中的牛蒡苷与牛蒡苷元积累情况各不相同, 这与已报道柴胡[16]、青风藤[17]、芍药[18]、大黄[19]、射干[20]等情况类似, 化学成分在不同的组织细胞中积累情况不同。牛蒡子胚薄壁细胞在花末期至成熟期牛蒡苷大量积累, 这一结论对于牛蒡子采收期确定、栽培管理和牛蒡的植物保护具有重要意义, 充分体现了植物次生代谢产物的积累是植物化学防御的必然结果[21]。牛蒡苷、牛蒡苷元等次生代谢产物的大量积累, 对牛蒡果实的抗病、抑菌、杀虫、自我保护等具有重要作用, 在牛蒡种子萌发过程中, 对种苗的发育也起到良好的保护作用。
目前对落叶松脂素生物合成牛蒡苷途径存在两种可能[22], 第一种为罗汉松脂素(matairesinol)由葡萄糖转移酶(glucosyltransferase)生成中间成分, 再甲基化(methylation), 将中间成分转化为牛蒡苷。第二种为由罗汉松脂素特异性甲基化(regiospecific methylation)生成牛蒡苷元, 再由牛蒡苷元通过β-葡萄糖苷酶(β-D-glucosidase)生成牛蒡苷。通过实验结果表明, 胚薄壁细胞中牛蒡苷元并没有在某一个时期升高, 说明在产生牛蒡苷的时期, 有一种直接作用于落叶松脂素的葡萄糖聚合酶, 存在于牛蒡子胚薄壁细胞中, 使罗汉松脂素增加了一个葡萄糖基团, 从而大量生成牛蒡苷。通过图 2, 可以发现, 在牛蒡花末期的内果皮石细胞中, 牛蒡苷元含量最多, 多于牛蒡苷的含量, 而在成熟期的内果皮石细胞中牛蒡苷含量增加, 牛蒡苷元含量大幅减少, 说明在花末期牛蒡子内果皮石细胞中可能含有将罗汉松脂素去甲基化的酶, 生成牛蒡苷元。结果表明, 在牛蒡子胚薄壁细胞和内果皮石细胞中, 牛蒡苷的生物合成途径可能存在不同。
目前木脂素类化合物的生成途径已经初步探明[23-25], 苯丙氨酸进行脱氨开始, 最终由松伯醛生成松柏醇。并通过两个松柏醇(coniferyl alcohol)能进一步在聚合蛋白酶(DIR)的作用下催化生成松脂醇, 松脂醇经松脂醇还原酶(PLR)催化生成落叶松脂素。而落叶松脂素经过松脂醇还原酶(PLR)与催化酶(SIRD), 生成罗汉松脂素, 而将罗汉松脂素转化成为牛蒡苷的葡萄糖转移酶和去甲基化酶尚未有文献报道。由实验结果可知, 在成熟期牛蒡子胚薄壁细胞中牛蒡苷的大量产生和积累, 这和牛蒡苷生物合成途径中相关酶的表达有着密切联系, 可以进一步对不同生长时期牛蒡子胚薄壁细胞进行RNA-Seq测序, 对生物合成途径中相关功能基因表达量进行差异化分析, 从而进一步研究牛蒡子在生长发育过程中与牛蒡苷相关的酶和功能基因。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China. Part 1 (中华人民共和国药典一部) [S]. Beijing: China Medical Science Press, 2015: 72. |
| [2] | Ma TY, Chen YP, Cheng SP, et al. Research progress of Fructus Arctii[J]. J Liaoning Univ Tradit Chin Med (辽宁中医药大学学报), 2018, 20: 113–116. |
| [3] | Fan XQ, Shen YF. Research progress on pharmacological activities of arctiin[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2017, 51: 113–116. |
| [4] | Kang TG, Dou DQ, Hen GR, et al. Component comparison of the raw and processed Arctii Fructus and elucidation of its processing principle[J]. Planta Med, 2010, 76: 524–525. |
| [5] | Xing YP, Chen SY, Xu L, et al. Study on high throughput sequencing identification of Fructus Arctii and five counterfeit species mix power[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 3862–3866. |
| [6] | Kang TG, Dou DQ, Xu L. Establishment of a quality marker (Q-marker) system for Chinese herbal medicines using burdock as an example[J]. Phytomedicine, 2019, 54: 339–346. DOI:10.1016/j.phymed.2018.04.005 |
| [7] | Xu L, Dou DQ, Wang B, et al. Identification of traditional medicine " Fructus Arctii" by nuclear ribosomal DNA ITS sequences[J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 338–341. |
| [8] | Zhang F, Cai YF. Laser microdissection technology and its application in botany[J]. Bull Biol (生物学通报), 2010, 45: 11–12. |
| [9] | Jiang YB, Shan JH, Wang Y, et al. Application progress of LC-MS/MS technology in drug metabolism research[J]. Chin J Pharm Anal (药物分析杂志), 2014, 34: 385–391. |
| [10] | Hu J, Qin KM, Zhu TT, et al. Qualitative and quantitative analysis of major constituents of raw and processed Arctii Fructus by UHPLC-UV-Q-TOF-MS/MS[J]. Acta Pharm Sin (药学学报), 2017, 52: 603–608. |
| [11] | Zhou A, Li QL, Peng DY, et al. Analysis of xanthones in gamboge by HPLC-PDA-ESI/MS[J]. Acta Pharm Sin (药学学报), 2008, 43: 838–842. |
| [12] | Xue Y, Li XW, Li ZY, et al. UPLC/Q-TOF MS and NMR plant metabolomics approach in studying the effect of growth year on the quality of Polygala tenuifolia[J]. Acta Pharm Sin (药学学报), 2015, 50: 340–347. |
| [13] | Liang Z, Chen Y, Xu L, et al. Localization of ginsenosides in the rhizome and root of Panax ginseng by laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J]. J Pharm Biomed Anal, 2015, 105: 121–133. DOI:10.1016/j.jpba.2014.12.005 |
| [14] | Zhou W, Liang Z, Li P, et al. Tissue-specific chemical profiling and quantitative analysis of bioactive components of Cinnamomum cassia by combining laser-microdissection with UPLC-Q/TOF-MS[J]. Chem Central J, 2018, 12: 71. DOI:10.1186/s13065-018-0438-x |
| [15] | Qiao Q, Xiao YP, Wang ZZ. Anatomical structure and histochemical localization of the drupe of Macrocarpium officinacle[J]. Acta Bot Yunnan (云南植物研究), 2004, 26: 651–655. |
| [16] | Liang Z, Oh K, Wang Y, et al. Cell type-specific qualitative and quantitative analysis of saikosaponins in three Bupleurum species using laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J]. J Pharm Biomed Anal, 2014, 97: 157–165. DOI:10.1016/j.jpba.2014.04.033 |
| [17] | Yi L, Liang ZT, Peng Y, et al. Tissue-specific metabolite profiling of alkaloids in Sinomenii Caulis using laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J]. J Chromatogr A, 2012, 1248: 93–103. DOI:10.1016/j.chroma.2012.05.058 |
| [18] | Wang Q, Liang Z, Peng Y, et al. Whole transverse section and specific-tissue analysis of secondary metabolites in seven different grades of root of Paeonia lactiflora using laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J]. J Pharm Biomed Anal, 2015, 103: 7–16. DOI:10.1016/j.jpba.2014.10.020 |
| [19] | Liang Z, Sham T, Yang G, et al. Profiling of secondary metabolites in tissues from Rheum palmatum L. using laser microdissection and liquid chromatography mass spectrometry[J]. Anal Bioanal Chem, 2013, 405: 4199–4212. DOI:10.1007/s00216-013-6819-z |
| [20] | Chen YJ, Liang ZT, Zhu Y, et al. Tissue-specific metabolites profiling and quantitative analyses of flavonoids in the rhizome of Belamcanda chinensis by combining laser-microdissection with UHPLC-Q/TOF-MS and UHPLC-QqQ-MS[J]. Talanta, 2014, 130: 585–597. DOI:10.1016/j.talanta.2014.07.004 |
| [21] | Zhai MZ. Disease Resistance Activity and Structure-Activity Analysis of Plant Secondary Metabolites (植物次生产物的抗病活性及构效分析) [D]. Fuzhou: Fujian Agriculture and Forestry University, 2003. |
| [22] | Liu DL, Xu SX, Liu FS. Advances in biosynthesis of lignans from Forsythia[J]. Chin J Med Chem (中国药物化学杂志), 1996, 6: 68–73. |
| [23] | Kim HJ, Ono E, Morimoto K, et al. Metabolic engineering of lignan biosynthesis in forsythia cell culture[J]. Plant Cell Physiol, 2009, 50: 2200–2209. DOI:10.1093/pcp/pcp156 |
| [24] | Boerjan W, Ralph J, Baucher M. Lignin biosynthesis[J]. Ann Rev Plant Biol, 2003, 54: 519–546. DOI:10.1146/annurev.arplant.54.031902.134938 |
| [25] | Umezawa T. Diversity in lignan biosynthesis[J]. Phytochem Rev, 2003, 2: 371–390. DOI:10.1023/B:PHYT.0000045487.02836.32 |
 2019, Vol. 54
2019, Vol. 54


