2. 中国科学院微生物研究所病原微生物与免疫学重点实验室, 北京 100101
2. Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
Foxo-1 (Forkhead box O1)是Fox forkhead转录调控因子家族的成员之一, 是调控肌肉生长和代谢的重要转录因子, 它在能量消耗性疾病中高表达, 例如禁食、癌症和糖尿病[1-3]。为了探索Foxo-1是否可以作为肌肉萎缩治疗的一个潜在分子靶点, 深入了解Foxo-1调节肌肉的发育和生长机制, 本研究设计使用了一种靶向Foxo-1 mRNA的修饰型反义RNA寡核苷酸。
由于合成的RNA寡核苷酸在生物体内血清环境中极易被核酸酶降解而不稳定, 且不易被组织吸收等特点, 因此有必要对合成的RNA寡核苷酸进行化学修饰, 增加其热稳定性和对核酸酶降解的抗性, 减少非特异性血液蛋白的吸附作用, 调节对靶组织的分布并改善药代动力学性质。包括硫代磷酸化(PS)修饰可增加RNA寡核苷酸半衰期[4-6]。但是这种修饰增加了RNA寡核苷酸与其他蛋白产生非特异性相互作用的几率, 导致序列非依赖性表型效应或细胞毒性。高浓度的PS反义寡核苷酸(ASOs)也可以约束和抑制DNA聚合酶和RNaseH的作用。为了消除PS ASOs的脱靶效应, 采用其他类型的修饰应用于ASOs的改造, 如采用裂隙技术(LNA/RNA gapmers)增加结合亲和力, 更为重要的是提高稳定性; 烷基修饰, 如2'-O-烷基修饰, 避免了PS修饰, 提高了ASOs的稳定性与有效性[7-10]。
为探索更加稳定的RNA寡核苷酸和评估RNA寡核苷酸的有效性, 为临床应用提供更丰富可靠的信息, 本文对RNA寡核苷酸进行了2'-O-甲基和3'-丁醇基末端修饰, 以期增强RNA寡核苷酸对靶序列的亲和力和对核酸内切酶及3'-外切酶的抗性。对修饰型RNA寡核苷酸的小鼠体内药效学、药动学行为及安全性进行了一系列分析。
材料与方法RNA寡核苷酸 靶向Foxo-1的RNA寡核苷酸由美国Oligos公司提供, 序列为AUGGGGUGGGACAG AGGC (GGR7), 主要修饰为2'-O-甲基和3'-丁醇基末端修饰, HPLC纯化。
实验动物 SPF级BALB/c小鼠雌雄各半, 6~8周龄, 体重15~18 g, 购自北京维通利华实验动物技术有限公司, 动物许可证号SCXK (京) 2012-0001, 饲养于中科院遗传与发育研究所实验动物中心, 室温22~26 ℃, 相对湿度40%~60%, 12 h/12 h明暗循环。动物实验已通过中国疾病预防控制中心营养与健康所动物伦理委员会批准。
试剂和仪器 总RNA提取TRIzol试剂购自美国Invitrogen公司; 反转录试剂盒、Real time PCR试剂盒购自TaKaRa公司; MEK6318K自动血液分析仪为日本光电公司产品; TECHNICON RA-1000生化分析仪为美国拜耳公司产品; Real time PCR仪为Bio-Rad公司产品。
RNA寡核苷酸的给药处理 小鼠实验中RNA寡核苷酸通过尾静脉注射和口服灌胃给药, 单次给药剂量为10、20和30 mg·kg-1, 两天给药一次, 持续4周。小鼠在给药期间每天进行称重。实验结束时, 解剖并称重腿部肌肉, 然后于液氮中保存待用, 其他新鲜组织用福尔马林溶液固定用于组织病理学分析。
Real Time PCR检测肌肉生长调控因子的表达 取小鼠后腿肌肉, 迅速置于液氮中研磨后, 用TRIzol试剂提取总RNA, 然后进行RT-PCR反应, 用荧光定量PCR仪检测肌肉生长调控因子Foxo-1、MyoD、GDF-8和内参β-actin mRNA相对水平, 引物见表 1。PCR反应参数为: 95 ℃预变性10 min; 95 ℃变性15 s, 60 ℃退火60 s, 40个循环。结果中的CT值运用公式2-ΔΔCt计算表达基因的相对变化。
| Table 1 Primers used in Real-time PCR assay |
血浆药代动力学测定 BALB/c小鼠通过尾静脉注射剂量为100 mg·kg-1 RNA寡核苷酸, 给药后0、5、15、30 min及1、2、4、8、12、24和48 h取血, 离心取上层血浆通过苯酚/氯仿抽提法提取分离RNA寡核苷酸。然后RNA寡核苷酸5'末端通过T4多核苷酸激酶(PNK)被[γ32P]-ATP标记, 通过19%变性聚丙烯酰胺凝胶电泳进行分离, 电泳结束后凝胶置于磷屏中扫描观察结果。利用ImageQuant图片处理软件分析RNA寡核苷酸含量并绘制血浆药物浓度(C)-时间(t)曲线, 用3P97统计软件判断房室模型, 并计算相应参数。
安全性分析 小鼠给药4周后取血, 进行血液学和临床生化指标分析。另取肝、脾、肾用于组织病理学分析, 用福尔马林溶液固定组织后石蜡包埋, 石蜡切片(2~4 µm)用苏木精和伊红(H & E)染色在光学显微镜下观察并拍照。
统计学方法 数据采用SPSS软件进行处理和分析, 统计处理以x ± s表示, 多组间的比较采用单因素方差分析(ANOVA)或者两组间的比较采用t检验对数据进行统计分析, P < 0.05为显著差异。
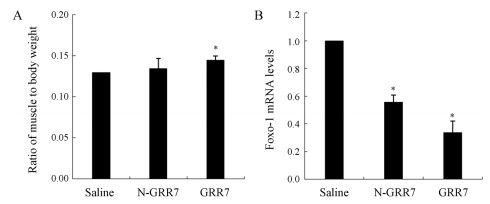
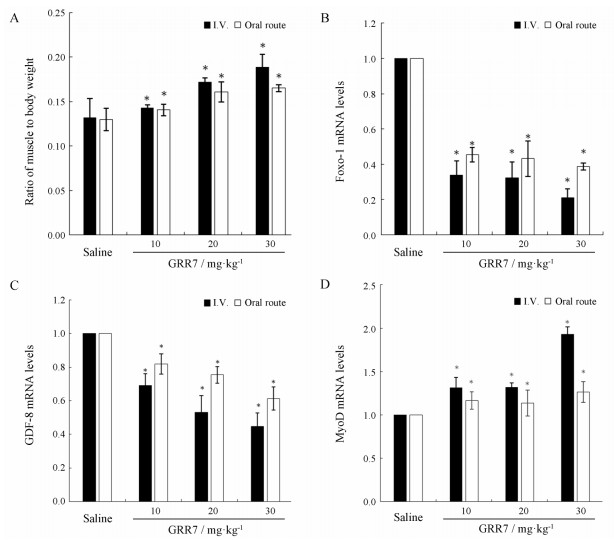
结果 1 RNA寡核苷酸药效学分析在前期研究工作中, 小鼠经静脉注射给予剂量为10 mg·kg-1的RNA寡核苷酸, 4周后肌肉称重, 并提取小鼠肌肉组织RNA, 通过Real Time PCR分析Foxo-1的mRNA水平, 结果表明同未修饰的RNA寡核苷酸相比, 修饰型RNA寡核苷酸作用效果更为显著(图 1)。在此基础上, 进一步分析不同给药途径和不同剂量的修饰型RNA寡核苷酸在小鼠体内的作用效果。结果显示同对照相比, 不同剂量的RNA寡核苷酸通过静脉注射和口服给药4周后均能降低小鼠骨骼肌Foxo-1的表达(图 2B); 分离小鼠腿部的肌肉称重, 结果显示, Foxo-1表达被抑制的实验组与正常对照组相比较, 肌肉重量都得到了增加(图 2A); 此外检测了GDF-8和MyoD的mRNA表达水平, Foxo-1表达被抑制的实验组与正常对照组相比较, GDF-8表达下调, MyoD表达上调(图 2C、D)。
|
Figure 1 Effect of Foxo-1 RNA oligonucleotide on mice four weeks postadministration. A: The ratio of muscle to body weight in normal mice treated with Foxo-1 targeted RNA oligonucleotides. B: Quantitative reverse transcription-PCR analysis of Foxo-1 at mRNA level in mice. GGR7: AUGGGGUGGGACAGAGGC; N-GRR7: Non-modified GRR7. n = 8, x ± s. *P < 0.05 vs Saline |
|
Figure 2 Effect of Foxo-1 RNA oligonucleotide on mice four weeks postadministration. A: The ratio of muscle to body weight in normal mice treated with Foxo-1 targeted RNA oligonucleotides. B: Quantitative reverse transcription-PCR analysis of Foxo-1 at mRNA level in mice. C: Quantitative reverse transcription-PCR analysis of GDF-8 at mRNA level in mice. D: Quantitative reverse transcription-PCR analysis of MyoD at mRNA level in mice. n= 8, x ± s. *P < 0.05 vs Saline |
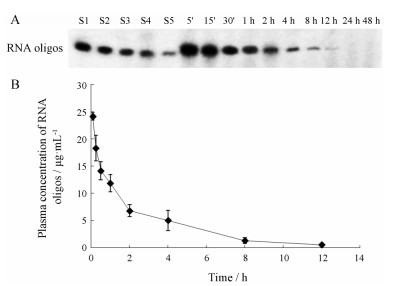
小鼠尾静脉注射剂量为100 mg·kg-1的修饰型RNA寡核苷酸后, 多个时间点取血检测RNA寡核苷酸血药浓度, 通过ImageQuant软件分析RNA寡核苷酸电泳的放射自显影结果, 绘制血浆药物浓度-时间曲线, 如图 3所示; 用3P97软件分析, 单次静脉注射给药后RNA寡核苷酸在小鼠体内的动力学过程符合线性过程, 最佳房室模型为二室模型。主要的参数如表 2所示。
|
Figure 3 Plasma concentration vs time after single dose of RNA oligos. A: Representative autoradiograph showing intact in plasma at various time points after dose. S1-S5 represent 1, 0.5 0.25, 0.125, 0.062 5 µg RNA oligos, respectively. B: Plasma concentration-time curve of RNA oligos. n= 6, x ± s |
| Table 2 Plasma pharmacokinetic parameters of Foxo-1 RNA oligonucleotide in mice. Cmax: Peak plasma concentration; t1/2α: Plasma distribution half-life; t1/2β: Elimination half-life; AUC: The area under the curve; CL: Total body clearance; Vd: Volume of distribution. n = 6, x ± s |
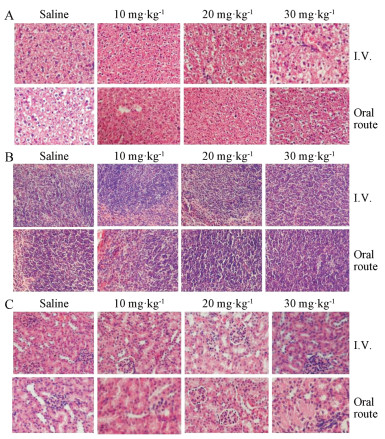
小鼠实验中靶向Foxo-1的修饰型RNA寡核苷酸通过尾静脉注射和口服灌胃给药, 单次给药剂量为10、20和30 mg·kg-1, 小鼠给药4周后取血, 进行血液学指标和肝肾功能等生化指标检测, 各项血液参数和生化指标均正常。组织病理学分析表明, 通过光学显微镜观察分析染色后的石蜡切片, 小鼠肝脏组织肝小叶结构清晰, 索窦比例正常, 汇管区未见纤维组织增生及炎细胞浸润; 脾脏组织结构清晰, 红髓、白髓及边缘区清晰, 未见明显异常; 肾脏组织皮、髓质分界清晰, 肾小球、肾小管、集合管、间质及肾盂粘膜均未见明显异常(图 4)。以上结果表明, 不同剂量的修饰型RNA寡核苷酸对小鼠安全无不良反应。
|
Figure 4 Histopathology of tissues from mice four weeks postadministration. These included tissues from the liver (A), spleen (B) and kidney (C). Original magnification: 200× |
Forkhead转录因子家族处在调控细胞不同功能的信号通路上, 例如生长、分化和新陈代谢过程。高表达有活性的Foxo因子能显著诱导肌管乃至整个肌肉组织的萎缩。作者前期的研究显示通过新型修饰的RNA寡核苷酸抑制Foxo-1表达能促进正常小鼠和恶病质模型小鼠肌肉的增长。进一步的研究表明, 抑制Foxo-1能够引起GDF-8表达下调的同时引起MyoD表达上调[11, 12]。
小分子RNA基因疗法的效果取决于它的稳定性、靶向性、转染效率和药物安全性等。为增强RNA寡核苷酸药物的生物稳定性, 已研究探索出很多的RNA寡核苷酸药物的修饰方式, 例如硫代核苷酸修饰(phosphorothioated backbones, PS oligos)、2'-O修饰、2'-甲基化修饰、2'-O-烷基、2'-C-烯丙位取代、肽核酸、P-己氧基、磷酸三脂、马林代、甲基磷酸脂连接等。在抗病毒和抗肿瘤的应用模型中还用到了包含2'碱基修饰或联合修饰从而形成混合修饰骨架的寡核苷酸[13, 14]。实验还表明, 2'-OH用甲基烯丙基、氨基、脱氧、氟代, 或O-甲基基团取代都可以提高合成的寡核苷酸的稳定性和药理性质。在细胞培养和动物实验中, 人们还把多个衍生物联合应用, 包括3'倒置、PS骨架及在寡核苷酸的不同位置上的2'-氟代-2'-脱氧嘧啶, 2'-O-甲基, 或2'-烯丙基核酸修饰等来加强寡核苷酸的稳定性[15-20]。
作者对寡核苷酸做了联合修饰, 这种修饰增加了寡核苷酸的稳定性; 并且2'-O-甲基修饰增强了它与靶RNA的结合力; 3'-丁醇基修饰增强其对3'-核酸外切酶的抵抗力。本研究在前期工作的基础上确定了靶向Foxo-1的序列特异的RNA寡核苷酸。药效学研究表明, 不同剂量和不同给药途径RNA寡核苷酸均能有效抑制小鼠肌肉Foxo-1的表达进而促进肌肉质量的增加。新型修饰的Foxo-1 RNA寡核苷酸单次静脉注射给药后在小鼠体内的动力学过程符合二室模型。安全性研究结果表明小鼠完全能耐受剂量为10.0、20.0和30.0 mg·kg-1RNA寡核苷酸。未发现小鼠的临床化学指标和组织病理分析异常, 说明这种RNA寡核苷酸对小鼠无不良反应。
RNA寡核苷酸已经迅速广泛地应用到基因功能研究、基因表达调控机制和抗肿瘤、抗病毒感染等热门领域, 并为基因治疗开辟了全新的途径。尽管反义核酸药物的研究经历了一些坎坷, 但得益于近年来化学修饰、载体递送、靶标筛选等技术的不断进步, 反义核酸作为核酸药物治疗领域中开发最早、成熟度最高的一个种类, 具有广阔的药物研发和应用前景。为加速RNA寡核苷酸的临床应用, 使小RNA分子成功应用于生物体内, 发展可被临床接受的制剂、能方便使用、高细胞转染效率、半衰期合适、细胞特异性和靶向性强的给药系统是今后研究的重要领域。
| [1] | Liu Y, Wang X, Leng W, et al. Aspartate inhibits LPS-induced MAFbx and MuRF1 expression in skeletal muscle in weaned pigs by regulating Akt, AMPKα and FOXO1[J]. Innate Immun, 2017, 23: 34–43. DOI:10.1177/1753425916673443 |
| [2] | Chacon Cabrera A, Fermoselle C, Urtreger AJ, et al. Pharmacological strategies in lung cancer-induced cachexia: effects on muscle proteolysis, autophagy, structure, and weakness[J]. J Cell Physiol, 2014, 229: 1660–1672. DOI:10.1002/jcp.24611 |
| [3] | Awad H, Nolette N, Hinton M, et al. AMPK and FoxO1 regulate catalase expression in hypoxic pulmonary arterial smooth muscle[J]. Pediatr Pulmonol, 2014, 49: 885–897. DOI:10.1002/ppul.v49.9 |
| [4] | Iannitti T, Morales Medina JC, Palmieri B. Phosphorothioate oligonucleotides: effectiveness and toxicity[J]. Curr Drug Targets, 2014, 15: 663–673. DOI:10.2174/1389450115666140321100304 |
| [5] | Flierl U, Nero TL, Lim B, et al. Phosphorothioate backbone modifications of nucleotide-based drugs are potent platelet activators[J]. J Exp Med, 2015, 212: 129–137. DOI:10.1084/jem.20140391 |
| [6] | Banks WA. Measurement of phosphorothioate oligodeoxynucleotide antisense transport across the blood-brain barrier[J]. Methods Mol Biol, 2011, 789: 337–342. DOI:10.1007/978-1-61779-310-3 |
| [7] | Lee JJA, Maruyama R, Duddy W, et al. Identification of novel antisense-mediated exon skipping targets in DYSF for therapeutic treatment of dysferlinopathy[J]. Mol Ther Nucleic Acids, 2018, 13: 596–604. DOI:10.1016/j.omtn.2018.10.004 |
| [8] | Prakash TP, Yu J, Kinberger GA, et al. Evaluation of the effect of 2'-O-methyl, fluoro hexitol, bicyclo and morpholino nucleic acid modifications on potency of GalNAc conjugated antisense oligonucleotides in mice[J]. Bioorg Med Chem Lett, 2018, 28: 3774–3779. DOI:10.1016/j.bmcl.2018.10.011 |
| [9] | Chery J, Petri A, Wagschal A, et al. Development of locked nucleic acid antisense oligonucleotides targeting Ebola viral proteins and host factor Niemann-Pick C1[J]. Nucleic Acid Ther, 2018, 28: 273–284. DOI:10.1089/nat.2018.0722 |
| [10] | Osawa T, Sawamura M, Wada F, et al. Synthesis, duplex-forming ability, enzymatic stability, and in vitro antisense potency of oligonucleotides including 2'-C, 4'-C-ethyleneoxy-bridged thymidine derivatives[J]. Org Biomol Chem, 2017, 15: 3955–3963. DOI:10.1039/C7OB00698E |
| [11] | Liu CM, Yang Z, Liu CW, et al. Effect of RNA oligonucleotide targeting Foxo-1 on muscle growth in normal and cancer cachexia mice[J]. Cancer Gene Ther, 2007, 14: 945–952. DOI:10.1038/sj.cgt.7701091 |
| [12] | Liu CM, Yang Z, Liu CW, et al. Myostatin antisense RNA-mediated muscle growth in normal and cancer cachexia mice[J]. Gene Ther, 2008, 15: 155–160. DOI:10.1038/sj.gt.3303016 |
| [13] | Javanbakht H, Mueller H, Walther J, et al. Liver-targeted anti-HBV single-stranded oligonucleotides with locked nucleic acid potently reduce HBV gene expression in vivo[J]. Mol Ther Nucleic Acids, 2018, 11: 441–454. DOI:10.1016/j.omtn.2018.02.005 |
| [14] | Harada T, Matsumoto S, Hirota S, et al. Chemically modified antisense oligonucleotide against ARL4C inhibits primary and metastatic liver tumor growth[J]. Mol Cancer Ther, 2019, 18: 602–612. DOI:10.1158/1535-7163.MCT-18-0824 |
| [15] | Le BT, Adams AM, Fletcher S, et al. Rational design of short locked nucleic acid-modified 2'-O-methyl antisense oligonucleotides for efficient exon-skipping in vitro[J]. Mol Ther Nucleic Acids, 2017, 9: 155–161. DOI:10.1016/j.omtn.2017.09.002 |
| [16] | Toonen LJA, Casaca-Carreira J, Pellisé-Tintoré M, et al. Intracerebroventricular administration of a 2'-O-methyl phosphorothioate antisense oligonucleotide results in activation of the innate immune system in mouse brain[J]. Nucleic Acid Ther, 2018, 28: 63–73. DOI:10.1089/nat.2017.0705 |
| [17] | Donner AJ, Bell TA, Greenlee S, et al. Characterization of the activity and distribution of a 2'-O-methoxyethyl-modified antisense oligonucleotide in models of acute and chronic kidney disease[J]. Nucleic Acid Ther, 2018, 28: 297–306. DOI:10.1089/nat.2018.0723 |
| [18] | Yamada K, Abe Y, Murase H, et al. Synthesis and properties of 2'-OMe-RNAs modified with cross-linkable 7-deazaguanosine derivatives[J]. J Org Chem, 2018, 83: 8851–8862. DOI:10.1021/acs.joc.8b01002 |
| [19] | Shen W, De Hoyos CL, Sun H, et al. Acute hepatotoxicity of 2' fluoro-modified 5-10-5 gapmer phosphorothioate oligonucleotides in mice correlates with intracellular protein binding and the loss of DBHS proteins[J]. Nucleic Acids Res, 2018, 46: 2204–2217. DOI:10.1093/nar/gky060 |
| [20] | Istrate A, Katolik A, Istrate A, et al. 2'β-Fluoro-tricyclo nucleic acids (2'F-tc-ANA): thermal duplex stability, structural studies, and RNase H activation[J]. Chemistry, 2017, 23: 10310–10318. DOI:10.1002/chem.v23.43 |
 2019, Vol. 54
2019, Vol. 54


