国际糖尿病联盟(IDF)糖尿病概览数据显示[1, 2]:至2017年, 我国糖尿病人数已达1.14亿, 其中2型糖尿病患者占90%以上, 需长期口服降糖药物以控制高血糖及并发症的发生和发展。在庞大糖尿病患病人群及后备军(糖尿病前期)用药市场的需求下, 全球抗糖尿病创新药物的研发逐渐走向新高。
α葡萄糖苷酶抑制剂通过抑制肠黏膜刷状缘糖苷酶活性, 减缓寡糖、双糖水解为单糖的速度, 以降低和延缓餐后血糖的上升。因此, 在调节餐后血糖方面优于其他降糖药物, 能有效延缓糖尿病前期患者向2型糖尿病的发展, 降低糖尿病发病率, 且对糖尿病并发症有很好的预防作用[3]。最新《ADA糖尿病治疗指南》和《中国2型糖尿病防治指南2017版》均指出, α葡萄糖苷酶抑制剂可作为一线治疗药物单独使用, 还可与其他口服抗糖尿病药物或胰岛素联合, 用于2型糖尿病的全程治疗[4]。我国的饮食结构特点是以碳水化合物为主, 且新诊断2型糖尿病患者中, 以餐后血糖升高为特点的比例可达80%~85%, 因此, 糖苷酶抑制剂是更适合中国糖尿病人群的抗糖尿病药物[5]。阿卡波糖(acarbose)作为首个上市的糖苷酶抑制剂, 一直位居我国口服降糖药物榜首。
我国丰富的中草药资源宝库及古籍中记载的多种治疗糖尿病(消渴症)方剂, 为探寻传统天然药材资源中的α葡萄糖苷酶抑制剂提供了重要线索。课题组采用体外酶学筛选体系, 评价了数百种中药提取物的糖苷酶抑制活性, 发现桑属系列药材(特别是桑枝的水提取物)具有较强的糖苷酶抑制活性[6, 7]。经多学科合作研究, 确定了桑枝有效部位提取物中主要活性成分是一组多羟基生物碱及其苷类, 通过后续工艺优化, 总生物碱含量可达到50%以上, 故命名为桑枝总生物碱(简称SZ-A)。本研究将在离体酶学和几种糖尿病动物模型中考察SZ-A的降糖活性和作用特点, 为其开发成为新型抗糖尿病中药提供依据。
材料与方法药品、试剂及实验仪器 SZ-A为中国医学科学院药物研究所提供, 总生物碱含量53.4%。阿卡波糖(德国拜耳公司); 血糖、甘油三酯(TG)、胆固醇(TC)试剂盒, 中生北控生物科技股份有限公司; 糖化血清蛋白测定试剂盒, 南京建成生物工程研究所; 链脲霉素(streptozotocin, STZ)、α淀粉酶, 购自Sigma公司; 葡萄糖、蔗糖、麦芽糖和四氧嘧啶等其他试剂均为国产分析纯; 小鼠超敏胰岛素ELISA试剂盒, ALPCO公司; μ-Quant酶标仪(美国BIO-TEK公司); 3-18K型低温高速离心机(德国Sigma公司); HZQ-C空气浴震荡器(哈尔滨东明医疗仪器厂); BS110S天平(德国Sartorius公司)。
α葡萄糖苷酶离体酶学活性评价方法 蔗糖和麦芽糖在α葡萄糖苷酶的作用下分解为葡萄糖。通过测定反应体系中葡萄糖的生成量, 判断受试样品对蔗糖酶和麦芽糖酶活性的抑制作用。淀粉在淀粉酶的作用下分解, 通过测定反应体系中淀粉的剩余量, 判断受试样品对淀粉酶的抑制活性。酶制备及抑制活性评价体系参考本实验室已建立的方法[8]。
糖尿病和糖尿病前期肥胖性胰岛素抵抗动物模型的形成 雄性ICR小鼠(22~24 g), 雄性SD大鼠(150~170 g)均购自北京维通利华生物科技股份有限公司, 许可证号为SCXK (京) 2016-0006;雄性C57BL/6J小鼠(26~28 g), 购自北京华阜康生物科技股份有限公司, 许可证号为SCXK (京) 2014-0004;所有动物均饲养于SPF级动物房。所用实验动物模型如下: ①四氧嘧啶高血糖小鼠:正常ICR小鼠尾静脉注射四氧嘧啶(alloxan) 70 mg·kg-1, 72 h后预测血糖(葡萄糖氧化酶法, 以下同), 选用血糖大于250 mg·dL-1的小鼠进行实验分组。②链脲霉素糖尿病大鼠:雄性SD大鼠腹腔注射STZ 55 mg·kg-1 (柠檬酸缓冲液配制), 72 h后预测血糖, 选用血糖大于300 mg·dL-1的大鼠并参照体重进行实验分组, 正常SD大鼠腹腔注射柠檬酸缓冲液作为正常对照组。③糖尿病前期肥胖性胰岛素抵抗小鼠:正常C57小鼠, 以高脂饲料(RD12942)饲养5个月后, 体重接近50 g, 即形成糖尿病前期肥胖性胰岛素抵抗C57小鼠(HFC57)模型, 伴有空腹血糖升高、胰岛素抵抗、高胆固醇血症和高胰岛素血症等特征。动物实验操作过程均依照中国医学科学院北京协和医学院《药物研究所动物实验中心标准操作规程》及实验动物管理与动物福利委员会的要求执行。
单次给药对小鼠蔗糖、淀粉和葡萄糖耐量的影响 正常雄性ICR小鼠(或四氧嘧啶高血糖小鼠) 50只, 按体重(或血糖)均分为对照组、阳性药物阿卡波糖组(Acar, 10 mg·kg-1 B.W., ig)和不同剂量SZ-A组(10、20、40 mg·kg-1 B.W., ig), 每组10只。分别进行口服蔗糖(4.0 g·kg-1)、淀粉(3.0 g·kg-1)和葡萄糖(2.0 g·kg-1)耐量实验。测定空腹血糖及给药后30、60、120 min的血糖值, 并计算血糖曲线下面积(AUC)。
对STZ糖尿病大鼠糖脂代谢的影响 链脲霉素糖尿病大鼠50只, 参照血糖和体重均分为5组(n=10), 一组饲以高蔗糖饲料作为糖尿病对照组(Con), 一组饲以含阿卡波糖的高蔗糖饲料(Acar, 0.3 g·kg-1 diet.), 另3组分别饲以含不同剂量SZ-A的高蔗糖饲料(0.3、0.6和1.2 g·kg-1 diet.)。正常对照组(Nor)饲以普通饲料。以上各组动物均自由摄食、饮水。每天观察动物一般状态, 记录摄食量和饮水量。每周测定随机血糖, 给药3周后, 测定空腹血糖、血脂(血TG、血TC)、糖化血清蛋白, 用代谢笼收集尿液以测定尿糖含量。
对糖尿病前期HFC57小鼠糖脂代谢的影响 选用空腹血糖在150~180 mg·dL-1的肥胖性胰岛素抵抗HFC57小鼠20只, 并参照血脂和体重均分为两组(n=10)。一组灌胃蒸馏水作为模型对照组(Con), 一组灌胃桑枝总生物碱(SZ-A, 50 mg·kg-1 B.W.); 另取正常C57小鼠作为正常对照组(n=10, Nor, 饲以普通饲料), 以蒸馏水灌胃。给药共6周, 期间从第3周开始, 每周测定随机血糖和空腹血糖, 第4周进行口服葡萄糖耐量实验, 并测定0和15 min的血清胰岛素水平, 计算糖刺激后15 min的胰岛素分泌倍数; 第6周进行胰岛素耐量实验, 并测定空腹血清胰岛素; 实验结束时, 测定血TG和血TC水平。
胰岛素耐量实验(ITT) 实验当天, 动物禁食4 h, 皮下注射常规胰岛素溶液(0.4 U·kg-1), 测定注射前(0 min)和注射后40、90 min各时间点的血糖水平, 并计算血糖AUC。
统计学方法 采用SPSS 17.0统计软件进行分析, 数据采用x ± s表示, 采用单因素方差分析进行统计学分析, P < 0.05表示有显著性差异, 绘图软件采用GraphPad Prism 6。
结果 1 SZ-A对α葡萄糖苷酶(蔗糖酶、麦芽糖酶、淀粉酶)活性的抑制作用如图 1所示, SZ-A抑制蔗糖酶活性的半数抑制浓度(IC50)为21.9 ng·mL-1, 作用略强于阿卡波糖(87.1 ng·mL-1); 抑制麦芽糖酶活性的IC50为40.4 ng·mL-1, 作用与阿卡波糖相当(39.3 ng·mL-1); SZ-A在100 μg·mL-1浓度时, 对淀粉酶无抑制作用, 而阿卡波糖对淀粉酶活性抑制的IC50为2.4 μg·mL-1, 这表明SZ-A是一种较强的双糖酶抑制剂。

|
Figure 1 The inhibitory effects of SZ-A against α-glucosidase, including sucrase (A), maltase (B) and amylase (C). D: The IC50 values on sucrase, maltase and amylase, respectively. SZ-A: Sangzhi alkaloids; Acar: Acarbose. n = 10, x ± s |
为了验证SZ-A的降糖活性和作用机制, 首先以正常ICR小鼠为模型, 观察单次口服给药后, 对蔗糖(双糖)、淀粉(多糖)及葡萄糖(单糖)负荷后血糖水平的影响。
图 2A和B所示, SZ-A在10~40 mg·kg-1剂量范围内, 单次给药能使正常小鼠蔗糖负荷后血糖峰值明显降低(P < 0.001), 峰值时间后移, 血糖曲线下面积(AUC)显著降低(P < 0.01); 图 2C和D所示, SZ-A在10~40 mg·kg-1剂量范围内, 降低正常小鼠淀粉负荷后的血糖峰值, 且大剂量组的血糖曲线下面积明显降低(P < 0.001); 图 2E和F结果显示, SZ-A各剂量组对正常小鼠葡萄糖负荷后各时间点的血糖均无影响。表明SZ-A的作用靶点确为α葡萄糖苷酶, 对葡萄糖自胃肠道的吸收无直接影响。

|
Figure 2 Effects of SZ-A at a single dose (10, 20, 40 mg·kg-1) on blood glucose and area under the blood glucose concentration time curve (AUC) after oral sucrose (A, B), starch (C, D) and glucose (E, F) loading in normal ICR mice. n = 10, x ± s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs Nor. Acar: 10 mg·kg-1 |
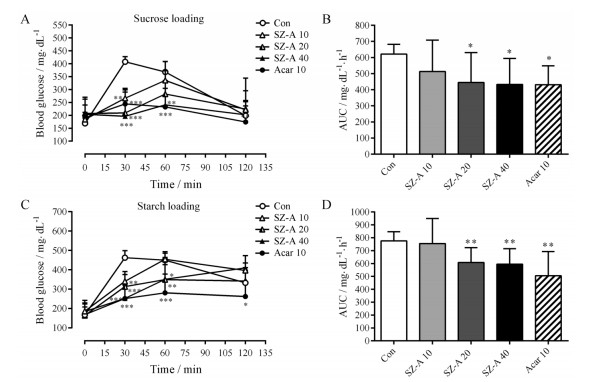
为进一步验证SZ-A的降血糖作用, 以四氧嘧啶高血糖小鼠为模型, 观察单次口服给药后, 对蔗糖和淀粉负荷后血糖水平的影响。
图 3A和B所示, SZ-A在20和40 mg·kg-1剂量下, 可降低四氧嘧啶糖尿病小鼠蔗糖负荷后的血糖峰值(P < 0.01, P < 0.001), 使峰值时间后移, 并降低血糖曲线下面积(P < 0.05); 图 3C和D所示, SZ-A在20和40 mg·kg-1剂量下, 亦可降低四氧嘧啶高血糖小鼠淀粉负荷后血糖峰值及血糖曲线下面积(P < 0.01)。
|
Figure 3 Effects of SZ-A at a single dose (10, 20, 40 mg·kg-1) on blood glucose and area under the blood glucose AUC after oral sucrose (A, B) and starch (C, D) loading in alloxan-induced hyperglycemic mice. n = 10, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs Con. Acar: 10 mg·kg-1 |
为了考察长期给予SZ-A的抗糖尿病作用, 在链脲霉素高血糖大鼠模型中, 连续给药3周, 监测其对糖脂代谢的影响。根据糖苷酶抑制剂的作用机制及临床用药特点, 采用药物与高蔗糖饲料混合喂养的方式给药。
图 4A所示, 给药1周后, SZ-A各剂量组的随机血糖均有所降低(中剂量组, P < 0.05);给药2周时, 3个剂量组的随机血糖均显著降低(P < 0.05, P < 0.05, P < 0.01);给药3周时, 除随机血糖降低外, 大剂量组的空腹血糖水平也明显降低(P < 0.05, 图 4B), 且糖化血清蛋白(GSP)水平显著低于Con组(P < 0.05, 图 4C), 尿糖含量亦显著减少(P < 0.05, 图 4D)。

|
Figure 4 Effects of SZ-A (0.3, 0.6, 1.2 g·kg-1 diet.) on glucose and lipid metabolism after long-term treatment in STZ-induced hyperglycemic rats. A: Postprandial blood glucose levels; B: Fasting blood glucose; C: Glycosylated serum protein levels; D: Urinary glucose levels; E: Blood triglyceride levels; F: Blood total cholesterol levels. n = 10, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs Con. Acar: 0.3 g·kg-1 diet |
给药3周后, SZ-A各剂量组的血甘油三酯水平显著降低(P < 0.05, P < 0.05, P < 0.01, 图 4E), 且呈一定量效关系, 大剂量组亦能够显著降低血总胆固醇水平(P < 0.01, 图 4F)。
5 SZ-A长期给药对糖尿病前期肥胖性胰岛素抵抗C57小鼠(HFC57)的糖脂代谢紊乱状态的影响在糖尿病前期C57小鼠(HFC57)模型中, 通过灌胃给药方式长期给予SZ-A (50 mg·kg-1), 考察SZ-A对糖脂代谢的影响以及是否存在抑制糖苷酶以外的药物作用途径或靶点。图 5A所示, 给药3周后, SZ-A显著降低HFC57小鼠的随机血糖(P < 0.01);给药第6周时, SZ-A显著降低HFC57小鼠的空腹血糖(P < 0.05, 图 5B); 给药4周后, SZ-A显著降低HFC57小鼠口服葡萄糖后30和60 min的血糖水平(P < 0.01, 图 5C), 降低血糖时间曲线下面积(P < 0.05, 图 5D); 至给药结束时, SZ-A对HFC57小鼠的血甘油三酯水平无显著影响(图 5E), 但可显著降低血胆固醇水平(P < 0.05, 图 5F)。表明SZ-A长期灌胃给药后, 可控制糖尿病前期HFC57小鼠的随机及空腹血糖, 延缓糖尿病的发生, 改善其糖脂代谢紊乱。

|
Figure 5 Effects of SZ-A (50 mg·kg-1) on glucose and lipid metabolism after long-term treatment in high fat diet induced insulin resistant obese C57 mice (HFC57). A: Postprandial blood glucose levels; B: Fasting blood glucose; C: Blood glucose levels in oral glucose tolerance test (OGTT); D: AUC of OGTT; E: Blood triglyceride levels; F: Blood total cholesterol levels. n = 10, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs Con |
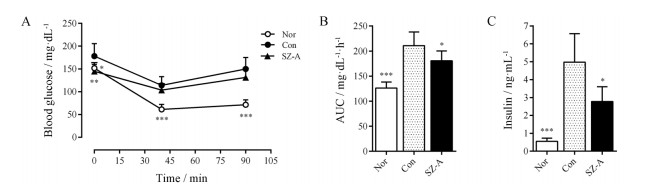
为考察SZ-A是否影响胰岛素敏感性, 在HFC57小鼠给药6周后, 进行ITT实验。如图 6A所示, SZ-A不仅显著降低HFC57小鼠的空腹血糖(P < 0.01), 也降低了ITT中的血糖AUC (P < 0.05, 图 6B); 同时, SZ-A可显著降低HFC57小鼠的空腹血清胰岛素水平(P < 0.05, 图 6C)。表明长期给予SZ-A对HFC57小鼠的胰岛素敏感性和高胰岛素血症有改善作用。
|
Figure 6 Effects of SZ-A (50 mg·kg-1) on insulin sensitivity after 6 weeks treatment in high fat diet induced insulin resistant obese C57 mice (HFC57). A: Plasma glucose levels in insulin tolerance test (ITT); B: Area AUC of ITT; C: Plasma insulin levels. n = 10, x± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs Con |
为考察SZ-A是否影响胰岛素分泌功能, 在口服葡萄糖耐量实验中, 同时测定了基础(0 min)和葡萄糖负荷后15 min的血清胰岛素水平, 结果如图 7所示, SZ-A可显著降低HFC57小鼠的基础胰岛素水平(P < 0.05, 图 7A); 与Con组相比, SZ-A虽对葡萄糖负荷后15 min的胰岛素水平无显著影响, 但能使葡萄糖刺激后15 min的胰岛素分泌倍数增加51.3% (P=0.07, 图 7B)。表明长期给予SZ-A可一定程度增加HFC57小鼠β细胞对葡萄糖的反应性, 改善葡萄糖刺激的胰岛素分泌功能。

|
Figure 7 Effects of SZ-A (50 mg·kg-1) on oral glucose stimulated insulin secretion after 4 weeks treatment in high fat diet induced insulin resistant obese C57 mice (HFC57). A: Blood insulin levels before and after oral glucose loading; B: Insulin secretion fold at 15 min after oral glucose loading compared with basal levels. n = 8-10, x ± s. *P < 0.05, ***P < 0.001 vs Con |
上世纪90年代初, 首个α葡萄糖苷酶抑制剂德国拜耳的阿卡波糖上市, 目前, 该类药物已成为糖尿病治疗的一线用药[9]。虽然随着“糖耐量异常(IGT)患者餐后血糖控制”适应症的增加, 阿卡波糖的市场空间进一步扩大[10], 但其肠胀气的不良反应一定程度限制了该药的临床应用。该不良反应主要源于阿卡波糖对淀粉酶有较强的抑制作用, 从而导致食物中的淀粉水解受影响而引起肠胀气[11]。因此, 特异性抑制双糖酶, 降低或消除对淀粉酶的抑制作用, 将可能减轻该类药物的胃肠胀气不良反应, 如目前已上市的伏格列波糖、米格列醇等。而发现具有更高选择性的新型糖苷酶抑制剂, 这也将成为研发该类药物的发展趋势之一。
中草药是我国具有原创优势的天然产物资源宝库, 从中发现结构新颖、具有生物活性的物质, 是发掘天然产物创新药物的重要途径之一[12]。特别是结合现代分离及分析技术手段, 有针对性地对“中药宝库”进行化学成分和药理活性研究, 将是我国天然产物新药研发的优势所在[13]。20世纪90年代初, 受阿卡波糖进口我国的启发, 本实验室率先在国内建立了灵敏可靠的α葡萄糖苷酶抑制剂筛选方法, 并对数百种中草药提取物进行活性评价, 发现桑属系列植物均具有很强的糖苷酶抑制活性。从药学经济和药用资源可持续性发展的角度考虑, 桑枝与桑叶或桑白皮等相比, 其资源丰富, 价格低廉, 最具产业化发展优势。因此, 本研究重点进行了桑枝提取物的活性成份分析和抗糖尿病作用评价。
为提升具有我国自主知识产权的中药品种市场竞争力, 填补有效部位降糖药物的研究空白, 课题组对桑枝有效部位及其制剂进行了深入研究。首先, 对桑枝提取物的多个部位、不同组分进行分离、纯化和结构鉴定, 结合体外药理活性示踪方法(即α-葡萄糖苷酶抑制活性评价), 发现桑枝总生物碱部位对α葡萄糖苷酶活性抑制的IC50小于0.04 μg·mL-1。由此, 确定了桑枝降血糖的有效部位是总生物碱组分。组成成分鉴定结果显示, 有效部位主要由1-脱氧野尻霉素(1-deoxynojirimycin, DNJ)、荞麦碱(fagomine, FAG)和1, 4-二脱氧-1, 4-亚氨基-D-阿拉伯糖醇(1, 4-dideoxy-1, 4-imino-D-arabinitol, DAB)等结构类似的水溶性多羟基生物碱或苷类组成[14]。最终, 以DNJ为对照品, 确定了优化工艺制备的有效部位提取物中总生物碱含量可达50%以上, 故此命名为SZ-A[15]。
酶学水平研究显示, SZ-A对蔗糖酶和麦芽糖酶具有较强抑制活性, 但对淀粉酶几乎无抑制作用, 明确了SZ-A是一个选择性的双糖酶抑制剂。根据α-葡萄糖苷酶抑制剂的作用特点, 本研究在正常ICR小鼠和四氧嘧啶高血糖小鼠, 发现单次给予SZ-A对口服蔗糖、淀粉负荷后血糖水平有显著降低作用, 但对葡萄糖负荷后的血糖上升无影响。结果验证了SZ-A不抑制肠道对葡萄糖的吸收, 而是通过抑制α葡萄糖苷酶活性以减缓碳水化合物水解为葡萄糖的进程, 控制餐后血糖的升高。
根据该类药物的作用特点, 在STZ糖尿病大鼠中, 采用了SZ-A与高蔗糖饲料混合的方式给药, 连续治疗3周。结果显示, SZ-A可改善模型大鼠的糖脂代谢紊乱状态。在给药期间, 通过对摄食、饮水量及体重的监测, 在该模型中, SZ-A对高血糖大鼠的摄食量、饮水量以及体重无明显影响。该结果提示, SZ-A的降血糖作用与实验动物的摄食饮水关系不大。另外, 在前期研究中, 课题组采用四氧嘧啶高血糖大鼠模型, 发现桑枝的水提物亦可改善其空腹和随机血糖、血果糖氨、尿糖及血脂等指标, 对糖尿病肾病也具有一定改善作用[16]。上述结果证实, 在高血糖大鼠模型中, 长期给予SZ-A有利于其糖脂代谢紊乱的改善, 对糖尿病及其并发症的发展也具有一定延缓作用。
α葡萄糖苷酶抑制剂在临床应用20余年, 该类药物为2型糖尿病患者带来的综合益处也日益显现。STOP-NIDDM研究显示[17, 18], 采用阿卡波糖在糖尿病前期进行干预, 可显著降低IGT发展为新发糖尿病的几率; 在我国患者中, 阿卡波糖预防IGT进展为2型糖尿病的作用也得到证实[19]。因此, 本研究也采用了糖尿病前期HFC57小鼠为模型, 考察SZ-A长期给药是否能够延缓糖尿病的发生发展。另外, 为了在该模型中考察SZ-A是否具有糖苷酶以外的作用机制, 本研究采用了单次口服给药方式。结果表明, SZ-A既可降低随机血糖、改善空腹血糖受损状况, 还可降低血胆固醇水平。这提示在糖尿病前期动物模型中, SZ-A长期给药可一定程度改善糖脂代谢紊乱, 延缓其糖尿病发展进程。在该模型中也设立了阿卡波糖阳性对照组(Acar), 至给药结束时, 均显示出明显的抗糖尿病作用, 这可能与其单一的抑制糖苷酶的作用机制有关。而SZ-A还可显著降低HFC57小鼠的基础血清胰岛素水平, 这提示SZ-A可能通过增加HFC57小鼠的胰岛素敏感性而降低空腹血清胰岛素水平。另外, SZ-A还可一定程度增加口服葡萄糖刺激后15 min的胰岛素分泌倍数, 这提示长期给予SZ-A可一定程度增加糖尿病前期HFC57小鼠的胰岛β细胞对葡萄糖的反应性, 改善了葡萄糖刺激的胰岛素分泌功能。在该模型中, 至给药结束时, 与Con组相比, SZ-A组的体重无显著变化, 这与前期在STZ糖尿病大鼠中观察到的结果一致。在HFC57小鼠中, SZ-A显示出上述多个药理作用可能源自其多组分的物质基础特点, 进而延伸其可能具有多靶点的特征。前期课题组对其具体生物碱成分进行了分析, 发现了一系列含量较高的典型生物碱(如DNJ等), 因此, 在后续研究工作中, 课题组还将围绕上述几个药理作用, 进一步发掘它的作用靶点和具体抗糖尿病作用机制。
综上, SZ-A是一种选择性双糖酶抑制剂, 可显著降低糖尿病前期和糖尿病动物的餐后血糖, 长期给药能有效控制血糖波动, 利于糖脂代谢紊乱状态的改善, 延缓糖尿病及其并发症的发生和发展。本研究为桑枝总生物碱开发成为新型抗糖尿病天然药物提供依据, 对填补我国抗糖尿病药物市场中天然药物有效部位品种的空白, 满足国内糖尿病患者日益扩大的用药需求, 具有重要意义。
| [1] | Cho NH, Shaw JE, Karuranga S, et al. IDF diabetes Atlas: global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Res Clin Pract, 2018, 138: 271–281. DOI:10.1016/j.diabres.2018.02.023 |
| [2] | No author listed. Q & A: key points for IDF Diabetes Atlas 2017[J]. Diabetes Res Clin Pract, 2018, 135: 235–236. DOI:10.1016/j.diabres.2018.01.005 |
| [3] | Joshi SR, Standl E, Tong N, et al. Therapeutic potential of alpha-glucosidase inhibitors in type 2 diabetes mellitus: an evidence-based review[J]. Expert Opin Pharmacother, 2015, 16: 1959–1981. DOI:10.1517/14656566.2015.1070827 |
| [4] | Garber AJ, Abrahamson MJ, Barzilay JI, et al. Consensus statement by the american association of clinical endocrinologists and american college of endocrinology on the comprehensive type 2 diabetes management algorithm - 2018 executive summary[J]. Endocr Pract, 2018, 24: 91–120. DOI:10.4158/CS-2017-0153 |
| [5] | He K, Shi JC, Mao XM. Safety and efficacy of acarbose in the treatment of diabetes in Chinese patients[J]. Ther Clin Risk Manag, 2014, 10: 505–511. |
| [6] | Ye F, Shen Z, Xie M. Alpha-glucosidase inhibition from a Chinese medical herb (Ramulus mori) in normal and diabetic rats and mice[J]. Phytomedicine, 2002, 9: 161–166. DOI:10.1078/0944-7113-00065 |
| [7] | Liu YL, Shen ZF, Chen Z, et al. Use of the effective fraction of alkaloids Mulberry Twig in preparing hypoglycemic agents: CN, 101129476A[P]. 2008-02-27. |
| [8] | Zhang R, Liu Q, Shen ZF, et al. High throughput screening of α-glucosidase inhibitors: application to hypoglycemic traditional Chinese medicine[J]. Chin Pharm J (中国药学杂志), 2007, 10: 740–743. |
| [9] | Ma RC. Acarbose: an alternative to metformin for first-line treatment in type 2 diabetes?[J]. Lancet Diabetes Endocrinol, 2014, 2: 6–7. DOI:10.1016/S2213-8587(13)70107-4 |
| [10] | Pan CY, Landen H. Post-marketing surveillance of acarbose treatment in patients with type 2 diabetes mellitus and subjects with impaired glucose tolerance in China[J]. Clin Drug Investig, 2007, 27: 397–405. DOI:10.2165/00044011-200727060-00003 |
| [11] | van de Laar FA, Lucassen PL, Akkermans RP, et al. Alpha-glucosidase inhibitors for patients with type 2 diabetes: results from a Cochrane systematic review and meta-analysis[J]. Diabetes Care, 2005, 28: 154–163. DOI:10.2337/diacare.28.1.154 |
| [12] | Bent S, Ko R. Commonly used herbal medicines in the United States: a review[J]. Am J Med, 2004, 116: 478–485. DOI:10.1016/j.amjmed.2003.10.036 |
| [13] | Miao ZX, Wang YH. Application of NMR technique in the discovery and pharmacological studies of active substances from natural products[J]. Acta Pharm Sin (药学学报), 2013, 48: 1383–1389. |
| [14] | Yang S, Mi J, Liu Z, et al. Pharmacokinetics, tissue distribution, and elimination of three active alkaloids in rats after oral administration of the effective fraction of alkaloids from Ramulus Mori, an innovative hypoglycemic agent[J]. Molecules, 2017, 22: E1616. DOI:10.3390/molecules22101616 |
| [15] | Yang S, Wang B, Xia X, et al. Simultaneous quantification of three active alkaloids from a traditional Chinese medicine Ramulus Mori (Sangzhi) in rat plasma using liquid chromatography-tandem mass spectrometry[J]. J Pharm Biomed Anal, 2015, 109: 177–183. DOI:10.1016/j.jpba.2015.02.019 |
| [16] | Ye F, Shen ZF, Qiao FX, et al. Experimental treatment of complications in alloxan diabetic rats with alpha-glucosidase inhibitor from the Chinese medicinal herb Ramulus Mori[J]. Acta Pharm Sin (药学学报), 2002, 37: 108–112. |
| [17] | Tuomilehto J, Lindstrom J, Hellmich M, et al. Development and validation of a risk-score model for subjects with impaired glucose tolerance for the assessment of the risk of type 2 diabetes mellitus-the STOP-NIDDM risk-score[J]. Diabetes Res Clin Pract, 2010, 87: 267–274. DOI:10.1016/j.diabres.2009.11.011 |
| [18] | Hanefeld M, Pistrosch F, Koehler C, et al. Conversion of IGT to type 2 diabetes mellitus is associated with incident cases of hypertension: a post-hoc analysis of the STOP-NIDDM trial[J]. J Hypertens, 2012, 30: 1440–1443. DOI:10.1097/HJH.0b013e328354663c |
| [19] | Pan CY. Reducing the risk of type 2 diabetes: early identification of high-risk individuals and treatment with acarbose[J]. Curr Diabetes Rev, 2007, 3: 141–148. DOI:10.2174/157339907780598243 |
 2019, Vol. 54
2019, Vol. 54


