2. 河南中医药大学呼吸疾病诊疗与新药研发河南省协同创新中心, 河南 郑州 450046
2. Collaborative Innovation Center for Respiratory Disease Diagnosis and Treatment and Chinese Medicine Development of Henan Province, Henan University of Chinese Medicine, Zhengzhou 450046, China
菊花为菊科植物菊(Chrysanthemum morifolium Ramat.)的干燥头状花序, 其味甘、苦, 性微寒, 归肺、肝经, 具有平肝明目、清热解毒之功效。现代药理研究表明, 菊花具有良好的抗炎作用, 张星海[1]通过二甲苯诱发的耳肿胀实验、角叉菜胶致小鼠足趾肿胀实验考察了不同来源对菊花药效的影响, 结果显示亳菊的抗炎效果最好, 滁菊的抗炎效果次之, 怀菊、贡菊和杭菊的抗炎效果再次之; Tao等[2]发现菊花多糖可以显著改善三硝基苯磺酸诱导的结肠炎大鼠, 其机制可能与调节TLR4/NF-κB和IL-6/JAK2/STAT3信号通路有关, 同时, 菊花多糖改变了血浆和尿液中的生物标记物和相应的代谢途径, 从而缓解了炎症的发生。采用脂多糖(lipopolysaccharide, LPS)诱导小鼠急性肺损伤(acute lung injury, ALI)模型, 发现开封菊花提取物能调节细胞因子抗炎/致炎的平衡, 从而改善急性肺损伤症状[3]; 黄勇等[4]发现野菊花提取物对气管内注入LPS诱导的慢性支气管炎大鼠血清和支气管肺泡灌洗液中TNF-α、IL-6等炎症因子水平具有一定的抑制作用, 且对肺组织的病理损伤具有明显改善作用。虽然文献报道已表明菊花对于多种炎症具有改善作用, 但目前仍缺乏对菊花抗炎作用的物质基础研究。本实验室长期从事四大怀药的化学成分及药理作用相关的研究工作, 在前期研究中已对怀菊花进行了全面的化学成分研究[5, 6], 并对怀菊花总提物及化学成分进行了活性筛选, 发现怀菊花对鼻腔滴注LPS诱导的急性肺损伤小鼠具有较好的保护作用, 之后又采用LPS诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)损伤模型来模拟ALI的病理特征, 对怀菊花中分离得到的作用较好的3种咖啡酰基奎宁酸类化合物进行作用机制探讨, 旨在阐明菊花抗炎作用的物质基础及其作用机制, 为ALI的临床治疗提供一定的参考, 也为河南省道地大宗药材的发展提供支撑。
材料与方法实验动物 雄性BABL/c小鼠, SPF级, 体重18~22 g, 购自北京维通利华实验动物技术有限公司, 许可证号: SCXK (京) 2012-0001。饲养于18~22 ℃清洁级动物实验室内, 空气流通, 12 h光照, 昼夜循环, 自由饮食、饮水。所有动物实验饲养及操作严格遵守国家动物福利伦理与保护相关规定。
细胞株 HUVEC由河南中医药大学第一附属医院李强老师惠赠。将细胞培养在含10%胎牛血清的RMPI-1640培养基中(含青霉素和链霉素10 u·mL-1), 置于37 ℃、5% CO2饱和湿度培养箱中培养, 均取对数生长期细胞用于实验。
药物与试剂 怀菊花采购于河南省焦作市武陟县, 经河南中医药大学陈随清教授鉴定为菊科植物菊Chrysanthemum morifolium Ramat.的干燥头状花序; LPS, 批号: 057M4013V, 美国Sigma公司; 醋酸地塞米松片, 批号: 015150902, 上海信谊药厂有限公司; 胎牛血清, 批号: 20170221, 浙江天杭生物科技股份有限公司; 肿瘤坏死因子-α (tumour necrosis factor-α, TNF-α)、白介素-6 (interleukin-6, IL-6)、白介素-1β (interleukin-1β, IL-1β)和血管细胞黏附分子-1 (vascular cell adhesion molecule- 1, VCAM-1)、细胞间黏附分子-1 (intercellular cell adhesion molecule-1, ICAM-1)、内皮细胞选择素(E-selectin)、内皮素-1 (endothelin-1, ET-1)试剂盒, 批号: E20170301A和E20170501A, 江苏卡尔文生物技术有限公司; 超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)和一氧化氮(nitric oxide, NO)试剂盒, 批号: 20170724、20170725和20170721, 南京建成生物工程研究所有限公司; 培养细胞总蛋白提取试剂盒, 批号: 12C29C03, 武汉博士德生物工程有限公司; BCA蛋白浓度测定试剂盒, 批号20170302, 北京索莱宝生物科技有限公司; β-Tubulin抗体(批号: CR123577-1)、MEK1+MEK2抗体(批号: CR232892-15)、ERK1+ERK2抗体(批号: CR197011-15)、ERK1 (phospho T202)+ERK2 (phospho T185)抗体(批号: CR217573-7)、P38抗体(批号: CR266461-8)、P38 (phospho T180+Y182)抗体(批号: CR319629-3), 英国Abcam公司; p-MEK1/2 (Ser217/221)抗体(批号: 05/2017)、SAPK/JNK抗体(批号: 07/2017)、p-SAPK/JNK (T183/Y185)抗体(批号: 05/2017), 美国CST公司; HRP标记的羊抗兔IgG二抗(批号: AG03297461), 北京博奥森生物技术有限公司; 超敏ECL化学发光试剂盒(批号: 1701102), 美国Millipore公司。
仪器 Centrifuge-5804R小型高速低温冷冻离心机, 德国Eppendorf有限公司; AB204-N型万分之一精密分析天平, 瑞士Mettler Toledo公司; Mills-Q-POD超纯水仪, 苏州赛恩斯仪器有限公司; SW-CJ-2FD超净工作台, 苏州安泰空气技术有限公司; Forma 3111细胞培养箱, 美国Thermo Fisher Scientific公司; ECLIPSE TS100倒置显微镜, 日本Nikon公司; iMark酶标仪, Trans-Blot Turbo System型蛋白快速转膜仪, 美国Bio-Rad公司; DYY7C型电泳仪, 北京六一仪器厂; Amersham Imager 600型超灵敏多功能成像仪, 美国GE公司。
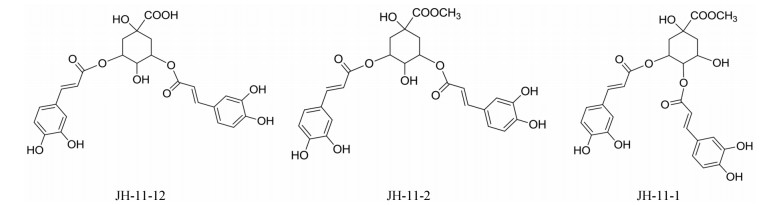
怀菊花总提物及单体化合物制备工艺[6] 干燥怀菊花(11.2 kg)经50%含水丙酮组织破碎提取2次, 合并滤液并减压浓缩后得到总浸膏(2161.1 g)为怀菊花总提物, 之后用水分散溶解后依次用石油醚、乙酸乙酯和正丁醇进行有机溶剂萃取, 得到石油醚、乙酸乙酯、正丁醇和水部位。乙酸乙酯部位(352.0 g)上柱色谱-硅胶, 将得到的各组分反复通过硅胶、Sephadex LH-20、Toyopearl HW-40C、MCI Gel CHP-20、ODS等色谱柱, 并利用重结晶及高压制备液相、NMR、MS等方法, 最终分离并鉴定得到3种咖啡酰基奎宁酸类化合物(图 1), 分别为JH-11-12 (1, 5-二-O-咖啡酰基奎宁酸, 42.3 mg, 纯度99.8%)、JH-11-2 (3, 5-二咖啡酰基奎宁酸甲酯, 167.4 mg, 纯度99.5%)、JH-11-1 (3, 4-二咖啡酰基奎宁酸甲酯, 16.2 mg, 纯度99.2%)。
|
Figure 1 Chemical structures of three caffeoyl quinic acids in Chrysanthemum morifolium |
实验动物分组、造模及给药 BABL/c小鼠, 适应性喂养3天, 根据体重均衡原则随机分为对照组(NC)、LPS组(M)、地塞米松组(Dex)、怀菊花总提物组(Tce)。地塞米松组给与100 mg·kg-1·day-1地塞米松, 连续灌胃给药3天, 怀菊花总提物组给与3.333 3 g·kg-1·day-1怀菊花总提物, 连续灌胃给药7天, 对照组与LPS组给予等量的生理盐水, 给药体积均为0.2 mL/10 g体重。末次给药l h后, 除对照组给予等量双蒸水外, 其他各组动物经鼻腔滴注[7]给予5 mg·kg-1 LPS。LPS滴注6 h后, 进行相关指标检测。
气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中炎症因子的检测 LPS滴注6 h后, 切开颈部皮肤, 分离气管, 用2 mL生理盐水反复灌洗4次, 回收BALF[8]。收集到的BALF通过4 ℃、3 000 r·min-1离心10 min, 收集上清液, 分装, 根据试剂盒操作说明书检测小鼠BALF中TNF-α、IL-6、IL-1β的含量。
实验动物肺组织湿重/干重(W/D)的测定[9] 将小鼠处死, 固定在手术板上, 打开胸腔, 取出小鼠左肺, 用生理盐水冲洗1~2次, 冲洗后用滤纸吸收多余水分, 称重并做记录。将肺组织放在80 ℃的烘箱中烘烤48 h至完全脱水, 称重。计算肺组织湿重与干重的比值。
LPS诱导血管内皮细胞损伤模型的建立与分组给药 根据本实验室前期已建立的模型建立方法[10], 将细胞用含10%胎牛血清的RMPI-1640培养基接种于96孔板, 调整细胞浓度为每毫升2×104个, 每孔200 μL。待细胞完全贴壁后, 饥饿处理12 h, 空白对照组更换为空白培养基, 模型组加入2.5 μg·mL-1 LPS, 阳性组加入含2.5 μg·mL-1 LPS和1 μmol·L-1地塞米松的空白培养基进行干预, 各给药组分别加入含2.5 μg·mL-1 LPS和5 μmol·L-1 3种咖啡酰基奎宁酸类化合物进行干预。各组处理完成后继续培养24 h, 收集上清液, 根据试剂盒操作说明进行相关指标检测。
细胞活力检测 培养24 h后, 每孔加入5 mg·mL-1 MTT溶液20 μL, 置于37 ℃、5% CO2培养4 h, 吸净上清液, 每孔加入DMSO 150 μL溶解结晶物, 振荡10 min后在酶标仪490 nm处测定各孔的吸光度值。
炎症因子、氧化损伤、细胞黏附分子、血管舒缩因子检测根据ELISA试剂盒操作说明检测 TNF-α、IL-6、IL-1β、VCAM-1、ICAM-1、E-selectin的含量; 根据南京建成试剂盒操作说明检测SOD、MDA、NO、ET-1的含量。
MAPK信号通路关键蛋白检测 提取各组细胞总蛋白, 用BCA蛋白定量试剂盒测定总蛋白浓度, 以每泳道30 μg蛋白上样, 经SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)后, 电转膜至PVDF膜上, 用5%脱脂奶粉封闭2 h, 再分别加入anti-ERK1/2 (1:5 000)、anti-p-ERK1/2 (1:1 000)、anti-JNK (1:1 000)、anti-p-JNK (1:1 000)、anti-P38 (1:2 000)、anti-p-P38 (1:1 000)的一抗, 室温孵育30 min, 4 ℃孵育过夜后, 室温孵育30 min, 用TBST洗涤5次, 每次6 min, 加入二抗(1:1 000), 室温孵育1 h, 再次用TBST洗涤5次, 每次6 min, ECL化学发光试剂盒显色, 采用超灵敏多功能成像仪采集蛋白条带, 用Quantity One软件对蛋白条带进行分析。
统计学方法 用SPSS19.0统计软件进行分析, 数据用x ± s表示, 组间比较采用单因素方差分析, 以P < 0.05为差异有统计学意义。
结果 1 怀菊花总提物对急性肺损伤小鼠肺湿重/干比(W/D)的影响如表 1所示, 与对照组相比, 模型组小鼠肺湿重/干比显著升高(P < 0.01), 与模型组相比, 怀菊花总提物可显著降低小鼠肺湿重/干比(P < 0.05)。
| Table 1 Effects of total acetone extract of Chrysanthemum morifolium on lung W/D ratio in mice. n = 6, x ± s. **P < 0.01 vs NC; #P < 0.05, ##P < 0.01 vs M. W/D: Weight/dry; NC: Control; M: Lipopolysaccharide; Dex: Dexamethasone; Tce: Total extract of Chrysanthemum morifolium |
如表 2所示, 与对照组相比, 模型组小鼠肺泡灌洗液中TNF-α、IL-6、IL-1β显著升高(P < 0.01), 与模型组相比, 怀菊花总提物可不同程度降低TNF-α、IL-6、IL-1β的含量(P < 0.05或P < 0.01)。
| 表 2 Effect of total acetone extract of Chrysanthemum morifolium on inflammatory factors in bronchoalveolar lavage fluid of mice. n = 6, x ± s. **P < 0.01 vs NC; #P < 0.05, ##P < 0.01 vs M. TNF-α: Tumour necrosis factor-α; IL-6: Interleukin-6; IL-1β: Interleukin-1β |
如表 3所示, 与对照组相比, 模型组细胞吸光度显著降低(P < 0.01);与模型组相比, 怀菊花总提物及3种咖啡酰基奎宁酸类化合物均可显著升高血管内皮细胞损伤模型吸光度值(P < 0.05或P < 0.01)。
| Table 3 Effects of three caffeoyl quinic acids on the cell viability of vascular endothelial cell injury model. n = 6, x ± s. **P < 0.01 vs NC; #P < 0.05, ##P < 0.01 vs M |
如表 4所示, 与对照组相比, 模型组上清液中TNF-α、IL-6、IL-1β的含量显著升高(P < 0.01), 说明LPS导致血管内皮细胞产生大量炎症因子; 与模型组相比, 3种咖啡酰基奎宁酸类化合物可不同程度降低培养上清中TNF-α、IL-6、IL-1β含量(P < 0.05或P < 0.01), 其中以JH-11-1作用最佳。
| Table 4 Effects of three caffeoyl quinic acids on TNF-α, IL-6 and IL-1β in vascular endothelial cell injury model. n = 6, x ± s **P < 0.01 vs NC; #P < 0.05, ##P < 0.01 vs M. TNF-α: Tumour necrosis factor-α; IL-6: Interleukin-6; IL-1β: Interleukin-1β |
如表 5所示, 与对照组相比, 模型组培养上清中SOD极显著降低, MDA含量极显著升高(P < 0.01);与模型组相比, JH-11-2、JH-11-1可降低培养上清中MDA含量, 升高SOD含量(P < 0.01), 且以JH-11-1作用最佳。
| Table 5 Effects of three caffeoyl quinic acids on SOD and MDA in vascular endothelial cell injury model. n = 6, x ± s. **P < 0.01 vs NC; ##P < 0.01 vs M. SOD: Superoxide dismutase; MDA: Malondialdehyde |
如表 6所示, 与对照组相比, 模型组上清液中VCAM-1、ICAM-1、E-selectin的含量极显著升高(P < 0.01);与模型组相比, JH-11-2、JH-11-1培养上清中VCAM-1、ICAM-1、E-selectin含量均显著降低(P < 0.05或P < 0.01), 其中以JH-11-1作用最佳。
| Table 6 Effects of three caffeoyl quinic acids on vascular endothelial cell injury model VCAM-1, ICAM-1 and E-selectin. n = 6, x ± s. **P < 0.01 vs NC; #P < 0.05, ##P < 0.01 vs M. VCAM-1: Vascular cell adhesion molecule-1; ICAM-1: Intercellular cell adhesion molecule-1 |
如表 7所示, 与对照组相比, 模型组培养上清中ET-1含量显著升高, NO显著降低(P < 0.01);与模型组相比, JH-11-2、JH-11-1可不同程度地降低培养上清中ET-1含量, 升高NO含量(P < 0.05或P < 0.01), 且以JH-11-1作用最佳。
| Table 7 Effects of three caffeoyl quinic acids on endothelin-1 ET-1 and NO in vascular endothelial cell injury model. n = 6, x ± s. **P < 0.01 vs NC; #P < 0.05, ##P < 0.01 vs M. ET-1: Endothelin-1; NO: Nitric oxide |
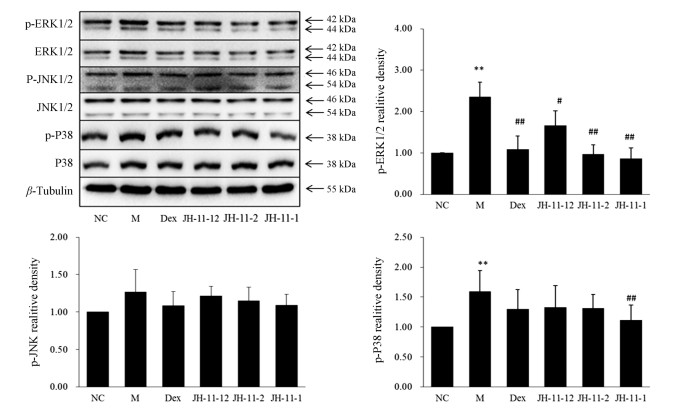
与对照组相比, 模型组p-ERK1/2、p-JNK、p-38含量显著升高(P < 0.05或P < 0.01);与模型组相比, JH-11-2、JH-11-1可不同程度地降低p-ERK1/2的表达, JH-11-1可降低p-P38的表达(P < 0.01) (图 2)。
|
Figure 2 Effects of three caffeoyl quinic acids on the key proteins of MAPK signaling pathway in vascular endothelial cell injury model. n = 6, x ± s. **P < 0.01 vs NC; #P < 0.05, ##P < 0.01 vs M |
急性肺损伤是急性呼吸窘迫综合症早期的一种症状, 表现为肺泡-毛细血管通透性增加以及肺泡上皮细胞和毛细血管内皮细胞的损伤[11]。引起急性肺损伤的主要因素为LPS, LPS是革兰阴性杆菌细胞壁的主要组成部分, 可以激活血管内皮细胞, 引起炎性因子表达紊乱以及细胞内相关信号转导通路如丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、核转录因子-κB (nuclear transcription factor, NF-κB)活化, 促使炎性反应细胞在肺组织中募集和活化[12], 诱发炎症介质如TNF-α、IL-1β和IL-6等大量释放, 并引起MDA、SOD的失衡, 从而导致肺泡上皮细胞及血管内皮细胞受损, 内皮细胞受损会引发ET-1、NO等血管舒缩因子的紊乱[13, 14], 过度的氧化应激也会通过促进血管平滑肌和炎症细胞的生长和迁移、降解细胞外基质、促进内皮细胞凋亡、激活转录因子(NF-κB、AP-1)、促进炎症因子和黏附分子(ICAM-1、VCAM-1和E-Selectin)过表达等方式损伤内皮细胞, 最终导致血管内皮细胞的活化而进一步损伤。因此, 血管内皮细胞的活化、损伤是ALI发生发展的病理生理基础[15]。
本实验首先采用LPS诱导的急性肺损伤小鼠模型, 探讨了怀菊花总提物对急性肺损伤的影响, 结果显示怀菊花对急性肺损伤小鼠模型具有一定的保护作用, 因此欲从菊花中找到具有改善急性肺损伤的化合物。在前期实验中, 课题组采用2.5 μg·mL-1 LPS处理HUVEC细胞24 h, 以抑制血管内皮细胞生长, 成功建立血管内皮细胞损伤模型, 并以此模型筛选得到一系列具有抗血管内皮细胞损伤作用的咖啡酰基奎宁酸类化合物。本实验从对炎症因子、细胞黏附分子、血管舒缩因子和细胞氧化损伤等方面, 研究了菊花中3种咖啡酰基奎宁酸类化合物对血管内皮细胞损伤模型的影响。实验结果表明, 怀菊花中3种咖啡酰基奎宁酸类化合物均可提高血管内皮细胞活力。其中, JH-11-2和JH-11-1可降低TNF-α、IL-1β、IL-6、MDA的含量, 升高SOD的含量, 提示其可通过抑制炎症和氧化损伤来干预血管内皮细胞损伤, 从而起到保护血管内皮的作用。进一步研究发现, JH-11-2和JH-11-1可不同程度降低ET-1含量, 升高NO的含量, 提示其可通过调节ET-1和NO等血管舒缩因子的分泌从而发挥保护血管内皮的作用。而且, JH-11-2和JH-11-1可降低VCAM-1、ICAM-1、E-seletin的含量, 提示其可通过干预血管内皮细胞分泌细胞间黏附因子, 从而改善血管内皮细胞损伤; 化合物JH-11-12对比模型组具有改善相关指标的趋势, 但是没有显著性差异, 可能是由于JH-11-1和JH-11-2结构中饱和六元环上的取代基为羧甲基, 而化合物JH-11-12结构中饱和六元环上的取代基为羧基, 所以导致JH-11-12的活性变弱。因此初步推测咖啡酰基奎宁酸类化合物饱和六元环上的羧甲基对于发挥抗炎、抗氧化, 调节细胞黏附分子和血管舒缩因子起到重要的作用。
MAPK信号通路被激活后可以刺激血管内皮细胞过度表达炎症递质如TNF-α、IL-6、IL-1β等, 并使血管舒缩因子ET-1和NO表达紊乱, 进而损伤血管内皮细胞[16]。其中ERK1/2通路是MAPK信号通路中的重要通路, 在细胞分化、凋亡及炎症等过程中发挥重要作用[17]; P38 MAPK信号通路是信号转导枢纽, 参与多种细胞信号转导, 介导炎症反应。本实验检测了JNK1/2、p-JNK1/2、ERK1/2、p-ERK1/2、p-P38, 发现怀菊花中3种咖啡酰基奎宁酸类化合物可不同程度下调p-ERK1/2、p-P38的表达, 其中以JH-11-1作用最佳。
综上所述, 怀菊花中咖啡酰基奎宁酸类化合物可升高内皮细胞损伤模型上清液中SOD、NO的含量, 降低TNF-α、IL-6、IL-1β、ICAM-1、VCAM-1、E-selectin、ET-1、MDA的含量, 并显著下调p-ERK1/2、p-P38的表达, 提示它们可通过抗炎、抗氧化, 降低细胞间黏附及舒张血管等方面发挥改善内皮细胞损伤的作用, 其中咖啡酰基奎宁酸类化合物饱和六元环上的羧甲基可能起着重要的作用; JH-11-1 (3, 4-二咖啡酰基奎宁酸甲酯)作用最佳, 并且JH-11-1主要是通过ERK/MAPK信号通路来改善内皮细胞损伤。怀菊花中咖啡酰基奎宁酸类化合物是否能改善ALI尚需动物实验进行进一步验证。
| [1] | Zhang XH. Study on the Changes of Chemical Composition, Anti-inflammatory Efficacy and Mechanism of Different Cultivars of Fios Chrysanthemi (不同来源菊花化学成分、抗炎作用及其机理的研究)[D]. Nanjing: Nanjing University of Chinese Medicine, 2014. |
| [2] | Tao JH, Duan JA, Zhang W, et al. Polysaccharides from Chrysanthemum morifolium Ramat ameliorate colitis rats via regulation of the metabolic profiling and NF-κB/TLR4 and IL-6/JAK2/STAT3 signaling pathways[J]. Front Pharmacol, 2018, 9: 746. DOI:10.3389/fphar.2018.00746 |
| [3] | Cheng XL. The Protective Effect of Chrysanthemum Extract on Acute Lung Injury in Mice (菊花提取物对小鼠急性肺损伤的保护作用)[D]. Henan: Henan University, 2015. |
| [4] | Huang Y, Huang YL, Su Y, et al. Effect of the extraction of Chrysanthemum indicum on the protein expression of TNF-α, IL-6 and pathological morphological changes of lung in chronic bronchitis model of rats[J]. Chin J Gerontol (中国老年学杂志), 2010, 30: 2614–2616. |
| [5] | Feng WS, Chen WJ, Li M, et al. Glycosides from the flowers of Chrysanthemum morifolium[J]. J Chin Med Mater (中药材), 2018, 41: 338–341. |
| [6] | Feng WS, Chen WJ, Zheng XK, et al. Flavonoids from the flowers of Chrysanthemum morifolium Ramat[J]. Chin Pharm J (中国药学杂志), 2017, 52: 1497–1502. |
| [7] | Qiu J, Yu L, Zhang X, et al. Asiaticoside attenuates lipopolysaccharide-induced acute lung injury via down-regulation of NF-κB signaling pathway[J]. Int Immunopharmacol, 2015, 26: 181–187. DOI:10.1016/j.intimp.2015.03.022 |
| [8] | Liu XX, Yu DD, Chen MJ, et al. Hesperidin ameliorates lipopolysaccharide-induced acute lung injury in mice by inhibiting HMGB1 release[J]. Int Immunopharmacol, 2015, 25: 370–376. DOI:10.1016/j.intimp.2015.02.022 |
| [9] | Qiushi W, Guanghua L, Guangquan X. Acanthoic acid ameliorates lipopolysaccharide-induced acute lung injury[J]. Eur J Pharmacol, 2015, 750: 32–38. DOI:10.1016/j.ejphar.2015.01.023 |
| [10] | Feng WS, Fan H, Xu RH, et al. The mechanism of the improvement of vascular endothelial cell injury induced by eriodictyol-7-O-β-D-glucoside[J]. J Chin Med Mater (中药材), 2018, 41: 1177–1181. |
| [11] | Yu ZR, Du GH. Advances in the treatment of acute lung injury caused by endotoxin[J]. Chin J New Drug (中国新药杂志), 2017, 26: 1510–1515. |
| [12] | Cheng X, Yang YL, Li WH, et al. Effect of esculin on acute lung injury induced by LPS in mice and possible mechanism[J]. Chin J New Drug (中国新药杂志), 2018, 27: 1849–1854. |
| [13] | Lin Y, Lai WF, Su YQ, et al. Effect of emodin on inflammatory response of astrocytes induce by LPS[J]. Chin Pharmacol Bull (中国药理学通报), 2018, 34: 1528–1533. |
| [14] | Zheng ZL, Qiu Y, Huang JW. Study of optimum dosage and application approach of ketamine for inflammation in acute lung injury of Wistar rat[J]. Prog Anat Sci (解剖科学进展), 2018, 24: 472–475. |
| [15] | Sheng Y. Study the therapeutic effect of glucocorticoid on acute lung injury[J]. Guide China Med (中国医药指南), 2017, 15: 50–51. |
| [16] | Yang YX, Li GY. Progression of lipopolysaccharide signal pathway[J]. J Central South Univ (Med Ed) (中南大学学报医学版), 2006, 31: 141–145. |
| [17] | Wu LN. Role of P38 MAPK and ERK1/2 Signaling Pathway in the Regulation of Heme Oxygenase-1 Expression in the Lung Tissue during Endotoxic Shock Induced ALI in Rats (P38MAPK和ERK1/2信号通路在内毒素性休克诱发急性肺损伤大鼠肺组织HO-1表达过程中的作用)[D]. Tianjin: Tianjin Medical University, 2013. |
 2019, Vol. 54
2019, Vol. 54


