2. 中国药科大学药学院, 江苏 南京 211198;
3. 浙江永宁药业股份有限公司, 浙江 台州 318020
2. School of Pharmacy, China Pharmaceutical University, Nanjing 211198, China;
3. Zhejiang Yongning Pharmaceutical Co. Ltd., Taizhou 318020, China
黄酮类化合物是中草药中具有生物活性的一类重要物质, 目前为止已发现并鉴定了大约8 000种天然存在的黄酮类化合物[1, 2], 该类化合物是具有苯并-γ-吡喃酮结构的多酚次级代谢产物, 具有共同的三环化学结构C6-C3-C6 (图 1)。现代药理学研究表明, 大多数天然黄酮具有显著的药理活性, 如抗氧化、抗炎、抗病毒、抗肿瘤、免疫调节和心血管保护等生物活性[3-10]。根据化合物结构的不同, 可将其分为黄酮类、黄酮醇类、二氢黄酮类、二氢异黄酮类以及异黄酮类等不同的类型(表 1)[11-20]。大多数黄酮类化合物水溶性较差, log P值介于1~5之间, 属于生物药剂学分类系统(BCS) Ⅱ类化合物[4, 21]。因其水溶性差、生物利用度较低等缺点, 使得黄酮类化合物研发和制剂存在一定困难。目前, 国内外研究者采用了多种制剂学手段针对上述缺点进行改善, 主要包括利用化学和生物方法对其进行结构修饰[2, 22], 利用高分子材料作为药物载体和磷脂复合物等的剂型改造[23-25]。
|
Figure 1 Basic flavonoid structure |
| Table 1 Classification of flavonoids based on chemical structure (NA: Not available) |
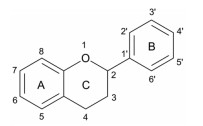
自然界中的化合物中70%以上是以晶体形式存在。通过对药物的晶型研究, 可以了解药物的理化性质、生物活性、药剂学性质等, 不同晶型的固体药物也会表现出溶解度、溶出速率、稳定性和生物利用度等方面的差异[26]。药物晶体工程学可在不改变药物分子化学结构的前提下, 优化药物的物理化学性质, 进而改善其生物学性质。药物的晶型研究主要包括多晶型、共晶、无定形、共无定形以及纳晶等方面(图 2), 本文从以上几个方面综述了近年来黄酮类有效成分的晶型研究进展, 以及对其理化性质和生物学性质的影响, 为药物晶体研究在中药难溶性有效成分中的应用提供参考和借鉴。
|
Figure 2 The common solid-state strategies and their components |
多晶型是在固体药物中普遍存在的现象, 是固体药物存在于多个晶体结构中同时又保留相同化学成分的能力[27], 分子间通过弱相互作用有序堆积在一起, 例如氢键、范德华力和π-π键等。多晶型的类型主要包括堆积多晶型、构型多晶型和构象多晶型。在堆积多晶型中, 分子通常非常刚性并且在每个多晶型物的晶胞中排列不同, 同时保持或多或少相同的分子构象。在构型和构象多晶型中, 分子更灵活并且作为截然不同的构型或构象存在。
多晶型在黄酮类药物中也非常常见, 研究[28]发现DA-6034黄酮(7-羧甲氧基-3', 4', 5-三甲氧基黄酮)存在6种不同的晶型, 但由于固体药物大多是分子晶体, 其晶格能差较小, 容易发生转晶。在相对湿度0%的条件下, DA-6034黄酮的1DMSO溶剂化物, 1/2DMSO溶剂化物, 1.5水合物, 和1/2乙酸溶剂化物转化为无定形的固体, 而1/2水合物, 1/4丁醇溶剂化物未发生转化, 1/2甲基乙基酮溶剂化物转化为无水化物。在52%和95%相对湿度的条件下, 1DMSO溶剂化物, 1/2 DMSO溶剂化物, 1/2甲基乙基酮溶剂化物, 1/2水合物和1/4丁醇溶剂化物转化为一水合物的形式。
1.2 多晶型对黄酮类药物性质的影响不同晶型药物的热力学、动力学、光谱学和机械等性质都会不同, 尤其是溶解度、溶出速率变化, 会对药物的生物利用度乃至临床疗效都有影响, 所以药物的晶型不但与原料药及制剂的制备工艺相关, 而且与药品质量和稳定性有关。作者所在课题组[29]首次发现了葛根素原料药为一水合物, 且在水中可向溶解度更低的二水合物转变, 转变条件受搅拌温度、搅拌强度等因素影响, 且聚乙烯吡咯烷酮类聚合物的加入可有效抑制/延缓该转变。在25 ℃、37 ℃、43 ℃水中, 葛根素一水合物转变成亚稳定的二水合物后溶解度分别降低46.7%、46.9%、48.9%;且在搅拌过程中, 葛根素一水合物溶解达到过饱和后向二水合物转变, 溶解度逐渐减小。因此, 研究和控制黄酮类药物的晶型多态性是药物研发中的重要因素之一。
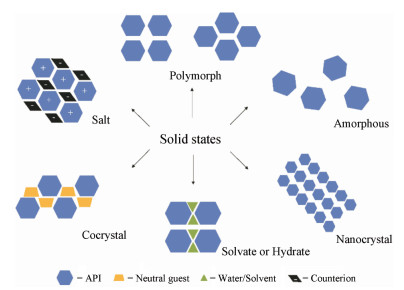
不同晶型药物的稳定性也有所不同, 如果化合物具有多晶型, 则在给定温度下仅一种多晶型物在热力学上是稳定的。稳定的多晶型物的特征在于最低的吉布斯自由能, 因此在任何溶剂中的溶解度最低(图 3)[30]。在单体系统中, 所有多晶型物的稳定性等级在它们全部熔化之前不随温度变化。换句话说, 各种多晶型物相对于温度的自由能曲线不会交叉(单变型多晶型)。对于对映体系, 自由能曲线随温度变化并在各个熔点之前显示交叉点。在一个温度下的稳定形式可以在另一个温度下变成亚稳态(互变型多晶型)。Franklin等[31]对杨梅素(myricetin, MYR) 4种晶型(两种水合物和两种亚稳态形式)进行了固态表征, 结果发现, 在室温下两种亚稳态形式的MYR (MYR IA和MYR IIA)在24 h后具有比水合物形式(MYR Ⅰ和MYR Ⅱ)更高的表观溶解度; 在23~56 ℃之间最稳定的晶型是MYR Ⅰ。
|
Figure 3 Solubility curves for two polymorphs Ⅰ and Ⅱ, related either enantiotropically (a) or monotropically (b)[30] |
多晶型的发现与筛选已经成为药物研究的重要部分。结晶是多晶型药物筛选的关键实验技术, 产生的多晶型是发生在成核和晶体生长两个过程之间动力学关系的结果。Ostwald阶段规则[27]表明, 对于二元形态系统, 亚稳态形式具有较低的成核自由能, 并且通常先成核, 在成长过程中转变为更稳定的形式。最终从结晶过程获得的多晶型物通过相对成核速率和相对晶体生长速率的组合来确定。有许多技术可用于多晶型筛选, 从溶液中结晶和从纯化合物中重结晶是多晶型筛选的常用方法[32]。此外几种创新方法, 如毛细管结晶、激光诱导结晶、超声结晶和非均相结晶, 都能够帮助发现新的多晶型。
影响药物产生多晶型的因素很多, 但总的来说不外乎内部因素和外部因素两类。内部影响因素主要包括药物分子的侧链结构、骨架空隙、骨架柔性以及极性基团; 外部因素包括温度、湿度、压力、光照、结晶时间等物理因素和化学纯度、溶剂的pH、重结晶溶剂系统等化学因素。黄酮类化合物骨架中存在较大空隙, 容易使结晶溶剂或结晶水等小分子进入形成种类及数量不同的共晶物质而形成不同晶型物质状态; 分子结构中含有羟基、羧基等极性基团, 容易形成分子间不同种类键合方式的晶型物质状态。因此在原料药存在溶解性差, 特别是在水溶液中难溶时, 在药物研发早期对药物进行多晶型的研究, 确定最终药用晶型, 同时避免在生产、运输和存放过程中由于温度、压力、相对湿度和粉碎程度等因素而导致的晶型转变, 从而提高药品质量。
2 黄酮类药物共晶研究 2.1 药物共晶的简介及设计药物共晶是指活性药物成分(active pharmaceutical ingredient, API)和共晶形成物(cocrystal former, CCF)在氢键或其他非共价键的作用下结合而成的晶体[33]。晶体工程的最新研究进展就是能够设计共晶体[34-39], 将两种或更多种分子化合物以特定的化学计量掺入相同的晶格中[40, 41], 通过对超分子组装体进行精确控制来微调物理性质, 从而实现改善药物的重要物理化学特征, 包括药物化合物的溶解度、溶出度、生物利用度和稳定性, 同时可以保持其治疗活性。此外, 共晶合成不涉及共价键的形成或断裂, 是一种绿色合成方法。与药物的成盐相比, 共晶的形成不需要质子的传递, 可适用于非离子型药物, 适用范围更广。
共晶的设计过程包括三个步骤:共形成体(CCF)选择、共晶的分析表征与筛选和共晶的应用(图 4)。药物共晶通常依赖于API和具有明确化学计量比的CCF之间的组装。在共晶中发现的最常见的分子内/分子间相互作用是氢键, 黄酮类化合物分子结构大多含有多个酚羟基, 既可作为质子受体, 又可作为质子给体, 可与CCF形成各种分子间氢键; 针对黄酮类化合物的结构, 4位的羰基具有吸电子效应, 可作为质子受体, 易形成氢键; 7与4'位的羟基在吸电子效应和p-π共轭效应的影响, 易作为质子的给体, 形成氢键。因此黄酮类成分较易与CCF形成多种共晶(表 2)[42-58]。

|
Figure 4 Process for cocrystal development, screening and applications |
| Table 2 Co-crystals of different flavonoids. CC: Cocrystal (anhydrous/nonsolvated); HC: Hydrated cocrystal; SC: Solvated cocrystal; ↑: Increase; -: No change; ↓: Decrease; NA: Not available |
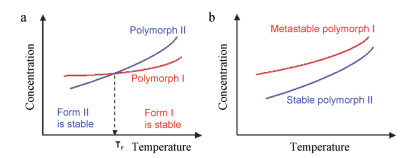
根据不同的结晶结构, 固体共晶存在的形式可分为:非溶剂化共晶、共晶盐、共晶水合物/溶剂化物和共晶盐的水合物/溶剂化物等形式[59-61] (图 5)。对于制备得到的共晶可以通过X-射线粉末衍射(PXRD)、差示扫描热分析(DSC)、热重分析(TGA)等技术手段对共晶进行表征分析, 筛选出目标共晶。
|
Figure 5 Multi-component solid forms inherently overlap with one another and in addition they can exhibit polymorphism |
溶解性差的药物是阻碍越来越多的药物发展的最常见问题之一[62], 中药黄酮类成分大多数属于BCS Ⅱ类化合物, 因溶解性差使制剂开发受到一定限制。为了改善黄酮的物理化学性质, 共晶技术已被应用于众多黄酮类化合物。Sowa等[51]成功制备了染料木素-咖啡因摩尔比为1:1的共晶, 结果发现染料木素的溶解度从0.588 mg·mL-1提高到0.861 mg·mL-1。作者所在实验室许姣姣等成功制备了杨梅素-咖啡因共晶, 与杨梅素晶体相比其特性溶出速率提高了约17倍, 单晶的结构解析表明杨梅素B环的4'-OH和A环的7-OH分别与咖啡因8位C=N和2位的C=O形成氢键。此外, 黄酮类成分亦可作为配体提高其他药物的物理特性, 作者所在实验室[63]将杨梅素作为WG163的配体, 成功制备了共晶, 将WG163的溶出度提高了0.7倍。
除了溶解性, 药物的稳定性和机械性质等在制药工业中也是至关重要的。了解其机械性能和稳定性对于原料混合、压片、胶囊填充、运输和放大等制剂工艺具有重要意义。共晶引起晶格中分子排列的变化, 具有改善物理化学性质的潜力, 包括药物稳定性和机械性能。Zhang等[46, 53]分别将槲皮素和染料木素与4, 4′-联吡啶制备成共晶, 不仅能提高其溶解度和溶出度, 而且显著改善了药物的吸湿性, 提高其稳定性。作者所在实验室[64]制备了葛根素-缬沙坦的药物-药物共晶盐, 葛根素作为配体, 不仅极大提高了BCS Ⅱ类药物缬沙坦的溶解性, 还显著改善了缬沙坦的可压性, 提高其机械性能。
药物的水溶性差可能会限制药物的胃肠道吸收过程, 从而影响药物的生物利用度。有报道表明, 共晶是解决药物溶解度低, 溶出度差的新兴方法。作者所在实验室[42]制备了摩尔比为1:1的黄芩素-烟酰胺共晶, 能使黄芩素从pH 3.6~6.8缓冲盐介质中的溶解度提高了50%到100%, 在pH 6.8 PBS介质中的溶出速率提高了2.5倍; 此外, 大鼠给予共晶后黄芩素的最大血药浓度(Cmax)比给予黄芩素原料药提高了2.5倍, 曲线下面积(AUC)提高了2.8倍。Chadha等[56]制备了橙皮苷-没食子酸的共晶, 将橙皮苷的溶解度提高了2.4倍, 溶出度增强2~4倍, 经药效学研究表明橙皮苷的抗氧化效果提高了1.5倍, 抗溶血效果提高了2.5倍。
在共晶设计中, 可通过共晶生长的规律和剑桥结构数据库系统(CSD)来选择共晶配体, 将API的物理化学和生物药剂学性质发挥到最佳程度, 获得更优的体内过程和治疗效果。但在某些情况下, 共晶并不能仅通过预测形成, 而且在制备过程中也存在多晶型及相互转变, 因此必须进一步探索共结晶的机制, 优化制备工艺获得优势共晶。
3 黄酮类药物无定形与共无定形研究 3.1 无定形药物的简介无定形态是一种特殊的物质晶型状态。与晶体药物相比, 无定形药物的特征是长程无序而短程有序。无定形态药物的各种理化性质及临床药效特征常有别于一般的晶体药物。由于结晶过程中冷却温度骤降、溶剂快速挥发, 混入高分子使系统黏滞性提高等原因抑制晶体成核、生长及有序排列, 形成无定形。Burke等[65]根据经典成核理论提出了非晶态形成的依据, 即用约化温度Tr衡量一种液体的非晶形成能力。根据Tr = Tg/Tm (Tr:约化温度, Tg:玻璃化转变温度, Tm:熔点), 对于Tr > 2/3的化合物, 如果其中不存在非均相成核, 则容易形成无定形。
3.2 无定形对黄酮类药物性质的影响无定形态药物具有高度分散性, 将其制成固体制剂能提高药物在溶出过程中的分散速度和程度, 有利于药物吸收; 无定形态药物由于其分子处于高度无序状态, 吉布斯自由能大, 由无定形药物溶解度与自由能的关系可知[66]:
| $ S_{\mathrm{a}}=\exp \left(-\Delta G_{\mathrm{aw}}^{*} / R T\right) / V_{\mathrm{m}} $ | (1) |
| $ \Delta G_{\mathrm{aw}}^{*}=-\Delta G_{\mathrm{va}}^{*}+\Delta G_{\mathrm{vw}}^{*} $ | (2) |
其中, Sa为无定形溶解度、ΔGaw*为过冷液态溶解在水溶液中的能量变化、R为气体常数、T为温度、Vm为无定形体积、ΔGva*为无定形吉布斯自由能、ΔGvw*为水化能。无定形吉布斯自由能越大, ΔGaw*越小, 溶解度越大, 有利于药物的吸收。Huang等[67]以聚乙烯吡咯烷酮K30为载体制备出7, 3', 4'-三羟基异黄酮(大豆苷元)的纳米粒子粉末(734THIN), 通过与聚乙烯吡咯烷酮K30形成分子间氢键, 使大豆苷元由晶态转变成无定形态, 有效地增加了大豆苷元的水溶性和细胞摄取, 还表现出新的抗炎或抗衰老活性。Zhu等[68]以聚乙烯吡咯烷酮K30为载体制备了汉黄芩素的固体分散体, PXRD和DSC结果表明汉黄芩素从晶态转变为无定形态, 与物理混合物相比具有更高的溶解度, 且体内生物利用度提高了6.2倍。
无定形态分子较晶态具有更高的能量, 按照热力学原理, 高能态物质一般稳定性较差, 易向低能态转变。Alonzo等[69]发现在溶出过程中, 溶出速率(dc/dt)与表面积A、溶液浓度C和平衡溶解度Ceq的差成正比; 成核过程中, J表示成核速率, 与过饱和度S成正比; 晶体生长过程中, 生长速率RG也与溶液浓度C和平衡溶解度Ceq的差成正比。从图 6中可以看出, 过饱和度升高, 使分子碰撞几率增加, 有利于晶核生成; 同时为体系提供更多物质和能量, 使晶核生长速率加快, 为结晶提供趋动力。因此, 随着无定形溶解过程中过饱和度的增加, 溶液中晶体成核和生长的可能性变大, 结晶越容易。作者课题组研究发现, 在37 ℃水中溶出10 min, 葛根素无定形达到最大浓度5.46 mg·mL-1, 葛根素晶体浓度为3.88 mg·mL-1, 随着时间的推移, 葛根素无定形浓度迅速降低, 说明葛根素无定形在溶出过程中不稳定, 易发生结晶。
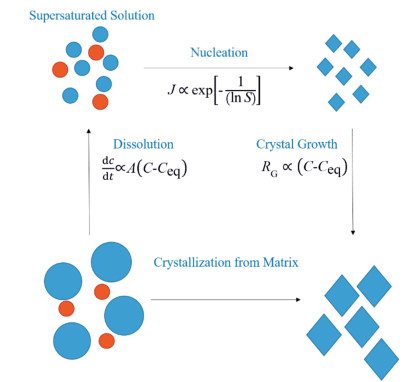
|
Figure 6 Amorphous crystal diagram[69] |
基于无定形药物的物理不稳定性和药物共晶的单相二元体系理念, 近来出现了另一种新的药物固体形态——共无定形。它是一种单相无定形二元体系, 既能提高无定形药物单体的稳定性, 又能改善药物的溶解度和溶出速率; 而且将具有协同作用的两种药物组合, 能产生协同药理作用, 提高临床疗效, 减少药物不良反应。因此, 药物共无定形体系对制剂的处方前研究及剂型设计有重要意义, 将越来越受到国内外学者的关注和重视。
在共无定形体系中, 处于无定形态的药物物理稳定性得到提高, 一般认为体系中另一种配体具有较高的Tg, 整体提高了共无定形体系的Tg, 或者另一种物质的引入起到位阻作用而抑制了无定形的成核结晶过程, 从而提高了物理稳定性。文献报道[70], 摩尔比1:2和2:1的槲皮素和利托那韦共无定形在40 ℃、90天内稳定性良好, 其Tg为51.93 ℃, 但摩尔比1:1的槲皮素和利托那韦共无定形在该条件下发生转晶, 其Tg为63.63 ℃, 比摩尔比2:1的共无定形Tg高, 而稳定性却较摩尔比2:1的槲皮素和利托那韦共无定形差, 说明共无定形的稳定性除了受Tg值影响, 还受分子间相互作用力及抑晶剂等其他因素影响。例如, 共无定形体系分子间氢键、π-π堆积等非共价键相互作用等使其无定形体系更加稳定; 抑晶剂的加入使得体系的黏度增大, 从而减缓甚至阻止了共无定形的重结晶。作者所在实验室成功制备了多烯紫杉醇-杨梅素共无定形, 多西紫杉醇无定形和共无定形的Tg均大于110 ℃, 理论上两者在加速储存温度下应该是稳定的, 但是共无定形的稳定性明显优于无定形。作者[25]认为对于更复杂的无定形系统, 如无定形固体分散体或共无定形体系, 添加的聚合物或小分子也会影响无定形药物在体系中的整体和/或局部迁移, 从而影响物理稳定性。
判断共无定形分子间是否存在相互作用力及其强弱可以通过将Gordon-Taylor方程、Simha-Boyer方程[71, 72]计算的理论Tg与实测Tg比较, 若存在相互作用力, 则其理论值与实测值会有一定程度的偏差。通常, 药物共无定形玻璃化转变温度的理论值小于实测值时, 表明组分间可能存在强的分子间相互作用力; 其理论值大于实测值时, 表明组分间可能不存在分子间相互作用力。方程如下:
Gordon-Taylor方程:
| $ T_{\mathrm{gl} 2}=\frac{W_{1} \times T_{\mathrm{g} 1}+K \times W_{2} \times T_{\mathrm{g} 2}}{W_{1}+K \times W_{2}} $ | (3) |
Simha-Boyer方程:
| $ K=\frac{\rho_{1} \times T_{\mathrm{gl}}}{\rho_{2} \times T_{\mathrm{g} 2}} $ | (4) |
其中, W1、W2分别为药物共无定形中组分1、组分2的质量百分数; Tg1、Tg2分别为药物单独无定形1、2的玻璃化转变温度; K为相关系数, ρ1和ρ2分别为药物单独无定形1、2的密度。
共无定形药物相比无定形药物而言, 除了能提高稳定性外, 还能进一步提高药物的溶解度和溶出速率。作者所在实验室制备的葛根素-烟酰胺共无定形[73]和葛根素-糖精[74]共无定形相比于葛根素无定形, 其在水中的溶出速率分别提高了78和3.8倍。
共无定形药物相比于晶体药物而言, 其具有较高的溶解度和溶出速率, 能显著提高药物体内生物利用度, 例如作者所在实验室利用共无定形技术制备出了多烯紫杉醇-杨梅素共无定形, 与原料药晶体相比, 共无定形中多烯紫杉醇的特性溶出速率提高了3.8倍; 此外, 大鼠体内药动学实验结果表明, 与晶体药物相比, 共无定形给药体系中多烯紫杉醇的Cmax和AUC分别提高了3.9和3.1倍, 且tmax显著缩短[75]。
共无定形本质上仍然是无定形, 其诸多性质与无定形相同, 具有显著提高药物溶解、溶出度, 改善生物利用度等优点。但是, 共无定形具有与无定形完全不同的溶解行为, 与无定形相比具有显著延长的过饱和优势[76]。这种优势一方面可以抑制药物的结晶, 另一方面, 长时间过饱和将有益于药物的体内吸收, 提高生物利用度。
4 黄酮类药物的纳米晶体研究近年来, 纳米技术已被应用于制药领域, 用于解决难溶性药物的溶解和溶出速率等问题。目前, 已经开发了几种基于纳米技术的药物递送系统, 例如纳米胶束[77], 纳米乳剂[78], 聚合物纳米颗粒[79, 80], 固体脂质纳米颗粒[81], 纳米凝胶[82]和纳米悬浮液[83]。与其他纳米载体不同, 纳米晶体是由表面活性剂, 聚合物或两者的混合物组成的稳定的纯药物纳米颗粒的亚微米胶体分散体系, 可用于配制不溶于水、油和有机相的化合物[84]。药物纳米晶体的主要优点是通过减小颗粒的尺寸和增加颗粒的比表面积来增强药物的生物活性。因此, 纳米晶体不仅可以提高药物的饱和溶解度和难溶性药物的溶出率, 而且减少药物的服用量, 提高患者的顺从性。
随着纳米技术的发展, 目前已有多种纳米晶体的制备方法, 包括湿法研磨、高压均质、微流化、控制沉淀、水溶胶技术、冷冻干燥和超临界流体技术等。通过不同的制备方法可以获得多种纳米粒子[85, 86], 同时也具有不同的物理化学性质。Zhang等[87]成功制备出了葛根素纳米晶体, 结果表明葛根素纳晶的粒径显著小于葛根素原料药, 在模拟胃液、模拟肠液及水中溶解度和溶出率均显著提高, 此外, 体内研究表明与葛根素原料药相比, 葛根素纳晶的口服生物利用度提高了2.8倍。作者所在实验室Zhang等[88, 89]成功制备了黄芩素和芹菜素纳米晶体。通过超临界反溶剂技术制备获得了芹菜素纳米晶体, 溶出度提高了1倍, 大鼠口服后Cmax和AUC分别提高了3.6、3.4倍。
由于纳米晶体在解决低溶解度和低生物利用度问题方面的独特优势, 且冷冻干燥、超临界提取等技术可实现工业化, 其应用前景十分广泛。然而由于纳米晶体具有较大的表面自由能, 热力学上不稳定, 有向大晶体成长减少吉布斯自由能的趋势, 因此应通过对药物载体的优化, 利用合适的聚合物来稳定纳米晶体这种转变, 获得良好的稳定性。
5 总结与展望药物晶体工程学在解决难溶性药物的问题上有独特的优势。本文综述了共晶、无定形、共无定形等药物制剂学前沿技术, 在提高难溶性药物溶解度、稳定性、生物利用度等方面的应用。黄酮类中药活性成分在生物药剂学分类系统中大部分属于BCS Ⅱ类, 具有低溶解性、高渗透性特点, 其低溶解性是导致低口服生物利用度的关键因素。为解决黄酮类中药活性成分低溶解性问题, 通过对其多晶形、与小分子配体或药物配体形成共晶、共无定形、制备纳晶等技术方法进行改善, 发现其在提高黄酮类活性成分的溶解、溶出度, 改善口服生物利用度方面具有显著作用, 为香豆素、生物碱等其他难溶性中药活性成分开发提供思路。
| [1] | Bhattacharya S. Are we in the polyphenols era?[J]. Pharmacogn Res, 2011, 3: 147. DOI:10.4103/0974-8490.81966 |
| [2] | Koirala N, Thuan NH, Ghimire GP, et al. Methylation of flavonoids:chemical structures, bioactivities, progress and perspectives for biotechnological production[J]. Enzyme Microb Technol, 2016, 86: 103–116. DOI:10.1016/j.enzmictec.2016.02.003 |
| [3] | Vezza T, Rodriguez-Nogales A, Algieri F, et al. Flavonoids in inflammatory bowel disease:a review[J]. Nutrients, 2016, 8: 211. DOI:10.3390/nu8040211 |
| [4] | Kumar S, Pandey AK. Chemistry and biological activities of flavonoids:an overview[J]. Sci World J, 2013, 2013: 162750. |
| [5] | Romagnolo DF, Selmin OI. Flavonoids and cancer prevention:a review of the evidence[J]. J Nutr Gerontol Geriatr, 2012, 31: 206–238. DOI:10.1080/21551197.2012.702534 |
| [6] | Xia JF, Gao JJ, Inagaki Y, et al. Flavonoids as potential anti-hepatocellular carcinoma agents:recent approaches using HepG2 cell line[J]. Drug Discov Ther, 2013, 7: 1–8. |
| [7] | Xie Y, Yang W, Tang F, et al. Antibacterial activities of flavonoids:structure-activity relationship and mechanism[J]. Curr Med Chem, 2015, 22: 132–149. |
| [8] | Peluso I, Miglio C, Morabito G, et al. Flavonoids and immune function in human:a systematic review[J]. Crit Rev Food Sci Nutr, 2015, 55: 383–395. DOI:10.1080/10408398.2012.656770 |
| [9] | Nijveldt RJ, van Nood E, van Hoorn DE, et al. Flavonoids:a review of probable mechanisms of action and potential applications[J]. Am J Clin Nutr, 2001, 74: 418–425. DOI:10.1093/ajcn/74.4.418 |
| [10] | Gonzalez R, Ballester I, Lopez-Posadas R, et al. Effects of flavonoids and other polyphenols on inflammation[J]. Crit Rev Food Sci Nutr, 2011, 51: 331–362. DOI:10.1080/10408390903584094 |
| [11] | Rothwell JA, Day AJ, Morgan MRA. Experimental determination of octanol-water partition coefficients of quercetin and related flavonoids[J]. J Agric Food Chem, 2005, 53: 4355–4360. DOI:10.1021/jf0483669 |
| [12] | Luo ZJ, Murray BS, Yusoff A, et al. Particle-stabilizing effects of flavonoids at the oil-water interface[J]. J Agric Food Chem, 2011, 59: 2636–2645. DOI:10.1021/jf1041855 |
| [13] | Li HF, Zhang D, Qu WJ, et al. Biopharmaceutics classification and absorption mechanisms primary study on four kinds of flavonoids[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 1198–1203. |
| [14] | Zhang JJ, Liu DP, Huang YT, et al. Biopharmaceutics classification and intestinal absorption study of apigenin[J]. Int J Pharm, 2012, 436: 311–317. DOI:10.1016/j.ijpharm.2012.07.002 |
| [15] | Zhang HJ, Wang M, Chen LN, et al. Determination of twelve flavonoids' oil-water partition coefficients[J]. Chin Tradit Pat Med (中成药), 2016, 38: 1708–1711. |
| [16] | Walle UK, Galijatovic A, Walle T. Transport of the flavonoid chrysin and its conjugated metabolites by the human intestinal cell line Caco-2[J]. Biochem Pharmacol, 1999, 58: 431–438. DOI:10.1016/S0006-2952(99)00133-1 |
| [17] | Zhou P, Li LP, Luo SQ, et al. Intestinal absorption of luteolin from peanut hull extract is more efficient than that from individual pure luteolin[J]. J Agric Food Chem, 2008, 56: 296–300. DOI:10.1021/jf072612+ |
| [18] | Madaan K, Lather V, Pandita D. Evaluation of polyamidoamine dendrimers as potential carriers for quercetin, a versatile flavonoid[J]. Drug Deliv, 2016, 23: 254–262. DOI:10.3109/10717544.2014.910564 |
| [19] | Wei Y, Zhou S, Hao T, et al. Further enhanced dissolution and oral bioavailability of docetaxel by coamorphization with a natural P-gp inhibitor myricetin[J]. Eur J Pharm Sci, 2018, 129: 21–30. |
| [20] | Li H, Dong L, Liu Y, et al. Biopharmaceutics classification of puerarin and comparison of perfusion approaches in rats[J]. Int J Pharm, 2014, 466: 133–138. DOI:10.1016/j.ijpharm.2014.03.014 |
| [21] | Petrussa E, Braidot E, Zancani M, et al. Plant flavonoids-biosynthesis, transport and involvement in stress responses[J]. Int J Mol Sci, 2013, 14: 14950–14973. DOI:10.3390/ijms140714950 |
| [22] | Cao H, Chen XQ, Jassbi AR, et al. Microbial biotransformation of bioactive flavonoids[J]. Biotechnol Adv, 2015, 33: 214–223. DOI:10.1016/j.biotechadv.2014.10.012 |
| [23] | Zhang KX, Jiang Y, Chen XH. Research progress of flavonoid phospholipid complexes[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2015, 32: 394–399. |
| [24] | Li QQ, Wang K, Xue XF, et al. Advance of the preparation and biological activity of flavonoid phospholipid complex[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2018, 35: 132–137. |
| [25] | Li H, Zhao X, Ma Y, et al. Enhancement of gastrointestinal absorption of quercetin by solid lipid nanoparticles[J]. J Control Release, 2009, 133: 238–244. DOI:10.1016/j.jconrel.2008.10.002 |
| [26] | Singhal D, Curatolo W. Drug polymorphism and dosage form design:a practical perspective[J]. Adv Drug Deliv Rev, 2004, 56: 335–347. DOI:10.1016/j.addr.2003.10.008 |
| [27] | Sarma B, Chen J, His HY, et al. Solid forms of pharmaceuticals:polymorphs, salts and cocrystals[J]. Korean J Chem Eng, 2011, 28: 315–322. DOI:10.1007/s11814-010-0520-0 |
| [28] | Seo HO, Sohn YT. Crystal transformation of a flavonoid derivative DA-6034[J]. J Therm Anal Calorim, 2015, 120: 749–757. DOI:10.1007/s10973-014-4126-3 |
| [29] | Zhong ZY, Wu M, Qian S, et al. Inhibition of transformation from puerarin monohydrate to puerarin dihydrate by polyvinylpyrrolidones during dissolution[J]. Acta Pharm Sin (药学学报), 2017, 52: 302–309. |
| [30] | Mangin D, Puel F, Veesler S. Polymorphism in processes of crystallization in solution:a practical review[J]. Org Process Res Dev, 2009, 13: 1241–1253. DOI:10.1021/op900168f |
| [31] | Franklin SJ, Myrdal PB. Solid-state and solution characterization of myricetin[J]. AAPS PharmSciTech, 2015, 16: 1400–1408. DOI:10.1208/s12249-015-0329-6 |
| [32] | Aaltonen J, Alleso M, Mirza S, et al. Solid form screening——a review[J]. Eur J Pharm Biopharm, 2009, 71: 23–37. DOI:10.1016/j.ejpb.2008.07.014 |
| [33] | Gao Y, Zu H, Zhang JJ. Pharmaceutical cocrystals[J]. Prog Chem (化学进展), 2010, 22: 829–836. |
| [34] | Aakeroy CB, Salmon DJ. Building co-crystals with molecular sense and supramolecular sensibility[J]. CrysTengComm, 2005, 7: 439–448. DOI:10.1039/b505883j |
| [35] | Goldberg I. Crystal engineering of nanoporous architectures and chiral porphyrin assemblies[J]. CrysTengComm, 2008, 10: 637–645. DOI:10.1039/b800107c |
| [36] | Banerjee R, Saha BK, Desiraju GR. Synthon robustness in saccharinate salts of some substituted pyridines[J]. CrysTengComm, 2006, 8: 680–685. DOI:10.1039/b608926g |
| [37] | Saha BK, Nangia A, Jaskolski M. Crystal engineering with hydrogen bonds and halogen bonds[J]. CrysTengComm, 2005, 7: 355–358. DOI:10.1039/b501693b |
| [38] | Braga D, Brammer L, Champness NR. New trends in crystal engineering[J]. CrysTengComm, 2005, 7: 1–19. DOI:10.1039/b417413e |
| [39] | Aakeroey CB, Desper J, Fasulo M, et al. Ten years of co-crystal synthesis; the good, the bad, and the ugly[J]. CrysTengComm, 2008, 10: 1816–1821. DOI:10.1039/b811809d |
| [40] | Jayasankar A, Reddy LS, Bethune SJ, et al. Role of cocrystal and solution chemistry on the formation and stability of cocrystals with different stoichiometry[J]. Cryst Growth Des, 2009, 9: 889–897. DOI:10.1021/cg800632r |
| [41] | Trask AV, Motherwell WSD, Jones W. Physical stability enhancement of theophylline via cocrystallization[J]. Int J Pharm, 2006, 320: 114–123. DOI:10.1016/j.ijpharm.2006.04.018 |
| [42] | Huang Y, Zhang B, Gao Y, et al. Baicalein-nicotinamide cocrystal with enhanced solubility, dissolution, and oral bioavailability[J]. J Pharm Sci, 2014, 103: 2330–2337. DOI:10.1002/jps.24048 |
| [43] | Sowa M, Slepokura K, Matczak-Jon E. A 1:1 cocrystal of baicalein with nicotinamide[J]. Acta Crystallogr C, 2012, 68: o262–265. DOI:10.1107/S0108270112024456 |
| [44] | Sowa M, Slepokura K, Matczak-Jon E. Cocrystals of fisetin, luteolin and genistein with pyridinecarboxamide coformers:crystal structures, analysis of intermolecular interactions, spectral and thermal characterization[J]. CrysTengComm, 2013, 15: 7696–7708. DOI:10.1039/c3ce41285g |
| [45] | He MY. Synthesis and Properties of Natural Pharmaceutical Co-crystals of Polyhydroxy Flavonoids (多羟基黄酮类天然药物共晶的合成及其性质研究)[J]. Jiamusi:Jiamusi University, 2017. |
| [46] | Zhang YN, Yin HM, Zhang Y, et al. Cocrystals of kaempferol, quercetin and myricetin with 4, 4'-bipyridine:crystal structures, analyses of intermolecular interactions and antibacterial properties[J]. J Mol Struct, 2017, 1130: 199–207. DOI:10.1016/j.molstruc.2016.10.034 |
| [47] | Smith AJ, Kavuru P, Wojtas L, et al. Cocrystals of quercetin with improved solubility and oral bioavailability[J]. Mol Pharm, 2011, 8: 1867–76. DOI:10.1021/mp200209j |
| [48] | Sowa M, Slepokura M, Matczak-Jon E. A 1:1 pharmaceutical cocrystal of myricetin in combination with uncommon piracetam conformer:X-ray single crystal analysis and mechanochemical synthesis[J]. J Mol Struct, 2014, 1058: 114–121. DOI:10.1016/j.molstruc.2013.10.071 |
| [49] | Hu CC, Cheng H, Xu JJ, et al. Formation thermodynamics of myricetin-caffeine cocrystal in different organic solvents[J]. Cent South Pharm (中南药学), 2017, 15: 567–572. |
| [50] | Xu JJ, Wei YF, Qian S, et al. Preparation of myricetin-caffeine cocrystal and its single crystal analysis[J]. J China Pharm Univ (中国药科大学学报), 2016, 47: 324–328. |
| [51] | Sowa M, Slepokura K, Matczak-Jon E. Solid-state characterization and solubility of a genistein-caffeine cocrystal[J]. J Mol Struct, 2014, 1076: 80–88. DOI:10.1016/j.molstruc.2014.07.036 |
| [52] | Sowa M, Slepokura K, Matczak-Jon K. A 1:2 cocrystal of genistein with isonicotinamide:crystal structure and Hirshfeld surface analysis[J]. Acta Crystallogr C, 2013, 69: 1267–1291. DOI:10.1107/S0108270113029545 |
| [53] | Zhang YN, Yin HM, Zhang Y, et al. Preparation of a 1:1 cocrystal of genistein with 4, 4'-bipyridine[J]. J Cryst Growth, 2017, 458: 103–109. DOI:10.1016/j.jcrysgro.2016.10.084 |
| [54] | Liang SJ, Zhou SY, Yang ST, et al. Thermodynamic studies of naringenin-isonicotinamide cocrystals[J]. Acta Pharm Sin (药学学报), 2017, 52: 625–633. |
| [55] | Luo C, Liang WD, Chen X, et al. Pharmaceutical cocrystals of naringenin with improved dissolution performance[J]. Crystengcomm, 2018, 20: 3025–3033. DOI:10.1039/C8CE00341F |
| [56] | Chadha K, Karan M, Chadha R, et al. Is Failure of Cocrystallization Actually a Failure? Eutectic Formation in Cocrystal Screening of Hesperetin[J]. J Pharm Sci, 2017, 106: 2026–2036. DOI:10.1016/j.xphs.2017.04.038 |
| [57] | Chadha K, Karan M, Bhalla Y, et al. Cocrystals of hesperetin:structural, pharmacokinetic, and pharmacodynarnic evaluation[J]. Cryst Growth Des, 2017, 17: 2386–2405. DOI:10.1021/acs.cgd.6b01769 |
| [58] | Smith AJ, Kavuru P, Arora KK, et al. Crystal engineering of green tea epigallocatechin-3-gallate (EGCG) cocrystals and pharmacokinetic modulation in rats[J]. Mol Pharmaceutics, 2013, 10: 2948–2961. DOI:10.1021/mp4000794 |
| [59] | Gadade DD, Pekamwar SS. Pharmaceutical cocrystals:regulatory and strategic aspects, design and development[J]. Adv Pharm Bull, 2016, 6: 479–494. DOI:10.15171/apb.2016.062 |
| [60] | Aitipamula S, Banerjee R, Bansal AK, et al. Polymorphs, salts, and cocrystals:what's in a name?[J]. Cryst Growth Des, 2012, 12: 2147–2152. DOI:10.1021/cg3002948 |
| [61] | Grothe E, Meekes H, Vlieg E, et al. Solvates, salts, and cocrystals:a proposal for a feasible classification system[J]. Cryst Growth Des, 2016, 16: 3237–3243. DOI:10.1021/acs.cgd.6b00200 |
| [62] | Savjani KT, Gajjar AK, Savjani JK. Drug solubility:importance and enhancement techniques[J]. ISRN Pharm, 2012, 2012: 195727. |
| [63] | Zhang JJ, Shi YL, Luo MQ, et al. Co-amorphous substance of a compound 2016A0C1 pharmaceutical composition: CN, 109180701 A[P]. 2019-01-01. |
| [64] | Zhang JJ, Xu XH, Chen H, et al. Valsartan-puerarin sodium salt complex and its preparation method: CN, 107935958 A[P]. 2018-04-20. |
| [65] | Burke JE, Turnbull D. Recrystallization and grain growth[J]. Prog Met Phys, 1952, 3: 220–292. DOI:10.1016/0502-8205(52)90009-9 |
| [66] | Luder K, Lindfors L, Westergren J, et al. In silico prediction of drug solubility free energy of solvation in pure amorphous matter[J]. J Phys Chem B, 2007, 111: 7303–7311. |
| [67] | Huang PH, Tseng CH, Lin CY, et al. Preparation, characterizations and anti-pollutant activity of 7, 3', 4'-trihydroxyisoflavone nanoparticles in particulate matter-induced HaCaT keratinocytes[J]. Int J Nanomed, 2018, 13: 3279–3293. DOI:10.2147/IJN |
| [68] | Zhu N, Li JC, Zhu JX, et al. Characterization and bioavailability of wogonin by different administration routes in beagles[J]. Med Sci Monit, 2016, 22: 3737–3745. DOI:10.12659/MSM.897621 |
| [69] | Alonzo DE, Zhang GG, Zhou D, et al. Understanding the behavior of amorphous pharmaceutical systems during dissolution[J]. Pharm Res, 2010, 27: 608–618. DOI:10.1007/s11095-009-0021-1 |
| [70] | Dengale SJ, Hussen SS, Krishna BS, et al. Fabrication, solid state characterization and bioavailability assessment of stable binary amorphous phases of ritonavir with quercetin[J]. Eur J Pharm Biopharm, 2015, 89: 329–338. DOI:10.1016/j.ejpb.2014.12.025 |
| [71] | Forster A, Hempenstall J, Tucker I, et al. The potential of small-scale fusion experiments and the Gordon-Taylor equation to predict the suitability of drug/polymer blends for melt extrusion[J]. Drug Dev Ind Pharm, 2001, 27: 549–560. DOI:10.1081/DDC-100105180 |
| [72] | Qian F, Huang J, Hussain MA. Drug-polymer solubility and miscibility:stability consideration and practical challenges in amorphous solid dispersion development[J]. J Pharm Sci, 2010, 99: 2941–2947. DOI:10.1002/jps.22074 |
| [73] | Gao Y, Yang ST, Qian S, et al. A co-amorphous compound of puerarin nicotinamide: CN, 107987065A[P]. 2018-05-04. |
| [74] | Wei YF, Ma MJ, Lin YN, et al. A co-amorphous substance of puerarin saccharin and its preparation method: CN, 109180659A[P]. 2019-01-11. |
| [75] | Hao T, Ling Y, Wu M, et al. Enhanced oral bioavailability of docetaxel in rats combined with myricetin:in situ and in vivo evidences[J]. Eur J Pharm Sci, 2017, 101: 71–79. DOI:10.1016/j.ejps.2017.02.009 |
| [76] | Qian S, Heng WL, Wei YF, et al. Coamorphous lurasidone hydrochloride-saccharin with charge-assisted hydrogen bonding interaction shows improved physical stability and enhanced dissolution with pH-independent solubility behavior[J]. Cryst Growth Des, 2015, 15: 2920–2928. DOI:10.1021/acs.cgd.5b00349 |
| [77] | Wang Y, Grayson SM. Approaches for the preparation of non-linear amphiphilic polymers and their applications to drug delivery[J]. Adv Drug Deliv Rev, 2012, 64: 852–865. DOI:10.1016/j.addr.2012.03.011 |
| [78] | Ammar HO, Salama HA, Ghorab M, et al. Nanoemulsion as a potential ophthalmic delivery system for dorzolamide hydrochloride[J]. AAPS Pharmscitech, 2009, 10: 808–819. DOI:10.1208/s12249-009-9268-4 |
| [79] | Liu ZH, Jiao YP, Wang YF, et al. Polysaccharides-based nanoparticles as drug delivery systems[J]. Adv Drug Deliv Rev, 2008, 60: 1650–1662. DOI:10.1016/j.addr.2008.09.001 |
| [80] | Patel T, Zhou JB, Piepmeier JM, et al. Polymeric nanoparticles for drug delivery to the central nervous system[J]. Adv Drug Deliv Rev, 2012, 64: 701–705. DOI:10.1016/j.addr.2011.12.006 |
| [81] | Blasi P, Glovagnoli S, Schoubben A, et al. Solid lipid nanoparticles for targeted brain drug delivery[J]. Adv Drug Deliv Rev, 2007, 59: 454–477. DOI:10.1016/j.addr.2007.04.011 |
| [82] | Chacko RT, Ventura J, Zhuang JM, et al. Polymer nanogels:a versatile nanoscopic drug delivery platform[J]. Adv Drug Deliv Rev, 2012, 64: 836–851. DOI:10.1016/j.addr.2012.02.002 |
| [83] | Rabinow BE. Nanosuspensions in drug delivery[J]. Nat Rev Drug Discov, 2004, 3: 785–796. DOI:10.1038/nrd1494 |
| [84] | Zhou YQ, Du J, Wang LL, et al. Nanocrystals technology for improving bioavailability of poorly soluble drugs:a mini-review[J]. J Nanosci Nanotechnol, 2017, 17: 18–28. DOI:10.1166/jnn.2017.13108 |
| [85] | Lu CH, Zhang QW, Jia Y. Preparation and characterisation of triangular pyramid-shaped puerarin and aspirin microparticles with nanostructures[J]. J Exp Nanosci, 2011, 6: 1–6. DOI:10.1080/17458081003720647 |
| [86] | Li Z, Yu L, Zheng LQ, et al. Studies on crystallinity state of puerarin loaded solid lipid nanoparticles prepared by double emulsion method[J]. J Therm Anal Calorim, 2010, 99: 689–693. DOI:10.1007/s10973-009-0127-z |
| [87] | Zhang Y, Li Y, Zhao XH, et al. Preparation, characterization and bioavailability of oral puerarin nanoparticles by emulsion solvent evaporation method[J]. RSC Adv, 2016, 6: 69889–69901. DOI:10.1039/C6RA08413C |
| [88] | Zhang J, Lv H, Jiang K, et al. Enhanced bioavailability after oral and pulmonary administration of baicalein nanocrystal[J]. Int J Pharm, 2011, 420: 180–188. DOI:10.1016/j.ijpharm.2011.08.023 |
| [89] | Zhang JJ, Huang YT, Liu DP, et al. Preparation of apigenin nanocrystals using supercritical antisolvent process for dissolution and bioavailability enhancement[J]. Eur J Pharm Sci, 2013, 48: 740–747. DOI:10.1016/j.ejps.2012.12.026 |
 2019, Vol. 54
2019, Vol. 54


