CAT3 (图 1)是基于天然产物娃儿藤活性成分CAT的结构进行一系列优化而得到的新型抗脑瘤化合物。药效学研究结果表明CAT3对Daoy和U87MG脑瘤细胞裸鼠原位异种移植模型具有显著的抗肿瘤活性, 其水解产物PF403不但对Daoy、U87MG和U251脑瘤细胞具有明显抑制作用(IC50 < 0.01 nmol·L-1), 而且对临床一线抗脑瘤药替莫唑胺耐药的U251细胞也具有明显抑制作用[1] (图 1)。CAT3作为有望治疗恶性脑瘤的化合物, 其药效学虽已广泛研究, 但其生物转化机制尚不清楚。

|
Figure 1 The structures of CAT3 and PF403 |
药代动力学前期研究结果表明, 小鼠口服CAT3后可在血液、粪便、尿液等生物样本中检测到原形药、活性代谢物PF403、葡萄糖醛酸结合产物GLU-PF403以及氧化脱水M1 (m/z 348), 双氧化脱水M2 (m/z 346), 甲基化氧化脱水M3 (m/z 362), 氧化M4 (m/z 366), 脱甲基M5 (m/z 336)等代谢产物, 但参与其代谢的同工酶类型尚不明确。本研究应用小鼠/犬/人全血、肝微粒体、人源化重组酶等体外温孵体系进行一系列研究, 旨在探究CAT3的生物转化机制, 鉴定参与其转化的代谢酶亚型, 为CAT3临床安全合理用药提供实验依据。
材料与方法仪器 Q Executive高分辨质谱(Thermol, 美国), Thermo Fisher Scientific Vanquish binary UPLC (Thermo, 美国)配有:二元梯度泵、在线脱气机、自动进样器、柱温箱。数据采集、分析软件TraceFinder4.1 General Quan。
药品与试剂 CAT3、PF403、GLU-PF403标准品由中国医学科学院药物研究所合成室提供, 纯度均大于99%。人全血由北京协和医院惠赠, 小鼠和犬全血由本实验室订购动物采集。小鼠肝微粒体(mouse liver microsome, MLM)由本实验室自制。人和犬肝微粒体(human liver microsome & dog liver microsome, HLM & DLM), 人源化重组葡萄糖醛酸转移酶(UDP-glucuronosyltransferases, UGTs)及CYPs (Cytochrome P450)酶购自美国BD公司。Sodium bis-p-nitrophenyl phosphate (BNPP)、BW284c51、5, 5'-dithiobis-nitrobenzoic (DTNB)、ethylenedinitrilotetraacetic acid (EDTA)、Ethyleneglycol-bis(2-aminoethylether)-N, N, N', N'-tetraacetic acid (EGTA)、tetra isopropyl pyrophosphoramide (iso-OMPA)、phenylmethy-sulfonyl fluoride (PMSF)、4-(2-aminoethyl-)benzenesulfonyl fluoride hydrochloride (Pefabloc®SC)、氟化钠、三羟甲基氨基甲烷、葡萄糖-6-磷酸、氧化型辅酶H (β-NADP)、尿苷二磷酸葡糖醛酸(UDP-D-glucuronide trisodium salt, UDPGA)、咪达唑仑、非那西丁、右美沙芬、美芬妥英、氯唑沙宗、双氯芬酸钠、1-羟基-咪达唑仑、4-羟基-美芬妥英、对乙酰氨基酚、右啡烷、4-羟基-双氯芬酸钠和6-羟基-氯唑沙宗、呋拉茶碱、磺胺苯吡唑、噻氯匹定、奎尼丁、二乙基二硫胺甲酸钠(diethylthiolcarbamate, DETC)和酮康唑购自Sigma Aldrich公司。7-羟基-4-甲基香豆素(4-methylumbelliferone, 4-MU)、7-羟基-4-甲基香豆素-β-D-葡糖醛酸苷(4-MUG)、苯海拉明和丙甲菌素购自北京百灵威公司。甲醇、乙腈为色谱纯(Fisher, 美国), 其他试剂为分析纯。超纯水由Milli-Q纯水仪制备(Millipore, MA, 美国)。
Tris-HCl缓冲液:三羟甲基氨基甲烷50 mmol·L-1, MgCl2·6H2O 5 mmol·L-1, pH = 7.4。
NADPH-GS: β-NADP 11.1 mmol·L-1, G-6-P 110 mmol·L-1, G-6-P-DH 10 U·mL-1。
动物 雄性ICR小鼠, SPF级, 体重26~28 g, 购自北京维通利华实验动物技术有限公司, 合格证编号: SCXK (京) 2016-0006。雄性Beagle犬, SPF级, 体重6~6.5 kg, 购自北京玛斯生物技术有限公司, 合格证编号: SCXK (京) 2016-0001。动物福利和动物实验操作遵循中国医学科学院动物伦理委员会规定。
CAT3在全血中的稳定性 CAT3 (终浓度5 μmol·L-1)与小鼠新鲜全血在37 ℃水浴温孵2、5、10、15、30 min终止反应; 与犬/人新鲜全血在37 ℃水浴温孵30、60、90、120、180 min终止反应。每个种属分别设0时对照。反应体系均为200 μL, 有机溶剂 < 1%。
全血中参与CAT3水解的酯酶鉴定 CAT3 (终浓度5 μmol·L-1)与含不同酯酶抑制剂(表 1)[2]的小鼠/犬/人新鲜全血在37 ℃温孵, 小鼠全血温孵10 min后终止反应, 设置0、10 min无抑制剂对照组; 犬和人全血温孵2 h后终止反应, 设置0、2 h无抑制剂对照组。每组3个平行样。抑制率计算公式为: Inhibition ratio (%) = (1-Dwith inhibitor/Dwithout inhibitor)×100%。D:表示相应的样品中PF403生成量。
| Table 1 Inhibitors and concentrations of esterase enzymes. BNPP: Sodium bis-p-nitrophenyl phosphate; DTNB: 5, 5'-Dithiobis-nitrobenzoic; EDTA: Ethylenedinitrilotetraacetic acid; EGTA: Ethyleneglycol-bis(2-aminoethylether)-N, N, N', N'-tetraacetic acid; iso-OMPA: tetra isopropyl pyrophosphoramide; Pefabloc®SC: 4-(2-Aminoethyl-)benzenesulfonyl fluoride hydrochloride; PMSF: Phenylmethy-sulfonyl fluoride; CE: Carboxyesterase; AChE: Acetylcholinesterase; PON: Aromatic dialkyl phosphatase; BChE: Butyrylholinesterase |
CAT3在肝微粒体中的稳定性 将小鼠、犬或人肝微粒体(蛋白终浓度0.5 mg·mL-1)与Tris-HCl缓冲液、NADPH-GS溶液混匀, 加入CAT3 (终浓度10 μmol·L-1)启动反应, 37 ℃水浴温孵5、10、20、30、45和60 min后终止反应。反应体系为200 μL, 有机溶剂含量 < 1%, 每组3个平行样。各种属肝微粒体分别设0 h对照和咪达唑仑阳性对照。
参与CAT3代谢的CYPs酶亚型鉴定 ①肝微粒体温孵体系:在人肝微粒体温孵液(蛋白终浓度0.5 mg·mL-1)中分别加入CAT3 (终浓度5 μmol·L-1)和高、低两个浓度同工酶抑制剂, 加NADPH-GS启动反应后, 37 ℃温孵60 min终止反应, 测定代谢物生成速率, 设定未加抑制剂和阳性抑制剂对照组。各同工酶阳性抑制剂及探针底物在肝微粒体中的温孵浓度和时间见表 2[3, 4]。②人源化重组酶温孵体系: PF403 (终浓度5 μmol·L-1)分别与14个人源化重组酶CYP1A1、CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP2J2、CYP3A4、CYP4A11、CYP4F2、CYP4F3、CYP4F12 (终浓度50 pmol·mL-1)在37 ℃预温孵5 min后, 加入NADPH-GS 20 μL启动反应, 温孵1 h后终止反应(n = 3)。温孵液总体积为200 μL, 有机溶剂含量 < 1%。每个重组酶体系分别设定阳性底物对照组。
| Table 2 Substrates, inhibitors, concentrations, analytes and incubation time for the assay of CYPs activity in liver microsome[3, 4]. DETC: Diethylthiolcarbamate |
GLU-PF403在肝微粒体内的生成速率 将不同浓度PF403 (0.02、0.05、0.1、0.2、0.5、1、2、5、10 μmol·L-1)加入小鼠、犬或人肝微粒体温孵液(蛋白终浓度0.5 mg·mL-1), 再加入丙甲菌素[终浓度50 μg·mg-1 (pro)]冰浴穿孔15 min, 37 ℃预温孵5 min后加入UDPGA (终浓度3 mmol·L-1)启动反应, 温孵15 min后终止反应(n = 3)。反应总体积为200 μL, 有机溶剂含量 < 1%。以4-MU作阳性对照验证温孵体系可靠性[5]。
参与GLU-PF403生成的人源重组UGTs酶鉴定 PF403 (终浓度1、10 μmol·L-1)分别与13种人源重组UGTs酶(终浓度0.2 mg·mL-1)在37 ℃预温孵5 min, 加入UDPGA (终浓度5 mmol·L-1)启动反应, 30 min后终止反应。反应液总体积200 μL, 有机溶剂 < 1%。实验设定阳性底物对照组[5-9]。
反应液处理及标准曲线配制 反应结束后加入含内标的2倍体积冰乙腈(IS-1和IS-2, 终浓度为8 ng·mL-1及2 μg·mL-1)终止反应, 混匀, 高速离心(14 000 r·min-1, 5 min)两次后, 取上清液10 μL进行液质分析, 同时检测原药及代谢物。
准确称取CAT3、PF403及GLU-PF403标准品, 用DMSO溶解为1 mg·mL-1储备液。储备液用乙腈稀释为一系列浓度工作液用于制备标准曲线。取空白基质100 μL, 与乙腈150 μL混合后加入不同浓度CAT3、PF403和GLU-PF403标准品各10 μL以及内标溶液各10 μL (IS-1和IS-2, 终浓度为8 ng·mL-1及2 μg·mL-1), 混匀, 高速离心(14 000 r·min-1, 5 min)两次后, 取上清液10 μL进行LC-MS/MS分析。M1~M5无对照品, 以PF403相对定量。
检测条件 采用ZORBAX SB-C18 column (2.1 mm×100 mm, 3.5 μm)色谱柱, 柱温25 ℃; 流动相为0.1%甲酸水和0.1%甲酸乙腈, 采用梯度洗脱。在平行反应监测(parallel reaction monitoring, PRM)模式下采用正离子检测, 定量分析反应离子为: CAT3, m/z 434.23→70.07; PF403, m/z 350.17→70.07; GLU-PF403, m/z 526.21→70.07; IS-1, m/z 364.19→70.07; IS-2, m/z 625.18→317.07; M1, m/z 348.16→348.16; M2, m/z 346.14→346.14; M3, m/z 362.14→362.14; M4, m/z 366.19→70.07; M5, m/z 336.23→70.07。
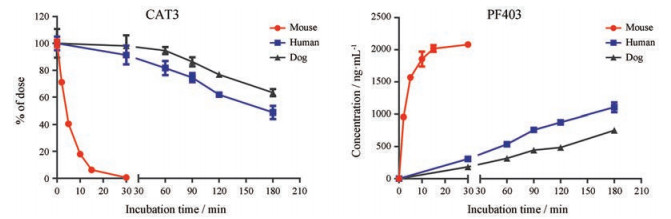
结果 1 CAT3在全血中的稳定性CAT3在小鼠/犬/人全血中稳定性见图 2。结果提示, CAT3在小鼠全血中不稳定, 37 ℃温孵30 min后98.69%被代谢转化为PF403。在人和犬全血中CAT3代谢较缓慢, 随着时间的延长代谢逐渐增加, 180 min时代谢率分别达到51.28%和36.68%。
|
Figure 2 Stability of CAT3 in mouse/dog/human blood (n = 3) |
酯酶鉴定结果表明, BNPP和iso-OMPA可显著抑制小鼠全血中CAT3代谢, 抑制率分别为66.57%和63.85%, 表明羧酸酯酶和丁酰胆碱酯酶是催化小鼠全血中CAT3水解为PF403的主要酯酶。iso-OMPA可显著抑制人和犬全血中CAT3代谢, 抑制率分别为39.51%和16.65%, 表明丁酰胆碱酯酶是催化人和犬全血中CAT3水解的主要酯酶。Pefabloc®SC和PMSF对小鼠、犬、人全血CAT3水解的抑制率分别为81.17%和53.40%、46.18%和52.32%、20.59%和20.18%, 表明丝氨酸水解酶参与CAT3水解。此外, 非选择性酯酶抑制剂NaF对小鼠、犬、人全血CAT3水解也有不同程度抑制作用。以上结果提示, 羧酸酯酶、丁酰胆碱酯酶和丝氨酸水解酶是参与CAT3水解的重要酯酶, 结果见表 3。
| Table 3 Effects of esterase inhibitors on the hydrolysis of CAT3 in mouse/dog/human blood (n = 3) |
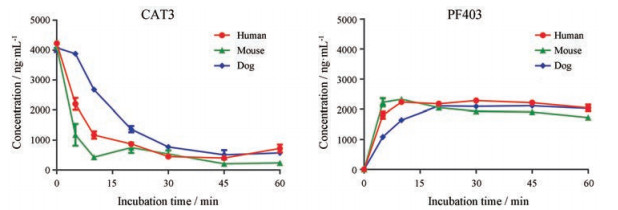
阳性药咪达唑仑(10 μmol·L-1)在3个种属肝微粒体内温孵, 代谢物1-羟基咪达唑仑生成速率为411.50~567.37 pmol·L-1·mg-1(pro), 证明温孵体系可靠。CAT3 (10 μmol·L-1)在小鼠、犬及人肝微粒体中温孵10 min后原形药代谢明显, 代谢速率小鼠 > 人 > 犬。活性代谢物PF403随温孵时间延长先快速增加后略有降低, 样品进一步鉴定发现有代谢产物M1、M2、M3和M4生成, 结果见图 3。
|
Figure 3 Time-dependent decreasing of CAT3 and formation of PF403 in mouse, dog and human liver microsome (n = 3) |
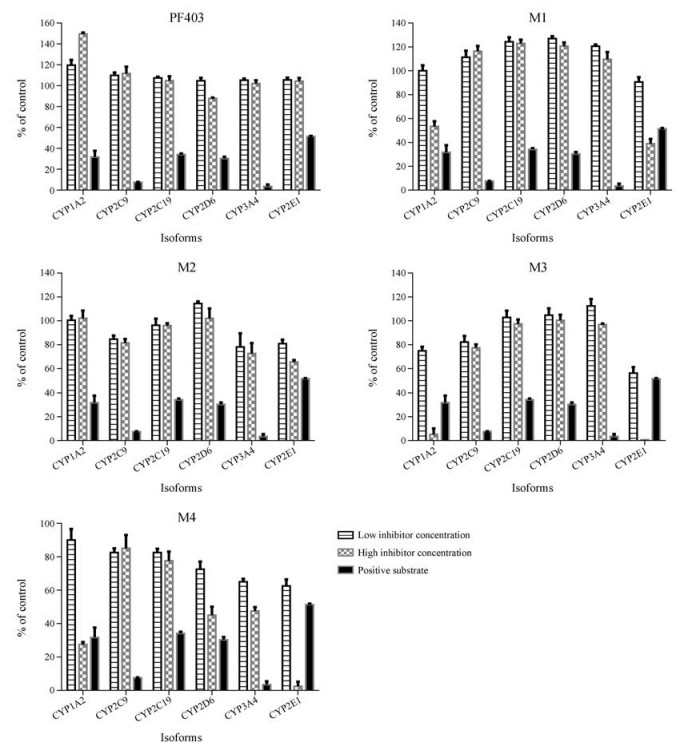
在人肝微粒温孵体系中加入CAT3 (5 μmol·L-1)后, 抑制剂呋拉茶碱(2和50 μmol·L-1)对M1、M3、M4生成的抑制率分别为15.19%和54.81%、24.74%和94.85%、10.00%和94.85%;磺胺苯吡唑(2和10 μmol·L-1)对M2、M3、M4生成的抑制率为15.00%~22.68%;噻氯匹定(5和25 μmol·L-1)对M4生成的抑制率为17.50%和22.50%;奎尼丁(1和10 μmol·L-1)对M4生成的抑制率为27.50%和55.00%。酮康唑(1和10 μmol·L-1)对M2、M4生成的抑制率分别为21.82%和27.44%、35.00%和52.50%。二乙基二硫胺甲酸钠(DETC, 2和50 μmol·L-1)对M1、M2、M3、M4生成的抑制率分别为: 23.15%和67.04%、19.01%和34.55%、44.33%和98.97%、37.50%和97.50%。以上结果提示, 人肝微粒体CYP1A2、2D6和2E1是参与M1~M4生成的主要同工酶, 2C19、2C9和3A4等亚型也有少量参与, 结果见图 4。
|
Figure 4 Effects of selective CYPs inhibitors on the formation of CAT3 metabolites (PF403, M1, M2, M3 and M4) in human liver microsome (n = 3) |
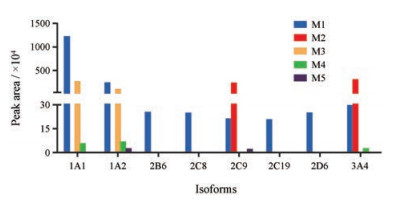
PF403浓度为5 μmol·L-1时, 人源化重组酶CYP1A1、1A2、2B6、2C8、2C9、2C19、2D6和3A4重组酶体系中可见M1的生成, CYP2C9和3A4体系中可见M2生成, CYP1A1和1A2体系可见M3生成, CYP1A1、1A2和3A4体系可见M4生成, CYP1A2和2C9体系可见M5生成。但CYP2E1、2J2、4A11、4F2、4F3、4F12重组酶体系中未见M1~M5的生成, 上述结果提示M1~M5的生成是多酶参与的代谢过程, 结果见图 5。
|
Figure 5 Formation of M1-M5 in recombinant CYPs. n = 3 |
肝微粒体经丙甲菌素穿孔后, 可催化PF403生成GLU-PF403, 且GLU-PF403的产生具有UDPGA依赖性, 提示GLU-PF403的生成由葡萄糖醛酸转移酶催化。不同浓度PF403与小鼠、犬、人肝微粒温孵后, GLU-PF403的生成速率随PF403浓度增加而递增, GLU-PF403在人和犬中的生成速率明显大于小鼠。结果见图 6。
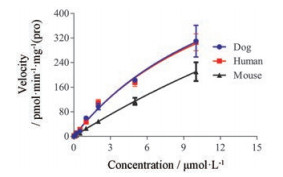
|
Figure 6 Kinetic plots of GLU-PF403 formation in mouse, dog and human liver microsome. n = 3 |
人源化重组酶UGT1A1、1A3、1A4、1A6、1A7、1A8、1A9、1A10、2B4、2B7、2B10、2B15、2B17与相应阳性底物温孵后均可见代谢产物显著生成, 提示上述重组酶研究体系可靠, 可用于药物的体外代谢酶研究。PF403浓度为1 μmol·L-1时, UGT1A1、1A3、1A9温孵体系中可见GLU-PF403的生成, 提示UGT1A1、1A3、1A9是催化GLU-PF403生成的主要同工酶; PF403浓度为10 μmol·L-1时, 除上述亚型外, UGT1A4、1A8、1A10重组酶也少量参与GLU-PF403的生成, 但UGT2B家族在PF403高低浓度时均不参与GLU-PF403的生成。以上结果提示GLU-PF403的生成是UGT1A家族多酶参与的代谢过程, 结果见表 4。
| Table 4 The formation of GLU-PF403 in human recombinant UGTs in vitro. n = 3. a: 4-MU as positive substrate; b: Diphenhudramine as positive substrate. /: Not detected |
药物体外生物转化机制研究不仅有助于了解药物发挥药理作用的物质基础, 也有助于预测人体内代谢特征。药物的体内生物转化反应主要分为Ι相反应(氧化、还原和水解反应)和Ⅱ相反应(结合反应)。在Ι相反应过程中, 化合物在Ⅰ相酶(酯酶、CYPs等)的作用下生成某些活性基团(-OH、-SH、-COOH、-NH2)。在Ⅱ相反应过程中, 化合物及代谢产物在Ⅱ相酶(葡萄糖醛酸转移酶、磺基转移酶等)作用下与细胞内某些基团如葡萄糖醛酸、硫酸、甲基等结合生成结合产物而排出体外[10]。
酯酶作为一类参与药物Ⅰ相代谢的重要酶系, 在肠道、血液及肝脏等广泛分布, 参与大约10%治疗药物的代谢, 催化化合物发生水解反应, 与一些前药活化, 药物失活, 甚至是药物毒性的发生密切相关[11]。PF403是天然产物CAT的活性代谢物, 其毒性相对较小, 但口服吸收差, 经结构改造成为酯类化合物CAT3, 使其更易吸收并脑内靶向分布。在小鼠全血中CAT3经羧酸酯酶、丁酰胆碱酯酶及丝氨酸水解酶催化水解, 但其水解速率远远大于人和犬全血, 这可能与酯酶在组织中的表达、活性以及底物特异性等方面存在的种属差异有关。文献报道大羟基端, 小酰基端的化合物, 更易被Ⅱ型羧酸酯酶水解, 而犬与小鼠、大鼠、猴和人相比, 肠道中几乎不含Ⅱ型羧酸酯酶[12], 这可能是比格犬口服CAT3后生物利用度大于小鼠(约为1.5倍)的主要原因。本研究鉴定了常见酯酶对CAT3水解的催化作用, 但是醛脱氢酶、白蛋白等一些酶或蛋白也一定程度参与酯类化合物水解, 不排除它们参与CAT3水解的可能。
肝脏作为主要代谢器官, 分布有大量CYPs酶, 其中CYP1A2、2C9、2C19、2D6、2E1和3A4是参与药物代谢的主要亚型[13]。在人肝脏微粒体温孵体系中采用上述6种主要CYPs同工酶的选择性抑制剂, 研究发现M1~M4生成是多酶催化的代谢过程, 并且一种CYPs酶亚型可催化M1~M4中的多个产物生成。在14种人源化重组酶中, CYP1A1、1A2、2C9和3A4是催化PF403代谢的主要CYPs同工酶, CYP2B6、2C8、2C19和2D6等亚型也有少量参与。
UGTs存在于肝微粒体中, 是一类主要的Ⅱ相转化酶[14]。小鼠/犬/人肝微粒体经丙甲菌素穿孔后可催化PF403生成GLU-PF403, 但存在一定种属差异, 与小鼠相比, 人肝微粒中GLU-PF403的生成与犬更为接近, 这可能是由于UGTs表达, 活性及底物选择性存在种属差异。在13种人源重组UGTs温孵体系中UGT2B家族不参与GLU-PF403的生成, 而UGT1A家族中UGT1A1、1A3、1A9是参与GLU-PF403生成的主要同工酶, UGT1A4、1A8和1A10也有少量参与。
综上所述, CAT3可经酯酶水解为PF403。PF403在多个CYPs同工酶的催化下生成多个氧化代谢产物, 与此同时, PF403还可经UGTs同工酶催化生成Ⅱ相结合产物GLU-PF403, 上述结果提示, CAT3的生物转化是一个多酶催化的反应过程, 代谢酶介导的药物相互作用值得临床关注。
| [1] | Chen J, Lv H, Hu J, et al. CAT3, a novel agent for medulloblastoma and glioblastoma treatment, inhibits tumor growth by disrupting the Hedgehog signaling pathway[J]. Cancer Lett, 2016, 381: 391–403. DOI:10.1016/j.canlet.2016.07.030 |
| [2] | Liu YL, He J, Abliz Z, et al. In vitro stability and metabolism of O2', O3', O5'-tri-acetyl-N6-(3-hydroxylaniline) adenosine in rat, dog and human plasma: chemical hydrolysis and role of plasma esterases[J]. Xenobiotica, 2011, 41: 549–560. DOI:10.3109/00498254.2011.573016 |
| [3] | Bi YF, Liu S, Zhang RX, et al. Metabolites and metabolic pathways of mesaconitine in rat liver microsomal investigated by using UPLC-MS/MS method in vitro[J]. Acta Pharm Sin (药学学报), 2013, 48: 1823–1828. |
| [4] | Mi JQ. Establishment of BCRP-MDCKⅡ Cells with High Expression of Human Breast Cancer Resistance Protein & Preclinical Pharmacokinetics of H002 (人源化乳腺癌耐药蛋白高表达BCRP-MDCKⅡ细胞模型的建立H002临床前药代动力学研究) [D]. Beijing: Peking Union Medical College, 2016. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y3075621 |
| [5] | Uchaipichat V, Mackenzie PI, Guo XH, et al. Human UDP-glucuronosyltransferases: isoform selectivity and kinetics of 4-methylumbelliferoneand 1-naphthol glucuronidation, effects of organic solvents, and inhibition by diclofenac and probenecid[J]. Drug Metab Dispos, 2004, 32: 413–423. DOI:10.1124/dmd.32.4.413 |
| [6] | Kerdpin O, Mackenzie PI, Bowalgaha K, et al. Influence of N-terminal domain histidine and proline residues on the substrate selectivities of human UDP-glucuronosyltransferase 1A1, 1A6, 1A9, 2B7, and 2B10[J]. Drug Metab Dispos, 2009, 37: 1948–1955. DOI:10.1124/dmd.109.028225 |
| [7] | Ismail S, Hanapi NA, Ab Halim MR, et al. Effects of Andrographis paniculata and Orthosiphon stamineus extracts on the glucuronidation of 4-methylumbelliferone in human UGT isoforms[J]. Molecules, 2010, 15: 3578–3592. DOI:10.3390/molecules15053578 |
| [8] | Liu Y, Ramírez J, House L, et al. Comparison of the drug-drug interactions potential of erlotinib and gefitinib via inhibition of UDP-glucuronosyltransferases[J]. Drug Metab Dispos, 2010, 38: 32–39. DOI:10.1124/dmd.109.029660 |
| [9] | Shan L, Yang S, Zhang G, et al. Comparison of the inhibitory potential of bavachalcone and corylin against UDP-glucuronosyltransferases[J]. Evid Based Complement Alternat Med, 2014, 2014: 1–6. |
| [10] | Yang R, Ma XH, Guo JH, et al. Characteristics of drug metabolic enzymes[J]. Chin J New Drugs (中国新药杂志), 2016, 25: 751–759. |
| [11] | Fukami T, Yokoi T. The Emerging Role of human esterases[J]. Drug Metab Pharmacokinet, 2012, 27: 466–477. DOI:10.2133/dmpk.DMPK-12-RV-042 |
| [12] | Wang R, Jiang JW, Li Y. Role of carboxylesterase in drug metabolism[J]. Acta Pharm Sin (药学学报), 2018, 53: 186–191. |
| [13] | Mandery K, Bujok K, Schmidt I, et al. Influence of the flavonoids apigenin, kaempferol, and quercetin on the function of organic anion transporting polypeptides 1A2 and 2B1[J]. Biochem Pharmacol, 2010, 80: 1746–1753. DOI:10.1016/j.bcp.2010.08.008 |
| [14] | Li X, Yu YN. Advance in research of drug phase Ⅱ metabolisms and conjugation enzymes[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2000, 16: 458–465. |
 2019, Vol. 54
2019, Vol. 54


