2. 西南大学药学院中医药学院, 重庆 400715
2. College of Pharmaceutical Sciences and Chinese Medicine, Southwest University, Chongqing 400715, China
细胞色素P450酶系是肝微粒体混合功能氧化酶系的主要成分, 是由多个同工酶组成的基因超家族, 参与内源性物质和包括药物、环境化合物在内的外源性物质的代谢[1]。研究发现, 当两种或两种以上药物联用时, 由于药物之间的相互作用而使药效或不良反应加强或减弱, 甚至出现未预期的不良反应[2]。药物相互作用可发生在吸收、代谢、排泄、蛋白结合等不同环节, 其中药物代谢性相互作用96%是由CYP450酶介导的, 其中酶抑制引起约占70%, 酶诱导引起约占23%, 其他类型占7%[3, 4]。研究药物对CYP450酶的影响, 有助于预测代谢性药物相互作用, 从而提高药物的有效性和安全性, 降低药物的不良反应, 指导临床联合用药。目前, 欧美各国已把CYP450酶系的测定用于新药的筛选及其代谢研究, 并把药物对它的作用列为新药申报必须进行的一项实验。我国新的《新药审批管理条例》也在积极倡导进行药物对于代谢酶影响的研究[5]。
加味佛手散胶囊(Jiawei Foshou San capsule, JWFSSC)为西南大学中药研究所自主研发的用于治疗子宫内膜异位症的一种新型中药单体复方制剂, 由中医妇科经典名方佛手散药物当归、川芎的有效组分阿魏酸(ferulic acid, FA)、川芎嗪(ligustrazine, LZ)及具有止痛作用的延胡索乙素(tetrahydropalmatine, THP)配伍而成。研究发现, 阿魏酸和川芎嗪均具有抗肿瘤血管生成作用, 并能抑制血管内皮生长因子的表达, 延胡索乙素具有抑制中枢神经系统, 松弛子宫平滑肌, 调节内分泌激素水平等作用[6, 7]。课题组前期研究表明, 阿魏酸、川芎嗪及延胡索乙素配伍合用具有抗子宫内膜异位症血管生成, 抑制子宫内膜异位症移植物生长作用[8-10]。本研究采用“鸡尾酒”探针底物法, 系统评价加味佛手散胶囊在体内和体外对大鼠肝微粒5种常见肝药酶CYP450亚型活性的影响, 并观察用药前后肝组织细胞形态变化, 以期弄清加味佛手散胶囊与亚酶底物合用时产生药物相互作用的可能性, 为临床安全合理用药提供实验资料和依据。
材料与方法仪器 液质联用系统(API 4000 Qtrap, SER. N:AR26221101, 岛津LC-20AD泵; SIL-20AC恒温自动进样器, CTO-20A柱温箱, CBM-20A控制器, ESI离子源; Analyst Software 1.5.2色谱工作站, 美国Beckman Coulter公司); Avanti J-301冷冻高速离心机(美国Beckman Coulter公司); Elix3超纯水系统(美国Millipore公司), EL2204电子天平(梅特勒-托利多仪器有限公司), SHB-ⅢS循环水式多用真空泵(郑州长城科工贸有限公司), 微量移液器(德国Eppendorf公司)。
药品与试剂 加味佛手散胶囊(西南大学中药研究所提供, 批号: 20145202);阿魏酸原料药(批号: QZ-100427, 纯度98%)、川芎嗪原料药(批号: QZ-100511, 纯度98%)、延胡索乙素原料药(批号: QZ-091224, 纯度98%)均购于南京泽朗有限责任公司; 非那西丁(批号: E3M0I)、对乙酰氨基酚(批号: 100018-201610)、甲苯磺丁脲(批号: 100500-200801)、4-羟基甲苯磺丁脲(批号: 1-PSB-27-2)、右美沙芬(批号: KC201003)、去甲右美沙芬(批号: 1531-23-3)、咪达唑仑(批号: FE101512-01)、1-羟基咪达唑仑(批号: FN101512-07)、氯唑沙宗(批号: 201302)、6-羟基氯唑沙宗(批号: 6-QFY-28-2)、卡马西平(批号: 201105)、α-萘黄酮(批号: AO222928)、磺胺苯吡啶(批号: 01022)、奎尼丁(批号: 1308376)、酮康唑(批号: 11205)等均购自天津一方科技有限公司; 还原型辅酶Ⅱ (批号: SLBJ6612V)购自美国Sigma公司; BCA蛋白测定试剂盒(碧云天生物技术研究所, 批号: P0012);苏木精(批号: 39Q10130)、伊红(批号: DH121)均购自北京鼎国昌盛生物技术有限责任公司; 20供体雌性混合大鼠肝微粒体(批号: RHSO)购自瑞德肝脏疾病研究(上海)有限公司; 甲醇为质谱纯, 购自美国Fisher公司; 所有其他溶剂和化学试剂均为分析纯或以上。
动物 SD雌性大鼠, SPF级, 体重(220 ± 20) g, 由重庆市中药研究院实验动物研究所提供, 生产许可证号SCXD (渝) 2012-0006, 实验动物质量合格证号No.0003223。饲养于西南大学药学院/中医药学院SPF级实验动物中心, 使用许可证号SYXK (渝) 2014-0002。大鼠的饲养、繁殖和使用均符合中国《实验动物管理条例》。环境适应性饲养一周后用于实验。本研究中动物实验方案获得西南大学药学院实验动物管理与使用委员会的批准。
色谱和质谱条件[11, 12] 色谱柱为(Agilent Zorbax XDB-C18, 2.1 mm×50 mm, 3.5 μm); 进样量: 10 μL; 检测波长: 280 nm; 流速: 0.45 mL·min-1; 流动相为含0.1%甲酸(A)和甲醇(B), 梯度洗脱程序: 0~0.5 min为98% A, 2% B; 0.5~2.5 min保持不变; 2.5~3.5 min为2% A, 98% B; 3.5~4.0 min, 保持不变; 4.0~5.0 min, 为98% A, 2% B。离子源为电子轰击式离子源(ESI); 扫描方式:多反应监测(MRM); 气帘气体为20 psi (1 psi≈6.9 kPa); 离子喷射电压(IS): 5 kV (ESI+)、-4.2 kV (ESI-); 源内气体1 (Gas 1)和源内气体2 (Gas 2)分别为55和50 psi, 离子源温度为550 ℃。5个探针药物代谢产物和内标的MRM质谱检测参数如表 1所示。
| Table 1 The multiple reaction response monitoring spectrum parameter of the 5 probe substrates and internal standard |
体外抑制实验 参照文献[13], 建立200 µL的0.1 mol·L-1磷酸盐缓冲液(pH 7.4)孵育体系:包含0.3 g·L-1大鼠肝微粒体蛋白50 µL, 5种混合探针底物[非那西丁10 µmol·L-1 (CYP1A2), 右美沙芬2.5 µmol·L-1 (CYP2D2), 甲苯磺丁脲100 µmol·L-1 (CYP2C6), 咪达唑仑5 µmol·L-1 (CYP3A1/2), 氯唑沙宗20 µmol·L-1 (CYP2E1)] 25 µL, 系列浓度的阳性抑制剂或各实验药物。平行设置药物组、阳性抑制剂组和空白对照组。药物组阿魏酸、川芎嗪、延胡索乙素的系列浓度为0.25、0.5、1、5、10、50、100和500 µmol·L-1, 加味佛手散胶囊的系列浓度为1.6、3.2、6.4、32、64、320、640和3 200 mg·L-1。阳性抑制剂α-萘黄酮(α-naphthoflavone, CYP1A2)的浓度为0.000 1、0.001、0.01、0.05、0.4、1.2、3.6、10.8和21.6 µmol·L-1, 磺胺苯吡啶(sulfaphenazole, CYP2C6)的浓度为0.000 1、0.001、0.01、0.1、0.2、0.8、2.4、7.2和21.6 µmol·L-1奎尼丁(quinidine, CYP2D2)的浓度为0.000 2、0.002、0.01、0.1、0.4、1.0和3 µmol·L-1。酮康唑(ketoconazole, CYP2E1, CYP3A1/2)的浓度为0.006、0.06、0.18、0.54、1.62、4.86、14.58和58.32 µmol·L-1。每个浓度组设3个平行样品。空白对照组不加受试药或阳性抑制剂。加入1 mmol·L-1 NADPH 100 µL启动反应, 将各组于37 ℃孵育15 min后加入含有内标75 ng·mL-1卡马西平的冰甲醇400 µL终止反应。10 000×g离心5 min, 取上清液, 应用“Cocktail”探针法以及LC-MS/MS法分析各探针底物代谢产物的生成量。
体内诱导实验 取雌性SD大鼠90只, 随机分成9组, 每组10只。分为0.5% CMC-Na溶液10 mg·kg-1·d-1空白对照组、苯巴比妥80 mg·kg-1·d-1阳性诱导剂对照组、阿魏酸100 mg·kg-1·d-1组、川芎嗪50 mg·kg-1·d-1组、延胡索乙素30 mg·kg-1·d-1组、加味佛手散原料药180 mg·kg-1·d-1组、加味佛手散胶囊三剂量组(45、90、180 mg·kg-1·d-1组, 给药剂量参考前期药效学实验)[11, 12], 灌胃给药, 每日1次, 连续给药28天。末次给药后将动物禁食12 h, 水合氯醛麻醉, 剪断腹股沟动脉以排出大鼠体内血液, 取出肝脏, 超速离心法制备肝微粒体[16]。配制200 µL的0.1 mol·L-1磷酸盐缓冲液(pH 7.4)孵育体系:包含0.3 g·L-1大鼠肝微粒体蛋白50 µL (分别含空白对照组、阳性对照组和各实验药物组大鼠的肝微粒体蛋白), 5种混合探针底物50 µL (非那西丁10 µmol·L-1, 右美沙芬2.5 µmol·L-1, 甲苯磺丁脲100 µmol·L-1, 咪达唑仑5 µmol·L-1, 氯唑沙宗20 µmol·L-1)。其中空白对照组采用灌胃0.5% CMC-Na溶液的大鼠肝微粒体蛋白, 阳性对照组采用灌胃苯巴比妥溶液的大鼠肝微粒体蛋白, 各实验药物组则采用相应给药的大鼠肝微粒体蛋白。按体外抑制实验项下的方法, 自“加入1 mmol·L-1 NADPH 100 µL启动反应”起, 依法测定各探针底物的代谢产物生成量。
肝脏组织形态学观察 参照文献[14], 各组实验动物取血处死后立即解剖摘取肝脏, 肉眼观察肝脏表面病理变化, 并固定于4%多聚甲醛溶液中, 梯度酒精脱水, 二甲苯透明, 石蜡包埋, 4~5 µm切片, 苏木精和伊红(hematoxylin and eosin, HE)染色, 中性树胶封片, 荧光显微镜下观察肝组织结构及炎症细胞浸润等症状。
数据处理
体外抑制实验 通过测定探针底物的代谢产物相对生成量来确定酶的相对活性。按Erel = Ci/C0×100%和抑制率% = 1-Erel, 计算受试药物作用下CYP酶的相对活性(Erel)和抑制率, C0为空白对照组孵育反应后代谢产物生成量, Ci为阳性抑制剂或受试药物组孵育反应后代谢产物生成量[12, 15]。
用GraphPad Prism version 5.0 (GraphPad software Inc, CA, USA)软件将酶活性剩余百分数Erel对药物浓度的Log值作图, 由抑制曲线得到IC50值。
体内诱导实验 由式1计算受试药物作用下探针底物的代谢产物生成速率(V), 作为各酶活性指标, 式1中C为孵育反应后代谢产物生成量(µmol·L-1), Cprotein为微粒体蛋白的质量浓度(g·L-1), t为孵育时间(min)[14]。
| $ V\left(\mathrm{mmol} \cdot \mathrm{g}^{-1} \cdot \min ^{-1}\right)=\frac{C \times 1000}{C_{\mathrm{protein}} \times t} $ | (1) |
采用SPSS Statistics 17.0统计学软件, 对照组和各给药组之间差异的比较用T-Test检验。实验数据均以x±s表示, P < 0.05为差异有显著性意义。
结果 1 加味佛手散胶囊及其组分体外对大鼠肝脏CYP450酶的抑制作用由阳性抑制剂或受试药物对5种CYP450酶亚型的抑制曲线计算得到IC50值。按照通用的CYP酶抑制剂强度的分级规则[16], 若IC50 > 10 µmol·L-1为弱抑制剂; 1 µmol·L-1 < IC50 < 10 µmol·L-1为中等强度抑制剂; IC50 < 1 µmol·L-1为强抑制剂。首先用已知的阳性抑制剂验证大鼠肝微粒体孵育体系。得到的阳性抑制剂IC50值均小于1.5 µmol·L-1, 表现出明显的抑制作用, 表明所用的孵育体系可以满足CYP酶抑制活性评价的要求。
在最高抑制浓度时(单味药为500 µmol·L-1, 复方加味佛手散胶囊为3 200 mg·L-1), 阿魏酸和川芎嗪对5种CYP450亚酶, 延胡索乙素对CYP1A2、CYP2C6、CYP2D2、CYP2E1, 加味佛手散胶囊对CYP1A2、CYP2C6的抑制率均未超过50%。而延胡索乙素对CYP3A1/2, 加味佛手散胶囊对CYP2D2、CYP2E1、CYP3A1/2的抑制率均大于50% (表 2)。
| Table 2 Inhibitory effects of JWFSSC (3 200 mg·L-1) and its active components (500 µmol·L-1) on CYP isoforms (n = 3, x±s). FA: Ferulic acid; LZ: Ligustrazine; THP: Tetrahydropalmatine; JWFSSC: Jiawei Foshou San capsule |
由抑制曲线计算得到IC50值, 阿魏酸和川芎嗪对5种CYP450亚酶, 延胡索乙素对CYP1A2、CYP2C6、CYP2D2、CYP2E1的IC50值大于500 µmol·L-1, 加味佛手散胶囊对CYP1A2、CYP2C6的IC50值大于3 200 mg·L-1, 在临床上产生明显酶抑制作用的可能性较小。延胡索乙素对CYP3A1/2的IC50为7.29 µmol·L-1, 显示延胡索乙素为CYP3A1/2的中等强度抑制剂。加味佛手散胶囊对CYP2D2、CYP2E1、CYP3A1/2的IC50分别为229.3、361.9和274.6 mg·L-1, 均远小于加味佛手散胶囊在孵育液中最高浓度的一半1 600 mg·L-1, 提示加味佛手散胶囊对CYP2D2、CYP2E1、CYP3A1/2的酶活性可能有抑制作用(图 1)。
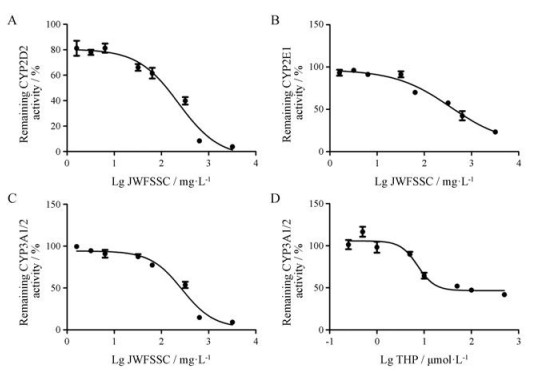
|
Figure 1 Inhibitory curves of JWFSSC on CYP2D2 (A), CYP2E1 (B), CYP3A1/2 (C) and THP on CYP3A1/2 (D). n = 3, x±s |
连续28天给药后, 实验结果显示阳性对照组5种CYPs亚型的酶活性与空白对照组中各酶活性比较, 其P < 0.05, 存在显著性差异, 证明本实验中采用评价大鼠肝药酶P450的诱导作用方法是可靠的。
与空白对照组比较, FA、LZ、THP 3个单体成分组5种CYPs亚型的酶活性均无显著性差异(P > 0.05);加味佛手散胶囊180 mg·kg-1·d-1组和加味佛手散原料药组CYP1A2、CYP2C6、CYP3A1/2的酶活性显著升高(P < 0.01);加味佛手散胶囊45 mg·kg-1·d-1组、90 mg·kg-1·d-1组上述5种CYPs亚型的酶活性均无显著性差异(P > 0.05); 3个剂量的加味佛手散胶囊组CYP2D2、CYP2E1的酶活性均无显著性差异(P > 0.05)。同加味佛手散原料药配伍合用(FA+LZ+THP)组比较, 加味佛手散胶囊180mg·kg-1·d-1组5种CYPs亚型的酶活性均无显著性差异(P > 0.05) (图 2)。

|
Figure 2 The in vivo effects of JWFSSC and its components on CYP1A2 (A), CYP2C6 (B), CYP2D2 (C), CYP2E1 (D), CYP3A1/2 (E) in rat liver microsomes. n = 10, x±s. *P < 0.05, **P < 0.01 vs vehicle control |
肝组织病理切片HE染色结果(图 3)显示:连续给药28天后, 空白对照组(图 3A)肝脏组织结构完整, 肝小叶轮廓清晰, 肝细胞索状排列整齐, 边缘清晰, 核大而圆, 沿中央静脉呈整齐放射性排列。总体观察, 肝细胞形态正常。FA组(100 mg·kg-1·d-1, 图 3B)和LZ组(50 mg·kg-1·d-1, 图 3C)的肝组织结构基本正常, 未见明显肝细胞变性、坏死等病理变化。THP组(30 mg·kg-1·d-1, 图 3D)病理损伤较大, 肝小叶界限不清, 肝细胞排列紊乱, 边缘模糊, 细胞核大小不均, 可见炎细胞浸润。加味佛手散原料药(FA+LZ+THP)组(180 mg·kg-1·d-1, 图 3E)和加味佛手散胶囊组(45、90和180 mg·kg-1·d-1, 图 3F-H)有炎症细胞浸润, 但较延胡索乙素组, 病变程度普遍较轻。随着加味佛手散胶囊给药剂量的增大, 其病变程度未呈现增大趋势。
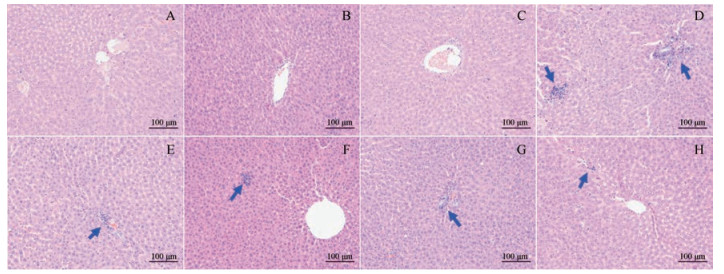
|
Figure 3 The influences of JWFSSC and its components on the hepatocyte morphology in rat liver tissues (×200, HE). The liver sections from female Sprague-Dawley rats treated with various doses of the drugs a relatively appearance. For each dosage group, three sections were produced, and the microphotos show the representative foci in the vehicle control rats (A), 100 mg·kg·d-1 FA-treated rats(B), 50 mg·kg·d-1 LZ-treated rats (C), 30 mg·kg·d-1 THP-treated rats (D), 180 mg·kg·d-1 (FA+LZ+THP)-treated rats (E), and 45 mg·kg·d-1 (F), 90 mg·kg·d-1 (G), and 180 mg·kg·d-1 (H) JWFSSC-treated rats. The tissues were fixed in paraformaldehyde solution and stained with HE. Some inflammatory cell infiltration was observed, as indicated with arrow |
体外单药实验结果显示, 阿魏酸和川芎嗪在大鼠肝微粒体CYP450中引起酶抑制作用的可能性比较小, 其结果与同类研究报道相符[17, 18]。本实验结果延胡索乙素对大鼠肝微粒体CYP3A1/2的酶活性有较强的抑制作用, 对CYP1A2、CYP2C6、CYP2D2、CYP2E1无明显的抑制作用。然而有报道延胡索乙素对人肝微粒体CYP2D6的酶活性有抑制作用[19], 推测其原因, 可能是动物种属差异所致。复方实验结果显示, 阿魏酸、川芎嗪、延胡索乙素单独给药对大鼠肝微粒体CYP2D2、CYP2E1均无抑制作用, 而3种药物的复方加味佛手散胶囊给药后有抑制作用。这一现象再次表明中药复方配伍后给药与单味给药相比, 其药代动力学过程可能会发生变化[20, 21]。另外, 延胡索并非传统的有毒中药, 但是左旋延胡索乙素(左旋四氢帕马丁)有一定的肝脏毒性。已有文献报道左旋延胡索乙素在临床上应用, 有儿童出现抑制神经中枢、呼吸系统等不良反应, 成年人常规应用也可能引起急性或者慢性肝炎[22-24]。国家食品药品监督管理局也要求修订含左旋延胡索乙素药品处方药说明书和非处方说明书, 并规定肝病患者慎用含该成分的制剂。目前其肝毒性的机制尚不清楚, 或许该物质对肝细胞具有直接毒性, 也可能与病人的特异质反应有关[25]。本实验加味佛手散胶囊中延胡索乙素采用的是消旋体, 也出现了肝损伤病理变化。目前还未见关于右旋延胡索乙素肝毒性的报道。后续研究将考察右旋延胡索乙素的肝脏毒性作用, 及其作为加味佛手散胶囊制剂的备选原料。
体内实验中延胡索乙素与阿魏酸、川芎嗪3种药物合用同延胡索乙素单独给药比较, 肝损伤程度有所减轻, 表明配伍阿魏酸、川芎嗪后, 能显著降低延胡索乙素不良反应; 而且配伍复方能显著激发CYP1A2、CYP2C6、CYP3A1/2的酶活性, 加快延胡索乙素单用在肝脏的代谢, 减少延胡索乙素对肝细胞形态的损伤, 这也印证了药效学研究复方配伍的合理性[14]。有关加味佛手散胶囊的肝脏毒性作用, 有待采用严格规范的GLP实验进一步验证。相同剂量的加味佛手散胶囊与加味佛手散原料药均对CYP1A2、CYP2C6、CYP3A1/2的酶活性具有诱导作用, 并且二者的酶活性比较没有显著性差异, 提示制剂中的辅料对酶活性无影响。作者还观察到加味佛手散胶囊对CYP3A1/2酶活性既表现出体外抑制效应也表现出体内诱导效应, 此现象也有文献[26]报道。推测其原因可能是体外实验是单次给药, 体内实验则是多次给药, 大鼠个体具有反馈调节机制。另外, 动物种属差异可能会导致药物的代谢过程在人和大鼠身上出现不同[27], CYPs各种亚酶在不同组织器官内的表达量也可能存在差异。大鼠的诱导数据可能有助于解释大鼠的多剂量PK-PD模型, 但其结果不能完全用于模拟人的反应, 而人类肝细胞实验的结果可以被认为是预测人类CYP诱导的决定性因素。因此, 下一步将进行基于人原代肝细胞的诱导评价实验。
基于上述结果可知, 加味佛手散胶囊临床使用如果与其他经CYP2D2、CYP2E1酶代谢的药物同时使用, 可能使该药作用效果增强, 作用时间延长, 联合用药时应适当减少用药剂量; 如果与其他经CYP1A2、CYP2C6酶代谢的药物同时使用, 则可能使该药作用效果减弱, 作用时间缩短, 联合用药时应适当增加用药剂量。
| [1] | Xing HJ, Wang HB, Sun G. Antioxidant response, CYP450 system, and histopathological changes in the liver of nitrobenzene-treated drakes[J]. Res Vet Sci, 2013, 95: 1088–1093. DOI:10.1016/j.rvsc.2013.08.002 |
| [2] | Hu DH, Wang YG, Chen ZW, et al. Effect of compound Danshen Dripping Pills on rat hepatic cytochrome P450[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2013, 27: 678–684. |
| [3] | Venkatakrishana K, von Moltke LL, Obach RS, et al. Drug metabolism and drug interactions: application and clinical value of in vitro models[J]. Curr Drug Metab, 2003, 4: 423–459. DOI:10.2174/1389200033489361 |
| [4] | Bertelsen KM, Venkatakrisnan K, von Moltke LL, et al. Apparent mechanism based inhibition of human CYP2D6 in vitro by paroxetine: comparison with fluoxetine and quinidine[J]. Drug Metab Dispos, 2003, 31: 289–293. DOI:10.1124/dmd.31.3.289 |
| [5] | Zhu GX, Wang YG, Li F, et al. Study on the effect s of Radix Adenophorae co-administrated with Veratrum nigrum L. on cytochrome P450 subtype enzymes activities of rats by cocktail approach using probe drugs[J]. Chin J Pharmacovigil (中国药物警戒), 2013, 10: 257–268. |
| [6] | Xu XY. Pharmacology of Chinese Materia Medica (中药药理学)[M]. Beijing: China Press of Traditional Chinese Medicine, 2010: 166-168. |
| [7] | Xu XY, Chen WH, Ye L, et al. Effect of sodium ferulate and total glucosides in paeony on tumor growth and expression of vascular endothelial growth factor and proliferating cell nuclear antigen in H 22 mice[J]. Chin Tradit Herb Drugs (中草药), 2007, 38: 570–573. |
| [8] | Tang Q, Shang FH, Wang XC, et al. Combination use of ferulic acid, ligustrazine and tetrahydropalmatine inhibits the growth of ectopic endometrial tissue: a multi-target therapy for endometriosis rats[J]. J Ethnopharmacol, 2014, 151: 1218–1225. DOI:10.1016/j.jep.2013.12.047 |
| [9] | Wang J, Yuan Z, Zhao H, et al. Ferulic acid promotes endothelial cells proliferation through up-regulating cyclin D1 and VEGF[J]. J Ethnopharmacol, 2011, 137: 992–997. DOI:10.1016/j.jep.2011.07.019 |
| [10] | Yang Y, Wang XC, Chen G, et al. Research of therapeutical effect and immunologic mechanism of Jiawei Foshou San on model rats of endometriosis[J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 3001–3006. |
| [11] | He F, Bi HC, Xie ZY, et al. Rapid determination of six metabolites from multiple cytochrome P450 probe substrates in human liver microsome by liquid chromatography/mass spectrometry: application to high-throughput inhibition screening of terpenoids[J]. Rapid Commun Mass Spectrom, 2007, 21: 635–643. DOI:10.1002/(ISSN)1097-0231 |
| [12] | Shang FH, Feng S, Chen Q, et al. In vitro inhibitory effects of Jiawei Foshou San capsule on activity of cytochrome P450 enzymes in rat and human liver microsomes[J]. Acta Pharm Sin (药学学报), 2016, 51: 926–930. |
| [13] | Yan JJ, He X, Feng S, et al. Up-regulation on cytochromes P450 in rat mediated by total alkaloid extract from Corydalis yanhusuo[J]. BMC Complement Altern Med, 2014, 14: 306–314. DOI:10.1186/1472-6882-14-306 |
| [14] | Shang FH, Feng S, Zhang FY, et al. Effect of Jiawei Foshou San and its compatibility on hepatic P450 enzyme activity and hepatocyte morphology in rats[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 2030–2036. |
| [15] | Zhong YH, Shen GL, Yuan H, et al. Evaluation of cytochrome P450 inhibition and induction by psoralen and isopsoralen in vitro[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2012, 26: 522–528. |
| [16] | Deng J, Shao J, Markowitz JS, et al. ABC transporters in multi-drug resistance and ADME-Tox of small molecule tyrosine kinase inhibitors[J]. Pharm Res, 2014, 31: 2237–2255. DOI:10.1007/s11095-014-1389-0 |
| [17] | Ai CH, Sun HX, Li H, et al. In vitro inhibition of cytochrome P450 activities by active constituents of Chinese herbal drugs[J]. Chin Pharmacol Bull (中国药理学通报), 2011, 27: 519–523. |
| [18] | Tan Y, Zhuang XM, Shen GL, et al. Investigation of metabolic kinetics and reaction phenotyping of ligustrazin by using liver microsomes and recombinant human enzymes[J]. Acta Pharm Sin (药学学报), 2014, 49: 374–379. |
| [19] | Sun SY, Wang YQ, Li LP, et al. Stereoselective interaction between tetrahydropalmatine enantiomers and CYP enzymes in human liver microsomes[J]. Chirality, 2013, 25: 43–47. DOI:10.1002/chir.v25.1 |
| [20] | Jiang B, Cai F, Gao SH, et al. Induction of cytochrome P450 3A by Shexiang Baoxin pill and its main components[J]. Chem Biol Interact, 2012, 195: 105–113. DOI:10.1016/j.cbi.2011.12.001 |
| [21] | Yan R, Wang Y, Shen WJ, et al. Comparative pharmacokinetics of dehydroevodiamine and coptisine in rat plasma after oral administration of single herbs and Zuojinwan prescription[J]. Fitoterapia, 2011, 82: 1152–1159. DOI:10.1016/j.fitote.2011.07.012 |
| [22] | Li D, Han YL, Yu T, et al. In vitro inhibition of Huanglianjiedu Decoction on 6 cytochrome P450 isoforms in human liver microsomes[J]. Chin J Chin Pharmacol Ther, 2012, 17: 131–136. |
| [23] | Li L, Ye M, Bi K, Guo D. Liquid chromatography-tandem mass spectrometry for the identification of L-tetrahydropalmatine metabolites in Penicillium janthinellum and rats[J]. Biomed Chromatogr, 2006, 20: 95–100. DOI:10.1002/(ISSN)1099-0801 |
| [24] | Wang C, Zhou J, Wang S, et al. Shotgun approach based comparative proteomic analysis of levo-tetrahydropalmatine-induced apoptosis in hepatocytes[J]. Toxicol Lett, 2010, 194: 8–15. DOI:10.1016/j.toxlet.2010.01.014 |
| [25] | Chen XY, Huang GH, Ma J, et al. Attaching importance to liver injury caused by Chinese herbal medicine[J]. Chin J Gastroenterol Hepatol (胃肠病学和肝病学杂志), 2008, 7: 607–610. |
| [26] | Zhang YL, Cui YQ, Wang XS, et al. Experimental study on effect of Astragalus granules and Astragalus injection on enzymatic activities of CYP1A2, CYP2D and CYP2C[J]. Chin Pharmacol Bull (中国药理学通报), 2013, 29: 512–519. |
| [27] | Martignoni M, Groothuis GM, de Kanter R. Species different between mouse, rat, dog, monkey and human CYP-mediated drug metabolism, inhibition and induction[J]. Expert Opin Drug Metab Toxicol, 2006, 2: 875–894. DOI:10.1517/17425255.2.6.875 |
 2019, Vol. 54
2019, Vol. 54


