2. 上海医药工业研究院, 上海 200437
2. Shanghai Institute of Pharmaceutical Industry, Shanghai 200437, China
固体化学药物的多晶型现象是一种物质普遍存在的自然现象, 多晶型药物的化学本质是一样的, 但其理化性质可能是不同的[1]。多晶型的这种理化性质差异不仅影响药物的稳定性、溶解度、溶出度等理化性质, 也会不同程度地影响药物临床应用时的生物利用度, 从而影响药物治疗效果[2-5]。对已发现化学药物的不同晶型进行生物活性评价, 是晶型药物研究的重要内容, 也是确定优势药物晶型临床作用的关键科学依据[6]。晶型研究对提高药物稳定性、控制药品质量、保证药物的治疗效果有重要意义[7]。
异丙双酚(图 1)是西安力邦制药有限公司研制的临床拟用于抗癫痫和抗惊厥[8, 9], 静脉注射用于治疗癫痫大发作和癫痫持续状态的一类新药(已获批临床2016L09980, 正在进行Ⅰ期临床)。其主要作用机制是通过变构调节增强GABAA受体电流, 使细胞膜产生超极化来降低神经细胞的兴奋性, 抑制神经元放电而发挥作用。异丙双酚有3种晶型, 其中有一种晶型是溶剂化物[10], 一般不适用作为药用晶型, 本研究将异丙双酚适合药用的两种晶型制成普通片剂, 并利用HPLC-MS/MS建立了异丙双酚在比格犬血浆中的测定方法[11-13], 分析了异丙双酚两种晶型片剂口服给药后的药代动力学参数, 为异丙双酚固体口服制剂研究提供参考。
|
Figure 1 Structure of dipropofol |
药品与试剂 异丙双酚原料(批号: 12082301, 西安力邦制药有限公司提供)、异丙双酚晶型Ⅰ及Ⅱ原料(批号: 1304211, 1304212, 西安力邦制药有限公司提供)、异丙双酚晶型Ⅰ及Ⅱ片剂(批号: 201307181, 201307182, 100 mg/片, 自制)、甲酸铵、甲醇和乙腈(均为色谱纯, 购自MERCK公司)、苯巴比妥钠(批号: 1222-9602, 国家麻醉品实验室提供)、微晶纤维素(批号: 60C3, 购自日本旭化成株式会社)、无水乳糖(批号: 1320016517, 购自美国KERRY公司)、羧甲淀粉钠(批号: E2562, 购自法国ROQUETTE公司)、硬脂酸镁(批号: 20120201, 购自安徽山河药用辅料股份有限公司)、十二烷基硫酸钠(批号: 20130518, 购自国药集团化学试剂有限公司)。
实验动物 Beagle犬(雌雄各半), 体重约10 kg, 由上海甲干生物科技有限公司提供。实验动物质量合格证号: 2010002800606, 动物饲养在上海医药工业研究院药理评价研究中心动物房, 所做实验获得了上海医药工业研究院实验动物管理和福利、伦理委员会批准。
仪器 TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司)、美国戴安公司Ultimate3000液相色谱系统和AB公司4000 Q-Trap型串联质谱仪(配有ESI源)、压片机DP50 (上海天凡药机制造厂)。
片剂的处方及制备 片剂处方的质量分数分别为:异丙双酚晶型Ⅰ/Ⅱ 30%、微晶纤维素(MCC101) 40%、无水乳糖18%、羧甲淀粉钠6%、硬脂酸镁1%、十二烷基硫酸钠5%, 采用粉末直接压片法制片。
溶出度 参照异丙双酚的特性, 以醋酸-醋酸钠(pH 4.5)缓冲液为介质, 每篮900 mL溶出介质, 37 ℃, 75 r·min-1, 30 min后取出溶液, 过滤出10 mL, 20 mL容量瓶定容, 为供试品。精密称取对照品10 mg, 置于100 mL量瓶中, 加10 mL乙醇溶解, 用溶出介质定容至100 mL。后取出5 mL, 定容至50 mL, 为对照品。分别测定供试品与对照品在275 nm处的吸光度, 每片溶出量不少于85%。
溶液配制 异丙双酚贮备液:精密称取异丙双酚适量, 用甲醇配制成1 mg·mL-1的异丙双酚贮备液, 于4 ℃冰箱内保存。使用时用流动相将其稀释成所需浓度。苯巴比妥钠(内标)贮备液:精密称取苯巴比妥钠适量, 用甲醇配制成1 mg·mL-1的贮备液, 于4 ℃冰箱内保存。使用时用流动相将其稀释成所需浓度。
测定条件 色谱条件为, 色谱柱: Kromasil® C18 (150 mm×2.1 mm), 柱温: 25 ℃, 进样体积: 4 µL, 流动相比例为10 mmol·L-1甲酸铵水溶液:乙腈=15:85, 0.3 mL·min-1流速洗脱。质谱条件为, 扫描方式: MRM, ESI-, 用于定量分析的离子对为m/z: 353.2/323.0 (异丙双酚), 230.9/188.0 (苯巴比妥钠, 内标)。
血浆样品处理 空白血浆处理方法为精密吸取血浆50 µL, 加入50%甲醇-水2.5 µL和甲醇150 µL, 涡悬器涡悬3 min沉淀蛋白, 13 000 r·min-1离心5 min, 取上层有机相, 0.22 µmol·L-1微孔滤膜过滤, 取滤液4 µL进行HPLC-MS/MS分析。血浆样品处理方法为精密吸取血浆50 µL, 加入50%甲醇-水2.5 µL、内标溶液(2 µg·mL-1) 5 µL和甲醇150 µL, 按“空白血浆处理”方法处理, 取样4 µL进行HPLC-MS/MS分析。
方法专属性考察 考察比格犬空白血浆、空白血浆单独加异丙双酚及内标和给药后1 h比格犬血浆的色谱图, 评估比格犬空白血浆对异丙双酚的测定是否存在干扰。
方法线性、准确度和精密度 该方法的线性是以被测物异丙双酚的峰面积与内标物峰面积比值为纵坐标(y), 被测物在血浆样品中的浓度为横坐标(x), 进行线性回归, 并以浓度平方的倒数(1/c/c)为加权系数, 求得测定效应与浓度的回归方程。日内准确度和精密度通过在同一天内测定3个浓度, 每个质控样品各5次来确定。日间准确度和精密度通过连续测定3天3个浓度各5个质控样品, 每天1次来确定。准确度和精密度分别由REC和RSD来表示。
方法回收率和基质效应 方法回收率通过配制低、中、高3种不同浓度异丙双酚的血浆样品, 按照血浆样品处理方法处理, 进行HPLC-MS/MS分析, 记录峰面积, 与相应浓度异丙双酚质控样品所得到的峰面积相比, 二者的比值即为回收率。基质效应通过测定空白血浆上清液溶解的异丙双酚峰面积和流动相溶解的异丙双酚峰面积, 二者面积之比即为基质效应。
稳定性 样品处理前将质控样品低、中、高浓度分别室温放置4 h、长期放置(-40 ℃, 6周)、反复冻融3次后, 按质控样品测定方法测定峰面积, 并与制备后直接进样的对应质控样品测定峰面积相比。自动进样器稳定性(4 ℃)是将制备好但未进样的样品在液相进样盘内放置24 h后再进样测定峰面积, 与处理后直接进样的样品对应浓度的峰面积相比。
稀释 血浆样品经10、100倍稀释后, 测定其浓度与理论浓度的偏差。
两种异丙双酚晶型片剂的药动学研究 Beagle犬6只(雌雄各半), 随机分为2组, 每组3只, 给药前禁食12 h, 自由饮水, 20 mg·kg-1的剂量口服给予异丙双酚晶型Ⅰ和Ⅱ, 于给药后0.167、0.5、1、1.5、2、2.5、3、4、6、8和12 h时前肢静脉采血0.5 mL。给药间隔一周, 每只动物分别给予另一种异丙双酚晶型, 每种晶型各6只动物。所采血液样品置于肝素抗凝管中, 8 000 r·min-1离心5 min, 分离血浆, 置于-40 ℃冰箱保存, 待测。超出线性范围的样品用犬空白血浆稀释。药代动力学参数由DAS3.0药动学软件采用非房室模型计算获得, 用Graphpad 6软件对拟合的药代参数进行统计学分析。
结果 1 片剂质量检查异丙双酚晶型Ⅰ和Ⅱ片剂外观色泽均匀, 片重、硬度、脆碎度及药物含量均符合普通片剂的质量要求。晶型Ⅰ和Ⅱ片剂溶出度分别为88.51%和90.31%, RSD分别为15.47%和14.94%, 且比较二者溶出能力, 晶Ⅱ比晶Ⅰ高1.8%。
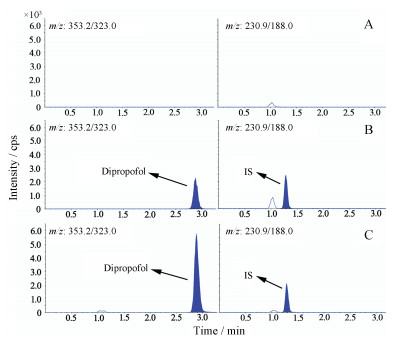
2 比格犬血浆异丙双酚含量测定的方法学考察 2.1 特异性异丙双酚和内标的保留时间分别为2.88和1.29 min。在保留时间范围内均没有内源性物质或其他物质的干扰, 基线噪音较小, 可满足定量测定要求(图 2)。
|
Figure 2 HPLC chromatograms of biological samples with dipropofol. A: Blank plasma; B: Standard solution; C: Plasma sample in 1 hour. IS: Internal standard |
该方法标准曲线的线性范围为10~5 000 μg·L-1, 效应与浓度的回归方程为y = 2.974×10-3x-5.500×10-3, 相关系数为0.999, 最低检测限10 μg·L-1。日内准确度97.1%~103.2%, 精密度为8.9%~12.7%。日间准确度为97.3%~102.1%、精密度为8.7%~12.3%。
2.3 回收率和基质效应异丙双酚在低、中、高3个浓度条件下的回收率分别为(104.1 ± 12.0) %、(106.4 ± 11.9) %和(105.3 ± 12.4) %, 其RSD分别为11.5%、11.2%和11.8%;基质效应分别为(95.0 ± 5.67) %、(102.6 ± 10.1) %和(106.8 ± 11.5) %, 其RSD分别为6.0%、9.8%和10.8%。
2.4 稳定性异丙双酚在各种稳定性考察条件下其准确度偏差介于-7.1%~10.7%, 其RSD介于1.4%~9.4%。表明异丙双酚在上述处理及放置条件下稳定, 能够满足本实验中样品测定的要求。
2.5 稀释样品稀释10倍和100倍准确度偏差分别为0.8%和3.3%, RSD分别为6.1%和4.2%, 表明样品在稀释10倍和100倍的条件下是稳定的, 能满足测量要求。
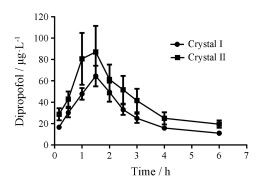
3 两种异丙双酚晶型片剂的吸收比较 3.1 比格犬体内两种异丙双酚晶型片剂的药时曲线比较从图 3可以看出, 异丙双酚两种晶型片剂的达峰时间相同, 晶型Ⅱ的达峰浓度和曲线下面积均大于晶型Ⅰ (8 h和12 h样品测量浓度低于最低检测限, 未在图中显示)。
|
Figure 3 Blood concentration-time curves of dipropofol crystal tablets after oral administration (n = 6, x±s) |
非房室模型拟合的两种异丙双酚晶型片剂的药代动力学参数(表 1), 由表可见两种晶型的代谢参数存在差异。晶型Ⅱ的AUC0-t和Cmax与晶型Ⅰ相比均有显著差异(P < 0.05)。
| Table 1 Main pharmacokinetic parameters of dipropofol crystal tablets in beagle dogs after orally administration. *P < 0.05 vs Crystal Ⅰ |
本文建立了HPLC-MS/MS检测比格犬体内异丙双酚血浆药物浓度的方法, 且该方法峰形好、准确度高、灵敏度高、稳定性可控、检测时间短, 可快速检测比格犬血浆样品中异丙双酚的浓度。目前未见异丙双酚药代动力学的相关研究报道。
比较两种晶型异丙双酚片剂的药代动力学参数, 可以看出:异丙双酚晶型Ⅱ片剂较晶型Ⅰ片剂在比格犬体内的Cmax更高, AUC0-t更大。溶出度结果显示, 晶型Ⅱ片剂比晶型Ⅰ提高1.8%, 这与比格犬体内的Cmax和AUC0-t相一致, 提示动物体内的吸收与片剂的相关性较好, 在一定程度上能反映片剂的体内吸收状况。药物不同晶型的药效差异, 主要体现在吸收过程, 但人体是一个复杂的有机体, 吸收出现差异, 与之对应的分布、代谢、排泄也都会受到一定影响, 进而表现出不同的药效。两种晶型片剂在Cmax和AUC0-t上有显著差异(P < 0.05), 提示两种片剂的吸收过程可能存在一定的差异, 而其他药代动参数无统计学上的差异, 表明两种晶型片剂的这种吸收差距对体内药物整体代谢过程的影响可能不足以表现出参数上的差异。本研究表明两种晶型异丙双酚片剂在比格犬体内药代动力学结果存在一定不同, 提示异丙双酚制剂的药效或与其晶型有密切关系, 在药物固体口服制剂的制备中要注意异丙双酚原料的晶型控制。
| [1] | Threlfall TL. Analysis of organic polymorphs[J]. Analyst, 1995, 120: 2435–2460. DOI:10.1039/an9952002435 |
| [2] | Clas SD. The importance of characterizing the crystal form of the drug substance during drug development[J]. Curr Opin Drug Discov Devel, 2003, 6: 550–560. |
| [3] | Yu LX, Furness MS, Raw A, et al. Scientific considerations of pharmaceutical solid polymorphism in abbreviated new drug applications[J]. Pharm Res, 2003, 20: 531–536. DOI:10.1023/A:1023285627778 |
| [4] | Byrn S, Pfeiffer R, Ganey M, et al. Pharmaceutical solids: a strategic approach to regulatory considerations[J]. Pharm Res, 1995, 12: 945–954. DOI:10.1023/A:1016241927429 |
| [5] | Ma LW, Du W, Zhao CS. Advances in the quantitative analytical methods of drug polymorphism[J]. Acta Pharm Sin (药学学报), 2011, 46: 896–903. |
| [6] | Du GH, Lv Y. Optimal drug polymorphism of solid compound[J]. Chin Pharm J (中国药学杂志), 2010, 45: 5–11. |
| [7] | Fang LH, He GR, Wang HY. Strategy of compound polymorph bioactivity study in early druggability evaluation[J]. Chin Pharm J (中国药学杂志), 2013, 48: 497–500. |
| [8] | Wang RT, Chen T, Hu HJ, et al. Application of dipropofol and its derivatives in the treat of epilepsy: CN, ZL201010160034.9 [P]. 2010-08-08 [2018-10-10]. |
| [9] | Zhang JL, Chen XL, K M, et al. Anticonvulsant effect of dipropofol by enhancing native GABA currents in cortical neurons in mice[J]. Nervous System Pathophysiol, 2018, 120: 1404–1414. |
| [10] | Wang RT, Chen T, Wang WJ. The crystal forms and preparation methods of 3, 3', 5, 5'-tetraisopropyl-4, 4'-diphenyl: CN, ZL201310055828.2 [P]. 2013-07-03 [2018-10-10]. |
| [11] | Shi JM, Han WL, Chen LY, et al. HPLC-MS/MS determination and pharmacokinetic study of propofol in human plasma[J]. Pharm Anal, 2012, 32: 1136–1142. |
| [12] | Sun XQ, Ma JS. Simultaneous determination of carbamazepine and phenobarbital in human plasma by UPLC-MS/MS[J]. China Pharm (中国药师), 2016, 19: 1826–1830. |
| [13] | Lee SH, Park HW, Kim MJ. External validation of pharmacokinetic and pharmacodynamic models of microemulsion and long-chain triglyceride emulsion propofol in Beagle dogs[J]. Vet Pharmacol Ther, 2012, 35: 329–341. DOI:10.1111/jvp.2012.35.issue-4 |
 2019, Vol. 54
2019, Vol. 54


