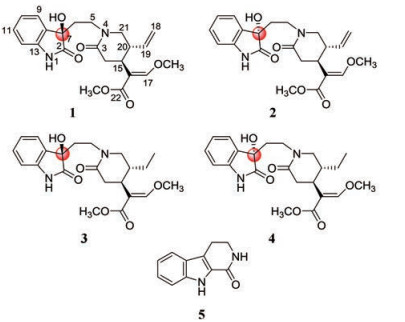
钩藤Uncaria rhynchophylla (Miq.) Jacks.为茜草科(Rubiaceae)钩藤属(Uncaria)植物, 主要分布在广东、广西、云南、贵州、福建、湖南、湖北及江西等地。该植物是传统中药钩藤的主要基源植物之一, 药用部位是带钩的茎枝, 具有息风定惊、清热平肝等功效[1]。关于U. rhynchophylla化学成分的研究, 已有大量报道, 从其药用部位(带钩茎枝)以及叶或根中, 已分离鉴定了包括生物碱、三萜和黄酮等不同结构类型的60余个化合物[2-15]。但是以往研究主要集中在乙醇或甲醇提取物, 很少对水煎物进行研究, 这与钩藤传统以水煎煮为主的使用方法不一致。因此, 作为对常用中药化学成分及其药理活性多样性系统研究的内容之一[16−30], 作者对钩藤水提物的化学成分进行了研究, 重点从化学成分的系统分离鉴定特别是微量成分入手, 以期获得结构多样的化学成分, 为深入阐明钩藤化学成分的多样性特点以及后续药理学评价奠定基础。作为初步结果, 本文报道5个生物碱类微量成分的分离纯化和结构鉴定, 包括2对单萜吲哚生物碱类差向异构体(1/2和3/4), 以及1个β-咔啉类生物碱(5) (图 1)。其中, 化合物1和2为新化合物, 3和4为首次通过非手性方法分离得到新天然产物, 5为首次从钩藤属分离得到。
|
Figure 1 Structures of compounds 1-5 |
化合物1为白色粉末, [α] +63.5 (c 0.29, MeOH), +19.1 (c 0.24, CHCl3)。红外光谱显示其分子结构中存在羟基和/或氨基(3 200~3 500 cm-1)、羰基(1 708和1 617 cm-1)及苯环(1 600和1 502 cm-1)的特征吸收峰。根据(+)-HR-ESI-MS m/z 415.186 9 [M+H]+ (C22H27O6N2计算值415.186 4)和NMR谱数据(表 1), 确定其分子组成为C22H26O6N2。在丙酮-d6中, 该化合物的1H NMR谱显示可归属于1个2-氧吲哚单元的特征信号δH 9.26 (1H, br s, NH-1)、7.37 (1H, br d, J = 7.2 Hz, H-9)、7.21 (1H, dt, J = 1.2, 7.2 Hz, H-11)、7.01 (1H, dt, J = 1.2, 7.2 Hz, H-10)和6.88 (1H, brd, J = 7.2 Hz, H-12); 1个三取代乙烯基单元的信号δH 7.35 (1H, s, H-17); 1个与次甲基相连的乙烯基单元的特征信号δH 5.52 (1H, ddd, J = 7.8, 10.2, 17.4 Hz, H-19)、5.03 (1H, dd, J = 1.8, 17.4 Hz, H-18a)和4.96 (1H, dd, J = 1.8, 10.2 Hz, H-18b); 以及2个甲氧基的信号δH 3.87和3.61。同时, 在δH 3.49~2.09之间, 1H NMR谱还显示可归属于4个亚甲基和2个次甲基的多重峰信号。该化合物的13C NMR和DEPT谱给出与以上单元完全对应的碳共振信号, 以及3个羰基(δC 179.6、169.4和168.0, C-2、C-3和C-22)和1个连氧季碳(δC 75.5, C-7) (表 1)。
| Table 1 NMR spectroscopic data of compounds 1-4 in acetone-d6. Data were measured at 600 MHz for 1H and at 150 MHz for 13C. Proton coupling constants (J) in Hz are given in parentheses. The assignments were based on 1H-1H COSY, HSQC, and HMBC experiments |
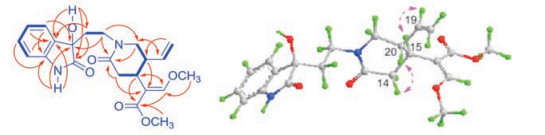
以上数据显示化合物1是1个单萜吲哚生物碱[6-10], 但是与文献中已报道从钩藤中分离鉴定化合物的数据差别显著, 推断该化合物为1个新的单萜吲哚生物碱。通过2D NMR实验对其结构进行了进一步确定。借助HSQC实验和图谱分析, 对1H NMR和13C NMR谱中质子与碳共振信号的对应连接关系进行了准确归属(表 1)。根据1H-1H COSY中质子之间相互偶合的交叉峰信号H2-5/H2-6、H-9/H-10/H-11/H-12、H2-14/H-15/H-20/H2-21和H2-18/H-19/H-20, 确定了1的分子中质子之间存在相互偶合的结构片段(图 2)。在HMBC谱中, NH-1与C-7、C-8和C-13, H2-5与C-7, H2-6与C-2和C-8, H-9与C-7和C-13, H-10和H-12与C-13, H-11与C-12, 以及OH与C-2、C-6和C-7的异核远程相关信号, 结合这些质子和碳的化学位移, 表明1的分子中存在1个羟基取代的2-氧吲哚乙基结构单元(图 2)。另外, 根据H2-5与C-3和C-21, H2-14和H2-21与C-3, H-19与C-21, H-18与C-20, 以及H2-21与C-19的HMBC信号, 结合它们的化学位移, 推断1的分子中存在1个乙烯基取代的环己内酰胺结构单元, 并且其N原子与2-氧吲哚乙基单元的C-5相连。另外, 由H2-14与C-16, H-15与C-17和C-22, H-17与C-15和C-22, 以及2个甲氧基的质子分别与C-17和C-22的HMBC信号, 结合它们化学位移, 推定1的分子中还存在1个甲氧基丙烯酸甲酯单元, 并与己内酰胺结构单元之间通过C-15和C-16之间的碳键连接。因此, 化合物1的平面结构确定为如图 2所示, 具有N-(2-氧吲哚乙基)-哌啶类单萜吲哚生物碱的结构特征。
|
Figure 2 The 1H-1H COSY (thick lines), key HMBC (arrows), and ROESY (double arrows) correlations of compounds 1 and 2 |
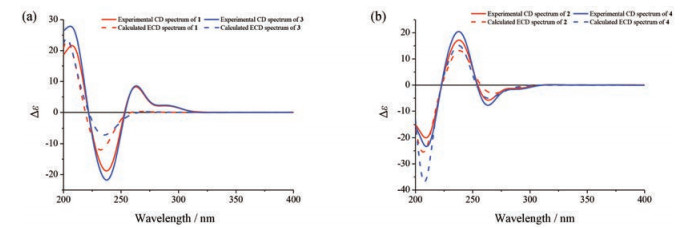
在1的ROESY图谱中, H-14a与H-20及H-15与H-19的NOE信号(图 2), 结合H-14a (dd, J14a, 14b = 17.4 Hz和J14a, 15 = 11.4 Hz)和H-21b (t, J21a, 21b ≈ J14a, 15 ≈ 11.4 Hz)的偶合裂分特征, 表明在丙酮-d6中环己内酰胺结构单元拥有近似椅式构象, H-15与H-20为反式取向。化合物1的平面结构与3-氧-7-羟基-3, 7-裂环钩藤碱[31, 32]的唯一差别是前者结构中的乙烯基单元在后者中被还原为乙基, 它们共有的己内酰胺结构单元的相对构型完全相同。根据生源联系[31-33], 推测在化合物1中己内酰胺结构单元C-15和C-20的绝对构型及C-16和C-17之间双键的几何构型与3-氧-7-羟基-3, 7-裂环钩藤碱的相同。特别是, 在化合物1的CD谱中, 238 nm处显示负Cotton效应(Δε = -18.83), 263和292 nm处显示正Cotton效应(Δε = +8.26和+2.06)。这些Cotton效应以及CD图谱的曲线形状与文献报道(7R)-3-氧-7-羟基-3, 7-裂环钩藤碱[32]的完全一致。进一步比较化合物1的实验CD与量子力学计算ECD曲线(图 3a), 发现二者之间Cotton效应的趋势一致。因此, 化合物1的结构确定为(+)-(7R)-3-氧-7-羟基-3, 7-裂环二氢钩藤碱。
|
Figure 3 (a) The overlapped experimental CD spectra of compounds 1 (red line) and 3 (blue line) and calculated ECD spectra of compounds 1 (red dash) and 3 (blue dash). (b) The overlapped experimental CD spectra of compound 2 (red line) and 4 (blue line), and calculated ECD spectra (red-shifted by 9.5 nm) of compound 2 (red dash) and 4 (blue dash) |
化合物2为白色粉末, [α] +5.7 (c 0.27, MeOH), +0.8 (c 0.26, CHCl3)。其UV、IR和NMR谱与1的非常相似, (+)-HR-ESI-MS给出与化合物1完全相同的分子组成。由此, 推断化合物2是1的同分异构体, 并得到2的2D NMR图谱解析的确证(图 2)。比较二者的NMR谱数据(表 1), 发现化合物2的13C NMR共振信号与1的相应信号之差在实验误差之内(ΔδC ≤ ±0.1); 1的同碳质子H2-5显示为化学不等价但化学位移比较接近的多重峰, 而2的H2-5 (δH 3.46, t, J = 7.8 Hz)呈典型的三重峰。另外, 2的7-OH较1的明显向高场位移ΔδH ≈ 0.10; 1和2的同碳质子H2-21均呈现为化学不等价, 前者的H-21a和H-21b共振信号部分重叠(ΔδH-21a-H-21b ≈ 0.03), 而后者的完全分离(ΔδH-21a-H-21b ≈ 0.07)。特别是, 1H NMR图谱显示两个化合物分子结构中环己内酰胺结构单元上质子的偶合裂分特征和偶合常数没有明显变化, 并且2的ROESY谱也显示H-14a与H-20及H-15与H-19的NOE相关信号(图 2)。因此, 推断化合物2和1拥有相同的环己内酰胺结构单元, 前者是后者的7S差向异构体。在化合物2的CD谱中, 238 nm处显示正Cotton效应(Δε = +17.21), 263和292 nm处显示负Cotton效应(Δε = -5.79和-1.21)。这些Cotton效应特征及CD图谱的曲线形状不但与(7S)-3-氧-7-羟基-3, 7-裂环钩藤碱[32]的一致, 也与理论计算的ECD图谱一致(图 3b)。因此, 化合物2的结构确定为(+)- (7S)-3-氧-7-羟基-3, 7-裂环二氢钩藤碱。
化合物3为白色粉末, [α] +64.0 (c 0.13, MeOH), +30.8 (c 0.16, CHCl3)。根据(+)-HR-ESI-MS m/z 417.201 8 (C22H29O6N2计算值417.202 0)和NMR谱数据(表 1), 确定其分子组成为C22H28O6N2 [M+H]+。该化合物的UV、IR和NMR谱与1和2的相似, 主要差别是1和2的乙烯基单元的NMR信号被3的乙基单元的信号替代。由此, 推断3是3-氧-7-羟基-3, 7-裂环钩藤碱[31, 32], 并得到2D NMR图谱解析的进一步确证。化合物3在甲醇中的CD谱特征与文献报道(7S)-3-氧-7-羟基-3, 7-裂环钩藤碱在同溶剂中[32]的完全一致, 也与理论计算的ECD图谱有一致性(图 3a)。因此, 化合物3的结构鉴定为(+)-(7R)-3-氧-7-羟基-3, 7-裂环钩藤碱。
化合物4为白色粉末, [α] +4.6 (c 0.13, MeOH), +1.4 (c 0.14, CHCl3)。其UV、IR和NMR谱与化合物3的非常相似, (+)-HR-ESI-MS给出与3完全相同的分子组成。比较二者的NMR谱数据(表 1), 发现它们的13C NMR共振信号之差在实验误差之内(ΔδC ≤ ±0.1);化合物4的H2-5和H-21b分别向高场位移ΔδH -0.04和-0.03, 而H-6向低场位移ΔδH +0.03。另外, 4的7-OH较3的明显向高场位移了ΔδH ≈ 0.08。由以上数据, 推断化合物4是3的C-7差向异构体, 并得到2D NMR图谱解析的支持。在化合物4的CD谱中, 238 nm处显示正Cotton效应(Δε = +20.48), 264和292 nm处显示负Cotton效应(Δε = -7.72和-1.52)。这些Cotton效应特征及CD图谱的曲线形状与(7S)-3-氧-7-羟基-3, 7-裂环钩藤碱[32]的完全一致, 也与理论计算的ECD图谱吻合(图 3b)。因此, 化合物4的结构确定为(+)-(7S)-3-氧-7-羟基-3, 7-裂环钩藤碱。
尽管化合物3和4的混合物曾经从钩藤属植物U. salaccensis (U. attenuata)的带钩茎枝的甲醇提取物中分离得到[31, 32], 然而它们是用非手性柱HPLC首次从植物中分离获得。特别是, 文献报道经异钩藤碱转化半合成得到(7R)-和(7S)-3-氧-7-羟基-3, 7-裂环钩藤碱的比旋光值分别为[α]D20+168.6 (c 0.025, CHCl3)和-17.4 (c 0.035, CHCl3)[32], 与化合物3和4的差别巨大, 甚至于出现了符号相反的情况。经反复测定, 确证文献中数据误差过大。本实验测得7R构型的化合物1与3的比旋光值接近, 7S构型的2与4的比旋光值接近; 且4个化合物均具有右旋光特性。根据比旋光值的加和性, 通过简单计算可知, 在1和2中乙烯基取代己内酰胺结构单元对比旋光值的贡献值约为正的28.9度; 而在3和4中乙基取代己内酰胺结构单元对比旋光值的贡献值约为正的29.7度。这些数值均与文献报道在异钩藤碱转化过程中得到的乙基取代己内酰胺结构单元副产物的[α]D20+35.3 (c 0.34, CHCl3)[32]接近, 支持本实验测定结果。
另外, ECD图谱量子力学计算结果显示, 对于(7R)-构型的化合物1和3, 计算ECD图谱与实验测定CD图谱的曲线有一致性, 但是在计算ECD图谱中, 大于250 nm区域几乎观察不到实测CD图谱显示的Cotton效应(图 3a)。然而, 对于(7S)-构型的化合物2和4, 计算ECD图谱与实验测定CD图谱能够达到几乎完美的匹配(图 3b)。分析ECD量子力学计算过程中利用Gaussian 16软件包的GMMX分子构象搜索程序计算得到的最低能量构象(相对能量小于3 kcal·mol-1), 发现(7R)-构型的1和3的最低能量构象分别为48和53个, (7S)-构型的2和4的最低能量构象分别达到97和115个。在CAM-B3LYP/6-31+G (d, p)基组水平, 优化后给出1和3的最低能量构象均为24个, 而2和4的分别为32和38个。可见, (7R)-构型的最低能量构象数目少, 而(7S)-构型的情况正好相反。因此, 认为(7S)-构型化合物2和4的理论计算构象数目多, 能够很好的代表在甲醇溶液中的实际构象; 然而(7R)-构型化合物1和3的理论计算预测构象数目少, 不能完全代表它们在甲醇中的实际构象, 进而导致在大于250 nm区域计算ECD与实测CD曲线的匹配度相对较低。
实验部分AUTOPOL V型旋光测定仪(美国Rudolph公司), Nicolet impact 5700型傅立叶变换红外光谱仪(美国Thermo Electron Corporation公司), JASCO V-650型紫外光谱仪(日本JASCO公司), JASCO J-815型CD测定仪(日本JASCO公司), SYS-600核磁共振仪(美国Varian公司, 以溶剂峰信号为参照), Q Exactive Focus型质谱仪(美国Thermo Fisher Scientific公司)。LC3000型高效液相色谱仪(中国创新通恒有限公司)。Sephadex LH-20 (瑞典Amersham Pharmacia公司), Toyopearl HW-40C凝胶树脂(日本TOSOH公司), AQ-C18反相色谱柱(日本资生堂公司), 柱色谱硅胶(200~300目)及薄层色谱用硅胶GF254 (青岛海洋化工厂生产)。所有试剂若无特别说明, 均购自北京化工厂, 级别为分析纯或色谱纯。
钩藤(带钩茎枝)于2016年8月购自河北安国药材市场, 订购产地为湖南省衡东县, 由中国医学科学院药物研究所马林副研究员鉴定为茜草科钩藤属钩藤(Uncaria rhynchophylla), 标本现存于中国医学科学院药物研究所植物标本室, 标本号为NO. ID-S-2753。
1 提取与分离干燥钩藤(97 kg)经粉碎后, 用水加热回流提取3次, 减压浓缩至干, 得到浸膏。浸膏经HP-20大孔树脂柱色谱分离, 依次用水、50%乙醇和95%乙醇洗脱, 各部分分别收集, 回收溶剂后得到水、50%乙醇和95%乙醇洗脱部分A~C。95%乙醇洗脱部分(100 g)经硅胶柱色谱分离, 以二氯甲烷和甲醇为溶剂, 梯度洗脱, 薄层色谱检测, 合并成分相同流分, 回收溶剂后, 得到20个亚组份Frs.1.1~Frs.1.20。Frs.1.2 (3.45 g)用Sephadex LH-20凝胶柱色谱分离, 石油醚-氯仿-甲醇(5:5:1)洗脱, 得到Frs.1.2.1~Frs.1.2.5。Frs.1.2.2再次用Sephadex LH-20凝胶柱色谱, 石油醚-氯仿-甲醇(5:5:1)洗脱, 得到Frs.1.2.2.1~Frs.1.2.2.3及化合物5 (4.0 mg)。Frs.1.4 (5.3 g)用Sephadex LH-20凝胶柱色谱分离, 用石油醚-氯仿-甲醇(5:5:1, 2:2:1, 0:0:1)依次洗脱, 得到Frs.1.4.1~Frs.1.4.5。Frs.1.4.1用硅胶柱色谱分离, 石油醚-丙酮(8:1~0:1)梯度洗脱, 得到Frs.1.4.1.1~Frs.1.4.1.4。Fr.1.4.1.4经硅胶柱色谱分离, 用石油醚-丙酮(10:1~0:1)梯度洗脱, 得到Fr.1.4.1.4.1和Fr.1.4.1.4.2, 其中Fr.1.4.1.4.2经反相半制备HPLC分离, 以45%甲醇为流动相(2.0 mL·min-1), 得到1 (tR = 66.4 min, 4.3 mg)、2 (tR = 71.8 min, 4.0 mg)、3 (tR = 96.8 min, 2.0 mg)和4 (tR = 103.9 min, 2.0 mg)。
2 结构鉴定化合物1:白色粉末; [α] +19.1 (c 0.24, CHCl3), [α] +63.5 (c 0.29, MeOH); UV (MeOH) λmax (log ε) 206 (2.88), 242 (2.61), 292 (1.49) nm; CD (MeOH): 208 (Δε +21.61), 238 (Δε -18.83), 263 (Δε +8.26), 292 (Δε +2.06) nm; IR νmax 3 274, 2 942, 1 708, 1 617, 1 502, 1 471, 1 439, 1 235, 1 191, 1 146, 1 117, 990, 923, 875, 754, 644 cm-1; 1H NMR (acetone-d6, 600 MHz)、13C NMR (acetone-d6, 150 MHz)数据见表 1。(+)-HR-ESI-MS m/z 415.186 9 [M+H]+ (C22H27O6N2计算值, 415.186 4)。
化合物2:白色粉末; [α] +0.8 (c 0.26, CHCl3), [α] +5.7 (c 0.27, MeOH); UV (MeOH) λmax (log ε) 206 (2.84), 242 (2.56), 292 (2.47) nm; CD (MeOH): 209 (Δε -20.02), 238 (Δε +17.21), 263 (Δε -5.79), 292 (Δε -1.21) nm; IR νmax 3 221, 1 702, 1 619, 1 502, 1 470, 1 436, 1 350, 1 334, 1 301, 1 231, 1 189, 1 145, 1 117, 990, 923, 873, 754, 479 cm-1; 1H NMR (acetone-d6, 600 MHz)、13C NMR (acetone-d6, 150 MHz)数据见表 1。(+)-HR-ESI-MS m/z 415.186 5 [M+H]+ (C22H27O6N2, 计算值415.186 4)。
化合物3:白色粉末; [α] +30.8 (c 0.16, CHCl3), [α] +64.0 (c 0.13, MeOH); UV (MeOH) λmax (log ε) 207 (2.67), 242 (2.43), 292 (1.48) nm; CD (MeOH): 206 (Δε +27.87), 238 (Δε -21.77), 264 (Δε +8.60), 292 (Δε +2.22) nm; IR νmax 3 256, 2 945, 2 877, 2 860, 1 703, 1 622, 1 504, 1 471, 1 440, 1 296, 1 240, 1 193, 1 136, 1 111, 992, 940, 874, 756, 658, 478 cm-1; 1H NMR (acetone-d6, 600 MHz)、13C NMR (acetone-d6, 150 MHz)数据见表 1; (+)-HR-ESI-MS m/z 417.201 8 [M+H]+ (C22H29O6N2, 计算值417.202 0)。
化合物4:白色粉末; [α] +1.4 (c 0.14, CHCl3), [α] +4.6 (c 0.13, MeOH); UV (MeOH) λmax (log ε) 207 (2.83), 242 (2.58), 290 (1.52) nm; CD (MeOH): 210 (Δε -23.35), 238 (Δε +20.48), 264 (Δε -7.72), 292 (Δε -1.52) nm; IR νmax 3 260, 2 946, 2 876, 2 858, 1 703, 1 622, 1 504, 1 471, 1 440, 1 364, 1 339, 1 307, 1 252, 1 193, 1 136, 1 112, 991, 938, 874, 756, 658, 484 cm-1; 1H NMR (acetone-d6, 600 MHz)、13C NMR (acetone-d6, 150 MHz)数据见表 1; (+)-HR-ESI-MS m/z 417.202 6 [M+H]+ (C22H29O6N2, 计算值417.203 1)。
化合物5:淡黄色固体; 1H NMR (acetone-d6, 600 MHz) δ: 10.93 (1H, brs, NH-9), 7.61 (1H, brd, J = 7.2 Hz, H-5), 7.52 (1H, d, J = 7.8 Hz, H-8), 7.25 (1H, dt, J = 1.2, 7.2 Hz, H-7), 7.09 (1H, brt, J = 7.8 Hz, H-6), 6.91 (1H, brs, NH-2), 3.68 (2H, m, H2-3), 3.02 (2H, brt, J = 7.2 Hz, H2-4); 13C NMR (acetone-d6, 150 MHz) δ: 162.9 (s, C-1), 42.6 (t, C-3), 21.4 (t, C-4), 119.6 (s, C-4a), 126.4 (s, C-4b), 120.9 (d, C-5), 121.0 (d, C-6), 125.1 (d, C-7), 113.3 (d, C-8), 138.4 (s, C-8a), 128.2 (s, C-9a); (+)-HR-ESI-MS m/z 187.086 6 [M+H]+ (C11H11ON2, 计算值187.086 6)。以上NMR数据与文献[34]报道1, 2, 3, 4-四氢-1-羰基-β-咔啉在氘代氯仿中的数据一致, 差别可归属于溶剂效应。因此, 化合物5鉴定为1, 2, 3, 4-四氢-1-羰基-β-咔啉。
3 ECD和UV谱计算应用Gaussian 16软件的GMMX模块, 在MMFF94分子力场中采用蒙特卡洛方式对化合物的构象进行搜索, 得到相对能量小于3.0 kcal·mol-1的优势构象。应用Gaussian 16 [35]程序、密度泛函算法和CPCM模型(conductor-like polarizable continuum model)模拟溶剂效应, 在CAM-B3LYP/6-31+G (d, p)水平上, 对搜索获得的构象进一步优化得到优化构象及其玻尔兹曼分布。在CAM-B3LYP/6-311++G (2d, p)水平上, 计算Gibbs自由能在3.0 kcal·mol-1以内的优化构象的各激发态能量、振子强度和转子强度。根据优化构象的玻尔兹曼分布概率, 通过加权平均化, 拟合得到理论计算的ECD和UV谱图[(σ = 0.30 eV)]。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. 2015 Ed. Beijing: China Medical Science Press, 2015: 257. |
| [2] | Ma B. Studies on Chemical Constituents and Bioactivities of the Leaves of Uncaria rhynchophylla (Miq) Jacks. (新药用资源-钩藤叶化学成分及生物活性的研究)[D]. Shenyang: Shenyang Pharmaceutical University, 2009. |
| [3] | Ndagijimana A, Wang X, Pan G, et al. A review on indole alkaloids isolated from Uncaria rhynchophylla and their pharmacological studies[J]. Fitoterapia, 2013, 86: 35–47. DOI:10.1016/j.fitote.2013.01.018 |
| [4] | Zhang Q, Zhao JJ, Xu J, et al. Medicinal uses, phytochemistry and pharmacology of the genus Uncaria[J]. J Ethnopharmacol, 2015, 173: 48–80. DOI:10.1016/j.jep.2015.06.011 |
| [5] | Endo K, Oshima Y, Kikuchi H, et al. Hypotensive principles of Uncaria Hooks[J]. Planta Med, 1983, 49: 188–190. DOI:10.1055/s-2007-969846 |
| [6] | Jiang WW, Su J, Wu XD, et al. Geissoschizine methyl ether N-oxide, a new alkaloid with antiacetylcholinesterase activity from Uncaria rhynchophylla[J]. Nat Prod Res, 2015, 29: 842–847. DOI:10.1080/14786419.2014.989847 |
| [7] | Pan H, Yang W, Zhang Y, et al. An integrated strategy for the systematic characterization and discovery of new indole alkaloids from Uncaria rhynchophylla by UHPLC/DAD/LTQ-Orbitrap-MS[J]. Anal Bioanal Chem, 2015, 407: 6057–6070. DOI:10.1007/s00216-015-8777-0 |
| [8] | Kong F, Ma Q, Huang S, et al. Tetracyclic indole alkaloids with antinematode activity from Uncaria rhynchophylla[J]. Nat Prod Res, 2017, 31: 1403–1408. DOI:10.1080/14786419.2016.1255885 |
| [9] | Wei X, Jiang LP, Guo Y, et al. Indole alkaloids inhibiting neural stem cell from Uncaria rhynchophylla[J]. Nat Prod Bioprospect, 2017, 7: 413–419. DOI:10.1007/s13659-017-0141-y |
| [10] | Guo Q, Yang H, Liu Y, et al. New zwitterionic monoterpene indole alkaloids from Uncaria rhynchophylla[J]. Fitoterapia, 2018, 127: 47–55. DOI:10.1016/j.fitote.2018.01.013 |
| [11] | Zhang JG, Huang XY, Ma B, et al. Dereplication-guided isolation of a new indole alkaloid triglycoside from the hooks of Uncaria rhynchophylla by LC with ion trap time-of-flight MS[J]. J Sep Sci, 2018, 41: 1532–1538. DOI:10.1002/jssc.v41.7 |
| [12] | Geng CA, Huang XY, Ma YB, et al. (±)-Uncarilins A and B, dimeric isoechinulin-type alkaloids from Uncaria rhynchophylla[J]. J Nat Prod, 2017, 80: 959–964. DOI:10.1021/acs.jnatprod.6b00938 |
| [13] | Zhang Q, Chen L, Hu LJ, et al. Two new ortho benzoquinones from Uncaria rhynchophylla[J]. Chin J Nat Med, 2016, 14: 232–235. |
| [14] | Yoshioka T, Murakami K, Ido K, et al. Semisynthesis and structure-activity studies of uncarinic acid C isolated from Uncaria rhynchophylla as a specific inhibitor of the nucleation phase in amyloid β 42 aggregation[J]. J Nat Prod, 2016, 79: 2521–2529. DOI:10.1021/acs.jnatprod.6b00392 |
| [15] | Li R, Cheng J, Jiao M, et al. New phenylpropanoid-substituted flavan-3-ols and flavonols from the leaves of Uncaria rhynchophylla[J]. Fitoterapia, 2017, 116: 17–23. DOI:10.1016/j.fitote.2016.11.005 |
| [16] | Jiang YP, Guo QL, Liu YF, et al. Codonopiloneolignanin A, a polycyclic neolignan with a new carbon skeleton from the roots of Codonopsis pilosula[J]. Chin Chem Lett, 2016, 27: 55–58. DOI:10.1016/j.cclet.2015.11.009 |
| [17] | Chen MH, Lin S, Wang YN, et al. Antiviral stereoisomers of 3, 5-bis(2-hydroxybut-3-en-1-yl)-1, 2, 4-thiadiazole from the roots of Isatis indigotica[J]. Chin Chem Lett, 2016, 27: 634–648. |
| [18] | Meng XH, Jiang ZB, Zhu CG, et al. Napelline-type C20-diterpenoid alkaloid iminiums from an aqueous extract of "fu zi":solvent-/base-/acid-dependent transformation/equilibration between alcohol iminium and aza acetal forms[J]. Chin Chem Lett, 2016, 27: 993–1003. DOI:10.1016/j.cclet.2016.05.013 |
| [19] | Guo QL, Lin S, Wang YN, et al. Gastrolatathioneine, an unusual ergothioneine derivative from an aqueous extract of "tian ma":a natural product co-produced by plant and symbiotic fungus[J]. Chin Chem Lett, 2016, 27: 1577–1581. DOI:10.1016/j.cclet.2016.06.040 |
| [20] | Li DW, Guo QL, Meng XH, et al. Two pairs of unusual scalemic enantiomers from Isatis indigotica leaves[J]. Chin Chem Lett, 2016, 27: 1745–1750. DOI:10.1016/j.cclet.2016.08.006 |
| [21] | Tao YW, Tian Y, Xu WD, et al. Terpenoids from Euphorbia micractina[J]. Acta Pharm Sin (药学学报), 2016, 51: 411–419. |
| [22] | Jiang YP, Liu YF, Guo QL, et al. Lignanoids from an aqueous extract of the roots of Codonopsis pilosula[J]. Acta Pharm Sin (药学学报), 2016, 51: 616–625. |
| [23] | Meng LJ, Guo QL, Liu YF, et al. 8, 4'-Oxyneolignane glucosides from an aqueous extract of "ban lan gen" (Isatis indigotica root) and their absolute configurations[J]. Acta Pharm Sin B, 2017, 7: 638–646. DOI:10.1016/j.apsb.2017.09.006 |
| [24] | Liu YF, Chen MH, Guo QL, et al. Aromatic compounds from an aqueous extract of "ban lan gen" and their antiviral activities[J]. Acta Pharm Sin B, 2017, 7: 179–184. DOI:10.1016/j.apsb.2016.09.004 |
| [25] | Zhou X, Guo QL, Zhu CG, et al. Gastradefurphenol, a minor 9, 9'-neolignan with a new carbon skeleton substituted by two p-hydroxybenzyls from an aqueous extract of "tian ma"[J]. Chin Chem Lett, 2017, 28: 1185–1189. DOI:10.1016/j.cclet.2017.03.028 |
| [26] | Guo QL, Xia H, Shi GN, et al. Aconicarmisulfonine A, a sulfonated C20-diterpenoid alkaloid from the lateral roots of Aconitum carmichaelii[J]. Org Lett, 2018, 20: 816–819. DOI:10.1021/acs.orglett.7b03956 |
| [27] | Guo QL, Xia H, Meng XH, et al. C19-Diterpenoid alkaloid arabinosides from an aqueous extract of the lateral root of Aconitum carmichaelii and their analgesic activities[J]. Acta Pharm Sin B, 2018, 8: 409–419. DOI:10.1016/j.apsb.2018.03.009 |
| [28] | Guo QL, Xu CB, Chen MH, et al. Sulfur-enriched alkaloids from the root of Isatis indigotica[J]. Acta Pharm Sin B, 2018, 8: 933–943. DOI:10.1016/j.apsb.2018.08.005 |
| [29] | Meng LJ, Guo QL, Chen MH, et al. Isatindolignanoside A, a glucosidic indole-lignan conjugate with a novel carbon skeleton from an aqueous extract of "ban lan gen"[J]. Chin Chem Lett, 2018, 29: 1257–1260. DOI:10.1016/j.cclet.2017.12.001 |
| [30] | Meng LJ, Guo QL, Zhu CG, et al. Isatindigodiphindoside, an alkaloid glycoside with a new diphenylpropylindole skeleton from the root of Isatis indigotica[J]. Chin Chem Lett, 2018, 29: 119–122. DOI:10.1016/j.cclet.2017.05.019 |
| [31] | Ponglux D, Wongseripipatana S, Aimi N, et al. Structure and synthesis of two new types of oxindole alkaloids from Uncaria salaccensis[J]. Chem Pharm Bull, 1990, 38: 573–575. DOI:10.1248/cpb.38.573 |
| [32] | Takayama H, Shimizu T, Sada H, et al. Stereochemical studies on the Uncaria alkaloid, 3-oxo-7-hydroxy-3, 7-secorhynchophyiline:the absolute configuration of 3-hydroxyoxindole derivatives[J]. Tetrahedron, 1999, 55: 6841–6846. DOI:10.1016/S0040-4020(99)00337-3 |
| [33] | Aimi N, Shimizu T, Sada H, et al. Structures of US-7and US-8:a new type of oxindole alkaloids isolated from Uncaria attenuata Korth[J]. J Chem Soc, Perkin Transactions 1, 1997: 187–188. |
| [34] | Qian P, Yang XW. Alkaloids from zuojin formula and their cytotoxicities against proliferation of cancer cells[J]. Chin Tradit Herb Drugs (中草药), 2014, 45: 8–15. |
| [35] | Frisch MJ, Trucks GW, Schlegel HB, et al. Gaussian 16, Revision B. 01.Wallingford, CT: Gaussian, Inc., 2016. |
 2019, Vol. 54
2019, Vol. 54


