2. 北京联馨药业有限公司, 北京 102628
2. Beijing Lianxin Pharmaceutical Co., Ltd., Beijing 102628, China
脑血管病是危害人类生命和健康的常见疾病, 具有高致死率和高致残率的特点[1]。在我国, 脑血管病患者死亡率占总死亡率的22.45%, 已跃居死因顺位之首[2]。近年来, 脑血管病死亡率随着我国人口老龄化程度的不断加深, 呈现较快的增长趋势。麝香作为我国传统的珍稀名贵药材之一, 具有开窍、醒脑、活血通络、抗炎消肿之功效, 在临床中广泛用于脑血管病的治疗, 如安宫牛黄丸等[3]。但是药材来源严重匮乏, 价格昂贵。为了保护野生资源, 在对天然麝香所含化学成分及药理作用全面研究的基础上完成了人工麝香的研究[4]。研究表明人工麝香(artificial musk, RGX)与天然麝香具有同等的药理活性, 并在1993年由卫生部批准人工麝香按中药一类新药试生产, 用以代替天然麝香使用。虽然天然麝香作为原料药多年来被广泛用于脑血管病的治疗, 以及人工麝香在动物模型中用于脑卒中的治疗也被报道[5], 但是人工麝香直接对不同类型脑卒中的临床前药效学系统的研究尚未见报道。因此, 本实验采用大鼠局灶性脑缺血再灌和蛛网膜下腔出血(subarachnoid hemorrhage, SAH)的动物模型, 评价人工麝香对缺血性脑卒中和出血性脑卒中的治疗作用与有效剂量的关系, 为人工麝香在临床中治疗缺血性脑卒中和出血性脑卒中的临床用量提供理论依据。
材料与方法实验动物 雄性Wistar大鼠, 体重250~270 g, 由中国医学科学院实验动物中心提供, 合格证号: SCXK京2004-007。手术前后单独饲养, 室温保持23~25 ℃, 自由进食和饮水。所有动物实验都遵循北京协和医学院动物伦理委员会的规定。
主要药品、试剂及仪器 人工麝香由北京联馨药业有限公司提供(批号: 0712198), 混悬于0.5%羧甲基纤维素纳(CMC-Na)中(p.o.), 临用前配制。MK801购自Sigma公司, 用生理盐水配制成5 mg·mL-1母液, 4 ℃避光保存。CMC-Na购自国药集团化学试剂有限公司。氯代三苯基四氮唑(2, 3, 5-triphenyltetrazolium chloride, TTC)购自Sigma公司, 用蒸馏水配制成4%溶液备用, 避光。水合氯醛购自北京化学试剂有限公司, 用生理盐水配制成10% (m/v)溶液, 常温保存。大鼠转棍仪购自中国医学科学院药物研究所。
实验分组及给药
人工麝香对急性局灶性脑缺血再灌注损伤的保护作用大鼠随机分组:假手术组、模型组、人工麝香给药组(2、10、50、200 mg·kg-1)和0.1 mg·kg-1 MK801阳性组。大脑中动脉阻断后5 min, 人工麝香灌胃给药(2 mL·kg-1); MK-801腹腔注射给药(1 mL·kg-1)。
人工麝香对大鼠蛛网膜下腔出血损伤的脑保护作用研究 大鼠随机分组:假手术组、模型组、人工麝香给药组(10、50、200 mg·kg-1)。大脑中动脉破裂致蛛网膜下腔出血后5 min时灌胃给药(2 mL·kg-1)。
暂时性局部脑缺血再灌注模型(tMCAO)制备 按照Longa的方法[6]制备tMCAO模型。大鼠用10%水合氯醛(350 mg·kg-1, i.p.)麻醉, 体温维持在(37 ± 0.5) ℃, 仰卧位固定于手术台上。沿颈正中线切开皮肤, 仔细分离右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。将ECA结扎剪断, 拉直与ICA成一直线。在ECA上剪一小口, 将一根长4.0 cm、直径0.26 mm的圆头硅化尼龙线(用0.1%多聚赖氨酸包被)由此开口插入ICA约1.85~2.00 cm, 至大鼠大脑前动脉起始处, 阻断大脑中动脉的血流供应。缺血2 h后小心抽出尼龙线, 结扎ECA开口并缝合手术切口, 动物放回笼子中再灌24 h。全部过程中室温保持在24~25 ℃。
大脑中动脉破裂致SAH模型制备 采用大鼠大脑中动脉破裂致SAH模型[7]。10%水合氯醛(350 mg·kg-1)麻醉大鼠。颈正中切开皮肤, 钝性分离肌肉, 依次分离左侧CCA、ECA和ICA, 并结扎ECA和ICA之间的吻合支。将ECA结扎并剪断, 拉直, 使其与ICA成一直线。将直径为0.26 mm的锐化后的尼龙线从ECA插入ICA的颅内, 当感觉有阻力时再往前进3 mm, 造成SAH, 然后迅速将尼龙线拔出。整个过程不超过30 s。假手术组除不刺破血管外, 其余操作与其他组相同。
tMCAO神经行为学评分 大鼠再灌注24 h后进行动物的行为学观察。参照Bederson等[8]和Belvyev等[9]的方法, 提鼠尾离开地面约1尺, 观察两前肢状况; 将大鼠置于水平地面, 推动其双肩, 观察两侧抵抗力有无差异; 大鼠置于地面, 观察其行走情况。采用四级评分法(0~5分), 分数越高, 说明其神经行为损伤越严重。0分:提鼠尾离开地面约1尺后, 大鼠前肢对称性地伸向地面; 1分:提鼠尾离开地面约1尺后, 手术对侧肩内旋, 前肢内收; 2分:提鼠尾离开地面约1尺后, 手术对侧肩内旋, 前肢内收; 推动双肩时手术对侧的抵抗力下降; 3分:提鼠尾离开地面约1尺后, 手术对侧肩内旋, 前肢内收; 推动双肩时手术对侧的抵抗力下降; 在空旷的平面上, 绕圈行走; 4分:提鼠尾离开地面约1尺后, 手术对侧肩内旋, 前肢内收; 推动双肩时手术对侧的抵抗力下降; 无自主活动。
tMCAO脑梗塞体积的测定 参照Belvyev等[9]的方法, 大鼠再灌注24 h后, 即刻断头取脑, 去除嗅束、小脑和低位脑干, 将其冠状切成6片(第1~5片每片2 mm, 第6片4 mm), 迅速置于5 mL含有1.5 mL 4% TTC及0.1 mL 1 mol·L-1 K2HPO4的溶液中染色(37 ℃, 避光) 20~30 min, 其间每隔5 min翻动1次。经TTC染色后, 正常组织深染呈红色, 梗死组织呈白色。将每组脑片排列整齐, 拍照保存。应用图象分析系统软件(Photoshop 7.0)处理并统计, 计算每片的梗塞面积, 并最终叠加换算成梗塞体积。梗塞体积以所占大脑半球的百分率来表示, 以消除脑水肿的影响。脑梗塞体积(%) = (手术对侧半球的体积-手术侧半球未梗塞部分的体积)/手术对侧半球的体积×100%。
SAH神经行为学评分 大鼠SAH 12 h和24 h后参照Bederson等[8]方法进行行为学观察, 评分标准同上。
转棍实验 大鼠转棍仪, 转速12 r·min-1, 每只大鼠测试3次, 每次测试间隔5 min, 大鼠从转棍上掉落为1次。记录大鼠在转棍上停留的最长时间及3 min内的掉落次数。手术前共训练3次, 将停留时间过短的大鼠剔除出实验, 其余动物进行手术造模。SAH 12 h和24 h后进行转棍实验, 记录第一次掉落的潜伏期和掉落次数。
统计学处理 所有数据均用均数(x) ±标准误(SEM)表示, 采用SPSS 11.5统计软件, 进行独立样本t检验(independent-samples t test)和单因素方差(one-way ANOVA)分析统计处理。P < 0.05表示差异具有统计学意义。
结果 1 人工麝香对缺血再灌注脑损伤大鼠死亡率的影响人工麝香对tMCAO模型大鼠死亡率改善作用的量效关系详见表 1。研究结果显示, tMCAO模型大鼠再灌后24 h内死亡率为50.0%, 而灌胃给予人工麝香2、10、50和200 mg·kg-1后, 其死亡率呈剂量依赖性的降低, 分别为45.4%、16.7%、16.7%和7.7%。而单次灌胃给予阳性药MK801 0.1 mg·kg-1对大鼠的死亡率未见明显改善, 详见表 2。
| Table 1 The effects of artificial musk (RGX) on mortality in rats after cerebral ischemia-reperfusion (tMCAO) for 24 h. ##P < 0.01 vs Sham group; *P < 0.05, **P < 0.01 vs tMCAO |
| Table 2 Effects of single administration of RGX and MK801 on mortality in rats after tMCAO for 24 h. ##P < 0.01 vs Sham group |
tMCAO模型大鼠, 缺血2 h再灌后24 h后, 其行为学评分和脑梗塞体积分别为2.5 ± 0.2和46.2% ± 3.2%。在灌胃给予人工麝香2、10、50和200 mg·kg-1后, 行为学评分和脑梗塞体积分别为2.3 ± 0.3和40.2% ± 5.1%、1.6 ± 0.2 (P < 0.01)和15.8% ± 3.3% (P < 0.01)、1.4 ± 0.3 (P < 0.01)和24.8% ± 4.9% (P < 0.01)、1.4 ± 0.3 (P < 0.01)和22.0% ± 4.2% (P < 0.01)。其中10 mg·kg-1剂量组作用最为显著, 且与0.1 mg·kg-1阳性药MK801的效果相当(图 1), 代表性的脑片染色病理图片见图 2。
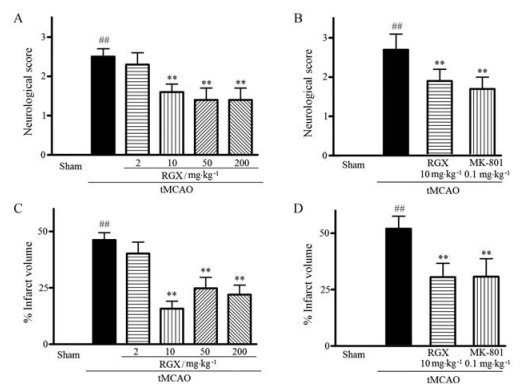
|
Figure 1 Improvement in neurological behavior and infarct volume of RGX in rats after 2-h intraluminal suture occlusion of MCA and 24-h reperfusion. A and C: RGX (2, 10, 50 and 200 mg·kg-1) were orally administered 10 min after the onset of MCAO. B and D: RGX (10 mg·kg-1) were orally administered and MK-801 (0.1 mg·kg-1) were intraperitoneally given 10 min after the onset of MCAO. n = 10-31, x± SEM. ##P < 0.01 vs Sham group; **P < 0.01 vs tMCAO group |
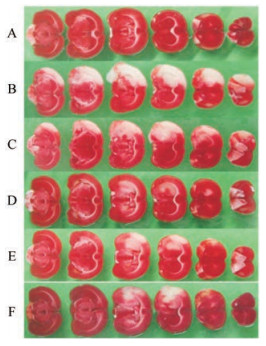
|
Figure 2 Effect of RGX (p.o.) on infarct volume in rat brain after 2-h intraluminal suture occlusion of MCA and 24-h reperfusion. The 2, 3, 5-triphenyltetrazolium chloride (TTC) stained coronal brain sections are from representative animals of Sham group (A), tMCAO group (B), and RGX (2, 10, 50 and 200 mg·kg-1)-treated group (C, D, E, and F), respectively. Drugs were orally administered 10 min after the onset of MCAO. Infarcted tissue is white, whereas live tissue is darkly stained by TTC |
人工麝香对SAH模型大鼠死亡率改善作用的量效关系详见表 3。研究结果显示, SAH模型大鼠24 h内死亡率为29.0%, 灌胃给予人工麝香10、50和200 mg·kg-1剂量后, 仅200 mg·kg-1剂量组死亡率明显降低, 其他剂量组与模型组相比较未见明显的差异。
| Table 3 The effects of RGX on mortality in rats after subarachnoid hemorrhage (SAH) for 24 h. ##P < 0.01 vs Sham group; *P < 0.05 vs SAH group |
SAH模型大鼠, 术后12和24 h的行为学评分分别为1.8 ± 0.3和1.9 ± 0.3。在灌胃给予人工麝香10、50、200 mg·kg-1剂量后, 其神经行为学评分明显低于病理模型组。其中, 人工麝香200 mg·kg-1组, 术后12和24 h的神经行为学评分显著低于病理模型组(图 3)。

|
Figure 3 Improvement in neurological behavior of RGX in rotarod test of rats after 12-h and 24-h of SAH. RGX (10, 50 and 200 mg·kg-1) were orally administered 10 min after SAH. n = 10-22, x ± SEM. ##P < 0.01 vs Sham group; **P < 0.01 vs SAH group |
应用转棍实验观察脑出血大鼠的运动平衡能力。与假手术组相比较, SAH模型大鼠术后12和24 h的第1次掉落潜伏期明显缩短(12 h: 44.7 ± 12.8 s比167.3 ± 6.8 s; 24 h: 49.6 ± 13.0 s比171.6 ± 4.6 s), 掉落次数显著增加(12 h, 11.8 ± 2.1次比0.1 ± 0.1次; 24 h: 12.0 ± 2.3次比0.1 ± 0.1次)。在灌胃给予人工麝香10、50和200 mg·kg-1剂量后, 其第1次掉落潜伏期呈剂量依赖性的增加, 掉落次数呈剂量依赖性的减少。人工麝香200 mg·kg-1组与模型组相比较, 其第1次掉落潜伏期(124.3 ± 21.8 s, P < 0.01)和掉落次数(3.8 ± 2.4次, P < 0.01)具有显著性差异(图 4), 各组代表性的脑出血图片见图 5。
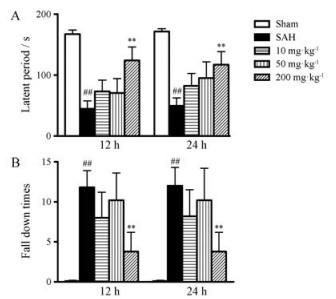
|
Figure 4 Improvement in latent period (A) and fall down times (B) of rotarod test of rats by dosing RGX after 12-h and 24-h of SAH. RGX (10, 50 and 200 mg·kg-1) were orally administered 10 min after SAH. n = 10-22, x± SEM. ##P < 0.01 vs Sham group; **P < 0.01 vs SAH group |
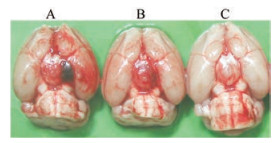
|
Figure 5 The photograph showed an example of SAH group (A), RGX (200 mg·kg-1)-treated group (B) and Sham group (C), respectively |
脑血管病包括缺血性脑血管病和出血性脑血管病, 具有高死亡率和高致残率的特征, 是严重危害我国居民健康的一组疾病。自2004年, 脑血管病已成为我国第一致死病因, 且在我国脑血管病的发病率有逐年升高的趋势, 给家庭和社会造成了严重的负担[2]。目前, 脑血管病较为明确的危险因素包括高血压、糖尿病、高血脂、超重和肥胖、过度饮酒和高胆固醇血症等[1, 2]。因此, 有效地控制这些危险因素, 可显著降低脑血管病的发生、复发和致残的风险。麝香在治疗心脑血管病中有重要的作用, 而一些名贵中成药含有麝香成分, 如安宫牛黄丸、牛黄清心和大活络丹等。其在治疗心脑血管急症中长期以来发挥着重要作用, 然而麝香或人工麝香治疗脑卒中的确切作用未见系统性的药效学研究, 因而仍有待研究证实。人工麝香作为天然麝香的替代物, 具有抗炎消肿[10, 11]、降低血小板聚集[12]、调血脂[13]、改善急性微循环障碍、增加心肌营养性血流量、提高心肌耐缺氧时间、降低心肌耗氧量的作用, 对于冠心病、动脉粥样硬化和脑缺血均具有治疗作用[14]。
本实验通过采用大鼠局灶性脑缺血再灌注和蛛网膜下腔出血的动物模型, 研究发现口服小剂量的人工麝香(10 mg·kg-1)即可显著改善tMCAO大鼠的行为学评分和脑梗塞体积, 且与腹腔注射给予阳性工具药MK-801 [N-甲基-D-天冬氨酸(NMDA)受体阻断剂0.1 mg·kg-1]的作用相当, 且行为学评分和24 h内死亡率均明显减少。在出血性脑卒中动物模型中其有效剂量则高达200 mg·kg-1, 治疗后的动物运动、平衡能力明显改善, 死亡率也明显改善。本研究的结果提示, 人工麝香在治疗缺血性脑卒中和出血性脑卒中时均有显著疗效。文献报道, 人工麝香可能通过抑制缺血再灌注后大鼠脑组织MMP-9的表达, 降低脑组织血脑屏障基底膜细胞外基质的降解和血脑屏障的通透性, 减轻脑缺血后脑水肿[5], 此外人工麝香可通过改善氧化应激损伤而对实验性脑缺血有保护作用[15], 但是人工麝香治疗脑卒中的具体机制仍不明确, 需要进一步的研究来阐明。鉴于治疗临床治疗脑卒中的可选药物较少, 而且人工麝香是已经应用于临床的、安全可靠的药物, 本研究为临床治疗脑卒中提供了新的方向, 为开发新的抗缺血脑卒中和脑出血脑新药打下基础。
| [1] | Yamazaki Y, Harada S, Tokuyama S. Sodium-glucose transporter type 3-mediated neuroprotective effect of acetylcholine suppresses the development of cerebral ischemic neuronal damage[J]. Neuroscience, 2014, 269: 134–142. DOI:10.1016/j.neuroscience.2014.03.046 |
| [2] | Jiang Y, Li X, Hu N, et al. Epidemiologic characteristics of cerebrovascular disease mortality in China, 2004-2005[J]. Chin J Prey Med (中华预防医学杂志), 2010, 44: 293–297. |
| [3] | Yang Q, Meng X, Xia L, et a1. Conservation status and causes of decline of musk deer (Moschus spp.) in China[J]. Biol Conserv, 2003, 109: 333–342. DOI:10.1016/S0006-3207(02)00159-3 |
| [4] | Yu DQ. Research on artificial musk[J]. Bull Med Res (医药研究通讯), 2000, 29: 16–17. |
| [5] | Xu Q, Liu Y, Shen Q, et a1. Effect of artificial musk on the expression of MMP-9 mRNA in rats after focal cerebral ischemia-reperfusion[J]. J Trop Med (热带医学杂志), 2011, 11: 875–878. |
| [6] | Longa E, Weinstein P, Carlson S, et a1. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20: 84–91. DOI:10.1161/01.STR.20.1.84 |
| [7] | Veelken J, Laing R, Jakubowski J. The Sheffield model of subarachnoid hemorrhage in rats[J]. Stroke, 1995, 26: 1279–1283. DOI:10.1161/01.STR.26.7.1279 |
| [8] | Bederson JB, Pitts LH, Tsuji M, et al. Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J]. Stroke, 1986, 17: 472–476. DOI:10.1161/01.STR.17.3.472 |
| [9] | Belayev L, Alonso OF, Busto R, et al. Middle cerebral artery occlusion in the rat by intraluminal suture:neurological and pathological evaluation of an improved model[J]. Stroke, 1996, 27: 1616–1622. DOI:10.1161/01.STR.27.9.1616 |
| [10] | Zhu XY, Wang WJ, Xu GF, et a1. The pharmacological activities of musk Ⅱ. The anti-inflammatory activity of the active components of musk[J]. Acta Pharm Sin (药学学报), 1988, 23: 406–410. |
| [11] | Kadota S, Orito T, Kikuchi T, et a1. Musclide-A1, -A2, and -B, cardiotonic potentiating principles from musk[J]. Tetrahedron Lett, 1991, 32: 1733–1736. DOI:10.1016/S0040-4039(00)74316-4 |
| [12] | Li H, Li J, Chen T, et al. Efects of synthetic musk on clotting-time and platelet aggregation rate in acute blood-stasis model rats[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2009, 14: 1004–1007. |
| [13] | Li H, Zhu X, Wu Q. Effects of artificial musk on hyperlipemia in rats[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2010, 15: 1008–1011. |
| [14] | Zhu X, Li H, Yu B, et al. Effect of artificial musk on myocardial ischemia in animals[J]. Chin Pharmacol Bull (中国药理学通报), 2009, 25: 951–954. |
| [15] | Dong SF, Lou LM, Zhang SF, et al. Protective effect of An-Gong-Niu-Huang-Wan (containing natural or artificial moschus) on experimental cerebral ischemia in rats[J]. World Sci Technol Mod Trad Chin Med Mater Med (世界科学技术-中医药现代化), 2013, 15: 85–90. |
 2019, Vol. 54
2019, Vol. 54


