2. 河北医科大学第四医院药学部, 河北 石家庄 050011
2. Department of Pharmacy, the Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China
靶向药物递送系统(targeted drug delivery system, TDDS)是递送药物至特定病变部位的载药系统。常见的药物包载方式包括物理包封和共价结合。物理包封方式具有制备简单、条件易控的特点, 但是这种包载形式的药物在血液循环过程中容易发生泄漏。以共价结合方式进行药物包载, 载药量可以通过控制物料比调节, 结合的药物在血液循环过程中相对稳定, 但是到达肿瘤部位后因化学键作用导致药物不易释放。针对物理包封方式可能存在的药物泄露问题, 学者们设计了接有门控基团的药物递送系统(DDS)。这一系统在血液系统循环过程中保持稳定载药状态, 当到达肿瘤部位后, 经内/外源性刺激, 暴露或产生释药通路, 实现载体内药物的快速释放[1]。
门控型药物递送系统通常具有以下特征: ①载体材料成分具有生物相容性或生物可降解性; ②一定药物负载能力; ③具有门控基团, 其对于载药系统达到靶部位之前、防止药物过早释放起关键作用。适宜的门控基团可成功封闭药物释放通道, 并于特定内/外源性刺激下打开, 导致负载药物释放。内源性刺激包括肿瘤微环境中低pH、高浓度谷胱甘肽和活性氧及酶等。外源性刺激涉及磁场、超声波和光等。学者们致力于在纳米载体基础上修饰门控基团, 主要基于两种思路: ①通过刺激响应连接臂将具有大于孔洞内径的基团连接至介孔材料载体。在内/外源环境刺激下连接臂断裂, 大尺寸基团脱落/前药释放, 药物从暴露的孔洞/产生的通道中释放。②刺激响应性基团引入介孔材料载体、无机纳米粒、胶束和脂质体等。该基团响应于内/外源环境刺激, 发生相变、构象改变、分子间相互作用和酸降解等变化, 暴露或产生通道实现药物释放。本文基于上述两种修饰方式, 对门控型药物递送系统的研究进展进行综述。
1 刺激响应性连接臂刺激响应性连接臂可将具有大于孔洞尺寸的门控基团连接至介孔材料载体, 从而构建门控型药物递送系统。在氧化还原、低pH、活性氧、酶和光等刺激下连接臂断裂, 封堵基团脱落, 药物自孔洞释放。不同刺激响应性连接臂见图 1。
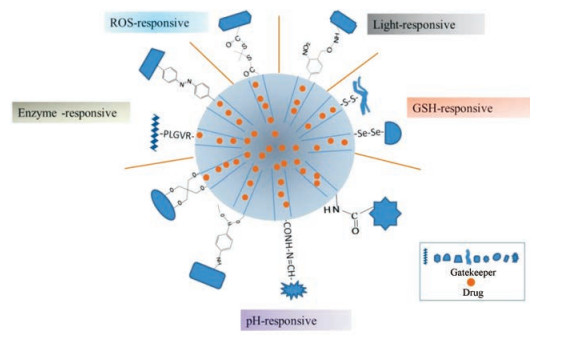
|
Figure 1 Different stimuli-responsive linkages. ROS: Reactive oxygen species; GSH: Glutathione; PLGVR: Matrix metalloproteinase substrate |
谷胱甘肽(glutathione, GSH)在细胞外部(2 μmol·L-1)和内部(10 mmol·L-1)的浓度显著不同, 并且在某些癌细胞内液中GSH的浓度进一步提高, 达正常细胞的4倍[2, 3]。由此, 学者们报道了连接门控基团并响应GSH的连接臂, 包括含二硫键连接臂和二硒键连接臂。
在GSH触发系统的研究中, 二硫键连接臂的应用最为广泛, 该连接臂可将多类门控基团(如转铁蛋白[4, 5]、糖类[6]、量子点[7]、聚合物[3][如聚乙二醇(polyethylene glycol, PEG)和细胞色素[8]等]连接至载体。Giménez等[9]将PEG链通过二硫键连接臂连接至介孔二氧化硅(mesoporous silica nanoparticles, MSN), 载体内部包封番红氧或多柔比星(doxorubicin, DOX), 在GSH作用下实现了番红氧或DOX的迅速释放。载药系统示意图见图 2。
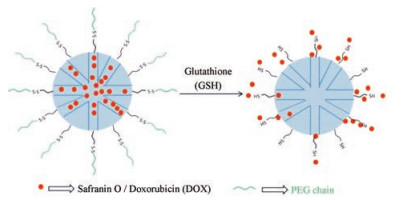
|
Figure 2 The delivery system based on mesoporous silica nanoparticles (MSN) capped with polyethylene glycol (PEG) chains via disulfide linkage |
此外, 二硫键连接臂在联合疗法方面亦得以应用。Cheng等[10]研究具有硫化铜(CuS)-帽子结构的介孔有机硅纳米粒。载体进入癌细胞后, 胞内高浓度GSH可还原连接CuS的二硫键连接臂致使CuS脱落, DOX释放。该研究表明, CuS不仅可避免输送过程中药物过早释放, 且可使该DDS实现化学和光热疗法联合治疗肿瘤。
二硒键连接臂也可响应GSH。An等[11]通过简单的硅烷偶联反应制备GSH可裂解的二硒键连接臂, 并将其连接至核壳型MSN (Fe3O4@mSiO2-DOX@Se-Se2)。研究表明, Fe3O4@mSiO2-DOX@Se-Se2在0 mmol·L-1 GSH条件下, 4 h内几乎无DOX释放, 而在10 mmol·L-1 GSH条件下, DOX释放速率显著加快, 48 h时药物累积释放高达84.04%。
1.2 pH值响应连接臂肿瘤微环境呈弱酸性(pH 6.5~6.8), 肿瘤细胞内涵体pH值进一步降低(pH 5.5), 但大多数正常细胞和血液细胞外的pH值约为7.4[12]。基于此pH值梯度, 学者们已设计出多种响应微酸环境而水解断裂的连接臂, 如酰胺键、腙键、硼酸酯键和缩醛键连接臂。
Hakeem等[13]将聚天冬氨酸通过酰胺键连接臂连接至MSN表面, DOX作为模型药物包载于MSN孔洞中。体外DOX释放研究表明, 在pH 7.4下DOX释放10%;而pH 4.5下酰胺键裂解, 引发聚天冬氨酸脱落, DOX释放可达56%。Zhang等[14]将3种葡聚糖二醛(polyaldehyde dextran, PAD)通过pH敏感的腙键连接臂与MSN偶联, 制备3种药物载体。pH 7.4时, PAD阻塞孔口防止DOX过早释放。在细胞内弱酸性环境(pH 5.5)中, 腙键断裂使药物从载体中释放。利用硼酸酯键连接臂在酸性条件下可逆水解的原理, Gan等[15]将Fe3O4纳米粒修饰至MSN。结果表明, 在pH 5~8时, Fe3O4纳米粒可有效封闭MSN孔口, 药物释放受到抑制。在pH 2~4时, 发生硼酸酯键的水解, 从而导致包载药物快速释放。并且通过将pH值从3到7交替变化, 可实现Fe3O4纳米粒的开-闭切换, 从而以脉冲方式释放包载药物, 载药系统示意图见图 3。
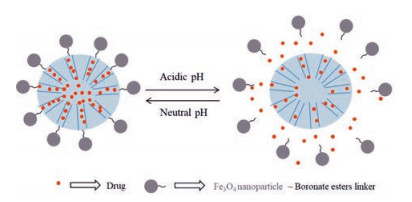
|
Figure 3 The pH-responsive delivery system based on MSNs capped with Fe3O4 nanoparticles via the boroester linker |
此外, Chen等[16]将含超小镧系元素的上转换纳米粒(S-NPs)作为门控基团, 通过缩醛键连接臂偶联至MSN表面, 载体内部包封DOX。在生理条件(pH 7.4)下, DOX几乎不释放, 表明S-NPs对载体具有较好的封阻特性。在pH 5.0和pH 2.0两种条件下, DOX累积释放率分别超过60%和90%。表明在酸性条件下, S-NPs的封阻性能解除, DOX快速释放。
1.3 活性氧响应连接臂肿瘤细胞内具有相对较高浓度活性氧(reactive oxygen species, ROS), 如过氧化氢、羟基自由基和超氧化物。但在肿瘤部位引发体内反应所需ROS的生物浓度更高。学者们使用ROS可裂解连接臂连接门控基团, 并且通过包载ROS生成剂或使用介孔TiO2纳米粒(mesoporous titanium dioxide nanoparticle, MTN)策略, 以增加肿瘤部位ROS浓度, 进而增强载药系统响应ROS的释药性能。
Hu等[17]进行ROS触发的自加速药物释放纳米递送系统(T/D@RSMSN)的研究。借助ROS可裂解的硫代缩酮(thioketal, TK)连接臂将β-环糊精(β-cyclodextrin, β-CD)连接至MSN。载体表面进一步通过主客体相互作用修饰共轭金刚烷的PEG链。同时载体内包封DOX和ROS生成剂α-生育酚琥珀酸酯(α-tocopheryl succinate, α-TOS)。对T/D@RSMSN处理后的MCF-7细胞中的红色荧光(DOX)进行强度分析, 结果显示, 在α-TOS作用下DOX的释放率(36 h)增加1.9倍。表明在MCF-7细胞中TK连接臂解离, DOX和α-TOS释放。释放出的α-TOS可进一步增加胞内ROS浓度, 促进DOX释放。
类似于MSN, MTN具有合适的载药孔径和较低的细胞毒性, 是刺激响应性DDS的另一种理想载体。MTN可强烈吸收紫外和可见(ultraviolet and visible, UV)光或经聚焦超声(ultrasound, US)辐射产生大量ROS。张振中课题组[18]使用TK连接臂将β-CD连接至MTN外表面, 该系统包载多西紫杉醇(docetaxel, DTX)。经两次40 s的US辐射, 24 h时DTX累积释放率为96.8%, 相比之下, 未经US辐射组仅7.5%。载药系统示意图见图 4。
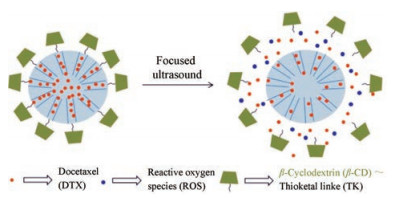
|
Figure 4 The delivery system based on mesoporous titanium dioxide nanoparticle (MTN) capped with β-CD via the thioketal linker |
肿瘤细胞可高表达多种酶, 如肿瘤微环境中基质金属蛋白酶(matrix metalloproteinase, MMP)[19]、透明质酸酶[20]、胞内溶酶体中组织蛋白酶B[21]和胞质内醌氧化还原酶等。醌氧化还原酶1是在多种癌细胞内高表达的一种细胞质还原酶, 其在低氧条件下具有较高的酶活性。Lee等[22]将MSN和环糊精之间引入偶氮苯连接臂。体内外实验表明, 醌氧化还原酶1在低氧条件下可选择性裂解偶氮苯去除环糊精, 有效触发MSN释放抗癌药物。可见门控型MSN载体可作为靶向肿瘤缺氧部位的潜在载体。
1.5 光响应连接臂UV光易对细胞造成光损伤并显示出有限的组织穿透深度, 因而其生物医学应用受到限制。近红外(near infrared, NIR)光因其更强的组织穿透性和较小的细胞毒性而被广泛应用。协同治疗法因治疗效果显著优于相应的单一疗法, 引起学者们越来越多的关注。该疗法包括光热/化学、光动力/化学和光热/光动力等双模式组合疗法。NIR光响应连接臂可将门控基团连接至载药系统, 实现光热/化学协同疗法。
邻硝基苄基可作为一种光可裂解连接臂构建门控型药物递送系统, Chen等[23]将NIR光敏感的邻硝基苄基衍生物连接臂(NB linker)应用至载药系统。载体以上转换颗粒(upconvertion nanoparticles, UCNPs)为核心、竹红菌素A (HA)/碳点(C)包被二氧化硅为夹心壳、MSN为外壳, 同时载体内包封DOX。该研究表明, NIR (980 nm)光可诱导该连接臂断裂, 促使DOX释放进而实现光热/化学协同治疗肿瘤。
1.6 多重刺激响应性连接臂同一载体可同时修饰多种刺激响应性连接臂, 响应多重刺激而逐级断裂, 从而构建门控型多重刺激响应性药物递送系统。多重刺激包括pH值/还原、酶/光等多种组合刺激。该组合策略能充分发挥不同环境响应性物质之间的协同效应, 目前已成为研究热点。
光热治疗主要利用近红外光激发光敏剂, 使光能转化成热能来达到杀死肿瘤细胞的目的。光热治疗的一个重要因素就是光敏剂, 吲哚菁绿(indocyanine green, ICG)是常见光敏剂, 生物相容性较好, 光转化效率高[24]。在载体内部进一步负载抗癌药物可实现光热/化学协同治疗肿瘤。Lei等[25]报道同时响应MMP和NIR光刺激的门控型药物递送系统。该课题组使用热不稳定偶氮连接臂VA057将CD连接至MSN孔口。通过CD和金刚烷之间的主客体相互作用, 在MSN上同时修饰短链PEG、MMP底物(PLGVR)和肿瘤细胞靶向RGD肽。载体内包封产热剂ICG及抗癌药物DOX。在血液系统循环期间, PEG链可保护载药MSN。当系统到达肿瘤组织后, 过表达的MMP-2可特异性切割PLGVR, 解除PEG链暴露RGD序列, 加速肿瘤细胞对纳米颗粒的内化。同时在NIR照射下, ICG产生局部热能, 有效地破坏偶氮连接臂使CD脱落, 实现DOX的精确控制释放。载药系统示意图见图 5。
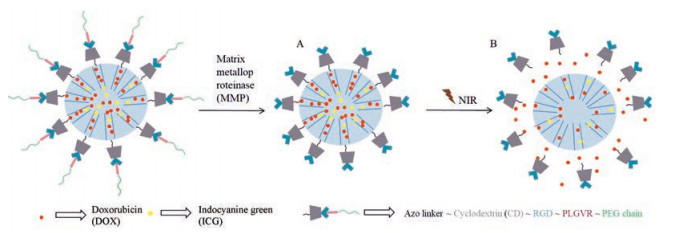
|
Figure 5 Multiple stimuli responsive drug delivery system with "gatekeeper". A: Removal of PEG by matrix metalloproteinase (MMP)and exposure RGD motifs; B: Near infrared (NIR) photothermal-triggered drug release |
Liu等[26]构建聚β-CD[poly (β-cyclodextrin), PCD]包裹且负载DOX的MSN (DOX@PRMSNs)。β-CD与吡啶连接后, 通过二硫键连接臂偶联至MSN。在酸性缓冲液中(pH 5.0)孵育12 h后, 通过热重分析法测量PRMSN的重量从39.8%降至30.7%, 接近于MSNs-SS-Py (27.8%), 表明几乎完全去除PCD。在氧化还原条件下(10 mmol·L-1二硫苏糖醇, 12 h), PRMSN的重量从39.8%降至23.3%, 接近MSNs-SH (20.5%), 表明由于二硫键连接臂的有效裂解致使PCD完全解离。吡啶与β-CD解离及二硫键连接臂裂解可分别赋予载体pH值和氧化还原响应特性, 有助于其发挥更佳的抗肿瘤效果。
2 刺激响应性基团除了上述提到的各种具备刺激响应性的连接臂之外, 有些门控基团本身也响应内/外源环境刺激, 发生相变、构象改变、分子间相互作用和酸降解等变化, 导致负载药物于靶部位释放。这些基团可修饰至介孔材料载体、无机纳米粒、胶束和脂质体等, 从而构建门控型药物递送系统。不同种类刺激响应性基团见图 6。
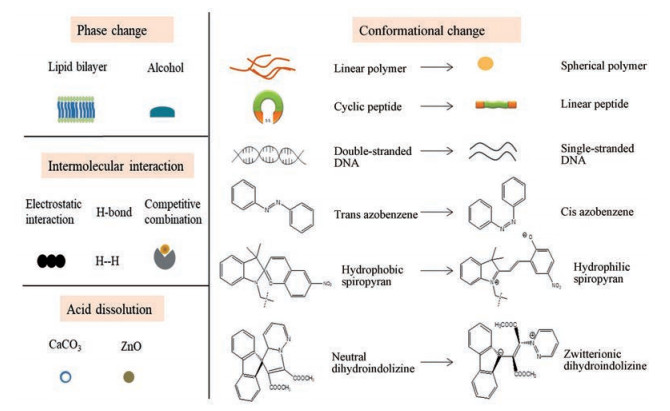
|
Figure 6 Different stimuli-responsive groups |
目前学者将多种热相变材料(如脂质双层、薄荷醇、十四烷醇等)应用于门控型药物递送系统。这类材料通常具有高生物相容性、略高于正常体温的熔点等特点。如生物相容性相变材料L-薄荷醇(L-menthol, LM)的熔点为43 ℃。
Feng等[27]制备共载抗癌药物博来霉素(bleomycin, BLM)和铜离子的中空介孔Cu2-xS纳米粒, 载体表面由LM包封、叶酸进一步修饰。实验显示, 载体在25 ℃ (12 h)条件下几乎不释放BLM, 37 ℃时释放少量BLM。在NIR光介导下温度升高至44 ℃, 药物释放量高达91%, 证明LM在一定温度范围内可熔化成液体, 同时伴随药物释放, 载药系统示意图见图 7。
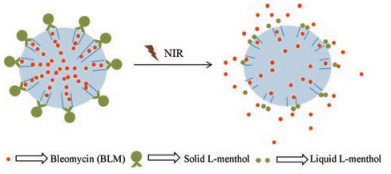
|
Figure 7 Chelate copper-based nanoplatform capped with L-menthol |
Feng等[28]将DOX和光敏药物二氢卟吩e6负载到介孔二氧化锆载体中, 载体表面由Nd3+敏感的UCNPs涂层。十四烷醇作为温度敏感相变材料(熔点39 ℃~40 ℃)掩盖载体的孔通道。NIR光照射引发温度升高至40 ℃时, 十四烷醇融化实现DOX释放。体内研究证明, 该纳米系统通过静脉注射给予U14荷瘤小鼠后, 在NIR光照射下, 具有良好的协同效应。同时, 介孔二氧化锆可作为多模态成像指导肿瘤治疗的理想纳米载体。此外, An等[29]合成由金纳米星为核心, MSN为壳的载DOX递送系统, 其表面涂有叶酸修饰的具有热敏性质的脂质双层。当NIR光加热至脂质双层相转变温度Tm (45 ℃)以上时, 其渗透性增加而无法堵塞MSN孔口, 进而实现DOX的稳定释放。
2.2 构象改变 2.2.1 生物大分子某些生物大分子(如肽类、核酸等)作为门控基团时, 在高浓度GSH、pH值或NIR光等条件下发生构象改变, 产生释放药物的通道。
多肽是一种生物活性聚合物, 可组装成有序的构象。使用多肽作为门控基团具有若干优点, 如高生物相容性, 细胞靶向特异性, 可增强内涵体逃逸或可实现酶促降解等。Lee等[30, 31]研究使用具有分子内二硫键且含NGR (Asn-Gly-Arg)或RGD (Arg-Gly-Asp)序列的环肽作为门控基团。加入GSH后环肽分子内二硫键断裂, 导致其构象由环状转变为线性结构而释放药物。多肽的降解产物也可经历构象变化。高钟镐课题组[32]构建了聚(L-谷氨酸)n-b-聚(D, L-乳酸)m修饰且负载DOX的聚合物胶束。在血液系统循环期间, 聚合物保护胶束上的Tat肽免于蛋白水解。在肿瘤组织微酸性条件下, 较短聚(L-谷氨酸)嵌段的聚合物经历构象变化, 形成加速DOX释放的通道。构象变化也使Tat肽暴露, 促进胶束的细胞内化。Li等[33]研究MSN壳包被的核-壳Fe3O4@Au纳米粒, 将可键合的寡核苷酸(bondable oligonucleotides, dsDNA)用作MSN壳的孔阻滞剂。通过NIR光加热双链体dsDNA, 使其展开最终脱开孔口而释放DOX。
2.2.2 聚合物聚(N-异丙基丙烯酰胺) [poly(N-isopropylacrylamide), PNIPAM]是研究最多的热响应聚合物之一。PNIPAM的热敏性原理源于聚合物链在水溶液中由线圈状到球状的转变。在低临界溶解温度(lower critical solution temperature, LCST)以下时, PNIPAM链在水溶液中为线圈状, 当温度升高至LCST以上时, PNIPAM链可收缩成致密的物质而转变为球状。Li等[34]制备接有热响应共聚物PNIPAM的以Fe3O4为核心的碳纳米粒, 共聚物纳米粒在808 nm激光照射下产热, 当温度升高至60 ℃ (大于其LCST)以上时, 聚合物由线圈状收缩成球状, 致使负载的米托蒽醌分子释放。
pH值响应性聚合物在细胞内涵体的微酸性环境下能够发生膜融合, 进而赋予脂质体pH值敏感特性, 促进负载药物在胞内释放。Banerjee等[35]使用聚苯乙烯-马来酸[poly (styrene-co-maleic acid), SMA]高分子修饰脂质体。该聚合物可由扩展(带电)结构转变为球型(低于其pK1, 不带电)结构。该构象变化导致脂质体在微酸条件下囊泡融合或形成孔通道, 最终导致负载药物释放。研究结果表明, 与普通脂质体相比, SMA修饰的脂质体表现出良好的细胞相容性, 可在结肠癌HT-29细胞内有效地递送氟尿嘧啶。
2.2.3 光转化小分子光转化分子可在光照条件下发生异构化实现药物的控制释放, 这类分子有偶氮苯、二氢中氮茚及螺吡喃。其在血液系统循环中保持封闭药物的构象, 当到达肿瘤部位后, 经光照射发生异构化转变而促使药物释放。
偶氮苯(azobenzene, Azo)及其衍生物可进行可逆异构化转变, 在300~380 nm光照射下由反式转为顺式构象, 大于400 nm时, 可从顺式到反式。Azo分子可嵌入DNA内引起DNA构象改变, 也可通过自身构象转化引起药物释放。Yuan等[36]报道通过将Azo引入DNA而构建光响应性MSN载药系统。经UV光照射引发偶氮苯发生顺反异构化, 从而可逆调节DNA双链结构的形成和解旋。该系统在可见光下将药物包封在载体内, 当波长达到紫外线范围时偶氮苯的光异构化导致互补DNA解旋, MSN孔口打开从而释放药物。Hou等[37]设计以UCNPs为核心, MSN为壳的包封偶氮苯基团和光敏剂玫瑰红的纳米粒, UCNPs可激活光响应性Azo和玫瑰红分子。NIR光照射下Azo分子发生构象改变, 减弱DOX与MSN表面硅烷醇之间较强的相互作用, 促进DOX释放。
二氢中氮茚可在紫外线照射下经历从浅黄色异构体到红色甜菜碱异构体的转变。Singh等[38]报道这种结构转化可破坏脂质体膜, 导致光响应性脂质体去稳定化从而释放药物。螺吡喃经疏水-亲水转换也可实现药物的控制释放。Liu等[39]设计在MSN涂层中引入UCNPs, 且进一步修饰光致变色螺吡喃, 疏水性药物姜黄素可负载于MSN通道内。通过NIR光照射引发螺吡喃分子的疏水性-亲水性转换, 最终诱导药物释放, 载药系统示意图见图 8。
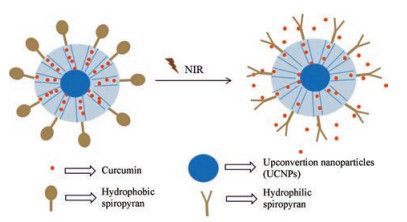
|
Figure 8 Spiropyran modified on mesoporous silica coated upconvertion nanoparticles |
基于分子间相互作用的调节机制, 学者们设计并构建了门控型药物递送系统。其中相互作用的调节方式包括: ①门控基团与载体非共价键相互作用的改变; ②门控基团与靶部位信号分子之间的竞争性置换。
2.3.1 非共价键相互作用如前所述, 载体系统通过裂解共价键去除大尺寸门控基团可引发药物释放, 但这一思路存在孔覆盖率低的不足。为解决此问题, 可通过静电相互作用等非共价键结合门控基团, 实现更高的孔隙封闭率。
Das等[40]报道由磁性氧化钆-氧化铁为核心, 以硼酸功能化高发光碳量子点(BNSCQD)门控的MSN为壳的多功能混合纳米粒。带负电荷的BNSCQD通过静电相互作用修饰至纳米粒孔口, 并将药物包封在载体内。实验结果显示, 当碳点上部分电离的羧酸或硼酸物质在低pH值下转化为质子化基团(COOH)时, 碳点从MSN表面脱落释放出抗癌药物。此外, 有研究[41]利用聚吡咯的介孔SiO2 (PPy/mSiO2)纳米复合材料包载甲氨蝶呤(methotrexate, MTX)。石墨烯量子点通过H键与mSiO2结合从而引入PPy/mSiO2外表面。NIR光照射下, PPy可有效地将光能转换为热能。温度升高使H键被破坏, 导致石墨烯量子点脱落, MTX可自mSiO2的孔洞释放。
2.3.2 竞争结合反应竞争结合反应机制的门控系统通常是肿瘤细胞内外生物分子如ATP、GSH、葡萄糖等与门控基团竞争结合, 使得门控基团脱落, 致使药物释放。
Zhu等[42]设计基于适体-靶标相互作用的生物响应性MSN纳米粒系统。在该系统中, MSN的孔口用ATP适体修饰的金纳米粒封闭。通过竞争性置换反应, ATP分子使金纳米粒从载体表面脱落, 进而释放药物。此外, Lu等[43]将金纳米粒通过相对弱的金-氮键连接至氨基功能化的MSN, 该纳米复合物进一步包载喜树碱。胞内GSH可与金纳米粒竞争性结合, 致使金纳米粒脱离实现药物释放。
碳水化合物转运蛋白在某些类型的癌细胞中过表达, 因此葡萄糖可应用于响应性靶向递送系统。Sinha等[44]设计苯硼酸和叶酸酯功能化的磁性介孔二氧化硅(magnetic mesoporous silica, MMS)。该MMS的孔内包载药物, 葡聚糖与苯硼酸结合封闭孔口。葡萄糖可与苯硼酸竞争结合, 置换葡聚糖促使药物释放。研究结果表明, 苯磺丁脲和喜树碱负载的MMS可实现肿瘤靶向释药。载药系统示意图见图 9。
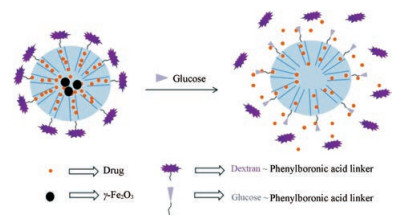
|
Figure 9 Dextran-gated mesoporous silica nanocarrier for glucose-responsive drug release |
无机纳米粒氧化锌作为门控基团时, 具有对正常组织无毒、可生物降解的特点, 同时可赋予药物递送系统pH值敏感性。Wang等[45]构建一种以UCNPs为核心、MSN为壳的纳米载体, ZnO作为门控基团封闭MSN孔口。该研究证明, ZnO可有效地将药物封堵于载体中, 当其溶解在肿瘤周围的酸性环境时可实现药物的持续释放, 同时证明其可用于清晰的多模态生物成像。
CaCO3在生理pH值条件下稳定, 但在低pH值环境(如溶酶体中pH 4.6~5.0, 炎症和肿瘤部位pH 3~5)中溶解成无毒产物(Ca2+和CO32-)。近期, Liu等[46]构建碳酸钙封端、叶酸介导的MMS纳米球。该载体中包封道诺霉素, 碳酸钙作为门控基团封闭二氧化硅的孔道。实验结果表明, 载体在pH 7.4 (120 h)条件下药物累积释放率为30%~40%。相比之下, pH 5.6条件下的释放率则达到74.98%。表明该载药系统在肿瘤微环境下表现出显著的pH值响应性释药特征。
3 其他在自然界中, 细胞膜中的水通道蛋白可调节通道润湿性来控制水分子的运输, 这是由于通道中氨基酸的构象变化所致。受此现象启发, Cheng等[47]用疏水性苯硫醚基团修饰至MSN纳米孔道的内表面来抑制DOX释放。ROS刺激时, 疏水性苯硫醚基团可氧化成亲水性苯亚砜或苯砜, 纳米孔道可逐渐润湿导致DOX从孔道中释放。这种系统可克服传统物理阻塞系统的局限。Liu等[48]报道了一种pH值响应性聚D, L-乳酸-共-羟基乙酸纳米粒。该纳米载体包载碳酸氢铵(NH4HCO3)和卵清蛋白(抗原)。NH4HCO3与树突细胞和溶酶体(pH 5.0和pH 6.5)中的氢离子产生NH3和CO2, 导致载体产生孔通道, 负载抗原得以释放。
4 问题与展望门控型药物递送系统是目前靶向递药系统的典型代表, 可较大程度地避免循环过程中的药物泄露且同时实现靶部位的响应性释药。多年来, 学者们主要从刺激响应性连接臂及响应性基团两方面进行研究, 设计和制备出不同机制的门控型药物递送系统, 以期达到提高药物靶向性, 减少毒副作用的目的。经刺激响应性连接臂连接的门控基团, 存在释放通道封阻不完全的问题。探索封阻完全的方式, 不应仅仅局限于化学共价键, 非共价键机制的门控系统有望实现更高的孔洞覆盖率。药物递送系统向着更精准化递药的方向发展, 门控型多重刺激响应性药物递送系统的应用是一种有效策略。但其存在载体材料设计、制备更加复杂和质量控制难度大等问题。相信随着学科的不断发展, 基于新材料、新机制的新型门控型药物递送系统将被成功构建, 未来药物递送和癌症治疗也将拥有更多更有效的解决办法和干预策略。
| [1] | Tseng YJ, Chou SW, Shyue JJ, et al. A versatile theranostic delivery platform integrating magnetic resonance imaging/computed tomography, pH/cis-diol controlled release, and targeted therapy[J]. ACS Nano, 2016, 10: 5809–5822. DOI:10.1021/acsnano.5b08130 |
| [2] | Cui Y, Dong H, Cai X, et al. Mesoporous silica nanoparticles capped with disulfide-linked PEG gatekeepers for glutathione-mediated controlled release[J]. ACS Appl Mater Interfaces, 2012, 4: 3177–3183. DOI:10.1021/am3005225 |
| [3] | Zhao Q, Wang S, Yang Y, et al. Hyaluronic acid and carbon dots-gated hollow mesoporous silica for redox and enzyme-triggered targeted drug delivery and bioimaging[J]. Mater Sci Eng C, 2017, 78: 475–484. DOI:10.1016/j.msec.2017.04.059 |
| [4] | Chen X, Sun H, Hu J, et al. Transferrin gated mesoporous silica nanoparticles for redox-responsive and targeted drug delivery[J]. Colloids Surf B Biointerfaces, 2017, 152: 77–84. DOI:10.1016/j.colsurfb.2017.01.010 |
| [5] | Neaime C, Amela-Cortes M, Grasset F, et al. Time-gated luminescence bioimaging with new luminescent nanocolloids based on[Mo6I8(C2F5COO)6]2- metal atom clusters[J]. Phys Chem Chem Phys, 2016, 18: 30166–30173. DOI:10.1039/C6CP05290H |
| [6] | Lin JT, Liu ZK, Zhu QL, et al. Redox-responsive nanocarriers for drug and gene co-delivery based on chitosan derivatives modified mesoporous silica nanoparticles[J]. Colloids Surf B Biointerfaces, 2017, 155: 41–50. DOI:10.1016/j.colsurfb.2017.04.002 |
| [7] | Zhang M, Wang W, Wu F, et al. Black phosphorus quantum dots gated, carbon-coated Fe3O4 nanocapsules (BPQDs@SS-Fe3O4@C) with low premature release could enable imaging-guided cancer combination therapy[J]. Chemistry, 2018, 24: 12890–12901. DOI:10.1002/chem.v24.49 |
| [8] | Zhang B, Luo Z, Liu J, et al. Cytochrome c end-capped mesoporous silica nanoparticles as redox-responsive drug delivery vehicles for liver tumor-targeted triplex therapy in vitro and in vivo[J]. J Control Release, 2014, 192: 192–201. DOI:10.1016/j.jconrel.2014.06.037 |
| [9] | Giménez C, de la Torre C, Gorbe M, et al. Gated mesoporous silica nanoparticles for the controlled delivery of drugs in cancer cells[J]. Langmuir, 2015, 31: 3753–3762. DOI:10.1021/acs.langmuir.5b00139 |
| [10] | Cheng X, Li D, Lin A, et al. Fabrication of multifunctional triple-responsive platform based on CuS-capped periodic mesoporous organosilica nanoparticles for chemo-photothermal therapy[J]. Int J Nanomedicine, 2018, 13: 3661–3677. DOI:10.2147/IJN |
| [11] | An N, Lin H, Yang C, et al. Gated magnetic mesoporous silica nanoparticles for intracellular enzyme-triggered drug delivery[J]. Mater Sci Eng C, 2016, 69: 292–300. DOI:10.1016/j.msec.2016.06.086 |
| [12] | Saroj S, Rajput SJ. Tailor-made pH-sensitive polyacrylic acid functionalized mesoporous silica nanoparticles for efficient and controlled delivery of anti-cancer drug etoposide[J]. Drug Dev Ind Pharm, 2018, 44: 1198–1211. DOI:10.1080/03639045.2018.1438467 |
| [13] | Hakeem A, Zahid F, Zhan G, et al. Polyaspartic acid-anchored mesoporous silica nanoparticles for pH-responsive doxorubicin release[J]. Int J Nanomedicine, 2018, 13: 1029–1040. |
| [14] | Zhang M, Liu J, Kuang Y, et al. Ingenious pH-sensitive dextran/mesoporous silica nanoparticles based drug delivery systems for controlled intracellular drug release[J]. Int J Biol Macromol, 2017, 98: 691–700. DOI:10.1016/j.ijbiomac.2017.01.136 |
| [15] | Gan Q, Lu X, Yuan Y, et al. A magnetic, reversible pH-responsive nanogated ensemble based on Fe3O4 nanoparticles-capped mesoporous silica[J]. Biomaterials, 2011, 32: 1932–1942. DOI:10.1016/j.biomaterials.2010.11.020 |
| [16] | Chen Y, Ai K, Liu J, et al. Multifunctional envelope-type mesoporous silica nanoparticles for pH-responsive drug delivery and magnetic resonance imaging[J]. Biomaterials, 2015, 60: 111–120. DOI:10.1016/j.biomaterials.2015.05.003 |
| [17] | Hu JJ, Lei Q, Peng MY, et al. A positive feedback strategy for enhanced chemotherapy based on ROS-triggered self-accelerating drug release nanosystem[J]. Biomaterials, 2017, 128: 136–146. DOI:10.1016/j.biomaterials.2017.03.010 |
| [18] | Shi J, Chen Z, Wang B, et al. Reactive oxygen species-manipulated drug release from a smart envelope-type mesoporous titanium nanovehicle for tumor sonodynamic-chemotherapy[J]. ACS Appl Mater Inter, 2015, 7: 28554–28565. DOI:10.1021/acsami.5b09937 |
| [19] | Egeblad M, Werb Z. New functions for the matrix metalloproteinases in cancer progression[J]. Nat Rev Cancer, 2002, 2: 161–174. DOI:10.1038/nrc745 |
| [20] | Qiu L, Zhang W, Wang S, et al. Construction of multifunctional porous silica nanocarriers for pH/enzyme-responsive drug release[J]. Mater Sci Eng C, 2017, 81: 485–491. DOI:10.1016/j.msec.2017.08.029 |
| [21] | de la Torre C, Mondragón L, Coll C, et al. Cathepsin-B induced controlled release from peptide-capped mesoporous silica nanoparticles[J]. Chemistry, 2014, 20: 15309–15314. DOI:10.1002/chem.v20.47 |
| [22] | Lee J, Oh ET, Yoon H, et al. Mesoporous nanocarriers with a stimulus-responsive cyclodextrin gatekeeper for targeting tumor hypoxia[J]. Nanoscale, 2017, 9: 6901–6909. DOI:10.1039/C7NR00808B |
| [23] | Chen Y, Zhang F, Wang Q, et al. Near-infrared light-mediated LA-UCNPs@SiO2-C/HA@mSiO2-DOX@NB nanocomposite for chemotherapy/PDT/PTT and imaging[J]. Dalton Trans, 2017, 46: 14293–14300. DOI:10.1039/C7DT02529G |
| [24] | Zong L, Yuan AR, Zhu Y, et al. Preparation of thermoresponsive micelles loaded with indocyanine green and doxorubicin for combined therapy in MCF-7 cells[J]. Acta Pharm Sin (药学学报), 2018, 53: 1169–1176. |
| [25] | Lei Q, Qiu WX, Hu JJ, et al. Multifunctional mesoporous silica nanoparticles with thermal-responsive gatekeeper for NIR light-triggered chemo/photothermal-therapy[J]. Small, 2016, 12: 4286–4298. DOI:10.1002/smll.v12.31 |
| [26] | Liu J, Liu XX, Yuan Y, et al. Supramolecular modular approach toward conveniently constructing and multifunctioning a pH/redox dual responsive drug delivery nanoplatform for improved cancer chemotherapy[J]. ACS Appl Mater Interfaces, 2018, 10: 26473–26484. DOI:10.1021/acsami.8b05232 |
| [27] | Feng Q, Zhang W, Li Y, et al. An intelligent NIR-responsive chelate copper-based anticancer nanoplatform for synergistic tumor targeted chemo-phototherapy[J]. Nanoscale, 2017, 9: 15685–15695. DOI:10.1039/C7NR05003H |
| [28] | Feng L, Gai S, He F, et al. Multifunctional mesoporous ZrO2 encapsulated upconversion nanoparticles for mild NIR light activated synergistic cancer therapy[J]. Biomaterials, 2017, 147: 39–52. DOI:10.1016/j.biomaterials.2017.09.011 |
| [29] | An J, Yang XQ, Cheng K, et al. In vivo computed tomography/photoacoustic imaging and NIR-triggered chemo-photothermal combined therapy based on a gold nanostar-, mesoporous silica-, and thermosensitive liposome-composited nanoprobe[J]. ACS Appl Mater Interfaces, 2017, 9: 41748–41759. DOI:10.1021/acsami.7b15296 |
| [30] | Lee J, Oh E, Han Y, et al. Mesoporous silica nanocarriers with cyclic peptide gatekeeper:specific targeting of aminopeptidase N and triggered drug release by stimuli-responsive conformational transformation[J]. Chemistry, 2017, 23: 16966–16971. DOI:10.1002/chem.201704309 |
| [31] | Lee J, Oh E, Song J, et al. Stimulus-induced conformational transformation of a cyclic peptide for selective cell targeting on-off gatekeeper of mesoporous nanocarrier[J]. Chem Asian J, 2017, 12: 2813–2818. DOI:10.1002/asia.v12.21 |
| [32] | Wang Q, Gao Z, Liu S, et al. Hybrid polymeric micelles based on bioactive polypeptides as pH-responsive delivery systems against melanoma[J]. Biomaterials, 2014, 35: 7008–7021. DOI:10.1016/j.biomaterials.2014.04.117 |
| [33] | Li WP, Liao PY, Su CH, et al. Formation of oligonucleotide-gated silica shell-coated Fe3O4-Au core-shell nanotrisoctahedra for magnetically targeted and near-infrared light-responsive theranostic platform[J]. J Am Chem Soc, 2014, 136: 10062–10075. DOI:10.1021/ja504118q |
| [34] | Li Z, Zhang J, Guo X, et al. Multi-functional magnetic nanoparticles as an effective drug carrier for the controlled anti-tumor treatment[J]. J Biomater Appl, 2018, 32: 967–976. DOI:10.1177/0885328217748023 |
| [35] | Banerjee S, Sen K, Pal TK, et al. Poly(styrene-co-maleic acid)-based pH-sensitive liposomes mediate cytosolic delivery of drugs for enhanced cancer chemotherapy[J]. Int J Pharm, 2012, 436: 786–797. DOI:10.1016/j.ijpharm.2012.07.059 |
| [36] | Yuan Q, Zhang Y, Chen T, et al. Photon-manipulated drug release from a mesoporous nanocontainer controlled by azobenzene-modified nucleic acid[J]. ACS Nano, 2012, 6: 6337–6344. DOI:10.1021/nn3018365 |
| [37] | Hou B, Yang W, Dong C, et al. Controlled co-release of doxorubicin and reactive oxygen species for synergistic therapy by NIR remote-triggered nanoimpellers[J]. Mater Sci Eng C, 2017, 74: 94–102. DOI:10.1016/j.msec.2017.02.016 |
| [38] | Singh P, Choudhury S, Kulanthaivel S, et al. Photo-triggered destabilization of nanoscopic vehicles by dihydroindolizine for enhanced anticancer drug delivery in cervical carcinoma[J]. Colloids Surf B Biointerfaces, 2018, 162: 202–211. DOI:10.1016/j.colsurfb.2017.11.035 |
| [39] | Liu C, Zhang Y, Liu M, et al. A NIR-controlled cage mimicking system for hydrophobic drug mediated cancer therapy[J]. Biomaterials, 2017, 139: 151–162. DOI:10.1016/j.biomaterials.2017.06.008 |
| [40] | Das RK, Pramanik A, Majhi M, et al. Magnetic mesoporous silica gated with doped carbon dot for site-specific drug delivery, fluorescence, and MR imaging[J]. Langmuir, 2018, 34: 5253–5262. DOI:10.1021/acs.langmuir.7b04268 |
| [41] | Liu X, Shou D, Chen C, et al. Core-shell structured polypyrrole/mesoporous SiO2 nanocomposite capped with graphene quantum dots as gatekeeper for irradiation-controlled release of methotrexate[J]. Mater Sci Eng C, 2017, 81: 206–212. DOI:10.1016/j.msec.2017.08.001 |
| [42] | Zhu CL, Lu CH, Song XY, et al. Bioresponsive controlled release using mesoporous silica nanoparticles capped with aptamer-based molecular gate[J]. J Am Chem Soc, 2011, 133: 1278–1281. DOI:10.1021/ja110094g |
| [43] | Lu HY, Chang YJ, Fan NC, et al. Synergism through combination of chemotherapy and oxidative stress-induced autophagy in A549 lung cancer cells using redox-responsive nanohybrids:a new strategy for cancer therapy[J]. Biomaterials, 2015, 42: 30–41. DOI:10.1016/j.biomaterials.2014.11.029 |
| [44] | Sinha A, Chakraborty A, Jana NR. Dextran-gated, multifunctional mesoporous nanoparticle for glucose-responsive and targeted drug delivery[J]. ACS Appl Mater Interfaces, 2014, 6: 22183–22191. DOI:10.1021/am505848p |
| [45] | Wang Y, Song S, Liu J, et al. ZnO-functionalized upconverting nanotheranostic agent:multimodality imaging-guided chemotherapy with on-demand drug release triggered by pH[J]. Angew Chem Int Ed Engl, 2015, 54: 536–540. |
| [46] | Liu MC, Liu B, Chen XL, et al. Calcium carbonate end-capped, folate-mediated Fe3O4@mSiO2 core-shell nanocarriers as targeted controlled-release drug delivery system[J]. J Biomater Appl, 2018, 32: 1090–1104. DOI:10.1177/0885328217752994 |
| [47] | Cheng Y, Jiao X, Xu T, et al. Free-blockage mesoporous anticancer nanoparticles based on ROS-responsive wetting behavior of nanopores[J]. Small, 2017, 13: 1701942. DOI:10.1002/smll.v13.40 |
| [48] | Liu Q, Chen X, Jia J, et al. pH-responsive poly(D, L-lactic-co-glycolic acid) nanoparticles with rapid antigen release behavior promote immune response[J]. ACS Nano, 2015, 9: 4925–4938. DOI:10.1021/nn5066793 |
 2019, Vol. 54
2019, Vol. 54


