外泌体最早于1981年由Trams等在透射电镜下发现, 并于1987年被Johnstone等命名[1]。外泌体的直径介于40~100 nm之间, 主要由脂质、蛋白质和遗传物质组成, 蛋白质和遗传物质是外泌体发挥生物学功能的有效成分[2]。所有的细胞都可以分泌外泌体[3], 且外泌体在体液中分布广泛, 血液、尿液、脑脊髓液、乳汁、羊水和腹水中均有外泌体被发现[4]。不同来源的外泌体有其特异的表面分子, 在细胞间的信息传递中起重要作用, 参与体内众多生理及病理过程[5]。外泌体在体内分布广泛, 具有非免疫性和易于透过细胞膜的特性。因此, 外泌体作为药物递送载体有其独特的天然优势[6]。近年来, 关于外泌体递送药物的研究逐渐增多, 一些小分子化学药物及基因药物等已被成功载入外泌体, 在神经系统疾病尤其是脑部疾病及肿瘤等的治疗中表现出巨大的潜力。
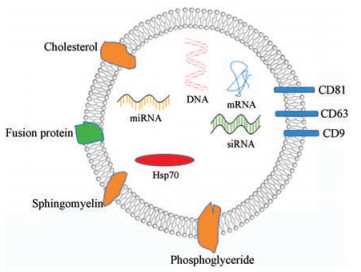
1 外泌体及其生物学功能外泌体是具有双层膜结构的“纳米球”[3], 由脂质、蛋白质、DNA和RNA组成, 如图 1所示[4, 7]。脂质包括胆固醇、鞘磷脂和磷酸甘油酯等。外泌体的表面特征是存在多个蛋白质家族, 如四旋蛋白(CD63、CD81、CD9)、热休克蛋白(Hsp70)、溶酶体蛋白(Lamp2b)和融合蛋白(CD9、flotillin、annexin)等[8]。四旋蛋白CD63、CD81和CD9的三位一体已被广泛用作外泌体标记物[7]。不同来源的外泌体还含有各自特异性的蛋白质分子, 如神经元分泌的外泌体含谷氨酸受体; 肠上皮细胞分泌的外泌体含各种代谢酶; 树突状细胞(DC)分泌的外泌体包含几乎所有的抗原呈递分子, 因此可以诱发或放大获得性免疫[9]。外泌体中携带的mRNA和miRNA在细胞间传递, 有调节受体细胞生物学功能的作用。肿瘤细胞来源的外泌体还含有DNA[2]。
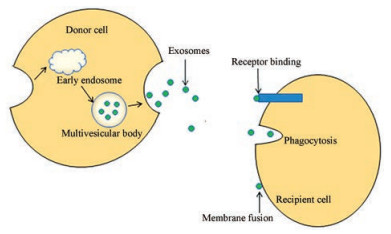
外泌体的形成一般分为3个阶段, 包括: ①细胞膜凹陷形成内吞囊泡; ②内吞囊泡膜向内出芽, 形成多泡体; ③多泡体与细胞膜融合, 释放的囊泡内容物, 称为外泌体[3, 4] (图 2)。
早期认为外泌体只具备排出细胞内冗余成分的功能[2]。近年来, 随着对外泌体研究的不断深入, 发现外泌体参与体内多种生理和病理过程, 具备多样化的功能。首先, 外泌体具有传递细胞间分子信号的功能, 主要通过3种方式: ①利用其上特异性表面分子与靶细胞结合; ②直接与靶细胞的细胞膜融合, 释放内容物到靶细胞内; ③通过内陷以类似胞吞作用的机制传递信息到靶细胞[10] (图 2)。
其次, 外泌体对免疫细胞具有调节作用, 参与的免疫过程包括促进造血干细胞增殖, 增加造血干细胞存活, 增强对T细胞的调节功能[11], 促进CD8+和CD4+ T细胞的活化以诱导特异性免疫应答等[3]。研究表明, 某些外泌体通过FasL传递死亡信号使T细胞凋亡, 发挥免疫抑制作用[12]。
除正常的生理功能外, 多种疾病的发生发展也与外泌体有关。外泌体通过递送mRNA和蛋白质, 诱导肿瘤微环境的形成[3]。同时, 外泌体是癌细胞与正常细胞交流的重要物质, 含有多种肿瘤相关基因, 在肿瘤的发生发展过程中起重要作用[5]。Koumangoye等[13]发现体外培养的乳腺癌细胞来源的外泌体含有特定的物质, 可集中固定在特定细胞的表面, 调节细胞与胞外基质的黏附, 促进肿瘤细胞扩散。Le等[14]研究发现, 具有高转移潜能的乳腺癌细胞通过外泌体将miRNA-200传递给低转移的乳腺癌细胞, 增强了后者的转移能力, 从而促进乳腺癌的转移。另有研究表明, 外泌体还具有抑制肿瘤的功能。Bruno等[15]发现, 间充质干细胞(MSC)来源的外泌体对卵巢癌和肝癌细胞的生长有抑制作用。神经系统疾病(如帕金森病)中, 外泌体负责将错误折叠的蛋白质从异常神经元运输到附近细胞, 致使疾病在细胞间传播[3]。
2 外泌体作为药物递送载体在疾病治疗中的应用 2.1 外泌体作为药物递送载体的优势外泌体结合了细胞和纳米技术递送药物的优势: ①与细胞疗法相比, 外泌体更易储存且安全性较高。如外泌体递送基因药物不会在体内不同部位沉积导致免疫排斥[16]。此外, 外泌体还可以从患者体液中分离, 经修饰后移回同一患者[17], 大大降低了临床中出现免疫反应的可能性; ②外泌体递送药物可以提高药物的稳定性。如外泌体可以保护核酸在运输过程中不被核酶水解[4]。同时, 外泌体可直接进入细胞液, 避免代谢消除, 从而延长药物在体内的循环时间[16]; ③外泌体为纳米级分子, 且携带细胞表面物质, 因此具有较强的穿透各种生物屏障的能力[18]; ④外泌体具有基于供体细胞的天然靶向能力。如肿瘤细胞来源的外泌体携带肿瘤特异性抗原、蛋白质和RNA等物质, 可以起到抗肿瘤免疫的作用[6]。
2.2 外泌体的获得及药物的加载 2.2.1 外泌体的获得外泌体主要从体液及细胞培养基中提取分离得到, 其供体细胞主要有肿瘤细胞(如HeLa细胞)、MSC、免疫细胞(如未成熟的DC、B细胞)及其他(HEK293细胞)来源。MSC相对于其他细胞, 产生外泌体的能力更强[19]。目前外泌体的提取分离方法以差速(超速)离心为核心, 随着技术的不断改良, 主要有8种, 各种提取分离方法的比较见表 1[3, 5, 18, 20, 21]。
| Table 1 Comparison of exosome isolation techniques |
差速离心法是目前最常用的方法, 被认为是外泌体提取分离的“金标准”[20]。该法先通过低速离心除去体液或细胞培养液中的细胞碎片, 再通过高速离心沉淀外泌体。整个过程操作简单, 但耗时较长, 通常需数小时, 且得到的外泌体中掺杂其他囊泡、蛋白质及蛋白质-RNA聚集体等物质[22], 导致外泌体纯度不高。此外, 重复超速离心还可能会对外泌体的结构造成破坏[23]; 密度梯度离心主要利用外泌体在1.13~1.19 g·mL-1的密度范围内富集, 该方法是超速离心与蔗糖密度梯度的组合。通过蔗糖密度梯度, 可以将与外泌体密度不同的杂质除去。研究发现梯度离心需要长时间(62~90 h)离心才能达到较好的分离效果[24]。密度梯度纯化被证明可以从血浆中得到最纯的外泌体制剂[25]; 超滤法分离主要取决于外泌体的分子大小或分子量[26], 耗时少, 仅需20 min[23]; 磁珠免疫法利用外泌体表面具有特异性标记物(如CD63、CD9、CD81蛋白), 当外泌体与偶联抗体(抗CD63)的磁珠共同孵育后, 外泌体即被特异性吸附, 后经洗脱分离[24]。当应用于血浆样品时, 磁珠免疫法所获得的总颗粒数和蛋白质产量比超速离心高10~15倍[27]; 单克隆抗体法利用外泌体相关抗原的抗体——如CD9、CD63、CD81、CD82、上皮细胞黏附分子(EpCAM)和Ras相关蛋白(Rab5)等物质进行分离。该方法可将抗体固定在不同的培养基条件下, 与磁珠、色谱基质、平板和微流体装置组合进行分离。该技术的缺点是携带抗原的非外泌体囊泡也与抗体结合, 降低了外泌体的纯度[3]; 分子排阻色谱根据外泌体的分子大小进行分离, 通常使用重力流进行, 外泌体结构的完整性和生物活性得以保证[28]; 聚乙二醇沉淀法利用聚乙二醇可与疏水性蛋白和脂质分子结合共沉淀外泌体, 沉淀过程中也存在非外泌体蛋白污染的问题导致纯度不高; 外泌体提取试剂盒是近年来新兴的提取方法, 通过特殊的过滤器过滤杂质或采用分子排阻色谱法进行分离纯化或利用化合物沉淀法沉淀外泌体。其中, 聚合沉淀法可通过ExoQuick试剂盒完成[24]。不同的提取分离方法对外泌体的可分散性和滤过效率有所影响[29]。实际操作中可综合采用多种方法以达到所需实验要求。实验表明, 与仅通过超滤或超速离心相比, 超速离心结合分子排阻色谱的方法大大提高了尿液中外泌体的产量[30]。采用PEG6000沉淀结合超高速离心的方法提取细胞来源的外泌体操作简洁, 比单纯的超高速离心法或ExoQuick试剂盒提取效率更高, 且成本较低[31]。
外泌体的分离纯化方法较为复杂, 且哺乳动物细胞释放的外泌体数量相对较少, 造成外泌体的产量不高。为解决该问题, 研究人员采用连续挤出细胞的方法制备外泌体-模拟纳米囊泡[18], 即在细胞加载药物后通过孔径为10、5和1 μm的聚碳酸酯膜进行连续挤出制备大量携带药物的外泌体-模拟纳米囊泡, 然后用10%和50%碘克沙醇纯化。实验结果表明, 外泌体-模拟纳米囊泡的总颗粒数和蛋白质产量比天然外泌体高100倍以上[32]。对肝细胞的外泌体-模拟纳米囊泡研究发现, 外泌体-模拟纳米囊泡在直径大小和特定蛋白质特征等方面与天然外泌体相似, 也具备向受体细胞传递信息的功能。来自原代肝细胞的外泌体-模拟纳米囊泡与原代肝细胞的外泌体具有类似的生物功能, 可以有效地促进肝细胞增殖和肝脏恢复, 并显著促进体内肝脏再生[33]。外泌体-模拟纳米囊泡产量高且易于纯化, 为外泌体应用于临床提供了可能。
2.2.2 药物的加载目前, 将药物载入外泌体的方法可分为外源性载药、内源性载药和转基因3种[2, 34]。外源性载药方式:先将外泌体从供体细胞中分离纯化, 再将药物通过与外泌体共培养、化学方法转染外泌体或电穿孔法导入外泌体; 内源性载药方式:先将药物通过与供体细胞的共培养或化学方法转染供体细胞[32]载入供体细胞中, 当药物进入外泌体且从供体细胞中释放后, 分离纯化得到载药外泌体; 由于外泌体来源于细胞, 某些蛋白类药物可通过转基因的方式让细胞自身表达, 最终随外泌体分泌至细胞外[2]。各种载药方式及适用药物类型见表 2[1, 2, 34]。
| Table 2 Exosome drug loading methods and applicable drug types |
疏水性的小分子药物如紫杉醇(PTX, 载药量一般为7.2%)、多柔比星(DOX, 载药量约为11.2%)和姜黄素等可采用与外泌体共培养的方法将药物负载其中[34]。药物-外泌体混合物超声处理6个循环, 30 s开/关, 共3 min, 每个循环之间的冷却时间为2 min, 可使药物有效地加载到外泌体中[35]。研究显示, 电穿孔、挤出、超声和低渗透析等载药方式均可提高卟啉化合物的载药量[34]。Haney等[36]研究了在室温下与外泌体共培养、皂苷介导的透化、超声处理、冻融循环和挤出等加载过氧化氢酶到外泌体的方法, 结果显示超声和挤出的载药量较高, 负载能力达20%~26%[22, 37]。电穿孔法参数易于控制、操作简便, 但可能会对外泌体或药物的完整性造成影响[7]。另有研究表明电穿孔法会使siRNA沉淀, Hood等[38]研究发现, 在电穿孔过程中, 使用50 mmol·L-1海藻糖脉冲介质(TPM)可实现外泌体聚集最小化。需要注意的是, 电穿孔法在加载基因药物时, 核酸分子和外泌体的大小对转染效率有重要影响[1]。
2.3 外泌体在疾病治疗中的应用近年来, 外泌体作为药物递送载体在神经系统疾病尤其是脑部疾病和肿瘤等的研究中, 显示出应用潜力。
2.3.1 外泌体在神经系统疾病中的应用多种中枢神经系统疾病, 如帕金森病、阿尔茨海默症和亨廷顿氏病等, 都是由遗传异常引起[39]。因而, 对于此类疾病的治疗也应当从基因层面着手。Alvarez-Erviti等[40]构建了编码Lamp2b的质粒并将其转染到DC中, 发现获得的外泌体通过膜上的Lamp2b与神经元特异性狂犬病病毒糖蛋白(RVG)肽强烈融合, 该靶向外泌体可以在小鼠模型中有效地将siRNA递送到大脑。在体外和体内研究载有miR-133b的MSC衍生的外泌体, 发现富含miR-133b的MSC外泌体提高了体外神经突向外生长的水平[7], 且消除了脑卒中诱导的脑中miR-133b的下调, 表明载有miRNA的外泌体治疗脑卒中可以促进脑重塑[41]。Tian等[42]采用点击化学的方法得到环(Arg-Gly-Asp-D-Tyr-Lys)肽[c (RGDyK)]缀合的外泌体(cRGD-Exo), 发现cRGD-Exo对脑缺血病变区域的靶向性更强。随后, 将姜黄素加载到cRGD-Exo上, 得到含姜黄素的cRGD-Exo (cRGD-Exo-cur), 与游离姜黄素相比, cRGD-Exo-cur更好地抑制脑缺血后的炎症反应, 且不会引起明显的毒性或组织损伤。
血脑屏障阻碍药物进入大脑, 致使脑部疾病难以治疗。研究者将未成熟的DC来源的外泌体进行修饰后通过电击载入抑制淀粉蛋白前β-分解酶1 (BACE1)的siRNA, 注射入小鼠体内, 发现经修饰后的载药外泌体可通过血脑屏障[43]。另有研究表明, 载有过氧化氢酶的外泌体可成功通过血脑屏障进入大脑, 改善帕金森病的疾病状态[3]。从神经母细胞瘤分离的外泌体可以结合脑中淀粉样蛋白β的聚集体, 实现对阿尔茨海默症的有效治疗[44]。Yang等[45]以斑马鱼为研究对象, 开发了一种原发性脑癌模型, 采用脑内皮细胞分泌的外泌体递送DOX, 结果显示外泌体递送的DOX显著抑制了斑马鱼脑肿瘤模型中血管内皮生长因子(VEGF)的RNA, 即通过脑内皮外泌体递送的DOX对该斑马鱼脑癌模型具有显著的治疗效果。
2.3.2 外泌体在肿瘤治疗中的应用在肿瘤治疗中, 外泌体表现出巨大的应用潜力。Ohno等[46]报道了在小鼠异种移植模型中, GE11靶向外泌体递送let-7a miRNA至表达生长因子(EGFR)的乳腺癌细胞, GE11靶向外泌体比对照组更多地积聚在肿瘤组织。Katakowski等[47]利用miR-146b质粒转染MSC, 得到载有miR-146b的外泌体, 将其注射至小鼠体内的多形性成角质细胞瘤(GBM)处, 发现利用外泌体运输miRNA的治疗方法可抑制肿瘤细胞生长。此外, 将高剂量PTX与MSC混合培养, 使PTX载入MSC来源的外泌体, 可有效抑制胰腺癌细胞增殖[48]。与脂质体相比, 载有PTX的巨噬细胞衍生的外泌体显著增加3LL-M227小鼠Lewis肺癌细胞系中PTX的细胞摄取[49]。将DOX加载到未成熟的DC来源外泌体中, 通过此外泌体直接靶向肿瘤组织, DOX的功效明显增强, 且对心脏的影响显著减少, 显示了外泌体递送该化疗药物的优越性[8]。姜黄素有抗炎、抗氧化及抑制肿瘤细胞增殖的作用[50]。由于水溶性差, 姜黄素的有效利用率较低。采用EL-4小鼠淋巴瘤细胞系来源的外泌体负载姜黄素, 在体外显示出较好的稳定性, 体内血药浓度也较高[51]。
此外, 另有研究表明, MSC来源的外泌体可以选择性地将let-7c miRNA递送至损伤的肾脏, 上调let-7c基因的表达, 减少肾纤维化[39]。该研究为外泌体递送RNA治疗肾脏疾病奠定了基础。
2.4 外泌体递送药物的给药途径及其生物分布 2.4.1 外泌体递送药物的给药途径临床上使用外泌体递送治疗性药物, 必须保证外泌体的稳定性且能通过正常的给药途径进行递送。对几种给药途径进行考察, 显示基于外泌体递送药物在临床上是可行的。①静脉注射:静脉注射是基于外泌体递送药物中使用最为广泛的给药途径。静脉注射的外泌体被递送至脑和胰腺, 尤其是肿瘤组织[7, 40, 46]。实体肿瘤中存在渗漏血管且缺乏适当的淋巴引流可能有利于外泌体在肿瘤内的渗透和保留[52]。因此, 静脉注射是外泌体给药的合适方法, 尤其是对于恶性肿瘤的治疗; ②瘤内注射:研究发现, 肿瘤内注射载药外泌体可成功减小肿瘤体积。直接注射确保了治疗剂的特定递送, 对于脑部疾病, 可避免侵入性手术造成的损害[7]; ③鼻腔给药:外泌体也可通过鼻腔, 以非侵入的方式透过血脑屏障进入脑实质, 还可抑制脑部炎症和癌症[7, 43]。在小鼠帕金森病模型中, 相比于静脉注射, 鼻内给予负载过氧化氢酶的外泌体可使其更多地积聚在脑组织中[37]; ④口服:从葡萄中提取的外泌体样纳米囊泡经口服进入体内, 可诱导肠道干细胞增殖并促进结肠炎消退[53]; ⑤腹腔注射:含姜黄素的外泌体腹腔注射后可增加姜黄素的抗感染活性, 还可用于抢救由于注射内毒素引起的小鼠感染性休克[43]。
2.4.2 外泌体进入体内后的分布采用荧光标记法观察外泌体在小鼠体内的分布, 发现小鼠在静脉注射外泌体24 h后, 肝脏中荧光信号最强, 其次是脾脏、胃肠道和肺部。腹腔注射和皮下注射与静脉注射相比, 外泌体在肝脏和脾脏中的积聚减少, 胰腺和胃肠道的积聚增加。研究表明, 细胞来源、外泌体剂量和给药途径均影响外泌体在体内的分布情况, 如注射较高剂量的外泌体会产生较低的肝脏积聚[37]。
2.4.3 外泌体的靶向性高度的靶向性有利于提高药物的疗效同时降低其毒副作用。外泌体具备一定的天然靶向能力, 但其靶向性不强, 难以满足临床应用的要求。为提高外泌体的靶向性, 研究人员在外泌体表面进行了各种修饰。最常用的技术是利用基因工程实现对外泌体表面的修饰, 即将编码靶向蛋白的基因插入供体细胞中, 使供体细胞在外泌体中分泌该蛋白质[40]。该方法操作复杂、成本高, 无法人为进行控制和修饰多种靶向分子, 且不能用于已经纯化的外泌体或体液外泌体。近来, 有研究者采用生物正交无铜叠氮化物炔环加成(点击化学)的方法将功能配体结合到外泌体表面, 实现靶向外泌体的制备[34, 42]。该方法简单、有效且快速, 可用于从培养基或体液预先分离的外泌体, 还可以同时缀合多个具有不同特性的配体[42]。此外, 另有一些研究采用非共价的方式对外泌体的表面进行修饰。Amstrong等[54]和Nakase等[55]通过静电相互作用将阳离子脂质结合在外泌体表面, 从而增强外泌体的摄取。
3 总结与展望外泌体递送药物已成为目前研究的热点, 限制其应用于临床的因素主要包括: ①产量问题。获取天然的纯外泌体比较困难, 外泌体-模拟纳米囊泡的制备为该问题的解决提供了方法。虽然肝细胞的外泌体-模拟纳米囊泡在结构和功能上与天然外泌体相似, 但外泌体来源广泛, 各种来源的外泌体是否均能采用连续挤出细胞的方法得到外泌体-模拟纳米囊泡, 其结构的完整性是否会遭到破坏及各方面生理活性是否均与天然外泌体相同仍有待于进一步研究。②靶向性问题。虽然靶向性修饰方法已在实验中取得了进展, 但体内环境复杂, 所修饰的外泌体进入体内后是否仍具备预期的靶向性尚不确定, 因此对于外泌体的靶向性修饰仍然是研究的重点。此外, 修饰后的外泌体是否会引起免疫反应也应在今后的研究中进一步考察。
| [1] | Wang ZY, Zheng R, Ma MJ, et al. Exosomes applied as drug carrier and targeted drug delivery strategies[J]. Chin J Cell Biol (中国细胞生物学学报), 2017, 39: 1118–1123. |
| [2] | Zhu YL. Study on the Functionalization of Exosomes as Pharmaceutical Carrier (外泌体作为药物载体的功能化研究)[D]. Nanjing: Southeast University, 2017. |
| [3] | Ha D, Yang N, Nadithe V. Exosomes as therapeutic drug carriers and delivery vehicles across biological membranes:current perspectives and future challenges[J]. Acta Pharm Sin B, 2016, 6: 287–296. DOI:10.1016/j.apsb.2016.02.001 |
| [4] | Li SD, Hou X, Qi HZ, et al. Exosomes:provide naturally occurring endogenous nanocarriers for effective drug delivery strategies[J]. Prog Chem (化学进展), 2016, 28: 353–362. |
| [5] | Wu Q, Yang GD, Wei MY, et al. Biological roles of exosome and its implication in gene therapy[J]. Prog Mod Biomed (现代生物医学进展), 2016, 16: 6785–6788. |
| [6] | Yuan P, Guo XC, Zhang JP, et al. Research progress of the exosomes as drug delivery vehicles of Chinese herbal drugs[J]. Acta Pharm Sin (药学学报), 2017, 52: 1667–1672. |
| [7] | Johnsen KB, Gudbergsson JM, Skov MN, et al. A comprehensive overview of exosomes as drug delivery vehicles-endogenous nanocarriers for targeted cancer therapy[J]. Biochim Biophys Acta, 2014, 1846: 75–87. |
| [8] | Conde-Vancells J, Rodriguez-Suarez E, Embade N, et al. Characterization and comprehensive proteome profiling of exosomes secreted by hepatocytes[J]. J Proteome Res, 2008, 7: 5157–5166. DOI:10.1021/pr8004887 |
| [9] | Wu JE, Ding JT. Advances in research on biological functions and applications of exosomes[J]. Prog Veterinary Med (动物医学进展), 2016, 37: 90–94. |
| [10] | Wang J, Chen JY. Research progress of extracellular vesicles[J]. Chin J Tissue Eng Res (中国组织工程研究), 2017, 21: 621–626. |
| [11] | Liu YC. The Biological Function of Extracellular Vesicle and Its Utilization as Small RNA Carrier In Vivo (细胞外囊泡的生物学功能及其作为体内小核糖核酸药物递送载体的研究)[D]. Nanjing: Nanjing University, 2016. |
| [12] | Wang YG, Wang SJ. The role of exosomes in the formation of microenvironment of immunosuppressive tumors[J]. Chin J Cell Mol Immunal (细胞与分子免疫学杂志), 2015, 31: 1417–1420. |
| [13] | Koumangoye RB, Sakwe AM, Goodwin JS, et al. Detachment of breast tumor cells induces rapid secretion of exosomes which subsequently mediate cellular adhesion and spreading[J]. PLoS One, 2011, 6: e24234. DOI:10.1371/journal.pone.0024234 |
| [14] | Le MTN, Hamar P, Guo C, et al. miR-200-containing extracellular vesicles promote breast cancer cell metastasis[J]. J Clin Invest, 2014, 124: 5109–5128. DOI:10.1172/JCI75695 |
| [15] | Bruno S, Collino F, Deregibus MC, et al. Microvesicles derived from human bone marrow mesenchymal stem cells inhibit tumor growth[J]. Stem Cells Dev, 2012, 22: 758–771. |
| [16] | Andaloussi SEL, Lakhal S, Mäger I, et al. Exosomes for targeted siRNA delivery across biological barriers[J]. Adv Drug Deliv Rev, 2013, 65: 391–397. DOI:10.1016/j.addr.2012.08.008 |
| [17] | Wahlgren J, Karlson TDL, Brisslert M, et al. Plasma exosomes can deliver exogenous short interfering RNA to monocytes and lymphocytes[J]. Nucleic Acids Res, 2012, 40: e130. DOI:10.1093/nar/gks463 |
| [18] | Jiang XC, Gao JQ. Exosomes as novel bio-carriers for gene and drug delivery[J]. Int J Pharm, 2017, 521: 167–175. DOI:10.1016/j.ijpharm.2017.02.038 |
| [19] | Yeo RWY, Lai RC, Zhang B, et al. Mesenchymal stem cell:an efficient mass producer of exosomes for drug delivery[J]. Adv Drug Deliv Rev, 2013, 65: 336–341. DOI:10.1016/j.addr.2012.07.001 |
| [20] | Zhang QJ, Di CX, Chen YH, et al. Research progress of exosomes in tumor cells and clinical application[J]. Modern Oncol (现代肿瘤医学), 2018, 26: 945–950. |
| [21] | Li X, Dang XT, Zeng XR. Exosome-mediated targeted therapeutic delivery and applications in cardiovascular diseases[J]. Chin J Biochem Mol Biol (中国生物化学与分子生物学报), 2016, 32: 1286–1294. |
| [22] | Batrakova EV, Kim MS. Using exosomes, naturally-equipped nanocarriers, for drug delivery[J]. J Control Release, 2015, 219: 396–405. DOI:10.1016/j.jconrel.2015.07.030 |
| [23] | Lobb RJ, Becker M, Wen S, et al. Optimized exosome isolation protocol for cell culture supernatant and human plasma[J]. J Extracell Vesicl, 2015, 4: 27031. DOI:10.3402/jev.v4.27031 |
| [24] | Taylor DD, Shah S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes[J]. Methods, 2015, 87: 3–10. DOI:10.1016/j.ymeth.2015.02.019 |
| [25] | Kalra H, Adda CG, Liem M, et al. Comparative proteomics evaluation of plasma exosome isolation techniques and assessment of the stability of exosomes in normal human blood plasma[J]. Proteomics, 2013, 13: 3354–3364. DOI:10.1002/pmic.v13.22 |
| [26] | Bu H, He D, He X, et al. Exosomes:isolation, analysis, and applications in cancer detection and therapy[J]. ChemBioChem, 2018, 19: 1–22. DOI:10.1002/cbic.v19.1 |
| [27] | Zarovni N, Corrado A, Guazzi P, et al. Integrated isolation and quantitative analysis of exosome shuttled proteins and nucleic acids using immunocapture approaches[J]. Methods, 2015, 87: 46–58. DOI:10.1016/j.ymeth.2015.05.028 |
| [28] | Muller L, Hong CS, Stolz DB, et al. Isolation of biologically-active exosomes from human plasma[J]. J Immunol Methods, 2014, 411: 55–65. DOI:10.1016/j.jim.2014.06.007 |
| [29] | Yamashita T, Takahashi Y, Nishikawa M, et al. Effect of exosome isolation methods on physicochemical properties of exosomes and clearance of exosomes from the blood circulation[J]. Eur J Pharm Biopharm, 2016, 98: 1–8. DOI:10.1016/j.ejpb.2015.10.017 |
| [30] | Rood IM, Deegens JKJ, Merchant ML, et al. Comparison of three methods for isolation of urinary microvesicles to identify biomarkers of nephrotic syndrome[J]. Kidney Int, 2010, 78: 810–816. DOI:10.1038/ki.2010.262 |
| [31] | Wang PP, Wang HH, Peng DY, et al. Comparison of different extraction methods of macrophage-derived exosomes[J]. Chin Pharm Bull (中国药理学通报), 2018, 34: 589–592. |
| [32] | Jang SC, Kim OY, Yoon CM, et al. Bioinspired exosome-mimetic nanovesicles for targeted delivery of chemotherapeutics to malignant tumors[J]. ACS Nano, 2013, 7: 7698–7710. DOI:10.1021/nn402232g |
| [33] | Wu JY, Ji AL, Wang Z, et al. Exosome-mimetic nanovesicles from hepatocytes promote hepatocyte proliferation in vitro and liver regeneration in vivo[J]. Sci Rep, 2018, 8: 2471. DOI:10.1038/s41598-018-20505-y |
| [34] | Zhao JL, Wang YM, Niu YW, et al. Research progress of exosome used as drug delivery system[J]. Mater Guide (材料导报), 2017, 31: 160–165. |
| [35] | Kim MS, Haney MJ, Zhao Y, et al. Development of exosome-encapsulated paclitaxel to overcome MDR in cancer cells[J]. Nanomedicine, 2016, 12: 655–664. DOI:10.1016/j.nano.2015.10.012 |
| [36] | Haney MJ, Klyachko NL, Zhao Y, et al. Exosomes as drug delivery vehicles for Parkinson's disease therapy[J]. J Control Release, 2015, 207: 18–30. DOI:10.1016/j.jconrel.2015.03.033 |
| [37] | Vader P, Mol EA, Pasterkamp G, et al. Extracellular vesicles for drug delivery[J]. Adv Drug Deliv Rev, 2016, 106: 148–156. DOI:10.1016/j.addr.2016.02.006 |
| [38] | Hood JL, Scott MJ, Wickline SA. Maximizing exosome colloidal stability following electroporation[J]. Anal Biochem, 2014, 448: 41–49. DOI:10.1016/j.ab.2013.12.001 |
| [39] | Lu M, Xing H, Xun Z, et al. Exosome-based small RNA delivery:progress and prospects[J]. Asian J Pharm Sci, 2018, 13: 1–11. DOI:10.1016/j.ajps.2017.07.008 |
| [40] | Alvarez-Erviti L, Seow Y, Yin HF, et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes[J]. Nat Biotechnol, 2011, 29: 341. DOI:10.1038/nbt.1807 |
| [41] | Bihl J, Wang J, Ma X, et al. Exosome and miRNA in stroke//Cellular and Molecular Approaches to Regeneration and Repair[M]. Cham: Springer International Publishing, 2018: 325-361. |
| [42] | Tian T, Zhang HX, He CP, et al. Surface functionalized exosomes as targeted drug delivery vehicles for cerebral ischemia therapy[J]. Biomaterials, 2018, 150: 137–149. DOI:10.1016/j.biomaterials.2017.10.012 |
| [43] | Wang S, Zhang ZH, Gu DF, et al. Advances of exosomes as a new drug delivery system[J]. J China Pharm Univ (中国药科大学学报), 2014, 45: 247–252. |
| [44] | Luan X, Sansanaphongpricha K, Myers I, et al. Engineering exosomes as refined biological nanoplatforms for drug delivery[J]. Acta Pharmacol Sin, 2017, 38: 754–763. DOI:10.1038/aps.2017.12 |
| [45] | Yang T, Martin P, Fogarty B, et al. Exosome delivered anticancer drugs across the blood-brain barrier for brain cancer therapy in Danio rerio[J]. Pharm Res, 2015, 32: 2003–2014. DOI:10.1007/s11095-014-1593-y |
| [46] | Ohno S, Takanashi M, Sudo K, et al. Systemically injected exosomes targeted to EGFR deliver antitumor microRNA to breast cancer cells[J]. Mol Ther, 2013, 21: 185–191. DOI:10.1038/mt.2012.180 |
| [47] | Katakowski M, Buller B, Zheng X, et al. Exosomes from marrow stromal cells expressing miR-146b inhibit glioma growth[J]. Cancer Lett, 2013, 335: 201–204. DOI:10.1016/j.canlet.2013.02.019 |
| [48] | Pascucci L, Coccè V, Bonomi A, et al. Paclitaxel is incorporated by mesenchymal stromal cells and released in exosomes that inhibit in vitro tumor growth:a new approach for drug delivery[J]. J Control Release, 2014, 192: 262–270. DOI:10.1016/j.jconrel.2014.07.042 |
| [49] | Kim MS, Haney MJ, Zhao Y, et al. Development of exosome-encapsulated paclitaxel to overcome MDR in cancer cells[J]. Nanomedicine, 2016, 12: 655–664. |
| [50] | Aggarwal BB, Harikumar KB. Potential therapeutic effects of curcumin, the anti-inflammatory agent, against neurodegenerative, cardiovascular, pulmonary, metabolic, autoimmune and neoplastic diseases[J]. Int Biochem Cell biol, 2009, 41: 40–59. DOI:10.1016/j.biocel.2008.06.010 |
| [51] | Sun D, Zhuang X, Xiang X, et al. A novel nanoparticle drug delivery system:the anti-inflammatory activity of curcumin is enhanced when encapsulated in exosomes[J]. Mol Ther, 2010, 18: 1606–1614. DOI:10.1038/mt.2010.105 |
| [52] | Maeda H, Wu J, Sawa T, et al. Tumor vascular permeability and the EPR effect in macromolecular therapeutics:a review[J]. J Control Release, 2000, 65: 271–284. DOI:10.1016/S0168-3659(99)00248-5 |
| [53] | Ju S, Mu J, Dokland T, et al. Grape exosome-like nanoparticles induce intestinal stem cells and protect mice from DSS-induced colitis[J]. Mol Ther, 2013, 21: 1345–1357. DOI:10.1038/mt.2013.64 |
| [54] | Armstrong JPK, Holme MN, Stevens MM. Re-engineering extracellular vesicles as smart nanoscale therapeutics[J]. ACS Nano, 2017, 11: 69–83. DOI:10.1021/acsnano.6b07607 |
| [55] | Nakase I, Futaki S. Combined treatment with a pH-sensitive fusogenic peptide and cationic lipids achieves enhanced cytosolic delivery of exosomes[J]. Sci Rep, 2015, 5: 10112. DOI:10.1038/srep10112 |
 2019, Vol. 54
2019, Vol. 54