近年来心脑血管疾病发病率呈逐年增高趋势, 其高致残率和高死亡率对人民健康构成严重威胁并给社会带来沉重负担。2017年中国心血管病报告显示, 心血管病死亡占全部死因的比率超过了40%, 居各疾病首位[1]。心血管疾病主要包括急性冠状动脉综合征、心肌梗死、脑卒中、不稳定型心绞痛、短暂性脑缺血和动脉粥样硬化等。能够引发心血管疾病的常见因素有吸烟、高血压、高血清总胆固醇和糖尿病等, 而血栓则是诱发心血管疾病最直接的因素。目前临床常见的用来防治血栓的药物主要分为3类:抗血小板药物、抗凝血药物和溶解血栓药物。抗血小板药物[2], 如血小板表面蛋白酶激活受体1 (protease-activated receptor 1, PAR1)拮抗剂vorapaxar、P2Y12拮抗剂氯吡格雷、GPIIb/IIIa拮抗剂阿昔单抗、血栓烷素A2抑制剂阿司匹林和磷酸二酯酶抑制剂西洛他唑等; 抗凝药物[2, 3], 如华法林、肝素, 以及新上市的凝血因子Xa (factor Xa, FXa)抑制剂(利伐沙班、阿哌沙班等)和凝血酶抑制剂(达比加群酯、水蛭素等); 溶栓类药物[4]包括尿激酶、阿替普酶、瑞替普酶等。这些药物对于减少血栓形成均有较好的临床效果, 但都存在一定的出血风险[5, 6]。目前接受抗凝药物治疗的患者, 发生颅内出血的比率为0.1%~0.3%[7, 8], 颅内出血的患者死亡率高达50%[9-11]。还有一些患者本身就患有可能会导致出血倾向的其他疾病而不适合使用目前市面上的抗凝药, 如心房颤动患者、胃穿孔患者和严重肾病的患者。这些临床问题清楚地表明, 研究者需要研发不影响或最小限度影响人体正常生理止血功能的药物。因此, 研发出血不良反应小的抗栓药物具有重要价值。
1953年Rosenthal等[12]首次报道FXI缺陷症, 其是一种常染色体隐性遗传性出血病, 曾被称为血友病C。与血友病A、B相比, FXI缺陷症患者发病无性别差异, 且一般无自发性出血, 少有出现关节和肌肉内出血, 在高纤溶活性部位的创伤或外科手术可能出现出血倾向, 如口腔、鼻和泌尿系统等, 而其他如整形外科、阑尾切除、包皮环割或皮肤切口等外科创伤极少出现过量出血[13]。FXI缺陷患者的临床表现使得研究人员开始关注FXI在凝血系统中的作用。人们首先对小鼠进行体内敲除FXI基因的研究, 发现FXI基因敲除小鼠能健康存活, 且繁殖力、止血功能与野生小鼠无异, 并且表现出活化部分凝血活酶时间(activated partial thromboplastin time, APTT)延长而凝血酶原时间(prothrombin time, PT)正常[14]; 同时在FeCl3诱导的小鼠颈总动脉血栓形成模型中, FXI基因敲除小鼠相比野生型小鼠也具有良好的抗栓效果[15], 这为FXI作为出血风险小的抗栓治疗新靶点提供依据。除动物实验对于FXI作为新靶点的支持, 临床资料显示, 先天缺乏FXI的患者中, 缺血性脑卒中及深静脉血栓(deep venous thrombosis, DVT)的发病率明显降低[16], 同时人们发现, 高FXI水平人群的DVT发病率是其他人群的2.2倍, 表明FXI水平与DVT的发生呈正相关[17]。这些研究表明, FXI是出血风险小的抗栓防治新靶点。目前已在研的FXI抑制剂主要包括反义寡核苷酸类(antisense oligonucleotides, ASOs)、小分子抑制剂和蛋白类抑制剂(含抗体和天然产物中分离的蛋白)等。本文以FXI的生理结构和作用机制为基础, 综述凝血因子XI抑制剂的相关研究进展, 期望为出血风险小的抗栓新药研发提供参考。
1 凝血因子XI的结构FXI是一种产自肝脏的丝氨酸蛋白酶原, 单体分子质量在80 kD左右, 同源二聚体分子质量为160 kD[18]。人FXI和血浆前激肽酶的氨基酸序列具有58%的相似性[19]。Papagrigoriou等[20]首次阐明全长FXI的晶体结构。该蛋白由二硫键连接的2个完全相同亚基构成, 其中每条多肽链上含607个氨基酸。每个亚基分为重链(N端催化区域)和轻链(C端催化区域), 其中重链为4个AP结构域(apple domain, A1~A4)[21, 22]。在凝血瀑布中, 4个AP结构域是FXI与其他分子相互作用的部位: A1结合凝血酶; A2结合高分子量激肽原(HK); A3结合凝血因子Ⅸ (factor Ⅸ, FⅨ)、糖蛋白Ib和肝素; A4结合活化的凝血因子Ⅻ (FXIIa)。4个AP结构域并列形成中央有空腔的杯碟状平台, 这个空腔主要由碱性和带正电荷的芳香性侧链组成。基于4个AP结构域形成的“杯与碟”结构更加利于FXI的催化功能[23]。
2 凝血因子XI的作用机制1964年Macfarlane[24]发表了他们关于凝血级联系统的假说, 内外源凝血途径得以修正, 人们关于凝血系统的认知得到进一步的改善。凝血级联反应的初始是由损伤血管壁暴露的组织因子(外源途径)或者活化的FXII因子(内源途径)触发的。外源途径中最强的激动剂是暴露在损伤血管壁上的组织因子, 在病理条件下, 组织因子会结合FVIIa形成复合物然后催化FX的活化, 接下来FXa会切割凝血酶原产生凝血酶进一步引起凝血[25]。当血液暴露在阴离子表面或者粗糙表面时, 凝血酶和纤维蛋白会通过一系列反应而产生, 这个过程被称为接触激活。接触激活系统中包含2个关键的酶原(前激肽释放酶和FXII)和1个辅因子HK[26]。FXII与多阴离子化合物结合会触发FXII的自我活化产生FXIIa, FXIIa在HK存在时催化前激肽释放酶(PK)转化为激肽释放酶(KK), 同时KK会活化更多的FXII。FXIIa在HK帮助下进一步活化FXI产生FXIa, FXIa可激活FⅨ产生FⅨa。最后FⅨa偶联凝血因子VIIIa触发凝血因子X的活化和凝血酶的产生。除了FXIIa以外, FXI也可以通过凝血酶来反馈激活, 两者相互作用, 加快形成纤维蛋白[27]。
研究表明, FXIa也可以水解组织因子抑制剂从而促进外源途径的激活[28]。另外, 在这个过程中, 血小板也辅助FXIa参与止血。有趣的是, 独立于FXIIa和接触激活途径, 血小板依赖的多聚磷酸可以增强FXI的活化, 并且短链的polyP能够增强FXIa钝化组织因子途径抑制剂(TFPI)的能力, 这进一步证明了血小板polyP和FXIa在止血过程中的联合作用。因此, FXI在凝血系统和血栓形成中扮演着关键的角色[29, 30]。
3 凝血因子XI抑制剂市面上现有的抗凝药都有一定的不良反应, 如影响正常生理止血。因此, 研究人员致力于寻找能够减少血栓形成而不影响止血的安全抗凝药。在逐渐了解凝血系统后, 人们发现体内FXI放大路径对正常止血必要性不大, 但对血栓形成有更重要的作用, 新抗凝方案探索的目光聚焦到FXI。目前已发现的抑制剂主要包括ASOs、小分子抑制剂和蛋白类抑制剂等。研究表明, 注射给药FXI ASOs效果显著且不良反应较小, 但将FXI的浓度降低到治疗窗的范围需要3~4周注射期, 这一点大大限制FXI ASOs用于治疗已经出现的血栓或者急性血栓[31]。小分子抑制剂可以用于治疗急性或慢性血栓, 起作用迅速但消退也迅速, 需每天多次口服或注射。抗体抑制剂表现出显著的优势, 药物反应迅速, 且药效维持时间长, 给药次数少[32]。不同抑制剂的作用特点见表 1[33-42]。
| Table 1 Comparison of the characteristic of the various factor XI (FXI) directed anticoagulant therapies. ASO: Antisense oligonucleotides |
反义治疗是基于碱基互补配对, 高度特异的ASOs结合到它们的互补目标mRNA上, 随后, 目标mRNA选择性裂解导致靶蛋白表达减少[43]。目前已有多种FXI ASOs的抗栓研究正在进行(表 2)[33-35, 44-46]。
| Table 2 Synthesis of studies on antisense therapy against coagulation factor XI |
利用FXI ASOs降低凝血因子XI表达水平的方法在动物模型中广泛应用。Zhang等[34]于2010年第1次发表应用反义寡核苷酸技术选择性针对FXI所进行的动物实验, 结果显示ASOs在多种血栓模型中均显示出剂量依赖的抗凝活性。其抗凝效果与华法林及伊诺肝素治疗组类似, 而出血低于后两者。Younis等[44]用ASOs治疗2~5岁的亚洲猕猴, 发现在尾部部分切除术或牙龈、皮肤切开术后, 出血时间及出血量并没有大幅上升, 而应用伊诺肝素组出血时间及出血量却较正常增加2~3倍。Crosby等[35]在狒狒体内给药ASOs, 发现血小板过度聚集导致血栓形成的比例相比对照组降低约40%, 而出血时间与对照组差异无统计学意义。Yau等[45]在兔子血栓模型发现ASOs兔子组导管出现血栓时间明显延长, 约为对照组的2倍。在4周龄雄性Apoe基因敲除的C57BL/6小鼠体内给药ASOs, 给药组相比对照组能有效降低血栓形成及纤维蛋白沉积, 而两组的出血时间基本相同[46]。
除了动物实验, 健康人安全试验也证明FXI特异性ASOs可引起FXI活性显著降低。Büller等[33]利用第二代FXI ASOs (ISIS416858)对300例初次进行单侧全膝关节置换术的患者进行了临床试验。患者们被随机分配到ASOs给药组(200 mg及300 mg剂量组)和伊诺肝素组(40 mg, 每天1次)。应用300 mg ASOs给药组的抗栓效果和安全性均优于伊诺肝素处理组。而伊诺肝素处理组注射部位相关不良反应的发生率(3%)低于200 mg ASOs给药组(22%, P < 0.001)及300 mg ASOs给药组(32%, P < 0.001)。
应用反义寡核苷酸技术抑制FXI的表达, 尤其是在动物模型中, 具有明显抗凝作用且不增加出血风险, 该结果在初步的临床试验中也得到验证。但是FXI ASOs的应用仍然存在一些不容忽视的问题, 如怎样确定最佳的起效浓度来抑制血栓形成而不显著增加出血风险、注射点相关不良反应的发生和达到治疗窗的给药时间过长等。因此, FXI ASOs用于治疗血栓性疾病还需要更多前瞻性临床试验及动物实验来进一步验证。
3.2 小分子抑制剂随着对FXIa蛋白结构的揭示以及抗血栓功能研究的不断深入, 目前已设计和合成出多种结构不同的FXIa抑制剂, 以下列举几类重要的小分子抑制剂。
3.2.1 共价抑制剂FXIa上保守的Ser195已被证明是活性必需氨基酸[47]。Lin等[48]报告的一系列酮噻唑类化合物, 如化合物1对FXIa的半数抑制浓度(half maximal inhibitory concentration, IC50)达到12 nmol·L-1, 其选择性高于凝血酶100倍, 高于FXa 1 000倍, 在大鼠血栓模型中也确有效果。百时美施贵宝公司报告的β-内酰胺类化合物BMS-262084 (化合物2[36, 49], IC50 = 2.8 nmol·L-1)是一种有效的共价FXIa抑制剂。与其他相关丝氨酸蛋白酶(如凝血酶、FXa、FⅨa、FXIIa、TF/VIIa、组织纤溶酶原激活剂、尿激酶和纤溶酶)相比, 化合物2对FXIa的选择性提高了70倍以上, 但对类胰蛋白酶和胰蛋白酶选择性不好。同时在大鼠或兔的血栓形成模型中均能观察到化合物2的抗血栓作用。Buchanan等[50]对海绵marine sponge中分离并提取出生物活性溴酚生物碱clavatadine A (化合物3, IC50 = 1.3 μmol·L-1)也是FXIa的共价抑制剂。化合物1、2和3结构见图 1。
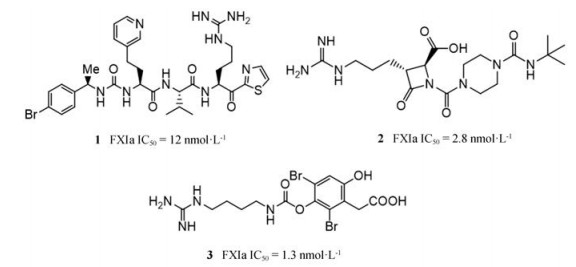
|
Figure 1 Covalent inhibitors of FXIa. IC50: Half maximal inhibitory concentration |
变构抑制剂的特点是不与FXIa催化区的活性位点结合, 其通过与FXIa上多个阴离子变构位点结合, 从而达到抑制作用。Al-Horani等[37]已经发表了一系列的硫酸化五酰吡喃葡萄糖苷作为FXIa的变构抑制剂, 其中化合物4的Ki为521 nmol·L-1, 选择性是其他相关酶的200倍。Argade等[51]报告的变构单硫苯并呋喃二聚体和三聚体也是FXIa抑制剂。其中化合物5可与FXIa的Apple 3域结合, 其IC50达到820 nmol·L-1。目前已公开FXIa变构抑制剂没有能达到与可逆抑制剂同样的活性水平。然而, 变构抑制为抑制FXIa提供了一种替代方法, 为进一步研究更加有效的小分子抑制剂提供了可能。化合物4和5结构见图 2。
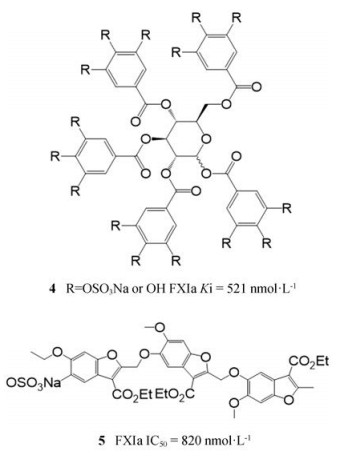
|
Figure 2 Allosteric inhibitors of FXIa. Ki: Inhibition constant |
非循环可逆抑制剂是FXI小分子抑制剂中数量最多的, 主要包括苯丙氨酸类、四氢喹啉类等。
Bayer公司发现苯丙氨酸类衍生物对FXIa具有抑制活性[52], 化合物6和7对FXIa的抑制活性较好(IC50分别为0.9和0.34 nmol·L-1)。该类化合物预期可用于治疗高纤维蛋白溶解性病症、心脏手术失血和器官移植等。
2014年BMS公司通过筛选发现四氢异喹啉类FXIa抑制剂。BMS-962212 (化合物8[53, 54])是BMS公司在2017年报道的一类可逆的并具有高度选择性的FXIa抑制剂。BMS-962212具有良好的FXIa结合亲和力(Ki = 0.71 nmol·L-1)、抗凝血活性(APTT EC1.5 = 0.30 μmol·L-1)和大于3 000倍的选择性(相对于广泛的丝氨酸蛋白酶, 如FVIIa、FⅨa、FXa、FXIIa、凝血酶、胰蛋白酶、活化蛋白C、纤溶酶、TPA、尿激酶和糜蛋白酶)。在家兔动静脉旁路分流模型中效果显著, 对血栓形成有83%的抑制作用(剂量为0.23 mg·kg-1静脉推注+ 1.55 mg·kg-1·h-1静脉滴注)。在兔表皮出血模型中, 2倍于动静脉旁路分流剂量的情况下, 出血时间没有增加。与安慰剂相比, 单独使用或与阿司匹林合用时, 出血时间未见增加, 耐受性良好且无严重不良反应。化合物6、7和8结构见图 3。

|
Figure 3 Acyclic reversible FXIa inhibitors |
大环已被公认为药物开发中的一个重要结构类别, 与相应的无环前体相比, 大环可改善一个或多个结合亲和力、选择性、代谢稳定性和药代动力学特性。BMS公司基于无环苯并咪唑化合物9的X射线晶体结构, 设计了一系列新的大环FXIa抑制剂如化合物10和11, 他们对FXIa亲和力强(Ki = 0.16 nmol·L-1和Ki = 0.03 nmol·L-1), 且两种化合物均具有良好的APTT效价(EC1.5X = 0.27和0.28 μmol·L-1)[55]。虽然大环酰胺键对FXIa的抑制作用至关重要, 但也导致了不良的药代动力学特征, 大环FXIa抑制剂的优化以解决口服生物利用度差的问题将在后续研究中作为重点。化合物9、10和11结构见图 4。

|
Figure 4 Macrocyclic FXIa inhibitors |
尚有几个结构未公布的FXIa抑制剂[47]。ONO制药公司披露了化合物ONO-8610539[47], 它是一种可注射的选择性小分子FXIa抑制剂(Ki = 0.9 nmol·L-1)。据报道, ONO-8610539能够抑制家兔和猴的血栓形成, 而不影响失血量。另一种化合物ONO-7750512[47], 不仅具有良好的FXIa抑制活性(Ki = 3.8 nmol·L-1), 而且在大鼠中口服生物利用度良好(F = 22%)。在深静脉血栓形成模型中, ONO-775051 2在4.0 mg·kg-1·h-1剂量下显著抑制血栓形成, 在兔耳出血模型中未观察到出血增加。同时还提供了口服生物可利用小分子ONO-5450598[47]的数据, 该化合物的FXIa Ki = 2 nmol·L-1, 并且在多个物种中显示出较高的口服生物利用度。在猴血栓模型中, 它在高于0.097 mg·kg-1·h-1的静脉注射剂量下抑制血栓形成, 并且在口服30 mg·kg-1剂量的猴指甲切开模型中没有延长出血时间。日本住友制药有限公司报道的DSR 130787是一个口服的FXIa抑制药物, 其IC50值小于10 nmol·L-1。在兔体内的抗栓效果与FXa抑制剂利伐沙班相当, 但出血风险并不显著[47]。
多项研究显示, FXIa小分子抑制剂在治疗血栓疾病中具有较好的抗栓效果且相对较低的出血风险, 但仍需解决其代谢过快和多次给药等问题。相信随着对FXI蛋白结构、作用机制、生物学活性测试方法等方面研究的深入, FXIa小分子抑制剂的研究会得以快速发展。
3.3 抗体本部分将列举已报道的FXI抗体及其药理学研究结果, 部分抗体已进入临床研究(表 3)[41, 42, 56-60]。
| Table 3 Comparison of the features of the FXI antibodies. APTT: Activated partial thromboplastin time; PT: Prothrombin time; BT: Bleeding time; DVT: Deep venous thrombosis; TKA: Total knee arthroplasty |
Gruber等[56]首先在狒狒动静脉血栓模型中, 发现抗人FXI的多克隆抗体具有抗栓效果, 延长APTT可与肝素相当, 但出血时间明显缩短。因多克隆抗体专一靶向效果不好, 后续人们将研究方向更多专注于抑制FXI不同活性位点的单克隆抗体。如选择性作用于FXI/FXIa的轻链而抑制FXa和FXIa活化的抗体XI-5108[57]; 结合FXI A3结构域的抗体aXIMab[41]; 作用于FXI A2结构域的抗体14E11[42]。另外, David等[58]设计合成了一系列人免疫球蛋白Gs (IgGs), 能抑制FXIa活性, 但不与FXI酶原或其他凝血蛋白酶结合, 其中效果最强的IgGs是C24和DEF。为预防抗体活性过剩, 研究人员还设计合成了一种逆转剂IgG, 可在人血浆和兔体内快速逆转DEF活性。van Montfoort等[59]设计了两种抗人FXI的抗体αFXI-175和αFXI-203, 其中αFXI-175可与FXI的A4结构域结合, αFXI-203与A2结构域结合。前述几种针对FXI靶点的抗体能抑制鼠、兔和狒狒等动物的血栓形成, 也均有出血风险小的优势。
目前已有两种抗体进入临床Ⅱ期试验, 分别是拜耳制药研发的FXIa抗体BAY121379[60]和诺华制药在研的FXI抗体MAA868[60]。
利用专一性抗体可使FXI的活性大大下降, 能在动物或人体内显著抑制血栓形成, 但单抗往往价格昂贵, 且各种抗体的抗栓阈值还有待明确, 使得这些抗体目前均还处于临床前或候选药物研究阶段。同时, 过量的抗体也需要适合的逆转剂与之配合。
3.4 天然产物中分离的蛋白抑制剂除上文中提及的FXI抗体, 尚有很多FXIa的蛋白抑制剂从天然产物中分离得到。如Ma等[61]从蝙蝠唾液腺中对比并重组表达得到蛋白desmolaris, 体外活性显示该蛋白是一个FXIa缓慢的紧密的非竞争性抑制剂(Ki = 12.35 ± 1.09 nmol·L-1)。从带状金环蛇Bungarus fasciatus的毒液分离得到一个特殊的FXIa抑制剂, 名叫fasxiator, 经重新构建后得到的突变体N17R和L19E在FeCl3诱导的血栓形成模型中可延长小鼠颈动脉闭塞时间[62]。另外, 微管连接蛋白酶2的kunitz蛋白酶抑制剂(kunitz protease inhibitor, KPI)结构域(57个氨基酸)也被发现是强效的专一FXIa抑制剂(Ki = 0.5 ± 1.4 nmol·L-1)[63]。上述几种蛋白均能在动物体内较好地抑制血栓的形成且出血风险较低。Gan等[64]从线虫Ancylostoma duodenale中克隆表达并确证一个新的抗凝蛋白—AduNAP4。该蛋白是一个FXa (Ki = 7.34 ± 1.74 nmol·L-1)和FXIa (Ki = 42.45 ± 3.25 nmol·L-1)抑制剂, 可显著延长APTT, 但并未进行动物体内实验。天然产物分离得到的蛋白抑制剂的具体信息见表 4[61-66]。
| Table 4 Comparison of the characteristics of the FXI protein inhibitors |
研究人员已从多种天然来源的物质中分离得到FXI的抑制蛋白, 不仅能够诠释天然产物如蛇毒的抗凝机制, 并且对蛋白进行结构优化或改造, 也为新的FXI蛋白抑制剂的研究发展提供了一条新的思路。
4 结语与展望先天缺乏FXI的患者患缺血性脑卒中及DVT的比率明显降低, 且一般无自发性出血, 提示体内FXI对正常止血必要性不大, 但对血栓形成有更为重要的作用, 多项研究表明抑制FXI活性可明显降低血栓形成且出血风险较小[67]。因此, FXI是研究新抗血栓药物的重要靶点。
目前已有多种抑制剂在研, ASOs效果显著且出血风险较小, 但起效慢且不易控制, 注射点可能出现不良反应等; 小分子抑制剂作用迅速但半衰期较短, 需每天多次口服或注射, 患者依从性较差; 抗体类抑制剂在预防和治疗急性或慢性血栓性疾病中起效迅速且作用时间长久, 临床使用可靠, 但其成本较高, 仍需考虑成本-效益比率。我国具有丰富的天然药物资源, 研究人员已从多种天然产物中分离得到许多抗栓或抗凝的组分, 推动抗栓药的发展。如从Hirudo medicinalis中分离得到的凝血酶抑制剂水蛭素[68], 但水蛭素是凝血酶的不可逆抑制剂。美国Medicines制药公司根据水蛭素蛋白序列设计合成了凝血酶可逆抑制剂比伐卢定, 用于经皮冠状动脉成形术患者[69]。因此, 进一步从天然药物资源中寻找以FXI为靶点的抗血栓药物, 并可以依据其活性位点进行改造, 研究出更加安全、有效且应用范围更广的抗血栓药物, 将可能对血栓性疾病的防治发挥重要的作用。
| [1] | Chen WW, Gao RL, Liu LS, et al. Summary of China cardiovascular disease report 2017[J]. Chin Circ J (中国循环杂志), 2017, 33: 1–8. |
| [2] | Mega JL, Simon T. Pharmacology of antithrombotic drugs:an assessment of oral antiplatelet and anticoagulant treatments[J]. Lancet, 2015, 386: 281–291. DOI:10.1016/S0140-6736(15)60243-4 |
| [3] | Zhu H, Lv YJ, Han XW, et al. Comparison of structural characteristics and anticoagulation activity of enoxaparin sodium with different degree of 1, 6-anhydro derivatives[J]. Acta Pharm Sin (药学学报), 2014, 49: 1049–1053. |
| [4] | Ali MR, Salim Hossain M, Islam MA, et al. Aspect of thrombolytic therapy:a review[J]. ScientificWorldJournal, 2014, 2014: 586510. |
| [5] | Balamuthusamy S, Arora R. Hematologic adverse effects of clopidogrel[J]. Am J Ther, 2007, 14: 106–112. DOI:10.1097/01.mjt.0000212708.81034.22 |
| [6] | Elcioglu OC, Ozkok A, Akpinar TS, et al. Severe thrombocytopenia and alveolar hemorrhage represent two types of bleeding tendency during tirofiban treatment:case report and literature review[J]. Int J Hematol, 2012, 96: 370–375. DOI:10.1007/s12185-012-1133-7 |
| [7] | Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation:a meta-analysis of randomised trials[J]. Lancet, 2014, 383: 955–962. DOI:10.1016/S0140-6736(13)62343-0 |
| [8] | Steiner T, Weitz JI, Veltkamp R. Anticoagulant-associated intracranial hemorrhage in the era of reversal agents[J]. Stroke, 2017, 48: 1432–1437. DOI:10.1161/STROKEAHA.116.013343 |
| [9] | Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation[J]. N Engl J Med, 2009, 361: 1139–1151. DOI:10.1056/NEJMoa0905561 |
| [10] | Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation[J]. N Engl J Med, 2011, 365: 883–891. DOI:10.1056/NEJMoa1009638 |
| [11] | Granger CB, Alexander JH, McMurray JJ, et al. Apixaban versus warfarin in patients with atrial fibrillation[J]. N Engl J Med, 2011, 365: 981–992. DOI:10.1056/NEJMoa1107039 |
| [12] | Rosenthal RL, Dreskin OH, Rosenthal N. New hemophilia-like disease caused by a third plasma thromboplastin factor[J]. Proc Soc Exp Biol Med, 1953, 82: 171–174. DOI:10.3181/00379727-82-20057 |
| [13] | Seligsohn U. Factor XI deficiency in humans[J]. J Thromb Haemost, 2009, 7(Suppl 1): 84–87. |
| [14] | Renne T, Oschatz C, Seifert S, et al. Factor XI deficiency in animal models[J]. J Thromb Haemost, 2009, 7(Suppl 1): 79–83. |
| [15] | Wang X, Cheng Q, Xu L, et al. Effects of factor Ⅸ or factor XI deficiency on ferric chloride-induced carotid artery occlusion in mice[J]. J Thromb Haemost, 2005, 3: 695–702. DOI:10.1111/jth.2005.3.issue-4 |
| [16] | Salomon O, Steinberg DM, Koren-Morag N, et al. Reduced incidence of ischemic stroke in patients with severe factor XI deficiency[J]. Blood, 2008, 111: 4113–4117. DOI:10.1182/blood-2007-10-120139 |
| [17] | Meijers JC, Tekelenburg WL, Bouma BN, et al. High levels of coagulation factor XI as a risk factor for venous thrombosis[J]. N Engl J Med, 2000, 342: 696–701. DOI:10.1056/NEJM200003093421004 |
| [18] | Osterud B, Bouma BN, Griffin JH. Human blood coagulation factor XI, purification, properties, and mechanism of activation by activated factor XⅡ[J]. J Biol Chem, 1977, 252: 6432–6437. |
| [19] | Fujikawa K, Chung DW, Hendrickson LE, et al. Amino acid sequence of human factor XI, a blood coagulation factor with four tandem repeats that are highly homologous with plasma prekallikrein[J]. Biochemistry, 1986, 25: 2417–2424. DOI:10.1021/bi00357a018 |
| [20] | Papagrigoriou E, McEwan PA, Walsh PN, et al. Crystal structure of the factor XI zymogen reveals a pathway for transactivation[J]. Nat Struct Mol Biol, 2006, 13: 557–558. DOI:10.1038/nsmb1095 |
| [21] | McMullen BA, Fujikawa K, Davie EW. Location of the disulfide bonds in human coagulation factor XI:the presence of tandem apple domains[J]. Biochemistry, 1991, 30: 2056–2060. DOI:10.1021/bi00222a008 |
| [22] | Gailani D, Smith SB. Structural and functional features of factor XI[J]. J Thromb Haemost, 2009, 7: 75–78. DOI:10.1111/jth.2009.7.issue-s1 |
| [23] | Emsley J, McEwan PA, Gailani D. Structure and function of factor XI[J]. Blood, 2010, 115: 2569–2577. DOI:10.1182/blood-2009-09-199182 |
| [24] | Macfarlane RG. An enzyme cascade in the blood eclotting mechanism, and its function as a biochemical amplifier[J]. Nature, 1964, 202: 498–499. DOI:10.1038/202498a0 |
| [25] | Schumacher WA, Luettgen JM, Quan ML, et al. Inhibition of factor XIa as a new approach to anticoagulation[J]. Arterioscler Thromb Vasc Biol, 2010, 30: 388–392. DOI:10.1161/ATVBAHA.109.197178 |
| [26] | Long AT, Kenne E, Jung R, et al. Contact system revisited:an interface between inflammation, coagulation, and innate immunity[J]. J Thromb Haemost, 2016, 14: 427–437. DOI:10.1111/jth.2016.14.issue-3 |
| [27] | Fredenburgh JC, Gross PL, Weitz JI. Emerging anticoagulant strategies[J]. Blood, 2017, 129: 147–154. DOI:10.1182/blood-2016-09-692996 |
| [28] | Puy C, Rigg RA, McCarty OJ. The hemostatic role of factor XI[J]. Thromb Res, 2016, 141: S8–S11. DOI:10.1016/S0049-3848(16)30354-1 |
| [29] | Geng Y, Verhamme IM, Smith SB, et al. The dimeric structure of factor XI and zymogen activation[J]. Blood, 2013, 121: 3962–3969. DOI:10.1182/blood-2012-12-473629 |
| [30] | Choi SH, Smith SA, Morrissey JH. Polyphosphate is a cofactor for the activation of factor XI by thrombin[J]. Blood, 2011, 118: 6963–6970. DOI:10.1182/blood-2011-07-368811 |
| [31] | Chen YH, Liu D, Peng LF. Research progress of coagulation factor XI as a new target of anti-thrombotic therapy[J]. Chin Pharmacol Bull (中国药理学通报), 2015, 31: 619–622. |
| [32] | Weitz JI. Factor XI and factor XⅡ as targets for new anticoagulants[J]. Thromb Res, 2016, 141: S40–S45. DOI:10.1016/S0049-3848(16)30363-2 |
| [33] | Büller HR, Bethune C, Bhanot S, et al. Factor XI antisense oligonucleotide for prevention of venous thrombosis[J]. N Engl J Med, 2015, 372: 232–340. DOI:10.1056/NEJMoa1405760 |
| [34] | Zhang H, Lowenberg EC, Crosby JR, et al. Inhibition of the intrinsic coagulation pathway factor XI by antisense oligonucleotides:a novel antithrombotic strategy with lowered bleeding risk[J]. Blood, 2010, 116: 4684–4692. DOI:10.1182/blood-2010-04-277798 |
| [35] | Crosby JR, Marzec U, Revenko AS, et al. Antithrombotic effect of antisense factor XI oligonucleotide treatment in primates[J]. Arterioscler Thromb Vasc Biol, 2013, 33: 1670–1678. DOI:10.1161/ATVBAHA.113.301282 |
| [36] | Wong PC, Crain EJ, Watson CA, et al. A small-molecule factor XIa inhibitor produces antithrombotic efficacy with minimal bleeding time prolongation in rabbits[J]. J Thromb Thrombolysis, 2011, 32: 129–137. DOI:10.1007/s11239-011-0599-0 |
| [37] | Al-Horani RA, Desai UR. Designing allosteric inhibitors of factor XIa. Lessons from the interactions of sulfated pentagalloylglucopyranosides[J]. J Med Chem, 2014, 57: 4805–4818. DOI:10.1021/jm500311e |
| [38] | Al-Horani RA, Ponnusamy P, Mehta AY, et al. Sulfated pentagalloylglucoside is a potent, allosteric, and selective inhibitor of factor XIa[J]. J Med Chem, 2013, 56: 867–878. DOI:10.1021/jm301338q |
| [39] | Deng H, Bannister TD, Jin L, et al. Synthesis, SAR exploration, and X-ray crystal structures of factor XIa inhibitors containing an alpha-ketothiazole arginine[J]. Bioorg Med Chem Lett, 2006, 16: 3049–3054. DOI:10.1016/j.bmcl.2006.02.052 |
| [40] | Quan ML, Wong PC, Wang C, et al. Tetrahydroquinoline derivatives as potent and selective factor XIa inhibitors[J]. J Med Chem, 2014, 57: 955–969. DOI:10.1021/jm401670x |
| [41] | Tucker EI, Marzec UM, White TC, et al. Prevention of vascular graft occlusion and thrombus-associated thrombin generation by inhibition of factor XI[J]. Blood, 2009, 113: 936–944. DOI:10.1182/blood-2008-06-163675 |
| [42] | Cheng Q, Tucker EI, Pine MS, et al. A role for factor XⅡa-mediated factor XI activation in thrombus formation in vivo[J]. Blood, 2010, 116: 3981–3989. DOI:10.1182/blood-2010-02-270918 |
| [43] | Bennett CF, Swayze EE. RNA targeting therapeutics:molecular mechanisms of antisense oligonucleotides as a therapeutic platform[J]. Annu Rev Pharmacol Toxicol, 2010, 50: 259–293. DOI:10.1146/annurev.pharmtox.010909.105654 |
| [44] | Younis HS, Crosby J, Huh JI, et al. Antisense inhibition of coagulation factor XI prolongs APTT without increased bleeding risk in cynomolgus monkeys[J]. Blood, 2012, 119: 2401–2408. DOI:10.1182/blood-2011-10-387134 |
| [45] | Yau JW, Liao P, Fredenburgh JC, et al. Selective depletion of factor XI or factor XⅡ with antisense oligonucleotides attenuates catheter thrombosis in rabbits[J]. Blood, 2014, 123: 2102–2107. DOI:10.1182/blood-2013-12-540872 |
| [46] | van Montfoort ML, Kuijpers MJ, Knaup VL, et al. Factor XI regulates pathological thrombus formation on acutely ruptured atherosclerotic plaques[J]. Arterioscler Thromb Vasc Biol, 2014, 34: 1668–1673. DOI:10.1161/ATVBAHA.114.303209 |
| [47] | Quan ML, Pinto DJP, Smallheer JM, et al. Factor XIa inhibitors as new anticoagulants[J]. J Med Chem, 2018, 61: 7425–7447. DOI:10.1021/acs.jmedchem.8b00173 |
| [48] | Lin J, Deng HF, Jin L, et al. Design, synthesis, and biological evaluation of peptidomimetic inhibitors of factor XIa as novel anticoagulants[J]. J Med Chem, 2006, 49: 7781–7791. DOI:10.1021/jm060978s |
| [49] | Schumacher WA, Seiler SE, Steinbacher TE, et al. Antithrombotic and hemostatic effects of a small molecule factor XIa inhibitor in rats[J]. Eur J Pharmacol, 2007, 570: 167–174. DOI:10.1016/j.ejphar.2007.05.043 |
| [50] | Buchanan MS, Carroll AR, Wessling D, et al. Clavatadine A, a natural product with selective recognition and irreversible inhibition of factor XIa[J]. J Med Chem, 2008, 51: 3583–3587. DOI:10.1021/jm800314b |
| [51] | Argade MD, Mehta AY, Sarkar A, et al. Allosteric inhibition of human factor XIa:discovery of monosulfated benzofurans as a class of promising inhibitors[J]. J Med Chem, 2014, 57: 3559–3569. DOI:10.1021/jm5002698 |
| [52] | Wang L, Yang H, Zhao LH, et al. Research progress in small molecular inhibitors of coagulation factor XIa[J]. Prog Pharm Sci (药学进展), 2018, 42: 62–68. |
| [53] | Pinto DJP, Orwat MJ, Smith LM, et al. Discovery of a parenteral small molecule coagulation factor XIa inhibitor clinical candidate (BMS-962212)[J]. J Med Chem, 2017, 60: 9703–9723. DOI:10.1021/acs.jmedchem.7b01171 |
| [54] | Perera V, Luettgen JM, Wang Z, et al. First-in-human study to assess the safety, pharmacokinetics and pharmacodynamics of BMS-962212, a direct, reversible, small molecule factor XIa inhibitor in non-Japanese and Japanese healthy subjects[J]. Br J Clin Pharmacol, 2018, 84: 876–887. DOI:10.1111/bcp.v84.5 |
| [55] | Corte JR, Fang T, Osuna H, et al. Structure-based design of macrocyclic factor XIa inhibitors:discovery of the macrocyclic amide linker[J]. J Med Chem, 2017, 60: 1060–1075. DOI:10.1021/acs.jmedchem.6b01460 |
| [56] | Gruber A, Hanson SR. Factor XI-dependence of surface-and tissue factor-initiated thrombus propagation in primates[J]. Blood, 2003, 102: 953–955. DOI:10.1182/blood-2003-01-0324 |
| [57] | Yamashita A, Nishihira K, Kitazawa T, et al. Factor XI contributes to thrombus propagation on injured neointima of the rabbit iliac artery[J]. J Thromb Haemost, 2006, 4: 1496–1501. DOI:10.1111/jth.2006.4.issue-7 |
| [58] | David T, Kim YC, Ely LK, et al. Factor XIa-specific IgG and a reversal agent to probe factor XI function in thrombosis and hemostasis[J]. Sci Transl Med, 2016, 8: 353r. |
| [59] | van Montfoort ML, Knaup VL, Marquart JA, et al. Two novel inhibitory anti-human factor XI antibodies prevent cessation of blood flow in a murine venous thrombosis model[J]. Thromb Haemost, 2013, 110: 1065–1073. DOI:10.1160/TH13-05-0429 |
| [60] | Tillman BF, Gruber A, McCarty OJT, et al. Plasma contact factors as therapeutic targets[J]. Blood Rev, 2018, 32: 433–448. DOI:10.1016/j.blre.2018.04.001 |
| [61] | Ma D, Mizurini DM, Assumpcao TC, et al. Desmolaris, a novel factor XIa anticoagulant from the salivary gland of the vampire bat (Desmodus rotundus) inhibits inflammation and thrombosis in vivo[J]. Blood, 2013, 122: 4094–4106. DOI:10.1182/blood-2013-08-517474 |
| [62] | Chen W, Carvalho LP, Chan MY, et al. Fasxiator, a novel factor XIa inhibitor from snake venom, and its site-specific mutagenesis to improve potency and selectivity[J]. J Thromb Haemost, 2015, 13: 248–261. DOI:10.1111/jth.2015.13.issue-2 |
| [63] | Wu W, Li H, Navaneetham D, et al. The kunitz protease inhibitor domain of protease nexin-2 inhibits factor XIa and murine carotid artery and middle cerebral artery thrombosis[J]. Blood, 2012, 120: 671–677. DOI:10.1182/blood-2012-03-419523 |
| [64] | Gan W, Deng L, Yang C, et al. An anticoagulant peptide from the human hookworm, Ancylostoma duodenale that inhibits coagulation factors Xa and XIa[J]. FEBS Lett, 2009, 583: 1976–1980. DOI:10.1016/j.febslet.2009.05.009 |
| [65] | Navaneetham D, Jin L, Pandey P, et al. Structural and mutational analyses of the molecular interactions between the catalytic domain of factor XIa and the Kunitz protease inhibitor domain of protease nexin 2[J]. J Biol Chem, 2005, 280: 36165–36175. DOI:10.1074/jbc.M504990200 |
| [66] | Navaneetham D, Sinha D, Walsh PN. Mechanisms and specificity of factor XIa and trypsin inhibition by protease nexin 2 and basic pancreatic trypsin inhibitor[J]. J Biochem, 2010, 148: 467–479. DOI:10.1093/jb/mvq080 |
| [67] | Yu HW, Ye H. Coagulation factor XI——a new target for antithrombotic therapy[J]. Prac J Med Pharm (实用医药杂志), 2014, 31: 170–172. |
| [68] | Corral-Rodriguez MA, Macedo-Ribeiro S, Pereira PJ, et al. Leech-derived thrombin inhibitors:from structures to mechanisms to clinical applications[J]. J Med Chem, 2010, 53: 3847–3861. DOI:10.1021/jm901743x |
| [69] | Warkentin TE, Greinacher A, Koster A. Bivalirudin[J]. Thromb Haemost, 2008, 99: 830–839. DOI:10.1160/TH07-10-0644 |
 2019, Vol. 54
2019, Vol. 54


