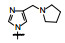
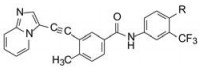
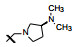
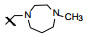
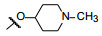
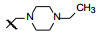
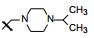
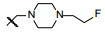
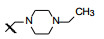
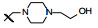
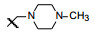
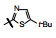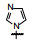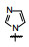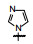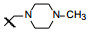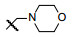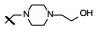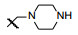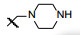新药创制是复杂的智力活动, 涉及科学研究、技术创造、产品开发和医疗效果等多维科技活动。每个药物都有自身的研发轨迹, 而构建化学结构是最重要的环节, 因为它涵盖了药效、药代、安全性和生物药剂学等多维性质。本栏目以药物化学视角, 对有代表性的药物的成功构建, 加以剖析和解读。
帕那替尼与伊马替尼为同类产品, 都是口服治疗慢性粒细胞白血病药物, 虽面市晚10年, 却是针对伊马替尼耐药的患者, 创新性显著, 在研发的源头性和路径上具有独立和独创的品格。在设计理念和化学模块的应用方面虽然从同类药物中有所借鉴, 但在分子设计—合成—评价—构效关系分析的循环反馈中, 将结构生物学、分子模拟和药物化学的交织应用与印证, 做到了精雕细刻的考察, 甚至是反复地验证, 呈现给读者创药的艰辛与严谨。
(编者按)
慢性粒细胞白血病(CML)是由于细胞核中第9号和第22号染色体的相互易位, 使后者变短, 被称作费城短染色体, 它携带有Bcr-Abl癌基因, 表达产物为嵌合的Bcr-Abl融合蛋白, 这个融合蛋白含有激活的Abl酪氨酸激酶结构域, 导致细胞内信号转导的失控, 引起CML的发生。2001年上市的伊马替尼是首创的强效Bcr-Abl抑制剂, 治疗慢性粒细胞白血病, 也开创了靶向药物分子治疗的新领域。但“道高一尺, 魔高一丈”, 患者反复应用伊马替尼, 刺激了Bcr-Abl激酶发生变异, 是白血病细胞获得性伊马替尼抗性的原因所在。此外, 耐受伊马替尼的白血病细胞的Src家族的激酶也过分表达。所以, 治疗耐受伊马替尼的CML, 应是针对Src/Abl的双重抑制剂。
伊马替尼对激酶的选择性抑制作用, 是由于结合在Abl裂隙处的P环套(P-loop)和活化环套处(A-loop), 使得活化环套的构象发生变化, 组成A-loop的DFG域(Asp-Phe-Gly)被挤出, 移动了10 Å, 呈非活化的DFG-out状态, 形成新的疏水腔, 供伊马替尼占据, 所以结合于DFG-out的激酶抑制剂选择性较强(Wang Y, Metcalf CA, Shakespeare WC, et al. Bone-targeted 2, 6, 9-trisubstituted purines: novel inhibitors of Src tyrosine kinase for the treatment of bone diseases. Bioorg Med Chem Lett, 2003, 13: 3067-3070)。
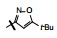
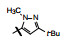
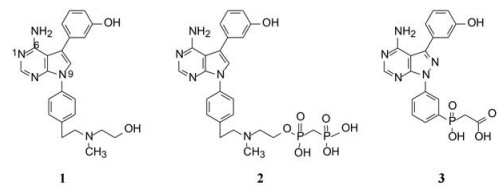
1 源于骨质疏松药物的研究 1.1 Src酪氨酸激酶抑制剂的研究帕那替尼也是治疗CML药物, 但开始的研究没有借鉴和模拟伊马替尼的思路, 而是源于研究骨质疏松药物。实验证明, Src过表达可引起骨质疏松, Src基因敲除小鼠可避免骨质疏松的发生, 在酪氨酸激酶中Src与骨质疏松关系密切。基于此, ARIAD公司确定以Src激酶为靶标研制抗骨质疏松药物。选择嘧啶并吡咯和嘧啶并吡唑类化合物作为筛选苗头, 源于诺华和辉瑞公司曾报道过这类化合物具有活性。ARIAD通过分子对接和设计合成, 发现化合物1抑制Src激酶IC50值40 nmol·L-1, 进而变换结构, 化合物2和3的IC50值分别为4 nmol·L-1和20 nmol·L-1。
|
化合物1~3分子对接表明, 6-氨基嘧啶并吡(唑)咯环占据ATP的腺嘌呤位置, 氨基和N1分别与Met341和Ser342形成两组氢键, N9-苯环相当于核糖的疏水面, 所连的极性链未与酶接触, 进入水相中, 磷(膦)酸基的引入有助溶作用, 也是亲骨组织基团(Sundaramoorthi R, Shakespeare WC, Keenan TP, et al. Bone-targeted Src kinase inhibitors: novel pyrrolo-and pyrazolopyrimidine analogues. Bioorg Med Chem Lett, 2003, 13: 3063-3066)。
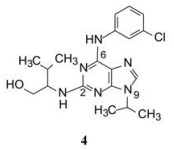
1.2 另一研发路径:基于依赖周期蛋白激酶研发骨质疏松药物在研究上述内容的同时, ARIAD还启动了以依赖周期蛋白激酶(CDK)为靶标, 研发抗骨质疏松的课题。2, 6, 9-三取代嘌呤化合物purvalanol A (4)是CDK强效抑制剂。将4与Src激酶作分子对接, 嘌呤环处于ATP结合的位点, 但环的取向和氢键形成方式与ATP不同, C6的NH与Ser320、N7的氮原子与Met319形成氢键(图 1)。
|

|
Figure 1 Hydrogen bonds formation in docking compound 4 to Src kinase |
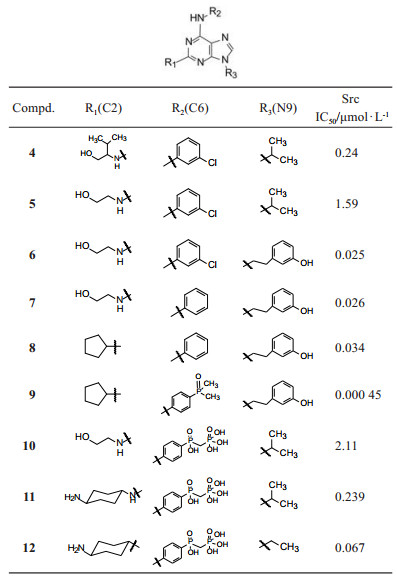
化合物4抑制CDK2的活性IC50高达70 nmol·L-1, 但抑制与骨质疏松相关的Src激酶活性不高, IC50值0.24 μmol·L-1, 由此设计合成了在嘌呤2, 6, 9-位变换不同取代的化合物, 表 1列出了化合物的结构与其活性(Wang W, Metcalf CA, III, Shakespeare WC, et al. Bone-targeted 2, 6, 9-trisubstituted purines: novel inhibitors of Src tyrosine kinase for the treatment of bone diseases. Bioorg Med Chem Lett, 2003, 13: 3067-3070)。
| Table 1 Structures and activity of 2, 6, 9-trisubstituted purine compounds |
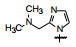
将化合物4的R1异丙基去除, 5的活性降低了6倍。将5的R2异丙基换作间羟基苯乙基, 6的活性为0.025 μmol·L-1, 提示这个较大的片段有利于同靶标的结合。化合物6的R3的氯苯基去除氯原子得到7, 活性不受影响。R1的烷胺基换成环戊基, 如化合物8的活性稍有降低, 而R2的苯环对位连接氧化膦基或亚甲二膦酸基, 对影响骨生成的Src激酶抑制活性很强, 其中9活性最高, IC50 0.45 nmol·L-1, 代号为AP23464, 为里程碑式化合物。
1.3 化合物9与Src激酶的结合模式图 2是化合物9与Src激酶复合物单晶在ATP结合腔中的相互作用图, 9处于Leu273、Val281、Ala293、Thr338、Tyr340和Leu393等疏水侧链组成的疏水腔中, 疏水链相向于9的平面环, 而9的极性片段面背于疏水链。嘌呤环的N7与Met341骨架的CO-NH形成氢键, N9相连的3-羟基乙苯基深插入结合腔内, 羟基与Lys239、Glu310和Asp404的极性侧链通过与结构水形成氢键网络。膦酸基进入水相中助溶, 但也经水分子与端口的Trp340形成弱的氢键。C2相连的环戊基占据了ATP的核糖位置, 佐证了核糖一侧亲水另侧疏水的性质。
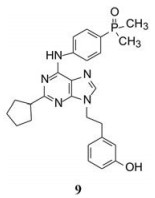
|
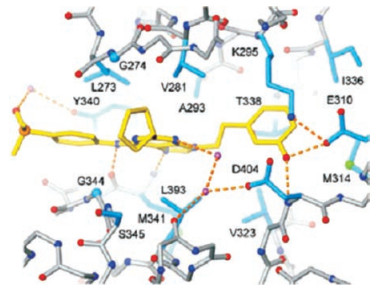
|
Figure 2 Crystallograph of the complex of compound 9 and Src kinase |
持续应用伊马替尼引起的耐药性是由于激酶的突变, 除了Abl变异之外, Src酪氨酸激酶家族的Lyn、Hck和Lyn等也发生突变, ARIAD进而以耐药的CML为目标, 研究对Src/Abl双靶标抑制的药物。
2.2 活性评价化合物的体外活性评价用以下模型:对Src和Abl激酶的抑制活性, 和用K562 [表达有野生型Bcr-Abl (WT)人CML细胞], 转染野生型Bcr-Abl的Ba/F3细胞, 评价对两株细胞的抑制活性。实验表明, 化合物的抑酶活性与抑制细胞活性的构效关系具有平行性。
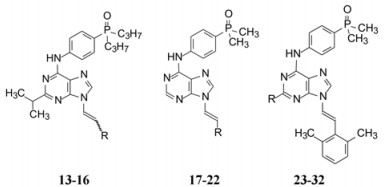
2.3 以化合物9为先导物的分子设计 2.3.1 N9亚乙基链的刚性化化合物9对两个激酶Src/Abl的抑制作用IC50都低于1 nmol·L-1, 根据9与Src晶体结构信息, 认为将亚乙基的柔性连接基刚性化, 以固定末端苯环的取向, 应能提高活性。用分子对接方法将N9连接的乙苯基变换成trans-乙烯苯(13), 由于双键的定向作用, 使苯基结合于激酶突变后产生的特异性疏水腔。同时也合成了cis-乙烯苯(14)以验证对接结果, 活性评价表明反式异构体13的活性显著强于顺式体14。进而模仿达沙替尼的结构片段, 合成了trans-乙烯2, 6-二甲苯基化合物(15)和cis-乙烯2, 6-二甲苯基(16), 抑制酶和细胞的活性进一步提高。表 2列出了结构变换的化合物及其活性。
| Table 2 Structure and activity of varied substituents on purine ring |
然而, 化合物13和15对Src和Abl抑制活性相差较大, 为提高对Abl激酶的活性, 特别是抑制白血病细胞的活性, 将二丙膦氧基片段换为体积较小的二甲基化合物17, 拉近了对Src和Abl的活性, 为此固定二甲基膦氧基不变, 变换N9乙烯基连接的芳环。
2.3.2 变换N9连接的化合物化合物17 (2, 6-二甲基苯)和18 (2-氯-6-甲基苯)对两个酶都有较高活性, 而且相近。只单边取代的化合物19活性降低。进而根据化合物9与Src晶体结构该处的氢键网络, 合成的吲哚(20)和吲唑(21)化合物活性降低, 可认为是单边取代的缘故。而5-甲基-4-吲唑化合物22活性显著提高, 可视作2, 6-双取代物, 分子对接表明甲基进入到一个由Ala293、Lys295和Thr338组成的小疏水腔中, 提供了熵的有利贡献。
2.3.3 C2取代基的变换为了考察C2的不同取代对活性的影响, 在C2引入了经C、N和O连接的基团, 表明对酶和细胞的抑制活性都显著提高, 尤其是化合物25~32对Src活性增高10倍以上, 这是因为从化合物9与Src激酶的晶体结构揭示, C2连接的疏水基团与P-环套(容纳ATP核糖疏水面, 核糖环面一边亲水, 一边疏水)发生疏水相互作用。然而Abl的P-环套折叠方式(构象)不同, Tyr272残基部分地占据了空间, 与C2的取代基有所碰撞, 故而活性相对较弱。
3 另一路径—设计DFG-out构象的抑制剂上述以化合物9为先导物所优化的双重抑制剂, N9连接的片段所结合的位点是活化环套的DFG呈与ATP结合的状态, 即结合于DFG-in构象的抑制剂。同时进行的另一途径是合成激酶的活化环套呈DFG-out构象的抑制剂, 犹如伊马替尼结合样式。
3.1 分子对接提示的信息Abl激酶与抑制剂的晶体结构表明, 当活化环套呈DFG-out构象时, 抑制剂N9连接的二芳酰胺片段与酶形成了氢键网络, 故而设计了化合物33并向呈DFG-out构象的Abl (伊马替尼的结合状态)作分子对接, 如图 3所示。
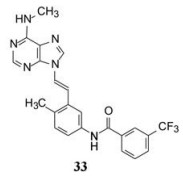
|
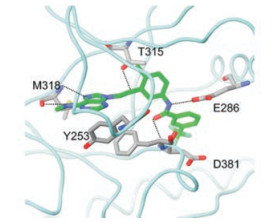
|
Figure 3 Docking diagram of compound 33 to Abl kinase |
化合物33与Abl形成4组氢键:绞链区的Met318与N7和C1上的甲胺NH生成两组氢键, N9连接的酰胺与DFG的Asp381以及Glu286又形成两组氢键。末端的三氟甲苯基进入只有DFG-out构象才能形成的小疏水腔中(是由Ile293、Leu298、Leu354和Val379构成)。此外, 反式双键与门户残基(gatekeeper) Thr315的羟基形成非经典型氢键。也由于DFG-out构象的缘故在C2处已没有当初容纳ATP核糖的空间, 因而不宜有C2取代基。因此, 针对DFG-out构象的设计只能限制于C6和N9两位点的变换, 而不能是前述的2, 6, 9-三位点的变换。
3.2 C6取代基的变换合成了上述对接设计的化合物33 (表 3), 活性评价结果证实对Src和Abl都有较高活性, 而且抑制白血病细胞活性也达到亚纳摩尔水平, 而且在10 μmol·L-1浓度下对正常细胞无作用, 提示有高选择性。大鼠药代动力学实验表明33的口服利用度(F) 20%, 半衰期很短, 是由于C6的甲胺基发生氧化去甲基作用。故而合成了环丙基化合物34 (环丙基代谢稳定性高于甲基), 仍保持了酶和细胞活性, 而改善了药代, F= 40%, 血浆中有高暴露量。环丙基的亲脂性强于甲基, 推论进一步增高亲脂性会有利于活性。为此合成了芳环35~40, 吡啶和嘧啶化合物活性都很高, 但2-吡啶基化合物35却很低, 可能是由于2'-N与嘌呤N1的电性排斥作用, 芳环扭转, 破坏了共面性, 而36和37没有排斥作用(但嘧啶也有邻位排斥作用, 活性下降却不明显)。化合物39移植了9的模块, 酶和细胞活性特别高。40的活性很弱。然而这些高活性化合物的大鼠药代都不好, 因而将C6-环丙胺基固定做进一步优化。
| Table 3 Structures and activity of varied C6 substituent. NT = not test |
优化N9位置, 借鉴了诺华的尼洛替尼的设计理念, 合成了脲基和反向酰胺连接的化合物41和42。41几乎没有活性, 而42 (-CONH-)比区域异构体34 (-NHCO-)活性强, 犹如尼洛替尼活性强于伊马替尼(成功的模拟)。为此, 以42为新起点, 优化末端芳环。表 4列出了化合物的结构与活性。
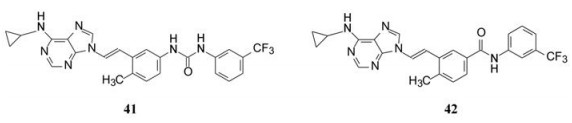
|
| Table 4 Structures and activity of prepared compounds based on lead compound 42 |
分析表 4的构效关系表明, 在三氟甲苯基环上再加入卤素(43, 44)活性减弱, 三氟甲基换成叔丁基(45), 对Src活性提高一倍多, 但抑制Abl作用降低, 提示这两种激酶结合腔的差异。化合物46为异丙基, 酶和细胞活性都比叔丁基弱。然而45亲脂性过强, c-log P 6.76, 超过化合物42, 综合考虑45不可取。含叔丁基的芳杂环化合物中异噁唑48的酶与细胞活性都很强, 但大鼠药代不如42。化合物50的活性优于42, 而且亲脂性比42降低10倍。有趣的是, 将上市药物尼洛替尼的“大块片段”连接在酰胺上, 化合物51活性非常高, 说明该优化的模块适用于本系列中, 也意味着与激酶结合的相似性。
3.4 连接基乙烯基的变换持续应用伊马替尼可引起Abl激酶发生变异(AblT315I), 即门户残基Thr315突变Ile315, T315I突变的后果, 是氨基酸侧链由CH(CH3)OH变成CH(CH3)CH2CH3, 不仅体积变大, 空间上阻碍了伊马替尼的进入, 而且失去形成氢键的能力(羟基O为氢键接受体)。
化合物51对AblT315I激酶有中等强度的活性, 提示该系列化合物的结构特征对门户残基的Abl变异仍可结合。将51与AblT315I分子对接, 揭示出窄长的乙烯基与Ile315没有明显的位阻现象(图 4的绿色分子)。进而设想将乙烯基换成直线型的乙炔基(图 4的蓝色分子)更能解除位阻效应。为此将乙烯基和乙炔基与有强结合作用的芳环进行组合优化, 合成的有代表性的化合物和活性列于表 5。
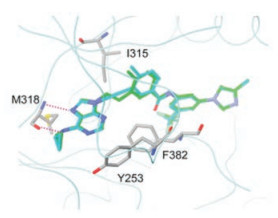
|
Figure 4 Docking diagram of compound 51 (green) and acetylene analog (cyan) to AblT315I kinase |
| Table 5 Activity of compounds with varied linker and substituent on phenyl group |
表 5的数据提示, 化合物54与53比较(同样56与55相比)虽然对未变异的Abl的活性相近, 但对变异的激酶活性提高了30~40倍, 对变异的细胞提高了5~10倍。这些结果说明乙炔基是优化的连接基, 实验证明了乙炔基更解除了对Ile315的空间障碍。然而化合物54和56的药代动力学性质不佳, 尤其是迅速代谢消除的缺点, 须进一步优化(Huang WS, Zhu X, Wang Y, et al. 9-(Arenethenyl) purines as dual Src/ABL kinase inhibitors targeting the inactive conformation: design, synthesis, and biological evaluation. J Med Chem, 2009, 52: 4743-4756)。
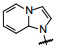
3.5 骨架迁越—更换嘌呤环乙炔基作为连接嘌呤N9与苯环的连接基, 是N-C≡C-C的炔胺结构, 在化学和药动学上不如C-C≡C-C稳定。试图变换嘌呤环结构, 想到了8-氨基咪唑[1, 2-a]并吡啶的母核, 因为8-氨基与N1可与激酶形成两组氢键, 替换嘌呤环形成氢键的元件。合成的化合物列于表 6。
| Table 6 Activity of the imidazolo-pyridine compounds |
化合物57和58的细胞活性都很高, 证明了骨架迁越的成功, 但大鼠的药代动力学不佳, 根据既往的经验, 在相对于C8位置的嘌呤环上有氨基或乙酰氨基的化合物药代都欠佳, 因而合成了没有氨基的化合物59, 保持了对变异酶的活性, 而且改善了大鼠药代, 口服利用度42%。但细胞活性弱于57, 即使在咪唑环上引入助溶基团60和61活性仍不高。进而还得以新的途径优化活性。
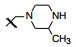
4 增加与活化环套的结合—模拟伊马替尼的结构设计在已有优化的基础上再提高与AblT315I酶的结合作用, 探索增加与活化环套(A-loop)的残基结合。设计在末端苯环上引入哌嗪基, 含以下意图:①哌嗪的N4在生理pH下质子化, 若位置合适可与活化环套的Ile360形成氢键, 会对结合提供焓的正贡献; ②哌嗪环是助溶基团, 有利于溶解和降低亲脂性; ③在哌嗪与苯环之间用亚甲基连接, 避免了N原子直接连于苯环而成为苯胺样片段, 会引起代谢的复杂性。也因嵌入亚甲基增加了局部的柔性, 有利于哌嗪的结合, 这与伊马替尼的设计不谋而合(或许是借鉴)。通过分子模拟设计了化合物62, 表明确实可与Ile360发生氢键结合(图 5)
|
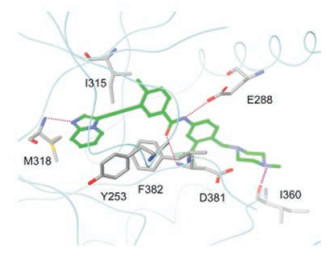
|
Figure 5 Docking diagram of compound 62 to AblT315I kinase |
合成后评价化合物62的活性结果表明, 对AblT315I激酶活性比59提高2倍, 细胞活性提高20倍, 而且在高浓度(340 μmol·L-1)人血浆白蛋白存在下对白血病细胞抑制活性并不减弱, 提示与血浆蛋白结合的较少, 因而成为一个很好的突破口。若将哌嗪片段移至5位, 活性减弱, 提示位置的重要性。下一步优化碱性片段都在苯环的4位。
表 7列出了变换碱基片段的活性结果, 化合物62的哌嗪N4被氧原子替换, 吗啉化合物63活性显著减弱, 佐证了N4形成氢键的重要性。64和65分别为缩环和扩环化合物, 虽然也存在类似于哌嗪N4的氮原子, 但这两个化合物的活性弱于62, 分子对接表明, 62的哌嗪环除与Ile360氢键结合外, 还与Val289、Phe359和Asp381有范德华作用, 推测64和65的环有不适宜或碰撞的因素。将62的N-CH3换成较大的烷基或氟(或羟)乙基(69、70)都不利于抑制突变株。优化结果表明63为该系列最佳化合物。
| Table 7 Activity of the compounds with alkali substituent on the terminal phenyl ring |
回顾优化路径, 由嘌呤变吡咯并吡啶, 乙烯基变乙炔基, 胺酰基变酰胺基, 末端苯环引入亚甲哌嗪片段, 至此似乎都已实现了优化状态。再回到母核本身, 当分子的其他部分都呈优化状态下吡咯并吡啶是否仍为最佳选择, 尚需进一步考察, 为此, 变换杂环, 化合物的结构与活性列于表 8。
| Table 8 Activity of compounds with varied core structure |
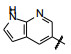
当初由8-氨基咪唑并吡啶去除(环外)氨基以改善药代时, 损失了一些活性(权衡结果划算), 现在为弥补该损失, 合成了增加杂环内的NH, 以提供氢键给体。化合物73~76的活性表明, 73和76对变异细胞株略有提高, 但74和75活性降低。另一思路是, 为了降低62的亲脂性(clog P 6.69), 在吡唑并吡啶环的不同位置加入一个氮原子(加一氮原子分配系数降低1个对数单位), 化合物78和79活性显著提高, 尤其是79。77的低活性是由于杂环的8位是用氢键接受体占据了氢键给体的位置, 从而发生互相排斥的缘故。79的大鼠药代优于78, 下一步是对母核换作咪唑并吡啶后的继续优化。
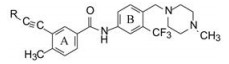
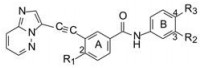
6 新骨架的各取代基的综合调整以化合物79为新一轮优化的起点, 在苯环A的2位变换甲基(称作旗甲基, flag-methyl), 苯环B的3, 4位变换三氟甲基和碱基, 对结构进行微调, 化合物及其活性列于表 9。
| Table 9 Activity of compounds with varied substituents on two phenyl rings |
表 9构效关系分析如下: ① N4-甲基哌嗪换成体积较大的烷基(80、81)对白血病变异细胞的抑制活性基本不变, 而N4无取代基(82)或没有哌嗪片段(88)的活性降低; ② A环的甲基换成氯原子活性不变, 而小尺寸的H和F原子(83、85)活性降低, 可以认为是小体积不足以起到调节构象的作用; ③ B环的三氟甲基是必需基团。
7 新骨架下乙炔连接基的再检讨各个位置进行多轮优化后, 再考察由亚乙基→乙烯基→乙炔基的优化程式是否仍然有效, 表 10列出了3个化合物的活性比较, 表明乙炔基仍然是高效的连接基团, 线型棒状的乙炔基避开了Ile315的阻挡, 而亚乙基和反式乙烯基没能(完全)绕开。
| Table 10 Effect of varied linkers in the novel skeleton on activity |
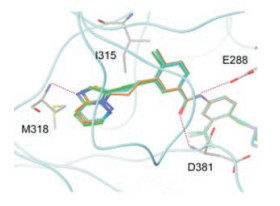
图 6比较化合物79与AblT315I激酶的晶体结构和89与90对接模型, 虽然这个方向投影图没有分辨出太大区别, 但“庞大的”Ile315横空阻挡, 突出影响了细胞水平的活性(Huang WS, Metcalf CA, Sundaramoorthi R, et al. Discovery of 3-[2-(imidazo[1, 2-b]pyridazin-3-yl)ethynyl]-4-methyl-N-{4-[(4-methylpiperazin-1-yl)-methyl]-3-(trifluoromethyl)phenyl}benzamide (AP24534), a potent, orally active pan-inhibitor of breakpoint cluster region-abelson (BCR-ABL) kinase including the T315I gatekeeper mutant. J Med Chem, 2010, 53: 4701-4719)。
|
Figure 6 Crystallographic diagram of the complex between 79 and AblT315I kinase and docking diagram of 89 and 90 to AblT315I kinase |
|
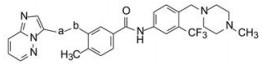
化合物79胜出为候选化合物, 与各个里程碑化合物作了药代动力学比较, 79大鼠灌胃的生物利用度18%, 半衰期11 h, 静脉注射的清除率0.65 L·h-1·kg-1。79定名为帕那替尼(ponatinib), 临床前和临床实验, 表明对慢性粒细胞白血病和费城染色体阳性的急性白血病有效, 于2012年经美国FDA批准上市。
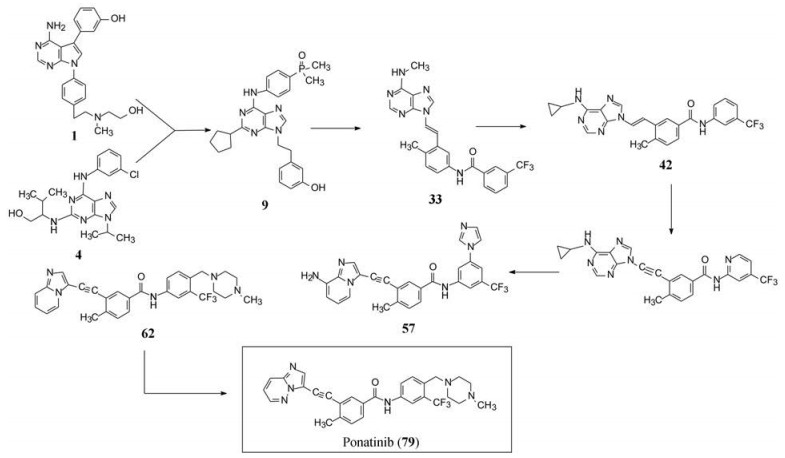
9 小结帕那替尼是一个线型分子, 它的研制涉及了整个分子所有的基团和片段的优化, 虽然同类产品伊马替尼在它10年前面市, 也在设计上有所借鉴, 但仍不失为创新性药物。在分子设计−合成−评价−构效关系分析的循环反馈中, 结构生物学、分子模拟和药物化学的交织应用与印证, 对结构的各个侧面做到了精雕细刻的考察, 甚至是反复地验证。图 7列出了重要节点的化合物结构变迁, 扼要展现出研发梗概。
|
Figure 7 Key nodes and molecules in the course of optimization and ponatinib creation |
 2019, Vol. 54
2019, Vol. 54