肿瘤是严重威胁人类健康的重大疾病之一, 也是现代医学所面临的难题。光动力疗法(photodynamic therapy, PDT)是一种利用光、光敏剂(photosensitizer, Ps)和氧分子发挥光动力效应的局部微创疗法[1, 2]。光动力疗法的策略是通过特定波长的激光激发肿瘤部位的光敏剂, 在体内通过一系列光反应产生具有很强反应活性的单线态氧(singlet oxygen, 1O2), 进而与肿瘤细胞内的生物大分子发生氧化反应, 杀死肿瘤细胞, 封闭肿瘤微血管, 使其凋亡、缺血坏死, 且不易产生化疗药物的耐药效应, 达到无痛无痕的治疗[3-5]。PDT在乳腺癌治疗的相关研究中主要用于手术后的辅助及显影诊断, 针对胸腔内壁的肿瘤转移结节及片状浸润[3-5]。但PDT在癌症治疗中也存在局限性。首先, 光敏剂受自身理化性质影响, 大多只能被紫外或可见光所激发, 此波段的光源在作用时受血液和组织的吸收、散射影响, 限制了PDT的治疗深度, 使其临床应用大多在皮肤或者浅表肿瘤[6-8]。其次, 光敏剂如卟啉类、钛菁类和吩噻嗪类等, 大多难溶于水, 容易在体内形成聚集体, 影响单线态氧的产生[7-9]; 最后, 光敏剂在体内分布的选择性较差, 通过血液循环蓄积至肿瘤的浓度不足, 影响治疗效果的同时对健康组织造成光毒性[10]。因此, 研究可靶向递送光敏剂的递药系统且利用近红外光作为激发光源的光动力疗法, 是亟待解决的科学问题。
利用近红外光激发光敏剂, 可延伸PDT的治疗深度, 通常有直接激发和间接激发两种策略。近红外光可直接激发的光敏剂非常少, 基于PDT作用机制“光敏剂的三线态能级需要高于氧分子的单线态能级”, 增大了这类光敏剂的合成难度[11]。另一种间接激发的策略, 是利用非线性光学的原理将近红外光上转换为可激发光敏剂的可见光, 其中, 由有机小分子或其配合物构成的新型强双光子吸收材料具有良好的应用前景。双光子吸收(two-photon absorption, TPA)通常指材料分子在强脉冲激光激发下发生极化, 通过虚拟中间态同时吸收两个光子达到高能态的过程。该过程能够同时吸收两个低能量光子, 从基态跃迁到近两倍入射光子能量的激发态, 实现长波长激发, 短波长发射[12-16]。
利用药剂学与材料学知识的交叉结合, 构建药物递送系统是解决难溶性药物水溶性和增加在肿瘤组织蓄积的最好选择之一[17]。同时, 由于双光子光动力疗法(two-photon PDT, TP-PDT)需要通过荧光共振能量转移(fluorescence resonance energy transfer, FRET)间接激发光敏剂, 在药物递送系统的帮助下, 供体(TPA材料)与受体(光敏剂)之间的距离可小于10 nm, 有利于能量转移的发生[18-20]。单甲氧基聚乙二醇-聚丙交酯[methoxy poly(ethylene glycol)-polylactide copolymer, mPEG-PDLLA]是一种生物相容性良好的可降解聚合物, 可在水溶液中自组装形成胶束, 用作难溶性药物、蛋白和多肽等的载体[19-21]。
在前期研究中, 作者合成了在近红外波段有较大的TPA截面(大于1 000 GM, 1 GM = 10-50 cm4s/photon)的双光子化合物(LTPA)。本实验选用的焦脱镁叶绿酸a (pyropheophorbide a, PPa)是叶绿素a的降解产物之一, PPa及其衍生物被广泛应用于光动力疗法。选用PPa作为光敏剂模型药物, 是由于其在340~460 nm均有较强吸收。且LTPA和PPa都具有较强的疏水性能, 有利于包载于胶束的疏水内核。此外, 作者合成了聚甲基丙烯酸酯为骨架的pH值响应聚合物包载了新型三苯胺氰基乙酸配合物LTPA[22]和PPa, 在生理pH值条件下此胶束内核的疏水性较弱(或对水分子通透性较强), 使得光敏剂分子发生聚集, 影响1O2产率; 当处于弱酸性pH值时, 聚合物的两个嵌段均离子化, 正负电荷相互吸引形成疏水性较强聚集体, 此时PDT被激活[23]。此过程利用pH值改变开/关了TP-PDT效应, 减少了治疗过程中的光毒性。但pH值开/关的过程及光敏剂分子的聚集, 使得PDT效率降低, 所以选择一种生物相容性好、疏水内核能使光敏剂保持分子状态的药物传递系统有望解决上述问题。
本文利用生物可降解胶束mPEG-PDLLA同时装载LTPA和光敏剂PPa (图 1), 使用TP-PDT对抗小鼠乳腺癌。对药物递送系统的形貌、体外释放、单线态氧产率等进行表征; 考察胶束对4T1小鼠乳腺癌细胞的光、暗毒性, 并利用双光子激光共聚焦显微镜观察细胞摄取、胞内活性氧变化和光动力效应对细胞形态的影响; 利用小鼠皮下肿瘤模型评价给药系统的靶向性和有效性等。

|
Figure 1 Molecular structures of photosensitizer, pyropheophorbide a (PPa) (a) and two-photon absorption compound (LTPA) (b) |
药品与试剂 PPa (Mn = 534.44, 上海先辉医药科技有限公司); mPEG2000-PDLLA2000 (济南岱罡生物工程有限公司); 蒽-9, 10-二丙酸二钠盐(anthracene-9, 10-dipropionic acid disodium salt, ADPA, 美国Santa Cruz Biotechnology公司); 胰蛋白酶-EDTA、3-(4, 5-二甲基噻唑-2-基)-2, 5-二苯基四唑鎓溴化物(MTT)、4, 6-二脒基-2-苯基吲哚二盐酸盐(DAPI)、syto 9, 2', 7'-二氯荧光素二乙酸酯(DCFH-DA) (美国Sigma-Aldrich公司); Dulbecco改良的Eagle培养基(DMEM, 南京凯基生物科技发展有限公司); 胎牛血清(FBS, 四季青生物有限公司); 再生纤维素透析膜(Spectra/Por 6, 截留分子质量: 3 500 Da, 美国Fisher公司)。
主要仪器 JEM-1200EX透射电子显微镜(日本电子公司); 激光粒度分析仪(Zetasizer, 英国马尔文仪器公司); UV-6100型分光光度计(上海马达仪器有限公司); F-7000荧光分光光度计(日本岛津公司); 双光子激光共聚焦显微镜(ZEISS 710, 德国Carl Zeiss公司); FACS Calibur流式细胞仪(美国Becton-Dickinson公司); 小动物活体成像系统(Fx Pro, 德国Bruker公司); 660 nm和808 nm光线耦合半导体固态激光器(中川光电有限公司)。
细胞培养 4T1细胞购自南京凯基生物科技发展有限公司。将小鼠乳腺癌细胞(4T1)在含10%胎牛血清(FBS)、1%抗生素(链霉素、青霉素)的高糖Dulbecco改良Eagle培养基(DMEM)中, 37 ℃、5% CO2下培养。
实验动物 选择雌性BALB/c小鼠(20 ± 2 g, 6~8周龄)用于皮下接种肿瘤, 动物许可证号: SYXK (YU) 2014-0002。小鼠购自重庆医科大学实验动物中心, 并饲养于温度恒定, 光照和黑暗交替循环的房间。动物实验符合中国实验动物护理和使用准则, 并经西南大学药学院实验动物伦理委员会批准。
胶束制备 采用薄膜水化法分别制备4种胶束:空白胶束(blank micelles, BM2K)、载PPa胶束(PPa encapsulated micelles, PM2K)、载LTPA胶束(LTPA encapsulated micelles, LTPAM2K)和载PPa/LTPA胶束(PPa and LTPA co-encapsulated micelles, PLTPAM2K)。PLTPAM2K具体制备过程如下:将mPEG2000-PDLLA2000 10 mg溶于2 mL氯仿中, 与溶解了药物(1 mg PPa和LTPA, 1:1 w/w)的2 mL氯仿溶液混合, 在40 ℃下减压旋转蒸发至少30 min, 形成薄膜。随后加入0.01 mol·L-1磷酸盐缓冲液(PBS, pH 7.4) 1 mL, 在室温下磁力搅拌6~8 h, 将溶液通过0.22 μm膜滤器过滤以除去未包载的疏水性药物。胶束溶液储存在4 ℃冰箱备用。如上所述类似地制备BM2K、PM2K和LTPAM2K。
包封率(encapsulation efficiency, EE)和载药量(loading capacity, DL)的测定:取1 mL胶束溶液, 冻干后用等体积DMSO复溶, UV-Vis分光光度仪检测吸光度值, 根据实验室制备的标准曲线计算胶束中PPa和LTPA的浓度。EE和DL按下式计算:
| $ \begin{array}{l} {\rm{EE}}\left( {\rm{\% }} \right){\rm{ = }}\frac{{{W_L}}}{{{W_0}}}\\ {\rm{DL}}\left( \% \right) = \frac{{{W_{\rm{L}}}}}{{{W_0} + {W_{\rm{M}}}}} \end{array} $ |
其中, WL为胶束中药物质量, W0为药物总质量, WM为聚合物质量。
胶束的表征 用JEM-1200EX透射电子显微镜表征胶束的形态。用Zetasizer测量胶束的平均粒径和ζ电位(聚合物质量浓度约为1 mg·mL-1), 平行测样3次。用UV-6100型分光光度计和F-7000荧光分光光度计记录载药胶束的紫外-可见吸收光谱和荧光发射光谱。
体外释放考察 采用透析法[24]考察载药胶束中LTPA和PPa的体外释放度。将pH 5.4和7.4含0.1% Tween-80的0.01 mol·L-1 PBS溶液作为两种释放介质, 两种介质均可使PPa和LTPA释放达到漏槽条件。操作过程如下:将5 mL PLTPAM2K溶液(CLTPA和CPPa分别为5.0和1.1 mg·mL-1)置于透析袋(MWCO = 3 500 Da)内, 然后置于100 mL释放介质中, 在37 ℃下搅拌, 于0、4、8、12、16、20和24 h取袋外液体1 mL并补充PBS缓冲液1 mL, 用0.22 μm微孔滤膜过滤所取液体, 冻干后用DMSO复溶, UV-Vis检测吸光度值。根据标准曲线计算PPa和LTPA的累积释放率。
单线态氧的测定 ADPA在400 nm处吸光度值因1O2的漂白而降低, 用来测定1O2的产率。将DMSO中的载药胶束或游离PPa与20 μmol·L-1 ADPA在PBS溶液(pH 7.4)中混合。然后将混合溶液装在1 cm× 1 mm、可容纳0.5 cm3溶液的石英微槽中, 用特定波长的激光(单光子激发波长660 nm, 双光子激发波长808 nm)照射。检测不同光照时间ADPA吸光度值的变化, 以评估样品1O2产率。
TPA横截面测定 以含钛蓝宝石激光器(680~1 080 nm, 80 MHz, 140 fs)作为光源, 采用双光子激发荧光法获得样品的双光子吸收截面(δ)。LTPAM2K溶液的浓度为1.0×10-4 mol·L-1。因此, 样品的δ值由以下公式计算:
| $ {\delta _{\rm{s}}} = {\delta _{\rm{r}}} \cdot {F_{\rm{s}}} \cdot {\varPhi _{\rm{r}}} \cdot {C_{\rm{r}}} \cdot {n_{\rm{r}}}/{F_{\rm{r}}} \cdot {\varPhi _{\rm{s}}} \cdot {C_{\rm{s}}} \cdot {n_{\rm{s}}} $ |
其中, 下标r代表对照品, s是待测样品, C是溶液的浓度, n是溶液的折射率, F是检测到的双光子诱导荧光信号的积分面积, Φ是荧光量子产率。δ参考值取自文献[25]。
细胞摄取成像 配有含钛蓝宝石激光器的双光子激光共聚焦显微镜ZEISS 710被用于细胞摄取成像实验。在细胞摄取测定中, 4T1细胞以5×105个/孔接种于6孔板内, 细胞培养过夜贴壁, 分别与PM2K (5.1 μmol·L-1 PPa)、LTPAM2K (1.3 μmol·L-1 LTPA)和PLTPAM2K (5.1 μmol·L-1 PPa和1.3 μmol·L-1 LTPA)孵育2 h, 再与染料DAPI和Syto9在37 ℃ (5% CO2)下孵育3 h。在培养板中加入PLTPAM2K后监测细胞活性摄取30 min。所有图像数据通过LSM Image Browser和Image J分析。
活性氧测定 用活性氧检测试剂盒测定4T1细胞内活性氧水平的变化。DCFH-DA在活细胞中被活性氧氧化为2', 7'-二氯荧光素(2', 7'-dichlorofluorescein, DCF), 其在530 nm处具有荧光信号。将细胞与PLTPAM2K孵育12 h, 然后在37 ℃下与DCFH-DA染料(10 μm)避光孵育30 min。用PBS洗涤3次后, 在显微镜下观察细胞内绿色荧光(EX = 485 nm, Em = 535 nm)在808 nm激光光照前后的变化。
体外细胞毒性实验 体外细胞毒性实验分为有、无光照(光、暗毒性)两个部分。4T1细胞以1×105个/孔接种于96孔板内, 细胞在孵育过夜后给药。对于无光照细胞毒性测定, 将各样品按浓度梯度(n = 6)分别加入96孔板, 与细胞避光孵育48 h后除去上清液, 将含有MTT (5 mg·mL-1)的100 μL新培养液加入到每个孔中, 孵育4 h后, 除去上清液, 加入150 μL DMSO以溶解甲䐶结晶。用酶标仪在570 nm处测量吸光度值。通过MTT分析确定活细胞的数量, 与对照进行比较以确定相对存活力。对于激光介导的细胞毒性测定, 将PLTPAM2K (0.3 μmol·L-1 PPa和0.1 μmol·L-1 LTPA)与细胞孵育6 h后, 以0.3 W·cm-2功率强度、808 nm激光在设定时间内照射, 然后进行相同的MTT实验, 以测定细胞存活率。
膜联蛋白V/PI细胞凋亡检测分析 利用流式细胞仪, 用膜联蛋白V-FITC和PI (Annexin V-FITC/PI)试剂盒评估由PLTPAM2K诱导的凋亡细胞群。将4T1细胞接种在6孔板(3×106个细胞/孔)中过夜贴壁。PLTPAM2K+激光组: PLTPAM2K (0.55 μmol·L-1 PPa和0.15 μmol·L-1 LTPA)与细胞一起孵育6 h, 然后用808 nm激光(0.3 W·cm-2)照射10 min。PLTPAM2K (0.55 μmol·L-1 PPa和0.15 μmol·L-1 LTPA)组和空白组以类似方法但不进行激光照射, 然后将膜联蛋白V-FITC和PI加入细胞悬液, 使用FACS Calibur流式细胞仪进行分析。
离体器官荧光成像 雌性BALB/c小鼠, 体重18~22 g, 皮下接种处于对数生长期的4T1细胞, 每只小鼠接种的细胞数为5×105个。使用PPa (Ex = 640 nm, Em = 710 nm)作为荧光探针, 测定胶束在模型小鼠体内的分布。将载药胶束经尾静脉注射于小鼠中(n = 3)。在给药后0.5、2、4和12 h, 分别处死小鼠。取心脏、肝脏、脾脏、肺脏、肾脏和肿瘤, 通过小动物活体成像系统进行观察。
载药胶束药效学考察 载药胶束的抗癌活性在小鼠4T1皮下肿瘤模型上评估。将5×105个4T1细胞注射至皮下造模。将50~100 mm3肿瘤体积的荷瘤BALB/c小鼠随机分成7组, 具体分组见表 1。每组6只小鼠。在第1、4、7天分别进行尾静脉注射给药及光照, LTPA和PPa的剂量分别为2和5 mg·kg-1, 光照组用808 nm激光(0.3 W·cm-2)照射30 min。从第0天起, 每两天测量1次小鼠体重和肿瘤体积。通过公式计算肿瘤体积(V): V = (d2×l)/2, 其中d和l分别是肿瘤的宽度和长度。给药方案见表 1。
| Table 1 Formulations for the treatments. PLTPAM2K: PPa and LTPA co-encapsulated micelles; LTPAM2K: LTPA encapsulated micelles; PM2K: PPa encapsulated micelles; PBS: Phosphate buffered saline. N/A: Represents not applicable |
统计学方法 实验数据表示为
所制备的BM2K、PM2K、LTPAM2K和PLTPAM2K, 通过激光粒度仪测得平均粒径均约为50 nm, 大小均一。4个胶束样品的平均粒径、包封率、载药量、聚合物分散指数和zeta电位见表 2。结果可知, PLTPAM2K的平均粒径最大, 为55.0 ± 5.9 nm。进一步通过透射电子显微镜(TEM)观察发现(图 2a、b), 胶束呈类球形, PLTPAM2K的平均粒径约为35.5 ± 6.9 nm。TEM中样品的粒径较DLS测得粒径减小, 这是由于TEM的制样过程中对胶束进行了干燥, 减少了水合粒径。本胶束粒径小于100 nm, 有利于通过增强渗透滞留(EPR)效应将药物递送至肿瘤[25]。同时, 胶束表面的PEG嵌段和带有的负电位, 有助于避免被内皮网状系统上的巨噬细胞所吞噬, 延长在血液循环中的时间, 有助于药物在肿瘤的蓄积[25]。通过紫外-可见吸收光谱在410 nm (LTPA)和450、710 nm (PPa)处的吸收峰表明, 双光子化合物LTPA和光敏剂PPa同时包载于胶束PLTPAM2K中(图 2c), 经优化后的各胶束对LTPA和PPa的包封率都在85%以上(表 2)。PLTPAM2K的PPa和LTPA的体外释放结果(图 2d)表明, LTPA和PPa在pH值7.4和5.4的释放介质中释放行为类似, 说明受pH值影响较小, 8 h后释放变缓, 24 h内几乎全部药物释放完毕。
| Table 2 Average particle size, polydispersity index (PDI) and zeta potential of micelle samples. BM2K: Blank micelles; EE: Encapsulation efficiency; DL: Drug-loading capacity |

|
Figure 2 TEM images of BM2K (a) and PLTPAM2K (b), Scale bars represent 200 nm; UV-Vis absorption of PM2K, LTPAM2K and PLTPAM2K (c), in vitro release profile of PLTPAM2K at pH 7.4 and pH 5.4 (d) |
使用近红外(near infrared, NIR)光源来实现TP-PDT, 能量从供体LTPA转移到受体PPa之间的FRET过程是必要的。通常需要满足3个条件:能量供体的发射图谱与受体的吸收图谱能尽可能重叠, 且能量供体具有较大的TPA截面, 以及二者的空间距离应在10 nm以内。经胶束包埋后, LTPA的发射光谱和PPa的吸收光谱能部分重叠(图 3a)。同时, 胶束中LTPA具有较大的TPA截面, 在808 nm处约为1 600 GM, 有利于FRET效率的提升。这可能是形成了π共轭体系, 使得LTPA分子中出现电子分布(图 3b)。能量供受体LTPA和PPa同时被包裹于胶束中, 可有效缩小二者之间的空间距离, 并且两个药物同步释放, 有利于FRET效率的提升, 从而提高TP-PDT的疗效。
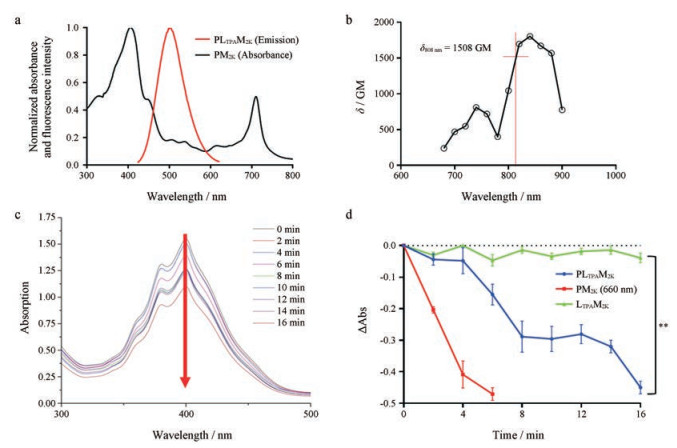
|
Figure 3 Normalized overlapping of LTPAM2K emission and PLTPAM2K absorption (a); two-photon absorption cross section (δ) of LTPAM2K (b); UV-Vis absorption spectra of PLTPAM2K with anthracene-9, 10-dipropionic acid disodium salt (ADPA) exposing under 808 nm laser within 16 mins (c); ΔAbs (absolute decrease value of absorption) of ADPA in different samples irradiating with laser (d). All the samples were irradiated with 808 nm laser except PM2K and PM* exposed under 660 nm laser. n = 3, |
单线态氧探针ADPA用于进一步测量胶束样品在光照下1O2产生, 如图 3c所示, PLTPAM2K在808 nm激光照射下, 400 nm处的吸光度值随照射时间延长而下降, 在16 min时下降近0.5, 且PLTPAM2K的1O2产率远高于LTPAM2K的1O2产率(图 3d)。相较之前工作中[23]利用PSPMA-PDPA胶束包载LTPA、PPa (PLTPAM*), PLTPAM2K大大提高了1O2的产生能力, 此现象在对比包埋PPa的PM2K和PM*胶束的1O2产率时也进一步得到印证。据文献[26]报道, 胶束内核的疏水能力会根据聚合物(或表面活性剂)疏水嵌段的结构组成不同, 而造成疏水程度的差异。此处以聚乳酸为胶束内核时, 相较聚2-(二异丙基氨基)乙基甲基丙烯酸酯(PDPA)有更强的疏水性能, 避免由于胶束内核的疏水程度不够而导致光敏剂聚集引起的荧光自猝灭, 从而提高1O2产率。此外, PM2K在660 nm激光照射下1O2产率高于PLTPAM2K, 在6 min时就能达到近0.5的下降值, 这是由于FRET过程中并未将能量完全转移, 造成了部分损耗, 但相较LTPAM2K组有大量1O2生成, 满足杀灭肿瘤细胞的要求[25], 并且本实验中使用的近红外激光能增加对生物组织的穿透深度, 有助于降低对皮肤的损伤。
3 体外抗肿瘤活性考察 3.1 肿瘤细胞摄取与TP-PDT效果利用双光子激光共聚焦显微镜观察4T1小鼠乳腺癌细胞对PM2K、LTPAM2K和PLTPAM2K的摄取, 胶束中LTPA和PPa都被细胞摄取并主要分布在细胞质中(图 4a), 两个化合物胞内分布的荧光较为重合。细胞对PLTPAM2K在30 min内的实时摄取情况(图 4b)表明, 细胞中LTPA和PPa的荧光强度同时增加。证明此递药系统可使两种化合物同步细胞内化, 有利于能量供受体在FRET过程中保持足够近的空间距离, 实现胞内TP-PDT。
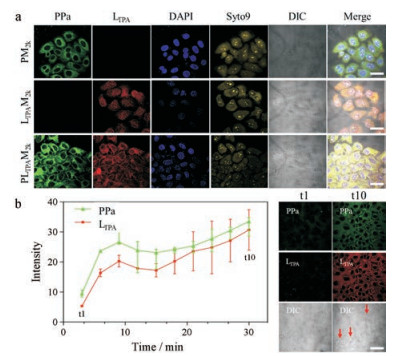
|
Figure 4 Live 4T1 cells treated with PM2K, LTPAM2K and PLTPAM2K (LTPA: Ex = 808 nm, Em = 505 nm; PPa: Ex = 610 nm, Em = 675 nm), stained with Syto9 (Ex = 488 nm, Em = 503 nm) and DAPI (Ex = 340 nm, Em = 488 nm), DIC is short for differential interference contrast (a); real-time cellular uptake of PLTPAM2K for 30 mins with 10 intervals. The live cell images of first and last time point were displayed as column t1 and t10, respectively, and red arrows indicate typical cell morphology changes after two-photon photodynamic therapy (TP-PDT) (b). n = 15, |
利用MTT法考察PLTPAM2K在有、无光照情况下对4T1细胞的毒性。PM2K、PPa和载体材料mPEG2000-PDLLA2000在最大给药浓度未观察到显著的细胞毒性(存活率高于70%) (图 5a)。作者前期工作中报道了LTPA具有抗癌活性[22], 本研究中LTPA对4T1细胞生长亦有明显抑制作用, 并且包载入胶束中可以进一步增加其细胞毒性(图 5b), PLTPAM2K的半数抑制浓度(0.105 ± 0.029 μmol·L-1)显著低于LTPA在DMSO中的半数抑制浓度(0.288 ± 0.073 μmol·L-1)。细胞摄取PLTPAM2K后, 光照对肿瘤细胞存活率的影响可见, 在功率密度为0.3 W·cm-2的808 nm激光照射10 min后, 光照组(PLTPAM2K+激光)的细胞存活率显著下降, 低至约23%, 而对照组细胞存活率保持在90%以上(图 5c)。为进一步验证TP-PDT对细胞存活率的抑制是由活性氧介导的细胞凋亡/坏死所造成, 利用膜联蛋白V-FITC和PI染色的流式细胞术进行了分析。结果表明, 与空白组晚期凋亡细胞群体(8.65%)相比, 对PLTPAM2K组光照10 min后, 晚期凋亡细胞群体增加至30.14% (图 6)。表明TP-PDT以诱导细胞凋亡/坏死的方式显著降低了肿瘤细胞的存活率。
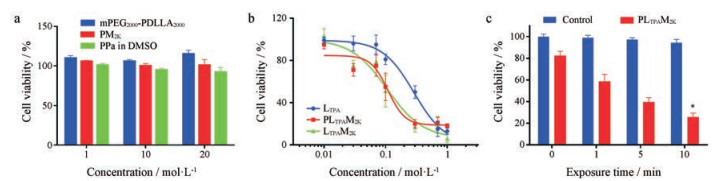
|
Figure 5 Light off cell viabilities of mPEG2000-PDLLA2000, PM2K and free PPa (in DMSO) (a); the viability of 4T1 cells treated with LTPA, LTPAM2K and PLTPAM2K in various concentrations (b); light on cell viabilities of PLTPAM2K treated cells and irradiated with 808 nm laser (0.3 W·cm-2) (c). n = 6, |
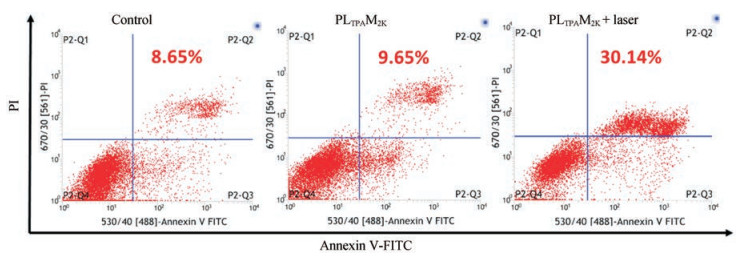
|
Figure 6 Annexin V-FITC/PI assays analyzing by flow cytometry. P2-Q1, P2-Q2, P2-Q3, P2-Q4 represent population of dead, late apoptotic/necrosis, early apoptotic and viable cells, respectively |
双光子激光共聚焦显微镜观察光照前后活性氧探针DCFH-DA绿色荧光信号的变化结果发现, 绿色荧光在808 nm激光照射后的激增表明TP-PDT使细胞内生产大量活性氧(图 7)。同时, 在DIC即微分干涉相位差通道观察到, 细胞形态在光照后发生明显变化, 在细胞膜和细胞核均出现了起泡、边缘变圆等典型的PDT现象(图 7)。而未给药组, 细胞的形态几乎没有明显变化(图 8)。结果表明, PLTPAM2K可在808 nm激光激发下进行高效的TP-PDT, 产生大量活性氧的同时, 迅速破坏肿瘤细胞的生理结构, 直接杀伤肿瘤细胞。
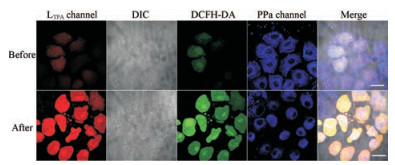
|
Figure 7 Reactive oxygen species (ROS) generated in cells treated with PLTPAM2K and then irradiated with an 808 nm laser (0.3 W·cm-2, 30 scans of 10 seconds each). Green fluorescence under two photon confocal microscopy indicated positive staining for ROS probe 2', 7'-dichlorodihydrofluorescein diacetate (DCFH-DA, Ex = 502 nm, Em = 523 nm). Scale bars represent 20 μm |

|
Figure 8 Cell morphology alternations by irradiating with 808 nm laser (0.3 W·cm-2, 30 scans of 10 seconds each). Scale bars represent 20 μm |
皮下接种4T1小鼠乳腺癌细胞的BALB/c小鼠用于药物离体分布和有效性考察。首先利用PPa的荧光信号进行离体荧光成像观察, 发现注射后药物能到达肿瘤部位, 并通过EPR效应在肿瘤部位蓄积, 约4 h后药物在肿瘤中累积的荧光强度达到最大值。因此, 将药效学实验中给予光照的时间点设定为静脉注射后4 h, 结果表明, 药物的荧光主要分布于肝脏和脾脏中(图 9a), 推测是由于载药胶束在体循环中对药物的快速释放造成。后续研究将对聚合物mPEG-PDLLA进行结构改造以提高胶束的靶向效率和体内稳定性。

|
Figure 9 Fluorescent imaging of ex vivo organ distribution of PLTPAM2K within 12 hours (Ex= 640 nm, Em = 710 nm, n = 3) (a); in vivo anticancer efficacy of PLTPAM2K against 4T1 xenograft tumors, the red arrows indicate the injection time points. *P < 0.05, ***P < 0.001 (b); tumor growth inhibition rates. *P < 0.05 vs laser group (c); body weight shifting in tumor-bearing mice (d). n= 6, |
体内药效考察结果如图 9b所示, 未加光照的PLTPAM2K和LTPAM2K组由于LTPA自身的抗肿瘤活性, 对肿瘤生长有一定的抑制作用。小鼠在注射PLTPAM2K后加以近红外激光照射, 对肿瘤生长有明显的抑制作用, 抑瘤率达到近60% (图 9c), 此效果是TP-PDT与LTPA的联合抗肿瘤作用, 且药物的载体在此过程中提高了LTPA的水溶性, 增加了其在肿瘤组织中分布, 有利于发挥药效。仅光照组相较于PBS组, 对小鼠肿瘤生长有轻微抑制作用, 这可能是光照产生的一定热量对肿瘤生长的影响。如图 9d所示, 各组小鼠的体重没有显著差别, 表明在实验中载药胶束对小鼠生长无明显影响。目前对TP-PDT的研究很多由于溶解性和药物递送的困难, 仅停留在细胞研究阶段, 本研究在不改变光敏剂和双光子化合物结构的前提下, 利用生物可降解的药物载体, 在肿瘤模型动物上进行了TP-PDT抗肿瘤药效考察, 并证实其对肿瘤的抑制作用。
结论本文利用生物可降解的纳米递药系统, 同时装载强双光子吸收化合物和光敏剂, 利用近红外激光(808 nm)实现TP-PDT抗小鼠乳腺癌。通过胶束的包埋, 减少了供体和受体之间距离, 且胶束中的双光子化合物具有较大的双光子截面, 保证了FRET效率, 实现了较高的1O2产率。所用胶束的生物相容性好, 粒径小且表面带负电, PLTPAM2K可将药物递送至肿瘤。光敏剂和胶束具有较低的细胞毒性, LTPA对肿瘤细胞生长有抑制作用; 对给药细胞加以NIR激光光照时, TP-PDT对4T1细胞产生杀伤作用, 且诱导细胞凋亡坏死。体内有效性实验表明, 载药胶束通过TP-PDT和LTPA的双重作用有效抑制肿瘤生长, 但其靶向性和体内稳定性还有待进一步提高, 此尝试有助于TP-PDT的进一步发展, 也证明TP-PDT在抗肿瘤应用上拥有巨大潜力。
| [1] | Awan MA, Tarin SA. Review of photodynamic therapy[J]. Surgeon, 2006, 4: 231–236. DOI:10.1016/S1479-666X(06)80065-X |
| [2] | Paszko E, Ehrhardt C, Senge MO, et al. Nanodrug applications in photodynamic therapy[J]. Photodiagnosis Photodyn Ther, 2011, 8: 14–29. DOI:10.1016/j.pdpdt.2010.12.001 |
| [3] | Master A, Livingston M, Sen Gupta A. Photodynamic nano medicine in the treatment of solid tumors:perspectives and challenges[J]. J Control Release, 2013, 168: 88–102. DOI:10.1016/j.jconrel.2013.02.020 |
| [4] | Zhang J, Jiang CS, Longo JPF, et al. An updated overview on the development of new photosensitizers for anticancer photody namic therapy[J]. Acta Pharm Sin B, 2018, 8: 137–146. DOI:10.1016/j.apsb.2017.09.003 |
| [5] | Hong EJ, Choi DG, Shim MS. Targeted and effective photody namic therapy for cancer using functionalized nanomaterials[J]. Acta Pharm Sin B, 2016, 6: 297–307. DOI:10.1016/j.apsb.2016.01.007 |
| [6] | Wang J, Zhang ZH, Zha S, et al. Carbon nanodots featuring efficient FRET for two-photon photodynamic cancer therapy with a low fs laser power density[J]. Biomaterials, 2014, 35: 9372–9381. DOI:10.1016/j.biomaterials.2014.07.063 |
| [7] | Duan XP, Chan C, Guo NN, et al. Photodynamic therapy mediated by nontoxic core-shell nanoparticles synergizes with immune checkpoint blockade to elicit antitumor immunity and antimeta static effect on breast cancer[J]. J Am Chem Soc, 2016, 138: 16686–16695. DOI:10.1021/jacs.6b09538 |
| [8] | Kim J, Santos OA, Park JH. Selective photosensitizer delivery into plasma membrane for effective photodynamic therapy[J]. J Control Release, 2014, 191: 98–104. DOI:10.1016/j.jconrel.2014.05.049 |
| [9] | You H, Yoon HE, Jeong PH, et al. Pheophorbide-a conjugates with cancer-targeting moieties for targeted photodynamic cancer therapy[J]. Bioorg Med Chem, 2015, 23: 1453–1462. DOI:10.1016/j.bmc.2015.02.014 |
| [10] | Temizel E, Sagir T, Ayan E, et al. Delivery of lipophilic porphyrin by liposome vehicles:preparation and photodynamic therapy activity against cancer cell lines[J]. Photodiagnosis Photodyn Ther, 2014, 11: 537–545. DOI:10.1016/j.pdpdt.2014.07.006 |
| [11] | Gu BB, Pliss A, Kuzmin AN, et al. In-situ second harmonic generation by cancer cell targeting ZnO nanocrystals to effect photodynamic action in subcellular space[J]. Biomaterials, 2016, 104: 78–86. DOI:10.1016/j.biomaterials.2016.07.012 |
| [12] | Kachynski AV, Pliss A, Kuzmin AN, et al. Photodynamic therapy by in situ nonlinear photon conversion[J]. Nat Photonics, 2014, 8: 455–461. DOI:10.1038/nphoton.2014.90 |
| [13] | Le Dévédec SE, van Roosmalen W, Pont C, et al. Two-photon intravital multicolour imaging to study metastatic behaviour of cancer cells in vivo[M]//Wells CM, Parsons M. Cell Migration. New York: Humana Press, 2011, 769: 331-349. |
| [14] | Zhang Q, Luo JS, Ye LL, et al. Design, synthesis, linear and nonlinear photophysical properties and biological imaging appli cation of a novel Λ-type pyrimidine-based thiophene derivative[J]. J Mol Struct, 2014, 1074: 33–42. DOI:10.1016/j.molstruc.2014.04.058 |
| [15] | Zhang Q, Luo L, Xu H, et al. Design, synthesis, linear and nonlinear photophysical properties of novel pyrimidine-based imidazole derivatives[J]. New J Chem, 2016, 40: 3456–3463. DOI:10.1039/C5NJ02874D |
| [16] | Pawlicki M, Collins HA, Denning RG, et al. Two-photon absorp tion and the design of two-photon dyes[J]. Angew Chem Int Ed, 2009, 48: 3244–3266. DOI:10.1002/anie.v48:18 |
| [17] | Floyd JA, Galperin A, Ratner BD. Drug encapsulated polymeric microspheres for intracranial tumor therapy:a review of the literature[J]. Adv Drug Deliv Rev, 2015, 91: 23–37. DOI:10.1016/j.addr.2015.04.008 |
| [18] | Dichtel WR, Serin JM, Edder C, et al. Singlet oxygen generation via two-photon excited FRET[J]. J Am Chem Soc, 2004, 126: 5380–5381. DOI:10.1021/ja031647x |
| [19] | Ouahab A, Cheraga N, Onoja V, et al. Novel pH-sensitive charge-reversal cell penetrating peptide conjugated PEG-PLA micelles for docetaxel delivery:in vitro study[J]. Int J Pharm, 2014, 466: 233–245. DOI:10.1016/j.ijpharm.2014.03.009 |
| [20] | Garofalo C, Capuano G, Sottile R, et al. Different insight into amphiphilic PEG-PLA copolymers:influence of macromolecular architecture on the micelle formation and cellular uptake[J]. Biomacromolecules, 2014, 15: 403–415. DOI:10.1021/bm401812r |
| [21] | Hu QY, Gu GZ, Liu ZY, et al. F3 peptide-functionalized PEG-PLA nanoparticles co-administrated with tLyp-1 peptide for anti-glioma drug delivery[J]. Biomaterials, 2013, 34: 1135–1145. DOI:10.1016/j.biomaterials.2012.10.048 |
| [22] | Zhao XS, Liu J, Wang H, et al. Synthesis, crystal structures and two-photon absorption properties of triphenylamine cyanoacetic acid derivative and its organooxotin complexes[J]. Dalton Trans, 2015, 44: 701–709. DOI:10.1039/C4DT02251C |
| [23] | Luo L, Zhong H, Liu S, et al. Intracellular "activated" two-photon photodynamic therapy by fluorescent conveyor and photosensi tizer co-encapsulating pH-responsive micelles against breast cancer[J]. Int J Nanomedicine, 2017, 12: 5189–5201. DOI:10.2147/IJN |
| [24] | Feng XY, Yao JH, Gao XL, et al. Multi-targeting peptidefunctionalized nanoparticles recognized vasculogenic mimicry, tumor neovasculature, and glioma cells for enhanced anti-glioma therapy[J]. ACS Appl Mater Interfaces, 2015, 7: 27885–27899. DOI:10.1021/acsami.5b09934 |
| [25] | Albota MA, Xu C, Webb WW. Two-photon fluorescence excita tion cross sections of biomolecular probes from 690 to 960 nm[J]. Appl Opt, 1998, 37: 7352–7356. DOI:10.1364/AO.37.007352 |
| [26] | Maibaum L, Dinner AR, Chandler D. Micelle formation and the hydrophobic effect[J]. J Phys Chem B, 2004, 108: 6778–6781. |
 2019, Vol. 54
2019, Vol. 54


