2. 南昌大学第一附属医院检验科, 江西 南昌 330006;
3. 南昌大学药学院, 江西 南昌 330006
2. Department of Clinical Lab oratory, the First Affiliated Hospital, Nanchang University, Nanchang 330006, China;
3. School of Pharmacy, Nanchang University, Nanchang 330006, China
基因治疗是一种新型的分子治疗技术, 在治疗基因缺陷、肿瘤及心血管疾病等具有巨大潜力[1-3]。基因治疗的成功取决于安全、有效的基因载体[4, 5]。常用的载体包括病毒载体和非病毒载体[6]。病毒基因载体转染效率高, 但存在安全性问题(免疫原性反应、致畸、致癌等), 而且制造工艺复杂、成本高、基因装载能力低等缺点[7], 临床应用受限。近年来, 由于在安全性、生产成本、制备工艺和基因装载量等方面优于病毒载体, 非病毒基因载体成为研究热点[8, 9]。
聚酰胺-胺(polyamidoamine, PAMAM)和聚乙烯亚胺(polyethylenimine, PEI)是两类结构不同的阳离子型非病毒基因载体, 被广泛用于体内外研究[10, 11]。两者结构中具有大量的伯胺和叔胺:伯胺在生理条件下质子化带正电荷, 可以压缩包裹带负电荷的基因, 从而实现对基因的装载和保护; 叔胺在溶酶体/内含体中通过“质子海绵效应”保护基因在细胞内免受破坏和降解, 实现有效传递[12]。通常, PAMAM (整代)和PEI的基因转染效率与分子量密切相关, 分子量越大转染效率越高但伴随着较大的细胞毒性, 而分子量越小毒性越低但伴随着低或无转染效率[13]。转染效率与细胞毒性之间的矛盾导致PAMAM和PEI均无法直接作为基因载体。然而, PAMAM和PEI易被修饰的性质为改善其性能、实现多功能化提供了多种可能性。有研究发现, 用低代PAMAM作为“内核”或将小分子PEI接枝到生物兼容材料构成的基因载体均可以获得高转染效率而同时保持较低的细胞毒性[13-19], 可以解决上述转染效率与细胞毒性之间的矛盾。此外, 血清中低转染效率是另一个阻碍PAMAM和PEI进行体内研究应用的重要因素。聚谷酸苄酯(poly benzyl glutamate, PBLG)是聚谷氨酸的一种衍生物, 具有良好的生物兼容性和易降解的特性, 常被用于药物传递和阳离子聚合物的修饰[14, 20]。Zhao等[21]发现在PBLG上引入精胺形成的聚合物具有较低的摩擦系数和蛋白吸附, 其与基因形成的复合物具有较强的稳定性。Wu等[16]、Cao等[22]和Pan等[23]都发现以PAMAM G1或G2氨解PBLG形成的阳离子聚合物在血清条件下具有较高的转染效率。上述研究结果提示, 基于聚谷氨酸构建的阳离子基因载体在血清中具有较强的稳定性。
根据上述背景, 本研究以低代PAMAM G0 (G0)为内核引发合成G0-PBLG, 然后用小分子PEI 423Da进行氨解脱苄合成了一种新型的聚合物G0-PLG-g-PEI (PGLP)。应用1H NMR对其结构进行表征, 并对其基因复合物的理化性质、生物性能及基因传递效率进行评价。
材料与方法材料 L-谷氨酸-γ-苄酯(98%, 阿拉丁试剂公司); 三光气(分析纯, 广州化学试剂厂); PAMAM G0、PEI (支链型Mn 25 000和423 Da, 分别简称为PEI 25K和PEI 423)、4, 6-diamidino-2-phenylindole dihydrochloride (DAPI) (美国Sigma-Aldrich公司); 核酸标记试剂盒(label IT TM-rhodamine labeling kit, 美国Mirus公司); 绿色荧光蛋白质粒pEGFP-C3 (美国Promega公司); 罗丹明试剂盒标记的pEGFP-C3 (Rho-labeled pDNA, 自制); HKE 293T细胞株、肝癌细胞BEL 7402、宫颈癌细胞HeLa (中国科学院上海细胞库); 大鼠主动脉平滑肌细胞(rat aortic smooth muscle cells, RASMC, 美国ScienCell公司); DMEM (Dulbecco's modified eagle medium)培养基、平滑肌细胞培养基(smooth muscle cell medium, SMCM)、胎牛血清(美国Gibco公司); TAE缓冲液、磷酸缓冲盐溶液(PBS) (武汉博士德生物公司); Endo free plasmid kit (Tiangen公司)。
仪器 LGJ-18型冷冻干燥机(北京四环科学仪器厂); Bruker Auance 600型核磁共振波谱仪(瑞士Bruker公司); Zetasizer Nano Series 90动态光散射粒度分析仪(英国Malvern公司); 倒置荧光显微镜(日本Olympus公司); Multiskan FC酶联免疫检测仪(美国ThermoFisher公司); 流式细胞仪(美国Beckman公司); 高速离心机(德国Eppendorf公司); 激光共聚焦显微镜(LSM 700, 德国Carl Zeiss公司)。
阳离子聚合物PGLP的合成 聚酰胺-胺-b-聚谷氨酸苄酯(G0-PBLG)共聚物的制备主要是参考作者先前的报道[14]。首先, 将L-谷氨酸-γ-苄酯(5 g, 0.021 mol)与三光气(3 g, 0.01 mol)置于无水四氢呋喃(tetrahydrofuran, THF)中, 在60 ℃条件下搅拌反应30 min, 然后将反应液倒入过量的冰冷石油醚中沉淀, 置于-20 ℃冰箱, 48 h后过滤, 真空干燥得到白色粉末状固体(BLG-NCA) (5.1 g, 产率92.2%)。然后, 将PAMAM G0 (0.1 g, 0.2 mmol)和BLG-NCA (4.2 g, 0.016 mol)溶解于无水的N, N-二甲基甲酰胺(N, N-dimethylformamide, DMF)中, 在25 ℃搅拌的条件下反应48 h, 将反应液加入到过量的乙醇中沉淀, 过滤, 真空干燥得到G0-PBLG (3.2 g, 89%)。
称取新制备的G0-PBLG (0.2 g, 0.014 mmol)和PEI 423 (3.8 g, 9.0 mmol)溶解于无水DMF中, 并加入催化剂二羟基吡啶(0.43 g, 4.5 mmol), 混合溶液于40 ℃搅拌反应48 h, 然后将其加到无水乙醚中沉淀, 再将沉淀物于透析袋(截留分子质量7 000 Da)中透析72 h, 最后将透析液真空干燥48 h,得G0-PLG-g-PEI (0.35 g, 73%), 即阳离子聚合物PGLP。以氘代氯仿(deuterated chloroform, CDCl3)为溶剂溶解G0-PBLG, 氘代水溶解起始原料PEI 423和聚合物PGLP, 四甲基硅烷为内标, 在室温条件下采用Bruker Auance 600型核磁共振仪测定聚合物的氢谱。
PGLP/pDNA复合物的制备 精密称取一定质量的PGLP, 加去离子水配成2 mg·mL-1溶液, 根据预先设定的质量比(w/w)稀释成不同的浓度, 再与等体积的pEGFP-C3溶液混合均匀, 室温孵育30 min,得到不同质量比的PGLP/pDNA复合物。
琼脂糖凝胶电泳 聚合物/pDNA含0.5 μg质粒按w/w= 0、0.05、0.1、0.3、0.5新鲜配制, PEI 25K和PEI 423作为对照。在孵育30 min后, 向复合物溶液中加入6×上样缓冲溶液2 μL, 混匀, 然后将复合物溶液上样至1%琼脂糖凝胶, 以120 V在1×TAE缓冲液中电泳30 min, 最后通过凝胶成像系统观察DNA迁移情况。此外, 为了考察PGLP对DNA的保护能力, 在复合物孵育30 min后加入胎牛血清(10%)并在37 ℃再孵育1 h, 按上述实验条件进行电泳分析DNA的迁移情况。
复合物的粒径与电位的检测 将PGLP/pDNA含20 μg质粒按w/w = 0.5、1、3、5、8配制成1 mL复合物溶液, 室温孵育30 min后, 采用Zetasizer Nano Series 90粒径分析仪在25 ℃测定复合物的粒径和电位。
聚合物的细胞毒性评估 将对数生长期的HeLa细胞和BEL 7402细胞以5 000个/孔分别接种于96孔板中, 当细胞培养达80%汇合度时, 吸出原培养基并加入150 μL预先配制的含不同浓度聚合物(10、30、50、100和200 μg·mL-1)无血清培养基孵育4 h, 然后替换新鲜的完全培养基, 再培养48 h后, 向每孔加入CCK-8试剂10 μL, 继续培养2 h, 最后用酶联免疫检测仪在450 nm波长下测定吸光度(A)值, 根据A值计算细胞的存活率(CL), 公式(1)如下:
| $ {\rm{CL}}\left( \% \right) = \left( {{A_{{\rm{sample}}}}-{A_{{\rm{blank}}}}} \right)/\left( {{A_{{\rm{control}}}}-{A_{{\rm{blank}}}}} \right) \times 100\% $ | (1) |
溶血分析 采集新西兰大白兔(长沙市天勤生物技术有限公司, 合格证号: No.43006700014864)耳缘静脉血液2 mL (南昌大学第一附属医院科研伦理委员会批准), 置于抗凝采血管内, 3 000 r·min-1、4 ℃离心10 min, 去血清后加入0.9%生理盐水重悬并离心, 清洗下层的红细胞至上清液为无色。以0.9%生理盐水为稀释剂, 制备2%红细胞悬液。将质量比为5和8的PGLP/pDNA复合物溶液与等体积的红细胞悬液混合后, 置于37 ℃水浴中孵育1 h, 再置于离心机中离心收集上清液并将其置于紫外分光光度计中540 nm波长下测量样品A值[24]。1% Triton X-100溶液处理组作为阳性对照, 生理盐水处理组为阴性对照, 计算溶血率(HR), 公式(2)如下:
| $ {\rm{HR}}\left( \% \right) = \left( {{A_{实验组}}-{A_{阴性对照组}}} \right)/\left( {{A_{阳性对照组}}-{A_{阴性对照组}}} \right) \times 100\% $ | (2) |
共聚焦显微镜观察细胞摄取 将细胞爬片加入24孔板, 按10 000个/孔加入对数生长期的HEK 293T细胞, 在37 ℃、含5% CO2孵箱中培养20~24 h, 待细胞密度达到60%左右时, 吸出原培养基并每孔加入无血清的DMEM 300 μL, 然后分别加入PGLP/Rho-labeled pDNA复合物(w/w = 8, 含1 μg pDNA), 孵育0.5、1和4 h后, 吸出原培养基, 用PBS洗涤3次, 用4%多聚甲醛固定10 min, 加入DAPI (0.2 μg·mL-1)孵育10 min, 再用PBS洗涤3次, 取出细胞爬片, 用甘油封片, 最后通过共聚焦显微镜观察细胞摄取。
体外转染 将对数生长期的HEK 293T、HeLa、BEL 7402和RASMC细胞以30 000个/孔分别接种于24孔板中, 在37 ℃、含5% CO2孵箱中培养20~24 h, 待细胞密度达到80%左右时, 吸出原培养基并每孔加入不含血清或含血清的DMEM 600 μL, 然后将聚合物/pEGFP-C3复合物按预先设计好的质量比分别与细胞孵育4 h, 转染完毕后, 用新鲜的含10% FBS的培养基换液, 继续培养48 h, 再置于荧光显微镜下初步评估转染效率, 用PBS洗涤1次, 再用胰酶消化、离心、收集细胞, 0.5%多聚甲醛溶液重悬, 最后用流式细胞仪测定转染效率。
统计学处理 统计学处理计数资料以均数±标准差(
本文首先以PAMAM G0引发BLG-NCA开环聚合生成G0-PBLG共聚物, 再以PEI 423对G0-PBLG进行氨解, 制得了一种树枝状聚合物(PGLP), 见合成路线1。在合成过程中, 由于BLG-NCA单体活性高, 遇水易导致PAMAM G0引发反应失败, 本文所使用的试剂均经过严格除水, 使反应一直在惰性环境下进行。另外, 为了减少氨解过程中G0-PBLG链的降解和分子间的交联, 通过使用过量的PEI和控制氨解条件(2-羟基吡啶作为催化剂, 40 ℃, 48 h)对此类副反应进行控制。结合最终产物的高产率和良好的水溶性, 初步表明聚谷氨酸链的降解和分子间的交联得到有效控制。

|
Scheme 1 Synthesis of PGLP composed of polyamidoamine dendrimer G0 as the inner core and poly (L-glutamic acid) grafted low molecular weight polyethylenimine as surrounding arms. BLG-NCA: γ-Benzyl-L-glutamate N-carboxyanhydride; DMF: Dimethylformamide; PAMAM G0: Generation 0 polyamidoamine; PAMAM G0-PBLG: PAMAM G0-b-poly(γ-benzyl-L-glutamate); PEI 423: Polyethylenimine with average molecular weight of 423 Da |
为了进一步确认聚合物PGLP的化学结构, 本文采用1H NMR进行了表征, 结果如图 1所示。图 1A~C分别为原料PEI 423、中间产物G0-PBLG和目标产物PGLP的1H NMR谱图。在图 1A中, δ 2.40~2.89 (A+B峰)为PEI中-CH2CH2NH-质子的特征吸收峰; 图 1B中, δ 5.03 (k)为苄基的亚甲基峰, δ 3.92 (g)和δ 7.25 (m)分别为聚谷氨酸中次亚甲基峰和苯环的质子峰[14], δ 2.41~2.96为PAMAM G0骨架质子吸收峰[13], 这些峰的存在证明G0-PBLG成功合成, 产率73.0%;图 1C中, 由于k峰消失, 而聚谷氨酸中次亚甲基峰(g、h)和PEI的质子吸收峰同时出现, 证明PGLP成功合成。根据g/A+B峰面积的比值算得PGLP的聚合度为56、平均分子质量为30 493 Da。

|
Figure 1 1H NMR spectra of PEI 423 (A), G0-PBLG (B), PGLP(C) |
载体能否对基因进行压缩包裹是实现有效基因传递的首要条件。本文采用琼脂糖凝胶电泳考察PGLP对基因的压缩包裹能力, PEI 25K作为阳性对照, 实验结果如图 2所示。从图 2A可以发现, 随着PGLP/pDNA复合物质量比的升高, 电场作用下迁移的DNA越来越少, 说明PGLP对基因的压缩包裹能力随着质量比的增高而增强。当w/w = 0.3时, 泳道中已完全观察不到迁移的DNA, 表明此时PGLP已可完全压缩包载DNA, 其能力与PEI 25K相似。相反, PEI 423在所有质量比均无法阻滞DNA在电场作用下迁移, 不具备压缩包裹能力。这些结果表明,PGLP具有较强的基因压缩包裹能力。
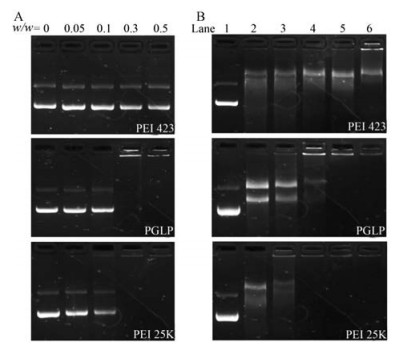
|
Figure 2 Gel retardation assay. Agarose gel electrophoresis of different polymer/pDNA complexes at various w/w ratios (A). Serum degradation assay (B). Lane 1: Naked plasmid DNA; Lane 2: Naked DNA treated with 10% fetal bovine serum (FBS); Lanes 3-6: PGLP or PEI 423/pDNA complexes at w/w ratios of 0.1, 0.5, 1.0, 5.0 treated with 10% FBS, respectively. PEI 25K/pDNA complexes at w/w ratios of 0.1, 0.5, 1.0, 1.3 were used as positive controls |
基因在传递过程中易被血清酶降解是引起基因治疗失败的一个原因。为了考察PGLP/pDNA复合物对血清酶降解的耐受能力, 本文采用PGLP/pDNA复合物与血清共孵育的方法进行验证。结果表明(图 2B), PEI 423/pDNA复合物不能耐受血清酶的降解, 即使在w/w = 5时, 泳道中仍然出现DNA的降解片段。而PEI 25K/pDNA复合物在w/w≥0.5时就能完全保护DNA免受血清酶的降解。PGLP/pDNA复合抗血清酶降解的能力稍弱于PEI 25K, 在w/w = 0.5时泳道中出现少量的DNA降解片段; 当w/w≥1时泳道中无DNA降解片段, 表明此时PGLP/pDNA复合物可以耐受血清酶的降解。另外, PGLP/pDNA复合物抗血清酶降解的能力随着质量比的增大而增强, 这与PGLP在高质量比对基因的压缩包裹能力增强有关。
3 PGLP/pDNA复合物的粒径和电位测定粒径和电位是影响阳离子基因载体转染效率的重要理化性质。据报道, 适度的正电荷有利于维持基因传递系统的稳定性和转染时对细胞膜的黏附; 合适大小的粒径(50~200 nm)有利于细胞摄取和胞内运输[25, 26]。采用动态光散射粒度分析仪对PGLP/pDNA复合物在w/w = 0.5~8内的粒径和电位进行测定, 结果如表 1和图 3所示。PGLP/pDNA复合物的粒径随质量比的增大先减小而后稳定, 这与PGLP的压缩包裹能力随质量比增加而逐渐增强有关。当w/w≥3时, PGLP/pDNA复合物粒径保持相对稳定, 大小维持在110 nm左右、多分散指数(PDI)在0.3左右, 表明粒径的均一度相对较高, 有利于细胞摄取和胞内运输。由于PGLP与DNA之间是通过正负电荷相互作用形成复合物, 当PGLP/pDNA的质量比增大时正电荷就会增多, 从而引起PGLP/pDNA复合物的电位从+8.5 mV升高至+28.5 mV。基于以上结果, PGLP/pDNA复合物的粒径和电位可满足转染要求。
| Table 1 Particle sizes and zeta potentials of PGLP/pDNA complexes at different w/w ratios |
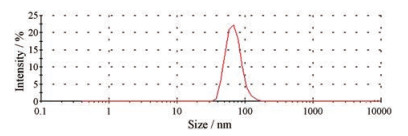
|
Figure 3 Size distribution by intensity of PGLP/pDNA complexes at w/w = 8 |
细胞毒性是影响阳离子基因载体安全运用的主要障碍之一, 过高的细胞毒性易导致非靶细胞的凋亡和治疗窗变窄。通过引入具有生物兼容性、可降解的聚谷酸肽作为载体骨架, 低毒的小分子PEI作为阳离子供体, 期望得到低细胞毒性的PGLP。CCK-8评估PGLP的细胞毒性的结果如图 4A、B所示, PEI 423对两种测试细胞几乎均无毒性, 细胞存活率均达90%以上; 相反, PEI 25K的细胞毒性随着浓度升高明显增大, 30 μg·mL-1时细胞活力就低于70%, 200 μg·mL-1时细胞活力低于20%; PGLP的细胞毒性也与浓度呈正相关, 但在浓度高达200 μg·mL-1时, 细胞活力仍然维持70%以上(约为PEI 25K浓度的7倍), 表明PGLP的细胞毒性低于PEI 25K。图 4C显示的是溶血实验结果, 在w/w = 5和8时PGLP/pDNA复合物的溶血率分别为9.1%和15.3%, 与PEI 423/pDNA复合物的溶血率无统计学差别(P > 0.05), 但显著低于PEI 25K/pDNA的溶血率(30.6%, P < 0.001)。进一步表明, PGLP的细胞毒性较低, 具有较高的安全性。PGLP的细胞毒性低于PEI 25K很可能与其结构中含生物兼容性良好、可降解的聚谷氨酸和低毒性的PEI 423有关。

|
Figure 4 Cytotoxicity assays. Relative viability of HeLa cells (A) and BEL 7402 cells (B) treated with different polymers at various concentrations. Percentage of hemolytic activity of polymer/DNA complexes compared to total hemolysis caused by 1% (v/v) Triton X-100 solution (C). n = 3, |
复合物进入细胞是治疗基因产生效应的必经途径。为了描述复合物在转染过程中的细胞摄入行为, 利用共聚焦显微镜在不同的时间点观察细胞摄入[27]PGLP/Rho-labeled pDNA复合物的情况, 结果如图 5所示, 其中蓝色为DAPI标记的细胞核, 红色为罗丹明标记的DNA。从图可以发现, 当复合物与细胞共孵育0.5 h后, 图 5A中出现轻淡的红色细胞膜轮廓, 表明PGLP/Rho-labeled pDNA已经开始被细胞摄取或吸附; 细胞内吞复合物时, 其轮廓上或胞内一般会出现点状/块状的荧光团[28]。当复合物与细胞共孵育1 h后, 图 5B出现清晰、由点/块构成的红色细胞膜轮廓, 表明PGLP/Rho-labeled pDNA已被细胞大量摄取。当复合物与细胞共孵育4 h后, 图 5C中细胞内出现大量红色荧光和部分红蓝叠加荧光区域(紫色), 表明复合物已经被细胞大量摄取并进入胞内, 且有部分DNA已到达细胞核。综上, PGLP/Rho-labeled pDNA复合物可以被细胞通过内吞摄入。
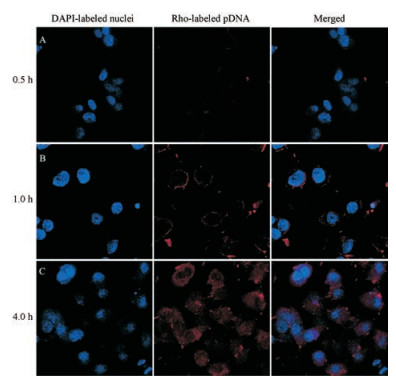
|
Figure 5 Confocal laser scanning microscope images (400× magnification) of PGLP/rhodamine-labeled pDNA complexes in HEK 293T cells after incubation for 0.5 h (A), 1 h (B) and 4 h (C) |
以pEGFP-C3为报告基因, 利用流式细胞仪测定PGLP分别在有血清和无血清条件下的转染效率, “金标准” PEI 25K及商业化转染试剂Lipofectamine 2000 (Lipo 2000)作为阳性对照, 结果如图 6所示。图 6A显示, PGLP在无血清的条件下对HEK 293T的基因转染效率先随质量比增加而增大而后降低, 在w/w = 8时转染效率达57.7%, 显著高于PEI 25K的34.7% (P < 0.01)及Lipo 2000的42.3% (P < 0.01)。图 6B显示, PGLP在有血清条件下的基因转染效率的变化趋势与无血清条件下的趋势相似, 在w/w = 8时转染效率为59.6%, 显著高于PEI 25K的19.4% (P < 0.001)和Lipo 2000的1.2% (P < 0.001)。细胞转染后的荧光点密度也直观显示PGLP在无血清和有血清转染条件下的转染能力均高于PEI 25K。PGLP获得高转染效率的原因有: ①细胞毒性相对较低(图 4), 可以通过高转染比例获得高转染效率(图 6), 而PEI 25K的细胞毒性较大, 提高转染比例后细胞毒性增大, 导致细胞死亡从而引起转染效率降低[13]; ②结构中的聚谷氨酸具有可降解特性[23], 有利于DNA释放和进入细胞核表达也可能是其获得高转染活力的原因。

|
Figure 6 Transfection efficiencies of PGLP/pDNA complexes at different w/w ratios in HEK 293T cells without serum (A) and with serum (B). PEI 25K and Lipofectamine 2000 (Lipo2000) at their optimal transfection ratio were used as controls. Fluorescence images (right) of cells transfected with PGLP/pDNA complexes at w/w = 8 and PEI 25K/pDNA complexes at w/w = 1.3 (the optimal ratio) in the absence or presence of serum were showed for qualitative comparison (100X magnification). n= 3, |
为了进一步评估PGLP作为基因载体的潜力, 采用不同类型的细胞(HeLa、BEL 7402和RASMC细胞)考察PGLP/pDNA复合物在有血清和无血清条件下的转染效率, PEI 25K作为阳性对照。从图 7可见, PGLP在不同细胞上转染效率均显著高于PEI 25K或与其保持相当水平, 该结果与HEK 293T细胞转染一致, 进一步证明PGLP作为基因载体性能优于PEI 25K。此外, 细胞类型对PGLP的转染效率有明显影响, 无血清时的转染效率大小趋势是HeLa > BEL 7402 > RASMC; 有血清时转染效率大小趋势为BEL 7402 > HeLa > RASMC。这些结果可为PGLP开发基因治疗的适应症提供参考。两种转染条件下RASMC的转染效率相对较低, 其原因可能与RASMC (正常细胞)的分裂速度比肿瘤细胞慢, 导致DNA进入细胞核的几率和数量降低有关。
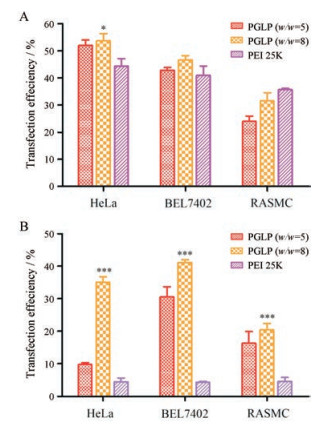
|
Figure 7 Transfection efficiencies of PGLP/pDNA complexes at w/w = 5 and 8 in different cell lines without serum (A) and with serum (B). PEI 25K/pDNA complexes at w/w =1.3 (the optimal ratio) were used as control. n = 3, |
阳离子基因传递系统由于在体内容易被血清破坏, 导致转染无效或效率大幅度降低, 因此具备抗血清能力是实现体内研究或应用的一个重要前提。本文采用血清中的转染效率/无血清中的转染效率的比值(转染比)[15]评估PGLP/pDNA复合物(w/w = 8)的抗血清能力, PEI 25K作为对照。从表 2可知, PGLP和PEI 25K在多种细胞上的转染比均小于1 (PGLP对HEK 293T细胞除外), 说明血清的存在对它们的转染具有一定程度的不利影响。这可能是由于血清蛋白的负电荷与PGLP和PEI 25K复合物的正电荷发生相互作用引起复合物聚集和DNA释放, 导致转染效率降低有关。但与PEI 25K相比, 血清的存在对PGLP的转染影响较小甚至无影响(HEK 293T为1.03), PGLP的转染比是PEI 25K的2~9倍, 表明PGLP具有更强的抗血清能力。根据Wu等[16]报道, G2 PAMAM-PGlu-G1 PAMAMs (ALA)在血清中的转染效率提高很可能与其结构导致的空间位阻和静电屏蔽效应相关。鉴于PGLP的骨架结构与ALA相似, 作者认为PGLP的抗血清转染能力可能与以下原因有关: PGLP是以球状PAMAM G0为核心和小分子PEI修饰的聚谷氨酸为侧链构建而成的星射形“蛛网”状嵌段共聚物(合成路线1), 被压缩包裹内到“蛛网”内的DNA分子可以凭借网内空间位阻避免被血清蛋白解聚, 而网外的PEI分子在吸附血清蛋白后可通过电荷屏蔽进一步保护网内DNA避免解聚, 加上聚谷氨酸链的柔性, 最终使复合物获得较高的稳定性, 从而实现PGLP在血清转染条件下也可获得高转染活力。
| Table 2 The rates of average transfection efficiency of PGLP/pDNA (w/w = 8) and PEI 25K/pDNA (w/w= 1.3) with serum/without serum in different cell lines |
本文成功合成了一种以PAMAM G0为内核、聚谷氨酸为骨架并接枝小分子PEI的树枝状聚合物(PGLP)。PGLP可以与DNA形成粒径和电位大小适宜的纳米粒并保护DNA避免血清酶的降解。PGLP具有细胞毒性低、转染效率高和一定的抗血清能力, 是一种有潜力的阳离子基因载体。
| [1] | Seymour LW, Thrasher AJ. Gene therapy matures in the clinic[J]. Nat Biotechnol, 2012, 30: 588–593. DOI:10.1038/nbt.2290 |
| [2] | Edelstein ML, Abedi MR, Wixon J, et al. Gene therapy clinical trials worldwide 1989-2004-an overview[J]. J Gene Med, 2004, 6: 597–602. DOI:10.1002/(ISSN)1521-2254 |
| [3] | Ginn SL, Alexander IE, Edelstein ML, et al. Gene therapy clinical trials worldwide to 2012-an update[J]. J Gene Med, 2013, 15: 65–77. DOI:10.1002/jgm.v15.2 |
| [4] | Liu L, Zong ZM, Liu Q, et al. A novel galactose-PEG-conjugated biodegradable copolymer is an efficient gene delivery vector for immunotherapy of hepatocellular carcinoma[J]. Biomaterials, 2018, 184: 20–30. DOI:10.1016/j.biomaterials.2018.08.064 |
| [5] | Gonzalez-Fernandez T, Sathy BN, Hobbs C, et al. Mesenchymal stem cell fate following non-viral gene transfection strongly depends on the choice of delivery vector[J]. Acta Biomater, 2017, 55: 226–238. DOI:10.1016/j.actbio.2017.03.044 |
| [6] | Yang LP, Cao L, Zhao T, et al. The progress of multifunctional envelope-type nano device[J]. Acta Pharm Sin (药学学报), 2018, 53: 47–53. |
| [7] | Yin H, Kanasty RL, Eltoukhy AA, et al. Non-viral vectors for gene-based therapy[J]. Nat Rev Genet, 2014, 15: 541–555. DOI:10.1038/nrg3763 |
| [8] | Han J, Hwang HS, Na K. TRAIL-secreting human mesenchymal stem cells engineered by a non-viral vector and photochemical internalization for pancreatic cancer gene therapy[J]. Biomaterials, 2018, 182: 259–268. DOI:10.1016/j.biomaterials.2018.08.024 |
| [9] | Wang T, Upponi JR, Torchilin VP. Design of multifunctional non-viral gene vectors to overcome physiological barriers:dilem mas and strategies[J]. Int J Pharm, 2012, 427: 3–20. DOI:10.1016/j.ijpharm.2011.07.013 |
| [10] | Palmerston Mendes L, Pan J, Torchilin VP. Dendrimers as nano carriers for nucleic acid and drug delivery in cancer therapy[J]. Molecules, 2017, 22: 1401. DOI:10.3390/molecules22091401 |
| [11] | Wang X, Niu D, Hu C, et al. Polyethyleneimine-based nano carriers for gene delivery[J]. Curr Pharm Des, 2015, 21: 6140–6156. DOI:10.2174/1381612821666151027152907 |
| [12] | Varkouhi AK, Scholte M, Storm G, et al. Endosomal escape path ways for delivery of biologicals[J]. J Control Release, 2011, 151: 220–228. DOI:10.1016/j.jconrel.2010.11.004 |
| [13] | Cao D, Qin L, Huang H, et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of lowgeneration PAMAM and branched PEI-1.8k[J]. Mol Biosyst, 2013, 9: 3175–3186. DOI:10.1039/c3mb70261h |
| [14] | Pan S, Cao D, Yi W, et al. A biodegradable and serum-resistant gene delivery carrier composed of polyamidoamine-poly N, N'-di-(2-aminoethyl) aminoethyl glutamine copolymer[J]. Colloids Surf B Biointerfaces, 2013, 104: 294–302. DOI:10.1016/j.colsurfb.2012.12.018 |
| [15] | Pan S, Cao D, Huang H, et al. A serum-resistant low-generation polyamidoamine with PEI 423 outer layer for gene delivery vector[J]. Macromol Biosci, 2013, 13: 422–436. DOI:10.1002/mabi.v13.4 |
| [16] | Wu HM, Pan SR, Chen MW, et al. A serum-resistant polyamido amine-based polypeptide dendrimer for gene transfection[J]. Biomaterials, 2011, 32: 1619–1634. DOI:10.1016/j.biomaterials.2010.09.045 |
| [17] | Jin GW, Koo H, Nam K, et al. PAMAM dendrimer with a 1, 2-diaminoethane surface facilitates endosomal escape for enhanced pDNA delivery[J]. Polymer, 2011, 52: 339–346. DOI:10.1016/j.polymer.2010.10.066 |
| [18] | Yao W, Cheng X, Fu S, et al. Low molecular weight polyethyl enimine-grafted soybean protein gene carriers with low cyto toxicity and greatly improved transfection in vitro[J]. J Biomater Appl, 2018, 32: 957–966. DOI:10.1177/0885328217748021 |
| [19] | Jeong GW, Nah JW. Evaluation of disulfide bond-conjugated LMWSC-g-bPEI as non-viral vector for low cytotoxicity and efficient gene delivery[J]. Carbohydr Polym, 2017, 178: 322–330. DOI:10.1016/j.carbpol.2017.09.048 |
| [20] | Thambi T, Yoon HY, Kim K, et al. Bioreducible block copoly mers based on poly(ethylene glycol) and poly(γ-benzyl L-gluta mate) for intracellular delivery of camptothecin[J]. Bioconjugate Chem, 2011, 22: 1924–1931. DOI:10.1021/bc2000963 |
| [21] | Zhao Y, Qin Y, Liang Y, et al. Salt-induced stability and serumresistance of polyglutamate polyelectrolyte brushes/nuclear factor-κB p65 siRNA polyplex enhance the apoptosis and efficacy of doxorubicin[J]. Biomacromolecules, 2013, 14: 1777–1786. DOI:10.1021/bm400177q |
| [22] | Cao D, Tian S, Yi W, et al. Nanocomplexes from RGD-modified generation 1.0 polyamidoamine based copolymers used for intra vascular gene release to prevent restenosis[J]. Nanomedicine (Lond), 2016, 11: 359–375. DOI:10.2217/nnm.15.201 |
| [23] | Pan S, Cao D, Fang R, et al. Cellular uptake and transfection activity of DNA complexes based on poly(ethylene glycol)-poly-(L-glutamine) copolymer with PAMAM G2[J]. J Mater Chem B, 2013, 1: 5114–5127. DOI:10.1039/c3tb20649a |
| [24] | Cao D, Tian S, Huang H, et al. Divalent folate modification on PEG:an effective strategy for improving the cellular uptake and targetability of PEGylated polyamidoamine-polyethylenimine copolymer[J]. Mol Pharm, 2015, 12: 240–252. DOI:10.1021/mp500572v |
| [25] | Chen L, Tian H, Chen J, et al. Multi-armed poly(L-glutamic acid)-graft-oligoethylenimine copolymers as efficient nonviral gene delivery vectors[J]. J Gene Med, 2010, 12: 64–76. DOI:10.1002/jgm.v12:1 |
| [26] | Morris VB, Sharma CP. Enhanced in-vitro transfection and biocompatibility of L-arginine modified oligo (-alkylaminosilox anes)-graft-polyethylenimine[J]. Biomaterials, 2010, 31: 8759–8769. DOI:10.1016/j.biomaterials.2010.07.073 |
| [27] | Qin LH, Cao DW, Pan SR, et al. Construction of serum-resistant cationic polymer α-CD-PAMAM and evaluation of its perfor mances as gene delivery vector[J]. Acta Pharm Sin (药学学报), 2017, 52: 139–145. |
| [28] | Douglas KL, Piccirillo CA, Tabrizian M. Cell line-dependent internalization pathways and intracellular trafficking determine transfection efficiency of nanoparticle vectors[J]. Eur J Pharm Biopharm, 2008, 68: 676–687. DOI:10.1016/j.ejpb.2007.09.002 |
 2019, Vol. 54
2019, Vol. 54


