2. 浙江大学药学院药物代谢与分析实验室, 浙江省抗肿瘤药物重点实验室, 浙江 杭州 310058
2. Laboratory of Pharmaceutical Analysis and Drug Metabolism, Zhejiang Province Key Laboratory of Anti-Cancer Drug Research, College of Pharmaceutical Sciences, Zhejiang University, Hangzhou 310058, China
氯化两面针碱(nitidine chloride, NC, 图 1)是从芸香科花椒属藤本植物两面针Radix Zanthoxyli的干燥根中提取分离得到的一种苯骈菲啶类生物碱, 是传统中药两面针的主要活性成分之一, 且是两面针镇痛片、三九胃泰颗粒等中药制剂的有效成分[1]。研究表明, NC具有抗肿瘤、抗炎、抗疟及镇痛等多种生物活性[2], 近年来在卵巢癌、肝癌等抗肿瘤[3, 4]方面显示出较强的作用, 是良好的抗肿瘤候选化合物。但有文献报道, NC可致斑马鱼心率降低并诱发心脏毒性[5], 而心脏毒性是早期成药性评价的重要指标之一, NC是否会在哺乳动物心脏蓄积及其相关机制尚不清楚。
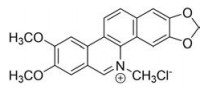
|
Figure 1 Chemical structure of nitidine chloride (NC) |
NC为季铵类生物碱, 被动透过性差, 需细胞膜转运体介导其跨细胞转运。人、鼠心脏上表达多种跨膜转运蛋白, 如有机阳离子转运体1和3 (OCT1、OCT3)、新型有机阳离子转运体1和2 (OCTN1、OCTN2)以及质膜单胺转运体(PMAT)等摄取型转运体[6, 7], 它们共同参与内源性和外源性物质由细胞外进入细胞内。
本研究首先考察NC在大鼠心脏的分布, 进一步应用多种稳定表达转运体的转基因细胞模型、原代心肌细胞和成纤维细胞, 研究NC的心脏积聚机制及毒性, 为NC的心脏毒性及成药性评价提供参考。
材料与方法药品和试剂 氯化两面针碱(NC, 纯度 > 98%, 批号: GR-134-170706)、左旋延胡索乙素(L-tetrahydropalmatine, L-THP, 纯度: 98%, 批号: ZL1612200426-LTD) (南京广润生物制品有限公司); 奎尼丁(quinidine, 纯度: 98%, 批号: G1705030)、左旋肉碱(L-carnitine, 纯度: 98%, 批号: J1423007)、氯雷他定(loratadine, 纯度≥98%, 批号: H1527108) (阿拉丁公司); Decynium 22 (纯 > 97%, 批号: 323764)、5-溴脱氧尿嘧啶(5-bromo-2'-deoxyuridine, 纯度≥99%, 批号: HMBF8725V)、胶原酶Ⅰ (批号: SLBW6959)、DMSO (纯度≥99.5%, 批号: SHBJ7919) (美国Sigma公司); 胰酶(批号: 1910485)、青-链霉素溶液(双抗, 批号: 2018052503)、胎牛血清(批号: 1908121) (美国Gibco公司); DMEM培养基(批号: 0024518)、DMEM/F-12培养基(批号: 0011518) (以色列Biological Industries公司); MTT (纯度≥98%, 批号: EZ2411A401, 德国Biofroxx公司); 乳酸脱氢酶试剂盒(批号: 07672403, 瑞士Roche公司); BCA蛋白浓度测定试剂盒(批号: P0011, 碧云天生物技术研究所); 乙腈(色谱纯, 批号: 18095192, 美国Tedia公司); 其他试剂均为分析纯或更高级别。
实验所用mock细胞及MDCK-hOCT1、MDCK-hOCT3、MDCK-hOCTN1、MDCK-hOCTN2、MDCK-hPMAT为本课题组构建[8-11]。
实验动物 新生P0代SD乳鼠; 8周龄SD大鼠(n = 30), 雌雄各半, 体重220 ± 20 g, 均由浙江省医学科学院动物中心提供(许可证号: SCXK (浙) 2015-0001, 清洁二级), 饲养于温度(22 ± 2) ℃和湿度(55 ± 5) %, 自由饮水进食。所有实验过程均获得了浙江大学医学中心动物保护和使用委员会的批准(2015-380-01), 符合中国动物福利标准。
动物给药与样品收集 将30只SD大鼠, 雌雄各半, 随机分成4组, 其中单次给药组每组6只, 连续给药组每组12只。大鼠单次静脉注射(iv) 5 mg·kg-1 NC, 其中3组分别于给药后0.25、0.5及2 h取全血(肝素抗凝)、麻醉后处死取心脏组织; 另1组连续iv 20天, 末次给药后2 h取全血、心脏组织。4 ℃、3 000 r·min-1离心10 min分离血浆; 心脏组织以溶剂(水-乙腈=1:1)制成125 mg·mL-1组织匀浆液, -80 ℃保存, 以LC-MS/MS测定NC浓度。
细胞培养 MDCK-hOCT1、MDCK-hOCT3、MDCK-hOCTN1、MDCK-hOCTN2、MDCK-hPMAT及mock细胞于含1%双抗、10%胎牛血清的DMEM培养基中生长, 于37 ℃、5% CO2饱和湿度的培养箱中培养。待细胞生长至80%~90%融合度时, 用0.25%胰酶消化传代, 并采用经典底物和抑制剂验证细胞功能。
细胞积聚 将各转基因细胞及mock细胞按密度2×105个/孔接种于24孔板, 生长3天后, 进行NC在细胞上的积聚实验。吸弃细胞培养液, 用37 ℃ HBSS (MDCK-hOCT1、MDCK-hOCT3细胞)或KRH (MDCK-hOCTN1、MDCK-hOCTN2、MDCK-hPMAT细胞)洗两遍, 预孵育10 min后, 加NC, 使终浓度为0.5~2 μmol·L-1, 或NC及各种转运体的经典抑制剂(OCT1、OCT3、OCTN1:奎尼丁, OCTN2:左旋肉碱, PMAT: Decynium 22;各抑制剂的浓度为4~100 μmol·L-1)共孵育, 孵育一定时间后迅速弃去孵育液, 用冰冷的PBS洗3遍终止积聚, 加100 μL 0.1% SDS裂解细胞, -80 ℃冻存, 以LC-MS/MS测定裂解液中NC浓度, 并以BCA法测定蛋白浓度进行校正。
乳鼠原代心肌细胞和成纤维细胞的分离 根据文献[12]进行改良:取乳鼠心脏, 清洗剪碎, 加入含0.05%胶原酶Ⅰ和0.03%胰酶进行消化, 所得细胞培养于含1%双抗、10%胎牛血清的DMEM/F12培养基中, 置37 ℃、5% CO2培养箱培养1.5 h后, 将未贴壁的心肌细胞转移至新的培养皿中, 加入终浓度为0.1 mmol·L-1的5-溴脱氧尿嘧啶抑制成纤维细胞的增殖, 48 h后换液, 成纤维细胞因生长迅速, 2天即呈融合状态可用于传代, 其细胞排列紧密、平坦, 胞质薄而透明; 心肌细胞则逐渐伸出伪足, 变为三角形、多边形等不规则形态, 并交织成网。
OCT1、OCT3抑制剂对NC在原代心肌细胞和成纤维细胞中积聚的影响 将心肌细胞按密度5×105个/孔接种于12孔板, 成纤维细胞按密度2×105个/孔接种于24孔板, 48 h后, 进行NC的细胞积聚研究。吸弃细胞培养液, 用37 ℃ HBSS洗两遍, 预孵育10 min后, 心肌细胞、成纤维细胞对照组加入含NC的HBSS溶液, 使NC终浓度分别为4、2 μmol·L-1, 抑制剂组加入含OCT1、OCT3阳性抑制剂(250 μmol·L-1奎尼丁, 250 μmol·L-1左旋肉碱, 5 μmol·L-1 Decynium 22)的同等浓度NC溶液。37 ℃孵育10 min, 迅速弃去孵育液, 按“细胞积聚”项下操作。
样品处理与LC-MS/MS分析 取血浆、组织匀浆液各100、50 μL, 分别加入200、400 μL乙腈(含内标氯雷他定30 ng·mL-1)沉淀蛋白; 细胞样品解冻后吹打收集裂解液80 μL, 加入乙腈160 μL (含内标氯雷他定20 ng·mL-1)沉淀蛋白, 旋涡振荡5 min, 4 ℃、13 000 r·min-1离心15 min, 取上清进行LC-MS/MS分析, 样品检测参考文献方法[13]。
MTT法细胞存活率和培养液中LDH检测 将原代心肌细胞和成纤维细胞分别以1×105个/孔和1×104个/孔的密度接种于96孔板, 贴壁后, 进行NC对细胞的毒性实验。细胞以含0.1~50 μmol·L-1 NC的培养液培养24 h后, 以同等NC浓度换液继续培养24 h, 同时设置DMSO空白对照组。以MTT法检测细胞存活率。同法选择2.5~10 μmol·L-1 NC给药刺激48 h后, 收集细胞培养液, 以LDH试剂盒测定LDH活力。
数据分析 以GraphPad Prism 5.0对实验数据进行作图分析, 结果均以
图 2显示, 大鼠单次iv 5 mg·kg-1 NC后0.25、0.5和2 h, 心脏中NC的平均浓度分别为47.7、71.1和63.2 μg·g-1, 与相同时间点血浆中的浓度比分别为576、1 352和1 212。大鼠连续iv 5 mg·kg-1 NC 20天, 末次给药后2 h, 心脏中NC平均浓度为458.5 μg·g-1, 为血浆中NC浓度的7 336倍, 单次给药后2 h浓度的7.3倍。上述结果提示, NC可在心脏组织中浓集和蓄积。
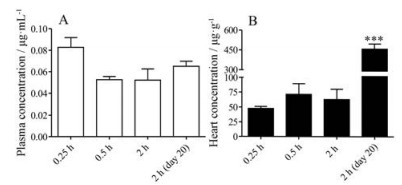
|
Figure 2 The concentration of NC in rat plasma (A) and heart (B) after single (n= 6) and successive intravenous administration of 5 mg·kg-1 NC for 20-days. n= 12, |
为探讨NC在心脏中的积聚机制, 本研究应用转基因细胞模型, 考察心脏上可能与NC积聚有关的转运体对NC的摄取作用。结果显示(图 3): NC在MDCK-hOCT1和MDCK-hOCT3细胞中的积聚分别是mock细胞的16.1和4.99倍, 提示NC为OCT1、OCT3的底物; 而NC在MDCK-hOCTN1、MDCK-hOCTN2、MDCK-hPMAT细胞中的积聚与mock细胞无明显差异(P > 0.05), 提示NC不是OCTN1、OCTN2、PMAT的底物。上述结果提示, NC可能通过OCT1和OCT3摄取进入心脏。
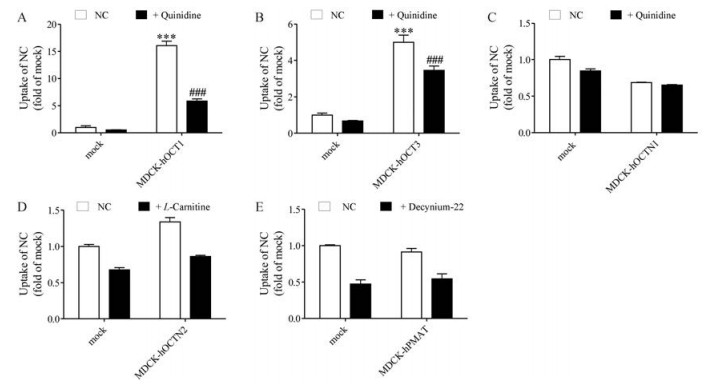
|
Figure 3 The cellular accumulation of NC in MDCK-hOCT1 (A), MDCK-hOCT3 (B), MDCK-hOCTN1 (C), MDCK-hOCTN2 (D), MDCK-hPMAT (E) and mock cells. Cells were incubated with 0.5-2 μmol·L-1 NC in the absence or presence of 100 μmol·L-1 quinidine, 100 μmol·L-1 L-carnitine or 4 μmol·L-1 Decynium-22 in uptake buffer for 2 min. n = 3, |
为进一步阐明OCT1、OCT3在NC大鼠心脏摄取中的作用, 本研究考察了OCT1、OCT3抑制剂奎尼丁、左旋延胡索乙素、Decynium 22对NC在乳大鼠原代心肌细胞和成纤维细胞中积聚的抑制。结果显示, OCT1、OCT3抑制剂均能明显降低NC在细胞中的积聚(图 4), 提示OCT1、OCT3参与NC在大鼠心脏的浓集和蓄积。

|
Figure 4 The accumulation of NC in primary cultured rat cardiomyocytes (A) and cardiac fibroblasts (B). Cells were incubated with 4 or 2 μmol·L-1 NC in the absence or presence of OCT inhibitors, 250 μmol·L-1 quinidine, 250 μmol·L-1 L-tetrahydropalmatine (L-THP) and 5 μmol·L-1 Decynium 22 for 10 min. n > 3, |
鉴于NC在大鼠心脏积聚现象, 以及乳大鼠心脏原代细胞可通过OCT1和OCT3介导NC的摄取, 本研究对NC是否引起原代心肌细胞和成纤维细胞的毒性进行了考察。
4.1 NC对细胞生长的影响乳大鼠心肌细胞和成纤维细胞以不同浓度NC处理48 h后, 置显微镜下观察形态变化, 典型图片见图 5A和5B。由图可见, 经1、5和10 μmol·L-1 NC处理后, 心肌细胞和成纤维细胞形态逐渐萎缩、脱落、死亡, 细胞密度随NC浓度的增加逐渐降低。

|
Figure 5 The morphology change of primary cardiomyocytes (A) and cardiac fibroblasts (B) after treatment with vehicle control (0.2% DMSO), 1, 5 and 10 μmol·L-1 NC for 48 h (×100) |
为进一步考察NC潜在的心脏毒性, 本研究考察了NC对心肌细胞和成纤维细胞存活率及细胞培养液中LDH活力的影响, 结果显示: 0.01~50 μmol·L-1 NC能降低心肌细胞和成纤维细胞的存活率, 且细胞毒性呈明显的浓度依赖性, LC50值分别为10.9和10.4 μmol·L-1 (图 6A, B)。此外, 2.5~10 μmol·L-1 NC显著增加细胞培养液中LDH的活性(图 6C, D), 提示NC处理增加细胞释放LDH。上述结果提示, NC对大鼠原代心肌细胞和成纤维细胞具有潜在的毒性。
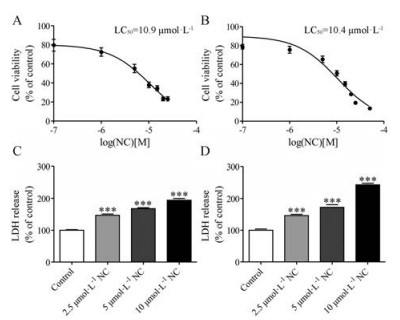
|
Figure 6 Cell viability of primary cardiomyocytes (A) and cardiac fibroblasts (B) treated with 0.01-50 μmol·L-1 NC for 48 h. Values were calculated as percentage of the control group (0.2% DMSO). n = 6, |
NC为抗肿瘤候选化合物, 具有抗癌谱广、作用强等特点, 但也发现其具有肝脏、肾脏及心脏毒性[2, 5, 13]。本研究在NC的组织分布中发现, NC在大鼠心脏中高度浓集。为探讨NC在心脏中的积聚机制, 根据NC的结构特征及心脏转运体分布[14, 15], 首先应用稳定表达有机阳离子类转运体的细胞模型, 考察了NC的细胞积聚, 发现NC是OCT1和OCT3的底物, 但不是OCTN1、OCTN2以及PMAT的底物。基于心肌细胞是心脏的基本功能单位, 成纤维细胞占非心肌细胞90%, 是构成心脏的主要细胞, 为更好地阐明NC的心脏积聚机制, 本研究进一步考察了在有或无OCT1和OCT3抑制剂存在下, NC在大鼠原代心肌细胞和成纤维细胞中的积聚情况。结果发现, 多种OCT1、OCT3抑制剂均能显著降低NC在心肌细胞和成纤维细胞中的积聚[13, 16, 17], 进一步提示OCT1、OCT3参与了NC在心脏中的积聚。此外, 心脏上也表达MDR1、MRP5、MATE1等外排转运体[6, 18, 19], 但本研究发现NC并不是MDR1、MRP5的底物, 而NC虽为MATE1的底物, 但其对NC的转运能力(Clint: 20.6 μL·mg-1 pro·min-1)远低于OCT1 (Clint: 311 μL·mg-1 pro·min-1)[13]。同时, 也不能排除心脏上其他外排转运体参与NC的转运, 但其对NC的外排可能弱于OCT1或OCT3对NC的摄取。
本研究发现10 μmol·L-1的NC可导致大鼠原代心肌细胞和成纤维细胞存活率显著降低及LDH显著升高, 且大鼠单次iv 5 mg·kg-1 NC后0.25~2 h, 心脏中NC浓度为47.7~71.1 μg·g-1 (约124.3~185.2 μmol·L-1), 连续iv 5 mg·kg-1 NC 20天, 末次给药后2 h, 心脏中NC浓度为458.5 μg·g-1 (约1 194.6 μmol·L-1)。因此, NC在心脏中的高浓度积聚对心脏具有潜在的毒性。实验室前期相关研究也表明[13], NC是OCT2高亲和力的底物, 而OCT2介导NC进入肾脏产生蓄积。大鼠连续20天iv 5 mg·kg-1 NC, 末次给药后2 h, NC在肾脏中的浓度为145.1 μmol·L-1, 同时也观察到NC引起的肾脏损伤。但值得说明的是, 尽管本研究发现了NC在大鼠心脏蓄积, 却未发现心脏组织相关生化指标和组织病理上的显著变化。这一现象可能与心脏自身的抗氧化酶防御系统有关[20, 21], 研究表明[22], 成纤维生长因子21以自分泌方式调节抗氧化基因参与心脏的保护作用。此外, 已有文献表明, 心肌细胞上OCT1和OCT3的表达, 且其功能可被奎尼丁显著抑制[23], 但尚未有文献报道成纤维细胞上OCT1、OCT3的表达。在原代细胞的NC积聚实验中, 本研究发现OCT1、OCT3的抑制剂既能显著抑制NC在心肌细胞中的积聚, 同时也能抑制其在成纤维细胞中的积聚, 推测成纤维细胞上可能也有OCT1和OCT3表达并参与NC的心脏积聚。
综上, 本研究结果提示, NC可在大鼠心脏高度浓集, 且OCT1、OCT3可介导NC在心脏积聚, 同时本研究还显示, NC对原代心肌细胞和成纤维细胞具有一定的毒性。因此, 本研究为NC在心脏中的积聚及潜在毒性提供了依据。
| [1] | Yang XF, Lu XS. Using HPLC method to determine the content of the two side of chloride in the tri-ninth gastric granules[J]. Chin J Ethnomed Ethnopharm (中国民族民间医药), 2017, 26: 25–27. |
| [2] | Li LP, Tu MJ, Yang X, et al. The contribution of human OCT1, OCT3, and CYP3A4 to nitidine chloride-induced hepatocellular toxicity[J]. Drug Metab Dispos, 2014, 42: 1227–1234. DOI:10.1124/dmd.113.056689 |
| [3] | Chen SP, Yang L, Feng J. Nitidine chloride inhibits proliferation and induces apoptosis in ovarian cancer cells by activating the Fas signalling pathway[J]. J Pharm Pharmacol, 2018, 70: 778–786. DOI:10.1111/jphp.2018.70.issue-6 |
| [4] | Liu LM, Xiong DD, Lin P, et al. DNA topoisomerase 1 and 2 A function as oncogenes in liver cancer and may be direct targets of nitidine chloride[J]. Int J Oncol, 2018, 53: 1897–1912. |
| [5] | Huan HL, Liu HG, Meng Y, et al. Effect of nitidine chloride on the heart development of zebra fish embryos[J]. Guangxi Med J (广西医学), 2011, 33: 546–548. |
| [6] | Koepsell H, Lips K, Volk C. Polyspecific organic cation trans porters:structure, function, physiological roles, and biopharma ceutical implications[J]. Pharm Res, 2007, 24: 1227–1251. DOI:10.1007/s11095-007-9254-z |
| [7] | Barnes K, Dobrzynski H, Foppolo S, et al. Distribution and func tional characterization of equilibrative nucleoside transporter-4, a novel cardiac adenosine transporter activated at acidic pH[J]. Circ Res, 2006, 99: 510–519. DOI:10.1161/01.RES.0000238359.18495.42 |
| [8] | Tu MJ, Sun SY, Wang K, et al. Organic cation transporter 1 mediates the uptake of monocrotaline and plays a key role in its hepatotoxicity[J]. Toxicology, 2013, 311: 225–230. DOI:10.1016/j.tox.2013.06.009 |
| [9] | Sun SY, Wang K, Lei HM, et al. Inhibition of organic cation transporter 2 and 3 may be involved in the mechanism of the antidepressant-like action of berberine[J]. Prog Neuropsycho pharmacol Biol Psychiatry, 2014, 49: 1–6. DOI:10.1016/j.pnpbp.2013.11.005 |
| [10] | Weng YY, Jin LS, Wang YQ, et al. Establishment and application of cell models with stable expression of hOCTN1/2[J]. Acta Pharm Sin (药学学报), 2016, 51: 931–937. |
| [11] | Sun SY, Zhou SS, Lei SW, et al. Jatrorrhizine reduces 5-HT and NE uptake via inhibition of uptake-2 transporters and produces antidepressant-like action in mice[J]. Xenobiotica, 2018. DOI:10.1080/00498254.2018.1542188 |
| [12] | Louch WE, Sheehan KA, Wolska BM. Methods in cardio myocyte isolation, culture, and gene transfer[J]. J Mol Cell Cardiol, 2011, 51: 288–298. DOI:10.1016/j.yjmcc.2011.06.012 |
| [13] | Li LP, Song FF, Weng YY, et al. Role of OCT2 and MATE1 in renal disposition and toxicity of nitidine chloride[J]. Br J Pharmacol, 2016, 173: 2543–2554. DOI:10.1111/bph.v173.16 |
| [14] | Wagner DJ, Hu T, Wang J. Polyspecific organic cation trans porters and their impact on drug intracellular levels and pharma codynamics[J]. Pharmacol Res, 2016, 111: 237–246. DOI:10.1016/j.phrs.2016.06.002 |
| [15] | Grube M, Ameling S, Noutsias M, et al. Selective regulation of cardiac organic cation transporter novel type 2(OCTN2) in dilated cardiomyopathy[J]. Am J Pathol, 2011, 178: 2547–2559. DOI:10.1016/j.ajpath.2011.02.020 |
| [16] | Bourdet DL, Pritchard JB, Thakker DR. Differential substrate and inhibitory activities of ranitidine and famotidine toward human organic cation transporter 1(hOCT1; SLC22A1), hOCT2(SLC22A2), and hOCT3(SLC22A3)[J]. J Pharmacol Exp Ther, 2005, 315: 1288–1297. DOI:10.1124/jpet.105.091223 |
| [17] | Hayer-Zillgen M, Brüss M, Bönisch H. Expression and pharma cological profile of the human organic cation transporters hOCT1, hOCT2 and hOCT3[J]. Br J Pharmacol, 2002, 136: 829–836. DOI:10.1038/sj.bjp.0704785 |
| [18] | Krishnamurthy K, Vedam K, Kanagasabai R, et al. Heat shock factor-1 knockout induces multidrug resistance gene, MDR1b, and enhances P-glycoprotein (ABCB1)-based drug extrusion in the heart[J]. Proc Natl Acad Sci U S A, 2012, 109: 9023–9028. DOI:10.1073/pnas.1200731109 |
| [19] | Dazert P, Meissner K, Vogelgesang S, et al. Expression and localization of the multidrug resistance protein 5(MRP5/ABCC5), a cellular export pump for cyclic nucleotides, in human heart[J]. Am J Pathol, 2003, 163: 1567–1577. DOI:10.1016/S0002-9440(10)63513-4 |
| [20] | Doherty KR, Wappel RL, Talbert DR, et al. Multi-parameter in vitro toxicity testing of crizotinib, sunitinib, erlotinib, and nilotinib in human cardiomyocytes[J]. Toxicol Appl Pharmacol, 2013, 272: 245–255. DOI:10.1016/j.taap.2013.04.027 |
| [21] | Li XH, Tang NF, Li YQ, et al. Cytoprotective effect of p62/Nrf2 signaling pathway[J]. Acta Pharm Sin (药学学报), 2018, 53: 1995–2005. |
| [22] | Planavila A, Redondo-Angulo I, Ribas F, et al. Fibroblast growth factor 21 protects the heart from oxidative stress[J]. Cardiovasc Res, 2015, 106: 19–31. DOI:10.1093/cvr/cvu263 |
| [23] | Rossato LG, Costa VM, de Pinho PG, et al. Structural isomeriza tion of synephrine influences its uptake and ensuing glutathione depletion in rat-isolated cardiomyocytes[J]. Arch Toxicol, 2011, 85: 929–939. DOI:10.1007/s00204-010-0630-9 |
 2019, Vol. 54
2019, Vol. 54


