2. 青岛大学药学院天然药物与生药学系, 山东 青岛 266021;
3. 海南省艾纳香工程技术研究中心, 海南 儋州 571737;
4. 山东药品食品职业技术学院, 山东 威海 264210
2. Department of Natural Medicinal Chemistry and Pharmacognosy, School of Pharmacy, Qingdao University, Qingdao 266021, China;
3. Hainan Engineering Research Center for Blumea balsamifera, Danzhou 571737, China;
4. Shandong Drug and Food Vocational College, Weihai 264210, China
植物内生真菌(fungal endophytes)是指生活在健康植物组织内部而不引起明显植物病状的真菌[1]。这些微生物长期伴随着宿主植物进化, 扮演着各种重要角色。植物内生真菌之间, 内生真菌与寄主植物之间, 以及内生真菌与外界环境之间均存在复杂的信息交流和相互作用[2], 如协助寄主植物抵御动物的取食[3], 帮助寄主植物抑制周围其他植物的生长[4], 以及内生真菌协助寄主植物抵御高温等环境胁迫等[5]。近期, 刘吉开课题组[6]从土豆内生真菌Trichothecium crotocinigenum中发现了结构骨架新颖的单端孢霉烯类化合物, 这些化合物具有明显的抗土豆病原菌的活性。丁刚团队[7]从植物内生真菌Chaetosphaeronema hispidulur中分离获得了一些大环内酯类化合物, 发现它们具有抑制植物幼苗生长的活性。因此, 植物内生真菌是天然生物活性化合物发现的重要源泉, 为研发抗宿主植物致病菌、有害植物或昆虫的生物农药提供一种新途径。
植物艾纳香[Blumea balsamifera (L.) DC.]又名大风艾、冰片艾, 是海南重要特色黎药[8], 然而目前艾纳香田间虫害严重, 主要为入侵性害虫稻水象甲(Lissorhoptrus oryzophilus Kuschel)。为了生物防治稻水象甲, 同时考虑到内生真菌、寄主植物以及外界取食动物三者之间复杂的互作关系[3, 9], 本研究从植物艾纳香中分离了多样的内生真菌, 并进行抗稻水象甲活性筛选。一株内生真菌Corynespora cassiicola J9分离于被稻水象甲取食的艾纳香茎伤口处, 显示了适度的抗稻水象甲活性。进一步化学成分研究获得了8个单体缩酚酸环醚类化合物(图 1)。缩酚酸环醚(depsidone)是由两个苔黑素(orcinol)单体通过酯键和醚键连接而成的聚酮类化合物[10]。这类化合物具有广泛的生物学活性, 包括抗炎、抗细菌、抗真菌、抗肿瘤、抗紫外线等[11, 12]。本研究评估了这类缩酚酸环醚类化合物的杀灭象甲活性。
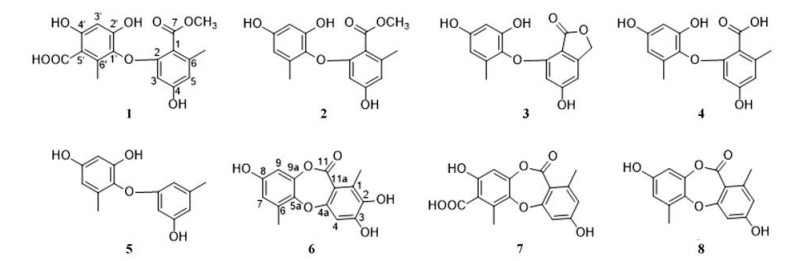
|
Figure 1 Structures of compounds 1-8 |
化合物1白色粉末, HR-ESI-MS给出准分子离子峰m/z 349.091 9 ([M+H]+, C17H17O8+; calcd. 349.091 7), 结合13C NMR图谱分析, 推测分子式为C17H16O8, 不饱和度10。1H NMR谱图分析表明该化合物含有2个甲基(δH 2.27和2.37)、1个甲氧基(δH 3.91)以及3个芳香氢(δH 5.83、6.32和6.35) (表 1)。13C NMR谱图显示化合物共含有17个碳原子, 包括2个羰基碳(δC 171.1和174.8)、3个sp3杂化碳(δC 15.3、20.1和52.7), 其余均为sp2不饱和碳。HMBC谱图(图 2)显示6'-CH3上的氢与1'、5'和6'位碳相关, H-3'与1'、2'、4'、5'、5'-COOH上的碳相关, 表明存在1个orsellinic acid类结构片段。同时, 在HMBC谱图中, 6-CH3与C-1、C-5和C-6相关, H-3与C-1、C-2、C-4、C-5和C-7相关, H-5与C-1和C-3相关, 提示化合物中存在另1个orsellinic acid类似结构片段。7-OCH3与C-1和C-7相关表明存在1个羧酸甲酯连接在C-1上。根据以上信息, 推测化合物1为缩酚酸环醚类化合物。进一步通过1D NMR的数据比较, 发现化合物1与corynether B (2)结构相似[13], 其中1H NMR比对表明化合物1结构相比化合物2少了1个芳香氢(δH 6.22), 推测可能被其他官能团取代。13C NMR谱图的比对显示化合物1比化合物2结构中多了1个羧基碳(δC 174.8)。综合以上分析, 推断化合物1为化合物2在5'位被羧基取代的类似物, 化合物1命名为corynether C。
| Table 1 1H (500 MHz) and 13C (125 MHz) NMR data of 1 in CD3OD |
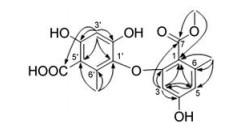
|
Figure 2 Key HMBC correlations (arrows) of 1 |
叶片喷洒饲喂法测定单体化合物杀稻水象甲活性结果显示, 化合物1~8在0.5 mg·mL-1的浓度下均无杀灭稻水象甲活性。
尽管杀虫活性不理想, 然而通过分析发现本研究获得的8个次生代谢产物均属于depsidone类型化合物。结合文献[14], 发现此类化合物具有很强的抗氧化和清除自由基活性, 活性跟抗坏血酸相当。另外, 此类化合物先前主要分离自地衣植物, 具有很强的紫外线吸收能力, 参与地衣植物应对强紫外线的保护机制[15]。本研究以喜强光照植物艾纳香为植物材料, 从其内生真菌C. cassiicola J9中获得大量depsidone类化合物, 提示寄主植物艾纳香可能会通过内生真菌产生的depsidone类次生代谢产物来协助抵御来自太阳光的强紫外辐射, 本研究对解释艾纳香内生真菌与寄主植物的互作关系具有重要参考价值。
实验部分核磁共振波谱仪(Bruker Avance DRX-500 MHz); 高分辨质谱仪(Waters Synapt G2, USA), Waters 2489半制备液相色谱系统(Waters Corporation, Milford, MA, USA); Thermo Scientific Nicolet iS5 FT-IR红外光谱仪(Thermo Fisher Scientific); SW-CJ-1D洁净工作台(江苏苏洁净化设备厂), 葡聚糖凝胶Sephadex LH-20 (GE Healthcare Bio-Sciences AB, Sweden); ODS-A反相键和硅胶(北京慧德易科技有限责任公司); 高效液相色谱柱YMC-Pack ODS-A (5 μm, 250 mm×10 mm), GF254薄层硅胶板(青岛海洋化工有限公司); 石油醚、乙酸乙酯、氯仿、甲醇等均为分析纯(天津市富宇精细化工有限公司)。
植物内生真菌分离自海南黎药植物艾纳香B. balsamifera (L.) DC., 植物材料于2017年12月采自农业农村部儋州药用植物种质资源圃, 内生真菌的鉴定采用之前报道的方法[16], 内生真菌采用ITS序列分析鉴定为C. cassiicola, 菌株编号为J9, 保存在中国热带农业科学院热带作物品种资源研究所南药研究室。
1 次生代谢产物的提取分离 1.1 菌株发酵将目标菌株接种到PDA平板培养基上, 室温培养1周, 作为发酵种子。500 mL三角瓶中装有60 g大米, 加水80 mL, 121 ℃高压蒸汽灭菌20 min, 获得无菌大米培养基。目标菌株发酵种子无菌条件下切块后接种到大米培养基中, 室温静置培养1个月, 加入乙酸乙酯终止发酵。
1.2 提取分离将发酵的大米培养基用乙酸乙酯提取3次, 每次30 min, 合并, 减压浓缩获得粗提物(13 g)。采用硅胶柱色谱分离, 二氯甲烷/甲醇梯度洗脱(100/0, 99/1, …, 0/100), 根据薄层色谱检测合并, 获得4个组分(F1~F4)。F2组分用甲醇溶解, 经ODS-A反相柱分离, 分别用甲醇/水(3:7, 1:0)洗脱, 共得3个组分(F2-1, F2-2, F2-3), 组分F2-1甲醇溶解, 经Sephadex LH-20凝胶柱分离, 甲醇洗脱, 薄层检测合并得3个流分(F2-1-1, F2-1-2, F2-1-3), F2-1-2采用HPLC制备, 以甲醇-水(72:28, V/V)为流动相, 分得化合物2 (20 mg, tR = 26.5 min, 流速为2 mL·min-1)、化合物1 (20 mg, tR = 27.5 min, 流速为2 mL·min-1)和化合物8 (15 mg, tR = 28.6 min, 流速为2 mL·min-1)。F2-1-3甲醇溶解, 采用HPLC制备, 以甲醇-水(75:25, V/V)为流动相, 得化合物6 (30 mg, tR = 25.5 min, 流速为2 mL·min-1)和7 (25 mg, tR = 31.7 min, 流速为2 mL·min-1)。组分F2-2甲醇溶解, Sephadex LH-20凝胶柱分离, 薄层检测合并共得到5个流分(F2-2-1, …, F2-2-5), F2-2-2甲醇溶解, 采用HPLC制备, 以甲醇-水(65:35, V/V)为流动相, 得化合物5 (20 mg, tR = 26.8 min, 流速为2 mL·min-1)和组分F2-2-2-1 (40 mg, tR = 22 min, 流速为2 mL·min-1), 组分F2-2-2-1以甲醇-水(50:50, V/V)为流动相进行分离, 得化合物4 (10 mg, tR = 21.8 min, 流速为2 mL·min-1)和3 (10 mg, tR = 22 min, 流速为2 mL·min-1)。
2 菌株的鉴定以PDA培养基上生长3~5天的菌株为实验材料, 液氮研磨提取DNA, 参考文献方法[16]对菌株nrDNA的ITS序列进行分析, 构建系统发育树, 确定系统分类地位。根据系统发育树, 该菌株与C.cassiicola聚类为一支, 因此该菌株命名为C. cassiicola J9 (GeneBank: MK640660) (图 3)。

|
Figure 3 The phylogenetic tree of the endophytic fungus C. cassiicola J9 |
化合物1 白色粉末, HR-ESI-MS m/z 349.091 9 ([M+H]+, C17H17O8+; calcd. 349.091 7); UV (MeOH) λmax (log ε): 211 (3.05), 250 (2.63), 301 (2.12) nm; IR υmax: 3 247, 2 977, 1 693, 1 643, 1 610, 1 459, 1 381, 1 292, 1 194, 1 155, 1 101, 1 045, 1 000, 985, 952, 878, 844, 808, 770, 743, 685, 623 cm−1。1H NMR (CD3OD, 500 MHz)和13C NMR (CD3OD, 125 MHz)数据见表 1。
化合物2 白色粉末, ESI-MS m/z 305.10 [M+H]+, 1H NMR (500 MHz, CD3OD) δH: 6.31 (1H, d, J = 2.0 Hz, H-5), 6.28 (1H, d, J = 2.0 Hz, H-3'), 6.22 (1H, d, J = 2.0 Hz, H-5'), 5.87 (1H, d, J = 2.0 Hz, H-3), 3.91 (3H, s, 7-OCH3), 2.27 (3H, s, 6-CH3), 2.02 (3H, s, 6'-CH3); 13C NMR (125 MHz, CD3OD) δC: 172.1 (C-7), 161.8 (C-2), 159.7 (C-4), 157.0 (C-4'), 152.4 (C-2'), 140.8 (C-6), 135.5 (C-1'), 134.5 (C-6'), 116.0 (C-1), 112.3 (C-5), 110.2 (C-5'), 103.5 (C-3'), 100.4 (C-3), 53.5 (7-OCH3), 20.9 (6-CH3), 17.1 (6'-CH3)。上述波谱数据与文献[17]基本一致, 确定化合物2为corynether B。
化合物3 灰色粉末, ESI-MS m/z 289.070 6 [M+H]+, 1H NMR (500 MHz, CD3OD) δH: 6.48 (1H, d, J = 2.5 Hz, H-5), 6.29 (1H, d, J = 2.5 Hz, H-5'), 6.23 (1H, d, J = 2.5 Hz, H-3'), 5.96 (1H, d, J = 2.5 Hz, H-3), 5.24 (2H, s, H-8), 2.02 (3H, s, 6'-CH3); 13C NMR (125 MHz, CD3OD) δC: 172.9 (C-7), 168.4 (C-2), 161.2 (C-4), 157.5 (C-4'), 154.4 (C-6), 152.2 (C-2'), 134.8 (C-1'), 134.4 (C-6'), 110.3 (C-5), 106.1 (C-5'), 103.8 (C-1), 103.6 (C-3'), 102.7 (C-3), 71.3 (C-8), 17.0 (6'-CH3)。上述波谱数据与文献[17]基本一致, 确定化合物3为corynetherlactone A。
化合物4 棕色粉末, ESI-MS m/z 289.072 2 [M-H]-, 1H NMR (500 MHz, CD3OD) δH: 6.33 (1H, d, J = 2.0 Hz, H-5), 6.28 (1H, d, J = 2.5 Hz, H-5'), 6.23 (1H, d, J = 2.5 Hz, H-3'), 5.89 (1H, d, J = 2.0 Hz, H-3), 2.35 (3H, s, 6-CH3), 2.06 (3H, s, 6'-CH3); 13C NMR (125 MHz, CD3OD) δC: 173.8 (C-7), 161.5 (C-4), 159.3 (C-2), 157.0 (C-4'), 152.3 (C-2'), 140.6 (C-6), 135.6 (C-1'), 134.6 (C-6'), 117.4 (C-1), 112.5 (C-5), 110.2 (C-5'), 103.5 (C-3'), 100.5 (C-3), 21.1 (6-CH3), 17.1 (6'-CH3)。上述波谱数据与文献[11, 17]基本一致, 确定化合物4为corynether A。
化合物5 白色粉末, ESI-MS m/z 247.06 [M+H]+, 1H NMR (500 MHz, CD3OD) δH: 6.30 (1H, d, J = 2.5 Hz, H-1), 6.25 (1H, d, J = 2.5 Hz, H-5), 6.22 (1H, d, J = 2.5 Hz, H-3), 6.18 (1H, d, J = 2.5 Hz, H-5'), 6.08 (1H, d, J = 2.5 Hz, H-3'), 2.18 (3H, s, 6-CH3), 1.99 (3H, s, 6'-CH3); 13C NMR (125 MHz, CD3OD) δC:161.7 (C-2), 160.0 (C-4), 156.4 (C-4'), 152.3 (C-2'), 142.1 (C-6), 135.7 (C-1'), 134.8 (C-6'), 111.1 (C-5), 110.2 (C-5'), 108.9 (C-1), 103.3 (C-3'), 101.0 (C-3), 22.5 (6-CH3), 17.2 (6'-CH3)。上述波谱数据与文献[17]基本一致, 确定化合物5为diaryl ether。
化合物6 灰色粉末, ESI-MS m/z 289.07 [M+H]+, 1H NMR (500 MHz, CD3OD) δH: 6.61 (1H, s, H-4), 6.46 (1H, d, J = 2.0 Hz, H-7), 6.46 (1H, d, J = 2.0 Hz, H-9), 2.36 (3H, s, 6-CH3), 2.31 (3H, s, 1-CH3); 13C NMR (125 MHz, CD3OD) δC: 166.5 (C-11), 158.2 (C-4a), 156.4 (C-8), 152.1 (C-3), 147.0 (C-9a), 144.9 (C-5a), 143.5 (C-2), 133.0 (C-6), 130.3 (C-1), 115.5 (C-7), 114.4 (C-11a), 106.6 (C-9), 105.7 (C-4), 16.9 (6-CH3), 14.5 (1-CH3)。上述波谱数据与文献[17]基本一致, 确定化合物6为corynesidone C。
化合物7 灰色粉末, ESI-MS m/z 317.07 [M+H]+, 1H NMR (500 MHz, CD3OD) δH: 6.59 (1H, s, H-9), 6.58 (1H, d, J = 2.0 Hz, H-4), 6.58 (1H, d, J = 2.0 Hz, H-2), 2.66 (3H, s, 6-CH3), 2.40 (3H, s, 1-CH3); 13C NMR (125 MHz, CD3OD) δC: 174.4 (-COOH), 165.3 (C-4a), 164.9 (C-3), 164.6 (C-3), 161.3 (C-8), 150.5 (C-a), 147.6 (C-1), 144.0 (C-5a), 135.3 (C-6), 117.8 (C-7), 113.9 (C-11a), 108.1 (C-9), 106.6 (C-4), 22.1 (1-CH3), 15.7 (6-CH3)。上述波谱数据与文献[17]基本一致, 确定化合物7为corynesidone D。
化合物8 白色粉末, ESI-MS m/z 271.06 [M-H]-, 1H NMR (500 MHz, CD3OD) δH: 6.56 (1H, d, J = 2.0 Hz, H-4), 6.55 (1H, d, J = 2.0 Hz, H-2), 6.47 (1H, d, J = 2.5 Hz, H-9), 6.47 (1H, d, J = 2.5 Hz, H-7), 2.40 (3H, s, 1-CH3), 2.37 (3H, s, 6-CH3); 13C NMR (125 MHz, CD3OD) δC: 166.2 (C-4a), 165.8 (C-11), 164.3 (C-3), 156.5 (C-8), 147.4 (C-1), 146.9 (C-9a), 144.1 (C-5a), 133.3 (C-6), 117.5 (C-7), 115.6 (C-2), 114.1 (C-11a), 106.7 (C-4), 106.6 (C-9), 22.2 (1-CH3), 16.9 (6-CH3)。上述波谱数据与文献[14, 17]基本一致, 确定化合物8为corynesidone A。
4 活性测试叶片喷洒饲喂试验采用Li等[13]报道的方法:将待测化合物分别用1%的氮酮溶液溶解, 获得0.5 mg·mL-1样品溶液, 将新鲜采集的叶片喷洒样品溶液, 挥干。取直径9 cm的玻璃培养皿, 底部铺一层水饱和滤纸, 将喷洒好的叶片置于滤纸上保湿, 每个培养皿中饲喂20只稻水象甲, 1%的氮酮溶液做空白, 实验重复3次, 24 h后观察虫体的死亡情况, 由于象甲具有假死性, 以象甲肢体是否舒展以及将虫体放进水中30 s后是否移动作为死亡判断标准。实验结果采用Abbot公式[18]计算矫正死亡率。
| [1] | Zhang HW, Song YC, Tan RX. Biology and chemistry of endophytes[J]. Nat Prod Rep, 2006, 23: 753–771. DOI:10.1039/b609472b |
| [2] | Wang HH, Li G, Peng XP, et al. Secondary metabolites from Colletotrichum fioriniae F18, an endophytic fungus isolated from the medicinal plant Mahonia fortunei[J]. Acta Pharm Sin (药学学报), 2018, 53: 1862–1867. |
| [3] | Cook D, Gardner DR, Lee ST, et al. A swainsonine survey of North American Astragalus and Oxytropis taxa implicated as locoweeds[J]. Toxicon, 2016, 118: 104–111. DOI:10.1016/j.toxicon.2016.04.033 |
| [4] | Yuan C, Ding G, Wang H, et al. Phytotoxic secondary metabo lites from the endolichenic fungus Myxotrichum sp.[J]. Chem Nat Compd, 2018, 54: 638–641. DOI:10.1007/s10600-018-2435-7 |
| [5] | Redman RS, Sheehan KB, Stout RG, et al. Thermotolerance generated by plant/fungal symbiosis[J]. Science, 2002, 298: 1581–1581. DOI:10.1126/science.1072191 |
| [6] | Yang HX, Ai HL, Feng T, et al. Trichothecrotocins A-C, antiphy topathogenic agents from potato endophytic fungus Trichothecium crotocinigenum[J]. Org Lett, 2018, 20: 8069–8072. DOI:10.1021/acs.orglett.8b03735 |
| [7] | Zhang XY, Liu ZL, Sun BD, et al. Bioactive resorcylic acid lactones with different ring systems from desert plant endophytic fungus Chaetosphaeronema hispidulur[J]. J Agric Food Chem, 2018, 66: 8976–8982. DOI:10.1021/acs.jafc.8b02648 |
| [8] | China Flora Editorial Board of CAS. Flora of China (中国植物志)[M]. Beijing: Science Press, 1988: 19-21. |
| [9] | Cook D, Gardner DR, Pfister JA. Swainsonine-containing plants and their relationship to endophytic fungi[J]. J Agric Food Chem, 2014, 62: 7326–7334. DOI:10.1021/jf501674r |
| [10] | Nguyen KH, Chollet-Krugler M, Gouault N, et al. UV-protectant metabolites from lichens and their symbiotic partners[J]. Nat Prod Rep, 2013, 30: 1490–1508. DOI:10.1039/c3np70064j |
| [11] | Russo A, Piovano M, Lombardo L, et al. Lichen metabolites prevent UV light and nitric oxide-mediated plasmid DNA damage and induce apoptosis in human melanoma cells[J]. Life Sci, 2008, 83: 468–474. DOI:10.1016/j.lfs.2008.07.012 |
| [12] | Hall RSB, Bornman JF, Björn LO. UV-induced changes in pigment content and light penetration in the fruticose lichen Cladonia arbuscula ssp. Mitis[J]. J Photochem Photobiol B, 2002, 66: 13–20. DOI:10.1016/S1011-1344(01)00270-6 |
| [13] | Li XY, Wang YH, Yang J, et al. Acaricidal activity of cyclodipep tides from Bacillus amyloliquefaciens W1 against Tetranychus urticae[J]. J Agric Food Chem, 2018, 66: 10163–10168. DOI:10.1021/acs.jafc.8b03806 |
| [14] | Chomcheon P, Wiyakrutta S, Sriubolmas N, et al. Aromatase inhibitory, radical scavenging, and antioxidant activities of depsi dones and diaryl ethers from the endophytic fungus Corynespora cassiicola L36.[J]. Phytochemistry, 2009, 70: 407–413. DOI:10.1016/j.phytochem.2009.01.007 |
| [15] | Huneck S, Yoshimura I. Identification of Lichen Substances[M]. Berlin: Springer-Verlag, 1996. |
| [16] | Yuan C, Li G, Zhang YB, et al. Secondary metabolites of an endophytic fungus Diaporthe sp. derived from Blumea balsamifera (L.) DC.[J]. Acta Microbiol Sin (微生物学报), 2019, 4: 753–761. |
| [17] | Okoye FBC, Lu S, Nworu CS, et al. Depsidone and diaryl ether derivatives from the fungus Corynespora cassiicola, an endo phyte of Gongronema latifolium[J]. Tetrahedron Lett, 2013, 54: 4210–4214. DOI:10.1016/j.tetlet.2013.05.117 |
| [18] | Abbott WS. A method of computing the effectiveness of an insec ticide[J]. J Econ Entomol, 1925, 18: 265–267. |
 2019, Vol. 54
2019, Vol. 54


