2. 西南民族大学药学院, 四川 成都 610041
2. School of Pharmacy, Southwest Minzu University, Chengdu 610041, China
肼(N2H4)是一种强极性化合物, 在医药及工业等领域应用广泛, 但对皮肤、眼睛和肝脏都有损害作用。作为一类强碱性和强还原性的化合物, 肼也常被应用于制药原料、显影剂、乳化剂、腐蚀抑制剂和纺织染料等[1]。然而, 当肼通过口服、皮肤及吸入途径进入人体后则会因为其剧毒性对不同的脏器甚至生命造成严重危害[2], 长期的动物实验表明, 肼还具有强致突变和致癌性[3], 肼在肝内代谢生成自由基, 肼自由基与生物大分子如DNA、蛋白质等结合, 产生细胞毒性、致突变性和致癌性; 肼基还可以和氧反应生成氧自由基, 氧自由基通过脂质过氧化作用造成肝损伤。近年来, 生物发光已经发展成为一个灵敏度高、可靠、简易的成像方法, 广泛应用于食品[4]、肿瘤[5]、重金属[6, 7]、各种离子[8, 9]、酶[10, 11]和有害气体[12]检测等多个领域。传统的肼的分析方法有很多, 例如液相色谱、气相色谱、电化学检测和荧光检测法等, 与生物发光检测法相比, 这些方法存在耗时长、设备昂贵、操作繁琐、响应慢、灵敏度低等不足[13, 14]。生物发光(bioluminescence)是指生物体内的化学物质在酶的作用下产生可见光的现象, 该过程不依赖于机体对光的吸收, 是将生物能转化为光能[15]。由于这一独特的发光原理, 生物发光的灵敏度是一般荧光的100甚至1 000倍[16, 17], 并且可以有效地避免荧光成像中由于外源性激发光所带来的自身荧光干扰等缺点。由于生物发光技术能够实现在活体水平以高灵敏度对底物进行检测分析, 使得其在生物研究领域越来越受重视, 已成为首选的检测手段和研究工具。
本研究以萤火虫荧光素为光学报告基团, 通过在合适的修饰位点引入肼的响应识别基团乙酰基, 首次设计并合成了用于活体可视化分析检测肼的生物发光探针BPH。合成探针的路线以乙酰溴、羟基苯并噻唑和D-半胱氨酸作为起始原料, 通过缩合和环合两步反应以较高收率(38%)完成了小分子生物发光探针BPH的合成(合成路线1)。
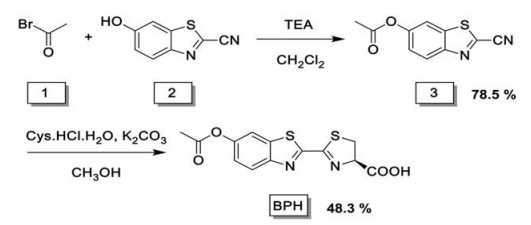
|
Scheme 1 The synthesis route of bioluminescent probe for hydrazine (BPH) |
萤火虫荧光素在被乙酰基修饰后形成生物发光探针BPH, 荧光素酶便无法对该分子进行特异性识别后的催化氧化, 从而阻断了生物发光现象的发生。然而当BPH与检测底物肼充分反应后, 通过酶促水解反应特异性裂解分子中的酯键, 释放出游离的萤火虫荧光素, 而萤火虫荧光素则在ATP、O2、Mg2+等辅助因子的存在下, 被萤火虫荧光素酶催化氧化, 将生物能转化为可检测的生物发光信号(图 1)。
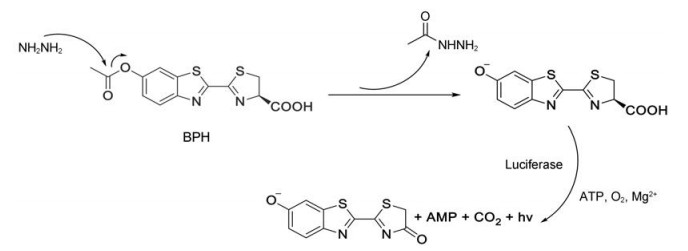
|
Figure 1 Response mechanism of probe BPH towards N2H4 |
图 2b结果表明, 与未加入肼溶液的对照组相比, 探针BPH与肼共孵育的低浓度组有较强的生物发光强度增加, 高浓度组则表现出更强的生物发光强度。由此可见, 探针BPH不仅可以实现对N2H4的可视化识别, 而且还能根据发光强度的变化对N2H4的浓度进行分析检测; 图 2a也表明, 探针BPH与底物肼反应后在波长560 nm即萤火虫荧光素发射波长处具有明显的生物发光强度, 这说明探针BPH与底物肼反应后可以释放出萤火虫荧光素。
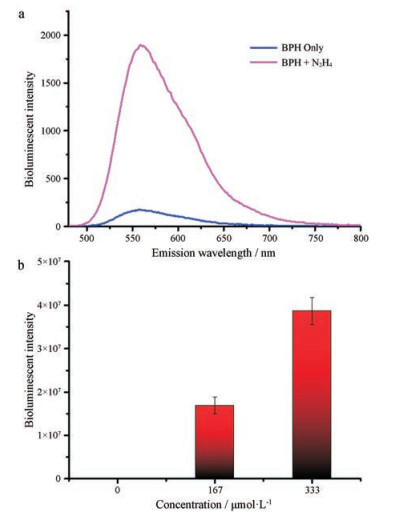
|
Figure 2 The capability of probe BPH (1.5 μmol·L-1) for tracking N2H4 |
如图 3所示, 在相同的水合肼浓度(0.33 mmol·L-1)下孵育同等时间, 肼探针浓度为1.5 μmol·L-1时, 生物发光强度处于最大值且随探针浓度的增加而趋于稳态, 因此确定肼探针BPH的最佳响应浓度为1.5 μmol·L-1。
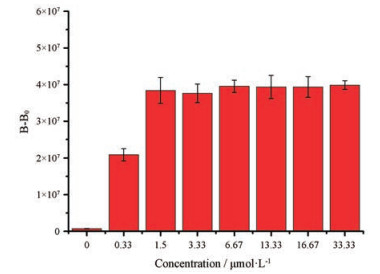
|
Figure 3 The bioluminescent intensity changes of 0.33 mmol·L-1 N2H4 incubated with BPH at different concentrations for 1 h |
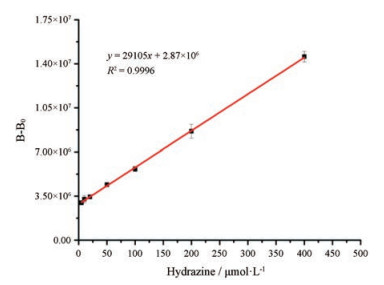
如图 4所示, 肼的浓度在5~400 μmol·L-1区间与生物发光强度具有良好的线性关系, 线性回归方程为y = 29 105x+2.87×106, 线性相关系数R2 = 0.999 6, 检测限为2.17 μmol·L-1。
|
Figure 4 The liner relationship between bioluminescent intensity and N2H4 at different concentrations incubated with BPH (1.5 μmol·L-1) for 1 h |
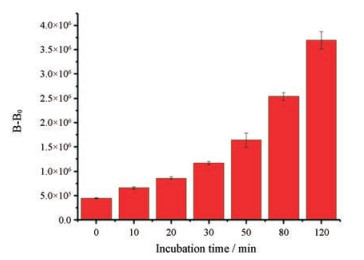
如图 5所示, 肼探针BPH (1.5 μmol·L-1)与N2H4 (0.3 mmol·L-1)在反应时间0~120 min内, 体系的生物发光强度随反应时间延长而增加, 并在120 min时生物发光强度达到最大。
|
Figure 5 The relationship of bioluminescent intensity changes and the reaction time of BPH (1.5 μmol·L-1) toward N2H4 solutions (0.3 mmol·L-1) |
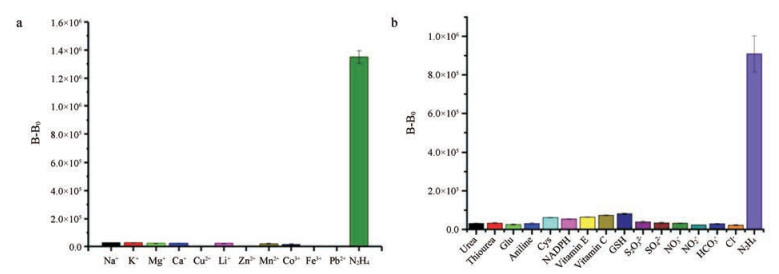
为了验证除肼以外的干扰物对探针BPH检测结果是否会产生影响, 本研究测定了探针对Na+、K+、Mg2+、Ca2+、Cu2+、Li+、Mn2+、Zn2+、Co3+、Fe3+、Pb2+多种阳离子和尿素(urea)、硫脲(thiourea)、谷氨酸(Glu)、苯胺(aniline)、半胱氨酸(Cys)、NADPH、维生素C、维生素E、谷胱甘肽(GSH)几种中性分子以及S2O32-、SO42-、NO3-、NO2-、HCO3-和Cl-几种阴离子的响应情况。结果如图 6所示, 探针BPH与肼反应后的生物发光强度是阳离子类干扰物质的50~300倍, 几乎可以忽略; 是阴离子类物质的20~40倍; 是中性分子类物质的10~35倍。这一结果表明探针BPH能够高灵敏度、高选择性地识别N2H4。
|
Figure 6 The selectivity of BPH (1.5 μmol·L-1) incubated with different kinds of cations (a) neutral molecules and ions (b) at the concentration of 0.3 mmol·L-1 for 1 h |
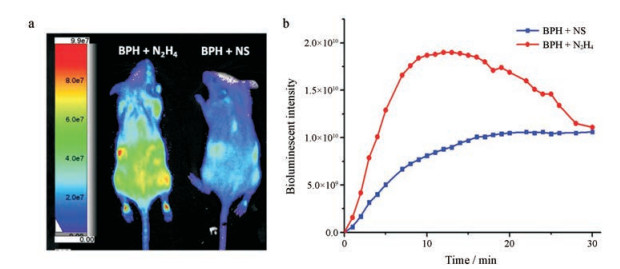
实验结果如图 7所示, 即使在没有肼存在的条件下对照组也会产生生物发光信号, 这可能是由于小鼠体内的羧酸酯酶通过水解酯键来释放荧光素底物产生生物发光现象, 即使在这种情况下, 与对照组相比, 实验组仍显示出明显增强的生物发光信号。随着时间的推移, 生物发光强度在15 min时达到最大值, 是对照组的2倍左右, 这进一步证明了探针BPH可以检测活体动物水平中肼的存在。
|
Figure 7 The application of probe BPH (10 mmol·L-1) for detecting N2H4 (10 mmol·L-1) in vivo |
本研究基于萤火虫荧光素-荧光素酶体系设计、合成了一种高选择性、高灵敏度的生物发光探针BPH, 其纯度经液相色谱−紫外检测仪分析达到98%以上, 结构经高分辨质谱及核磁鉴定。BPH通过特异性识别化合物肼, 释放出萤火虫荧光素, 进而被催化氧化释放出生物发光信号。BPH对底物肼表现出了出色的选择性, 是对其他干扰物质响应能力的20~300倍; 同时当探针浓度处于1.5 μmol·L-1的低水平时也能对底物表征出良好的响应能力, 验证BPH的高灵敏度; 并且生物发光强度与底物肼浓度之间具有范围较广的线性关系(y = 29 105x+2.87×106, R2 = 0.999 6)。除此之外, 该BPH不仅可以在溶液中定量和高选择性地检测痕量的肼, 还可以在活体水平对外源性摄入的肼进行可视化分析检测。因此BPH可发展应用于定性和定量分析肼在活体水平的情况, 这对研究与肼相关疾病的病理生理过程提供了强有力的辅助工具。
实验部分核磁共振仪(Bruker-AC-E20 or Varian-Unity INOVA-400);高分辨质谱(Waters Q-TOF-Premier); 超灵敏多功能成像仪(Amersham imager 600);高效液相分析仪(岛津制作所); 小动物活体成像系统(SPECTRAL LagoX Spectrum); 分析天平(赛多利斯科学仪器(北京)有限公司); 恒温培养摇床(上海智城分析仪器制造有限公司); 荧光光谱仪(HORIBA Instrument Inc.); EYELA A-1100旋转蒸发仪; DF-101S加热磁力搅拌器; ZKXF真空干燥箱; 循环水式多用真空水泵; 移液枪(北京卓信伟业科技有限公司); 96孔板(上海卧宏生物科技有限公司); EP管(成都永旺晨科技有限公司); 2-氰基-6-羟基苯并噻唑(上海药明康德有限公司); D-半胱氨酸盐酸盐(D-Cys·HCl, 天津希恩思生化科技有限公司); 盐酸(成都永旺晨科技有限公司); 三羟甲基氨基甲烷(成都贝斯特试剂有限公司); 二甲基亚砜、无水亚硫酸钠、硫酸氢钠、无水硫酸钠、硝酸钠、亚硝酸钠、硫氰酸钾、硫代硫酸钠(天津市瑞金特试剂有限公司); 氯化镁、氟化钠、溴化钠、氯化钠、碘化钾(天津市致远化学试剂有限公司); 碳酸氢钠、碳酸钠、磷酸二氢钠(成都市科龙化工试剂厂); 三磷酸腺(Adamas Reagent Co., Ltd.); 荧光素酶(北京华越洋生物科技有限公司)。
1 肼生物发光探针BPH的合成将乙酰溴(100 mg, 0.57 mmol)溶于10 mL二氯甲烷中, 氩气保护下缓慢滴加三乙胺(115 mg, 1.14 mmol)和羟基苯并噻唑(139 mg, 1.14 mmol), 室温反应2 h。反应结束后, 减压浓缩得到黄色粗品, 经硅胶柱色谱法纯化(环己烷:乙酸乙酯= 94:6, V/V), 得到97 mg白色固体中间体3, 产率78.5%, mp 122.1~123.0 ℃。1H NMR (400 MHz, CDCl3): δ 2.38 (s, 3H), 7.40 (dd, J = 2.4, 9.0 Hz, 1H), 7.78 (d, J = 2.0 Hz, 1H), 8.21 (d, J = 9.2 Hz, 1H); 13C NMR (100 MHz, CDCl3): δ 21.2, 112.8, 114.5, 122.9, 125.9, 136.1, 136.7, 150.0, 150.8, 169.0。
将化合物3 (214 mg, 1.75 mmol)溶于甲醇和二氯甲烷(10 mL, V/V = 1:1)的混合溶剂中, 氩气保护下滴加甲醇和水(10 mL, V/V = 1:1)溶解的D-半胱氨酸盐酸盐(308 mg, 1.75 mmol)和K2CO3 (242 mg, 1.75 mmol), 室温反应1 h。反应结束后, 减压浓缩有机溶剂, 用1 mol·L-1盐酸调节pH = 2, 析出乳黄色固体, 抽滤。粗品经硅胶柱色谱法纯化(二氯甲烷:甲醇= 94:6, V/V), 得272 mg白色固体BPH, 产率48.3%, mp 158.5~160.2 ℃。1H NMR (400 MHz, CDCl3): δ 2.33 (s, 3H), 3.71 (m, 1H), 3.81 (m, 1H), 5.46 (m, 1H), 7.41 (dd, J = 2.0, 8.2 Hz, 1H), 8.04 (d, J = 2.4 Hz, 1H), 8.20 (d, J = 8.8 Hz, 1H), 13.25 (s, 1H); 13C NMR (100 MHz, CDCl3): δ 20.8, 34.8, 78.1, 115.8, 122.1, 124.6, 136.0, 149.3, 150.4, 161.0, 164.4, 169.2, 171.0。HR-MS: m/z [M+H]+ Calcd. for C13H11N2O4S2+ 323.015 5, Found 323.015 8。
2 肼生物发光探针BPH的体外动力学研究本实验所用的浓储液均为10 mmol·L-1, 所有溶液除特殊说明外均使用含10 mmol·L-1镁离子的50 mmol·L-1 Tris-HCl (pH 7.2~7.4)缓冲液配制; 探针BPH均使用DMSO溶解, 用含10 mmol·L-1镁离子的50 mmol·L-1 Tris-HCl (pH 7.2~7.4)缓冲液稀释; 含ATP的荧光素酶溶液的配制:将荧光素酶分装成每管60 μg, 用前加入Tris-HCl缓冲液3 mL, 得到质量浓度为20 μg·mL-1的荧光素酶溶液, 再加入ATP (腺苷-5'-三磷酸二钠盐水合物, 98%, MW = 605.2) 3 mg, 得到含ATP (2 mmol·L-1)的荧光素酶(20 μg·mL-1)溶液, 现配现用。
2.1 探针BPH对肼的可视化识别将肼探针浓储液稀释成终浓度为1.5 μmol·L-1的工作液, 肼配制成终浓度为167 μmol·L-1和333 μmol·L-1两个浓度的工作液。先后将探针溶液和肼溶液50 μL加入到黑色的96孔板中(每个浓度做3个复孔), 37 ℃摇床反应1 h后, 加入荧光素酶溶液50 μL, 立即用Amersham imager 600测定生物发光强度, 曝光时间为3 min。
2.2 最佳探针浓度的确定以Tris-HCl (含10 mmol·L-1的Mg2+)缓冲液将肼探针的浓储液稀释, 使反应体系里的终浓度分别为0、0.33、1.5、3.33、6.67、13.33、16.67和33.33 μmol·L-1, 再将肼浓储液稀释至终浓度为0.33 mmol·L-1的工作液。分别取探针50 μL和不同浓度的肼溶液加入到黑色96孔板中, 每个浓度设3个复孔, 37 ℃摇床孵育1 h后, 加入含ATP的荧光素酶溶液50 μL, 随即用Amersham imager 600测定生物发光强度, 曝光时间为3 min。
2.3 探针BPH对肼识别的线性范围将肼浓储液稀释成不同的浓度梯度5、10、20、50、100、200和400 μmol·L-1加入到黑色96孔板中, 随后每孔加入探针溶液(1.5 μmol·L-1) 50 μL, 37 ℃恒温摇床孵育60 min, 加入含ATP的荧光素酶溶液50 μL (每个浓度做3个复孔), 立即用Amersham imager 600测定生物发光强度, 曝光时间为3 min。
2.4 反应时间对生物发光强度的影响将探针BPH和肼分别稀释成终浓度为1.5 μmol·L-1和0.3 mmol·L-1的工作液, 先加入探针50 μL至黑色96孔板中, 每隔一个时间间隔加入肼溶液50 μL (每个时间做3个复孔), 37 ℃恒温摇床反应, 以探究不同反应时间下的生物发光强度, 最后每孔加入含ATP的荧光素酶溶液50 μL, 用Amersham imager 600测定生物发光强度, 曝光时间为3 min。
2.5 探针BPH的选择性考察为了验证除肼以外的干扰物对探针BPH对检测结果是否会产生影响, 本研究测定了探针对Na+、K+、Mg2+、Ca2+、Cu2+、Li+、Mn2+、Zn2+、Co3+、Fe3+、Pb2+多种阳离子和尿素(urea)、硫脲(thiourea)、谷氨酸(Glu)、苯胺(aniline)、半胱氨酸(Cys)、NADPH、vitamin C、vitamin E、谷胱甘肽(GSH)几种中性分子以及S2O32-、SO42-、NO3-、NO2-、HCO3-、Cl-几种阴离子的响应情况。将探针溶液50 μL (1.5 μmol·L-1)和干扰物质溶液50 μL (0.3 mmol·L-1)加入到黑色96孔板中(每种物质做3个复孔), 37 ℃恒温摇床反应60 min, 然后加入含ATP的荧光素酶溶液50 μL, 立即用Amersham imager 600测定生物发光强度, 曝光时间为3 min。
3 探针BPH在体内的生物发光成像将探针BPH用生理盐水和DMSO (9:1)配制成浓度为10 mmol·L-1的溶液, 用生理盐水将肼配制成10 mmol·L-1的溶液。取体重相近的成年转基因雄性小鼠(FVB-luc+)随机分为两组, 其中实验组尾静脉注射肼溶液200 μL, 空白对照组尾静脉注射生理盐水200 μL, 体内孵育30 min后, 两组小鼠同时腹腔注射探针BPH 200 μL, 用小动物活体成像系统在30 min内每隔1 min进行拍摄, 曝光时间为1 s, 取小鼠除尾部以外的所有部分作为ROI值, 计算各个时间点的光子数。
| [1] | Cui L, Ji C, Peng Z, et al. Unique tri-output optical probe for specific and ultrasensitive detection of hydrazine[J]. Anal Chem, 2014, 86: 4611–4617. DOI:10.1021/ac5007552 |
| [2] | Choi MG, Hwang J, Moon JO, et al. Hydrazine-selective chro mogenic and fluorogenic probe based on levulinated coumarin[J]. Org Lett, 2011, 13: 5260–5263. DOI:10.1021/ol202136q |
| [3] | No authors listed. Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide. Proceedings of the IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, France, 17-24 February 1998[J]. IARC Monogr Eval Carcinog Risks Hum, 1999, 71 Pt 1: 1-315. https://www.ncbi.nlm.nih.gov/pubmed/10507919 |
| [4] | Theisen S, Hänsch R, Kothe L, et al. A fast and sensitive HPLC method for sulfite analysis in food based on a plant sulfite oxidase biosensor[J]. Biosens Bioelectron, 2010, 26: 175–181. DOI:10.1016/j.bios.2010.06.009 |
| [5] | Gao Y, Lin Y, Liu T, et al. Bioluminescent probe for tumor hypoxia detection via CYP450 reductase in living animals[J]. Anal Chem, 2017, 89: 12488–12493. DOI:10.1021/acs.analchem.7b03597 |
| [6] | Jiang T, Ke B, Chen H, et al. Bioluminescent probe for detecting mercury(ⅱ) in living mice[J]. Anal Chem, 2016, 88: 7462–7465. DOI:10.1021/acs.analchem.6b02200 |
| [7] | Ke B, Chen H, Ma L, et al. Visualization of mercury(ⅱ) accumu lation in vivo using bioluminescence imaging with a highly selec tive probe[J]. Org Biomol Chem, 2018, 16: 2388–2392. DOI:10.1039/C8OB00398J |
| [8] | Ke B, Wu W, Wei L, et al. Cell and in vivo imaging of fluoride ion with highly selective bioluminescent probes[J]. Anal Chem, 2015, 87: 9110–9113. DOI:10.1021/acs.analchem.5b02237 |
| [9] | Tang C, Gao Y, Liu T, et al. Bioluminescent probe for detecting endogenous hypochlorite in living mice[J]. Org Biomol Chem, 2018, 16: 645–651. DOI:10.1039/C7OB02842C |
| [10] | Lin Y, Gao Y, Ma Z, et al. Bioluminescence probe for gammaglutamyl transpeptidase detection in vivo[J]. Bioorg Med Chem, 2018, 26: 134–140. DOI:10.1016/j.bmc.2017.11.025 |
| [11] | Feng P, Zhang H, Deng Q, et al. Real-time bioluminescence imaging of nitroreductase in mouse model[J]. Anal Chem, 2016, 88: 5610–5614. DOI:10.1021/acs.analchem.6b01160 |
| [12] | Ke B, Wu W, Liu W, et al. Bioluminescence probe for detecting hydrogen sulfide in vivo[J]. Anal Chem, 2016, 88: 592–595. DOI:10.1021/acs.analchem.5b03636 |
| [13] | Christopher BM, Banks CE, Simm AO, et al. The electroanalytical detection of hydrazine:a comparison of the use of palladium nanoparticles supported on boron-doped diamond and palladium plated BDD microdisc array[J]. Analyst, 2005, 131: 106–110. |
| [14] | Tang YH, Lee DY, Wang JL, et al. Development of fluorescent probes based on protection-deprotection of the key functional groups for biological imaging[J]. Chem Soc Rev, 2015, 44: 5003–5015. DOI:10.1039/C5CS00103J |
| [15] | Tai W, Sun MM, Liu N, et al. Study on the anti-tumor effect of paclitaxel mixed micelle by using in vivo optical imaging technique[J]. Acta Pharm Sin (药学学报), 2010, 45: 530–534. |
| [16] | O'Brien MA. Homogeneous, bioluminescent protease assays:caspase-3 as a model[J]. J Biomol Screening, 2005, 10: 137–148. DOI:10.1177/1087057104271865 |
| [17] | Cali JJ, Ma D, Sobol M, et al. Luminogenic cytochrome P450 assays[J]. Expert Opin Drug Metab Toxicol, 2006, 2: 629–645. DOI:10.1517/17425255.2.4.629 |
 2019, Vol. 54
2019, Vol. 54


