2. 南京中医药大学江苏省方剂高技术研究重点实验室/江苏省中药资源产业化过程协同创新中心, 江苏 南京 210023
2. Jiangsu Key Laboratory for High Technology Research of TCM Formulae and Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, Nanjing University of Chinese Medicine, Nanjing 210023, China
肾脏是人体的重要排泄器官, 其基本功能是过滤形成尿并排出代谢废物, 调节体内的电解质和酸碱平衡。肾脏还具有内分泌功能, 通过产生肾素、促红细胞生成素、前列腺素、活性维生素D3等, 参与调节血压、红细胞生成和钙的代谢。肾脏受到某些致病因素的损害时, 上述正常功能均可受到影响, 出现一系列临床症状。一般认为肾损伤系各种肾脏疾病的病变结果, 糖尿病肾病(diabetic nephropathy, DN)[1]和慢性肾脏疾病(chronic kidney disease, CKD)[2]为目前严重影响人类健康的常见多发肾脏疾病, 一旦发展到终末期肾脏病, 往往比其他肾脏疾病的治疗更加棘手, 因此及时防治意义重大。中医经典方剂二至丸由归肝肾经的女贞子(Fructus Figustri Lucidi)与墨旱莲(Herba Ecliptae)两味中药按(1:1)等量配伍制成, 两味药合用, 其性平和、偏寒, 为养阴益肾、补气舒肝之良剂[3]。现代药理学研究亦证实, 二至丸有调节机体免疫功能、降糖、降脂、抗氧化物、改善血液微循环及保肝降酶等作用, 在心血管、肝胆病、肾病及妇科疾病的治疗方面颇有成效[4]。虽然二至丸对肾脏具有较明确的保护作用, 但其作用机制仍不清楚。
“网络药理学”是基于系统生物学和多向药理学等的多学科理论, 其运用各种组学、高通量筛选和网络分析等多种技术, 揭示“药物-基因-靶点-疾病”之间复杂的网络关系, 从多维度视角理解疾病的分子基础, 预测药物的药理学机制[5], 为新药的研发提供新途径、新方法。反向药效团匹配[6] (PharmMapper)是1种基于配体特征靶点预测的方法, PharmMapper包含了TargetBank、BindingDB、DrugBank和PDTD数据库中所有蛋白的药效团数据, 可自动搜索和查询与分子构象最为匹配的药效团并进行打分, 具有运算速度快、靶点信息全面等优点。翟园园等[7]以网络药理学为基础, 基于反向药效团匹配的方法, 通过PharmMapper在线服务平台搜寻药物潜在作用靶点, 为阐述复方二至丸保护肝脏的作用机制提供了借鉴。对接(Docking)是基于化学结构的药物设计中最常用的虚拟筛选方法之一, 且能阐明药物作用的生化过程[8]。杨欣等[9]采用分子对接技术, 对熊果酸和类风湿性关节炎蛋白靶标进行能量匹配, 筛选具有抗类风湿性关节炎作用的潜在靶标, 初步揭示了熊果酸抗类风湿性关节炎的分子机制。因此, 本文拟借助网络药理学的研究思路, 从系统角度和分子水平, 基于“分子(药物)-靶点-通路”以及“分子-核心靶点”多层次网络研究分析二至丸保护肾脏的药效活性成分和可能的分子网络机制, 对后期深入开展二至丸实验研究乃至临床应用都具有十分重要的意义。
材料与方法 活性成分的筛选利用中药系统药理学数据库(TCMSP, http://ibts.hkbu.edu.hk/LSP/tcmsp.php)对女贞子和墨旱莲进行检索, 收集二至丸中女贞子和墨旱莲的主要化学成分, 再通过Scifinder (https://scifinder.cas.org/)对其CAS号进行检索, 进一步验证其确切的化学成分中英文名称及其化学结构。在此基础上根据文献筛选具有保肾作用的活性成分, 对收集到的化学成分进行口服生物利用度(oral bioavailability, OB)和药物相似性(drug-likeness, DL)的计算, 根据OB≥30%和DL≥0.18的原则进一步筛选活性成分, 最终得到17个具有保肾作用的成分, 包括熊果酸、齐墩果酸、橄榄苦甙、红景天苷、山奈酚、芦丁、漆黄素、芹菜素、槲皮素、大豆甙元、橙皮苷、丁香酚、圣草酚、绿原酸、二羟基桂皮酸、原儿茶酸和类叶升麻苷。最后, 采用Chembiodraw Ultra 12.0软件绘制上述活性成分的结构图, 并以*.mol2格式保存。
潜在作用靶点反向预测采用反向药效团匹配的方法将二至丸保护肾脏主要活性成分以*.mol2格式上传到PharmMapper (http://59.78.96.61/pharmmapper/)系统, 将蛋白种类设定为Human Protein Targets Only, 其余参数均为默认设置。分子-靶点匹配度(Fit Score)反映配体构型与药效团模型的叠合情况, 所以将其作为筛选标准选取Fit Score值最高的10个靶点。将靶点名称上传到UniProt数据库(http://www.uniprot.org/), 并限定物种为“人”, 校正靶点名称为官方简写, 由此获取与活性成分相关的靶点信息。
靶蛋白对接预处理在PDB (http://www.rcsb.org/pdb/)蛋白数据库中找到相应蛋白的PDB-ID并下载含有原配体的靶蛋白复合晶体结构。利用Discovery Studio 2016软件, 将配体从靶蛋白中抽离出来, 再通过AutoDock软件重新对接回复合物的活性位点, 对比结果构象和目标构象的偏差。若得到的均方根偏差值(RMSD)大于2Å ,证明原靶蛋白配体对接效果不好, 则舍弃相应靶蛋白。若RMSD值小于2 Å ,则证明对接方法可行[10], 可进行下一步预处理:将靶蛋白结构导入AutoDock软件, 对靶蛋白进行去水加氢以及计算点电荷等操作, 确定靶蛋白复合物中配体分子对接的空间活性位点, 为活性成分和靶蛋白的对接做准备。
活性成分与靶蛋白对接及结果筛选利用AutoDock软件对二至丸成分及靶蛋白进行对接, 运行Run AutoGrid计算格点能量, 选择拉马克遗传算法作为对接算法, 运行Run AutoDock进行分子对接。对接完成后, 以结合能(binding energy)为参考筛选二至丸活性分子作用靶点。结合能小于0说明配体与受体可以自发结合, 目前对于活性分子的筛选尚无统一标准, 经大量文献[11]查阅, 这里选取结合能≤-5.0 kJ·mol-1作为二至丸保护肾脏活性成分作用靶点的筛选依据。
靶点通路注释分析将筛选得到的潜在药效靶点的官方简写上传到DAVID数据库(https://david.ncifcrf.gov/), 进行GO (gene ontology)生物学过程富集分析和KEGG (KEGG pathway analysis)通路注释分析, 限定靶基因名称列表为人(homo sapiens), 设定阈值P < 0.05选取具有显著性差异的所有通路, 并用GraphPad Prism5绘图。
“成分-靶点-通路”网络构建根据上述二至丸化学成分的靶点筛选结果, 采用Cytoscape软件构建二至丸“活性成分-靶点-通路”网络。其中, 以不同颜色的节点(node)表示分子, 靶蛋白和相关注释通路, 边(edge)表示分子与靶蛋白及靶蛋白与通路间的相互关系, 由此构建网络探讨二至丸多成分、多靶点和多通路的作用机制。
肾损伤相关靶点的收集以“kidney”、“renal”、“nephropathy”等为关键词, 检索治疗靶点数据库(therapeutic target database, TTD) (http://bidd.nus.edu.sg/BIDD-Databases/TTD/TTD.asp)和遗传关联数据库(genetic association database, GAD) (http://geneticassociationdb.nih.gov/), 获取肾损伤相关靶点的信息, 利用UniProt校正靶点名称为官方简写。
肾损伤核心靶点的筛选与验证将上述靶点收集结果与上述预测并筛选得到的二至丸保肾活性成分靶点进行比对, 选取相同的靶点作为肾损伤核心靶点。在此基础上进一步采用阳性药[12-15]进行对照, 将核心靶点与阳性药主要活性成分进行分子对接, 以验证靶点的准确性。
“成分-核心靶点”网络构建根据疾病靶点筛选结果, 采用Cytoscape软件构建二至丸“活性成分-核心靶点”网络。以不同颜色的节点(node)表示药效成分、核心靶点, 边(edge)表示成分与核心靶蛋白的相互关系。
结果 1 二至丸保护肾脏活性成分的筛选通过TCMSP数据库以及文献[16-19]挖掘, 分别在墨旱莲和女贞子中收集到48和79个主要化学成分, 利用文献验证其是否具有保护肾脏的作用, 筛选过程中发现部分成分未能满足OB≥30%和DL≥0.18, 但在二至丸中含量较高且有大量文献证明其具有保肾作用, 所以也将其纳入活性成分进行研究, 最终确定17个成分为二至丸保护肾脏的活性成分。
2 靶点的预测 2.1 二至丸活性成分的靶点预测首先根据靶点匹配度对预测的17个成分的潜在作用靶点降序排列, 分别选取靶点匹配度最高的10个靶点进行整合, 删去重复靶点, 共得到潜在作用靶点90个。
2.2 肾损伤相关靶点预测利用TTD和GAD数据库对肾损伤相关靶点进行搜索整合, 删去重复靶点, 最终汇总得到244个与肾损伤相关的靶点蛋白。
3 肾损伤相关靶点筛选 3.1 靶蛋白对接前处理及对接筛选经检验, 预测的90个蛋白靶标中有38个靶蛋白的RMSD值小于2 ,对分子对接结果进行筛选, 但由于对接情况较为复杂, 以结合能≤-5.0 kJ·mol-1为指标筛选作用靶蛋白, 最终得到32个靶蛋白与活性成分对接较好。筛选得到的相关靶蛋白及其RMSD值见表 1, 部分对接结果见表 2。
| Table 1 Target proteins and RMSD values |
| Table 2 The binding energy value of the 17 compounds that has been docked with the targets (Unit: kJ·mol-1) |
将244个肾损伤靶点与最终得到的二至丸保护肾脏的活性成分作用的32个靶点进行对比, 发现7个靶点(MMP3、VDR、GSTP1、ESR1、INSR、GCK和PDE4D)可能是与肾损伤相关的关键靶点。同时, 阳性药对照分子对接结果也显示, 阳性药主要活性成分均与4个及以上靶点对接良好, 验证了研究方法的合理性以及研究结果的准确性, 结果见表 3。
| Table 3 The binding energy value of the positive drug that has been docked with 7 disease targets (Unit: kJ·mol-1) |
根据AutoDock对接结果, 通过DAVID数据库对靶点基因生物学过程及代谢通路进行富集分析。图 1为二至丸保肾活性成分靶点富集的GO生物学过程分析, 预测靶点在生物学过程中靠前的有信号转导、转录调节DNA模板、细胞对胰岛素刺激的反应、RNA聚合酶Ⅱ启动子的转录以及蛋白质磷酸化过程等。图 2为根据P值(P < 0.05), 再结合生物学信息筛选得到的6条代谢通路, 主要包括PI3K-Akt信号通路(PI3K-Akt signaling pathway)、雌激素信号通路(estrogen signaling pathway)、嘌呤代谢(purine metabolism)过程、催乳素信号通路(prolactin signaling pathway)、黏着连接(adherens junction)以及癌蛋白多糖通路(proteoglycans in cancer)。

|
Figure 1 Enriched gene ontology terms for biological processes from main active ingredients of Erzhi Pill |

|
Figure 2 Enriched KEGG pathways of potential targets from main active ingredients of Erzhi Pill |
采用Cytoscape软件构建“成分-靶点-通路” (图 3)以及“成分-核心靶点” (图 4)网络。从图中可以看出二至丸17个活性成分的作用靶点分布于不同的代谢通路, 相互协调, 共同调节机体水平, 体现药物多成分、多靶点保护肾脏的作用机制。
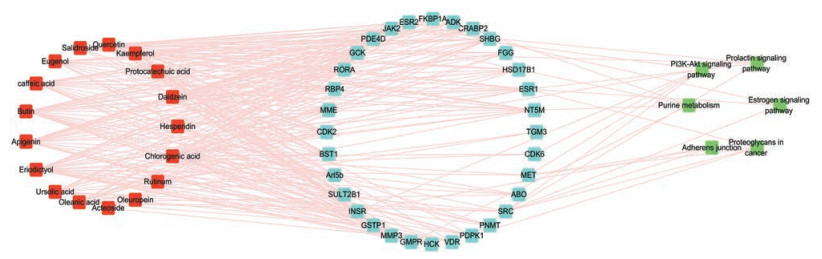
|
Figure 3 Ingredients-targets-pathways network of Erzhi Pill.    |

|
Figure 4 Ingredients-core targets network of Erzhi Pill.   |
本研究经大量的文献调研, 最终得出二至丸中17个对肾损伤有保护作用的活性成分, 其中萜类有熊果酸、齐墩果酸和橄榄苦苷, 黄酮类有山奈酚、芦丁、漆黄素、芹菜素、槲皮素、大豆苷元和橙皮苷, 酚酸类有圣草酚、二羟基桂皮酸、绿原酸、原儿茶酸和丁香酚, 醇苷类有红景天苷以及苯丙素苷类有类叶升麻苷。化合物节点度值(degree)表示成分与靶点的相关个数[20], 由网络图(图 3)可知, 具有较大度值(degree > 18)的活性成分有8个:大豆苷元(degree = 21)、二羟基桂皮酸(degree = 19)、槲皮素(degree=23)、漆黄素(degree=29)、芹菜素(degree = 26)、圣草酚(degree = 29)、山柰酚(degree = 20)、绿原酸(degree = 21), 同时也是对接较好的成分, 均有大量文献证明其对肾损伤引起的DN和CKD等疾病发挥作用。通过GO生物学富集分析(图 1)发现, 复方二至丸保护肾脏的活性成分可影响细胞信号转导、转录调节DNA模板、细胞对胰岛素刺激的反应、RNA聚合酶Ⅱ启动子的转录以及蛋白质磷酸化过程, 这些生物学过程很可能涉及病理性肾损伤的原因以及治疗手段, 同时表明二至丸可能通过改善这些生物学过程发挥其保护肾脏的作用。根据KEGG通路(图 2)以及“成分-靶点-通路” (图 3)分析发现, 二至丸保肾活性成分潜在作用靶点在DN以及CKD等肾脏疾病的诱导因素中富集, 并可能通过调控PI3K-Akt、雌激素、嘌呤代谢、催乳素等多条信号通路发挥作用。
根据上述二至丸保护肾脏活性“成分-靶点-通路” (图 3)的网络信息以及查阅的相关文献, 其主要作用通路的生物学意义分析如下:
PI3K/Akt信号通路是DN中一条重要的信号转导途径, 控制疾病的发生发展。磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)是一种脂质激酶, 参与细胞增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节。PI3K/Akt信号通路与肾损伤相关的靶标数量最多, 其中, 周期蛋白依赖性激酶(cyclin-dependent kinases, CDK)是调控细胞周期的调控因子之一。PI3K/Akt信号通路的活化可激活CDK-2和CDK-6, CDK-2和CDK-6结合不同类型的cyclin形成复合物, 使激酶失活, 各种底物去磷酸化, 促进染色体的凝集、核膜核仁重建[21]。近年来研究发现, DN的发生发展与PI3K/Akt信号通路的过度激活密切相关[22]。国外学者 lvarez-Cilleros等[23]研究发现PI3K/Akt通路的适度活化可增强足细胞对胰岛素信号的敏感度进而维持体内葡萄糖的稳态, 对血糖过高或者糖尿病引起的肾损伤以及稳固正常肾功能有积极影响。另外, PI3K/Akt信号通路不仅可以抑制细胞凋亡的上游通路, 还能激活肾近端小管的α7烟碱型乙酰胆碱受体诱导血红素加氧酶-1的表达, 产生抗凋亡, 促生殖的活性[24]。
催乳素(prolactin, 简称PRL, 又叫促乳素或催乳激素)是一种由垂体前叶腺嗜酸细胞分泌的蛋白质激素。研究发现, 高催乳素血症病的病因归责于脾、肝、肾三脏功能失调, 肾虚、血瘀、痰火、气郁互见, 以肾虚血瘀为主, 补肾活血方能有效降低PRL值, 从而达到改善高催乳素血症病的症状的功效[25]。PRL信号通路中与肾损伤相关的靶标有5个, 其中葡萄糖激酶(glucokinase, GCK)和SRC蛋白激酶是公认的血糖调节因子, 几乎在主要作用通路中都表达, GCK和SRC活化后, 通过促进胰岛素分泌, 加快肝糖原的合成, 增强血管内皮生长因子抵抗, 降低高糖情况下引起的肾小管上皮细胞的损伤[26]。多数医学认为, DN的病机关键是本虚标实, 本研究中二至丸为养阴益肾, 补气舒肝之良剂, 可以有效抑制催乳素信号通路, 激活GCK和SRC等重要细胞因子, 调节机体免疫功能, 改善血液微循环, 间接起到保护肾脏的作用。
肾组织的炎症反应和糖尿病肾病等相关的组织损伤, 都是导致慢性肾脏疾病发展到终末期肾脏疾病的重要因素, 雌激素信号通路是抗炎药物干预肾组织炎症性损伤中比较重要的途径, 该通路中与肾损伤相关的靶标主要是雌激素受体(estrogen receptor, ER)。雌激素是人体内常见的甾体类固醇激素, 在各种炎性疾病中发挥着重要作用[27]。张洋等[28]以去卵巢大鼠为研究对象, 发现雌激素可能通过调节辅助性T细胞17型细胞/调节性T细胞的平衡从而抑制由缺血再灌注损伤诱发的肾组织炎症反应。这提示雌激素受体基因很可能作为研究肾损伤相关疾病的候选基因, 深入分析其作用于肾损伤的分子机制, 对实现肾损伤相关疾病的防治有一定的意义。
嘌呤代谢和黏着连接是包含靶蛋白较少的通路, 但是, 有研究证实腺嘌呤诱导可引起肾组织缺血、缺氧, 甚至导致活性氧、一氧化氮等代谢产物累积, 造成肾损伤[29]。李霜等[30]的RT-PCR法结果显示, 在2型糖尿病中, 黏着斑激酶可能作为转化生长因子β1的下游分子被活化, 并通过活化细胞外信号调节激酶1/2使纤维连接蛋白表达增多, 从而参与DN的发生发展。癌蛋白多糖通路是6条通路中唯一与癌相关的通路, 说明肾损伤相关疾病可能影响癌症的发生发展, 这些对判定肾损伤的严重程度以及进行癌症方面的研究意义重大。
对“成分-核心靶点”网络图(图 4)进行分析, ESR1和PDE4D相邻化合物节点最多, 分别有13个活性分子与之有较好的结合。现代研究表明, ESR1是雌激素受体的一种亚型, 影响雌激素基因的表达与调控, 而雌激素的受体广泛存在于机体组织和细胞之中, 对内分泌、心血管、代谢系统、骨骼的生长和成熟、皮肤等均有明显的影响。二至丸保护肾脏的活性成分中黄酮类成分槲皮素、绿原酸、芹菜素等, 酚酸类成分二羟基桂皮酸、原儿茶酸、圣草酚等以及醇苷类成分红景天苷可能通过调控ESR1基因, 提高其在肾组织中的表达, 对肾脏起到保护作用。PDE4D是人类磷酸二酯酶4的同功酶中的一个亚型, 与多种炎性细胞的环磷酸腺苷水解有关, PDE4D可促进平滑肌细胞的生长以及抑制炎症细胞的增殖[31]。DN的发生机制可能与高血糖造成的代谢异常和炎症介质有关, 现代药理学研究指出女贞子具有降血糖、降血脂和抗炎作用。其中, 姜斐等[32]检测了女贞子中8个化合物对具有胰岛素抵抗的HepG2细胞的葡萄糖消耗情况, 发现齐墩果酸、红景天苷和槲皮素均对胰岛素抵抗。佟昌慈等[33]通过实验证实红景天苷对脂多糖诱导的炎症反应具有抑制作用。
此外, MMP3、GSTP1、INSR、GCK均连接9个及以上活性分子。基质金属蛋白酶-3[34]是重塑组织结构, 实现组织愈合的关键酶。谷胱甘肽硫转移酶[35]是体内生物转化最重要的Ⅱ相代谢酶之一, 是细胞抗损伤、抗癌变的主要解毒系统。胰岛素受体[36]为胰岛素起作用的靶细胞膜上特定部位, 仅可与胰岛素或含有胰岛素分子的胰岛素原结合, 具有高度的特异性, 且分布非常广泛。GCK是重要的血糖调节因子, 几乎在所有活性成分中都表达。二至丸组方药材中的漆黄素、槲皮素、山奈酚等活性成分充分显示出了对高血糖引起的DN的防治作用, 可能通过调节INSR、GCK等多种细胞因子, 促进糖酵解途径中肝糖原的合成, 提高糖利用, 改善胰岛素生物功能, 维持糖代谢功能正常。有研究证实, 槲皮素[37]、大豆苷元[38]、二羟基桂皮酸[39]等活性成分可干预一氧化氮的合成和释放, 可能通过抑制肾素-血管紧张素-醛固酮系统, 调节核转录因子-κB水平, 减少活性氧和一氧化氮代谢产物在肾脏累积, 降低其对内皮细胞的损害, 调节MMP3和GSTP1, 重塑肾小管上皮细胞并增强其抗损伤的能力, 以发挥对肾脏保护的作用。另外, 圣草酚[40]和绿原酸[41]具有抗氧化和抗炎作用, 在肾氧化应激损伤中, 通过正调节核因子E2相关因子2/血红素加氧酶-1的表达, 以及抑制核转录因子-κB在肾组织中的激活, 降低肾组织损伤, 与GSTP1抗细胞损伤作用一致。
结论二至丸由女贞子和墨旱莲两个配伍药材组成, 共有17个不同的活性成分通过调控不同的靶蛋白, 作用于不同的通路, 协同配伍从而对肾脏起到保护作用, 体现中药方剂整体性、系统性的特点。本研究发现, 二至丸可能从以下3个方面发挥保护肾脏的作用: ①干预PI3K-Akt、雌激素等信号通路, 介导足细胞表型改变, 增强足细胞对胰岛素信号的敏感度, 缓解糖尿病引起的肾脏损伤。②通过体内多种代谢途径, 维持体内葡萄糖的稳态, 降低糖尿病风险。③调控MMP-3、INSR、GCK等小分子, 重塑组织结构, 调节体内激素水平, 降低病理性肾损伤。预测所得二至丸成分疾病靶点与已有文献较为接近, 表明基于网络药理学与分子对接相结合的技术手段探讨其保护肾脏的作用机制具有一定的准确性, 同时也揭示了二至丸多成分、多靶点的特点, 为后续的相关研究提供参考。
| [1] | Li J, Lim SS, Lee JY, et al. Purple corn anthocyanins dampened high-glucose-induced mesangial fibrosis and inflammation:possible renoprotective role in diabetic nephropathy[J]. J Nutr Biochem, 2012, 23: 320–331. DOI:10.1016/j.jnutbio.2010.12.008 |
| [2] | Stack AG, Casserly LF, Cronin CJ, et al. Prevalence and variation of chronic kidney disease in the irish health system:initial findings from the National Kidney Disease Surveillance Programme[J]. BMC Nephrol, 2014, 15: 185. DOI:10.1186/1471-2369-15-185 |
| [3] | Hu DM, Chen XL, Lu Y, et al. Research progress on hepatopro tective effects of Erzhiwan and its components[J]. J Pharm Pract (药学实践杂志), 2016, 34: 289–291. |
| [4] | Lv DN. The application of erzhi pills in kidney diseases[J]. Jiangsu J Tradit Chin Med (江苏中医药), 2006, 27: 54. |
| [5] | Liu ZH, Sun XB. Network pharmacology:new opportunity for the modernization of traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2012, 47: 696–703. |
| [6] | Liu X, Ouyang S, Yu B, et al. PharmMapper server:a web server for potential drug target identification using pharmacophore mapping approach[J]. Nucl Acids Res, 2010, 38: 609–614. DOI:10.1093/nar/gkq300 |
| [7] | Zhai YY, Liu QN, Xu J, et al. Network pharmacology-based study on mechanism of liver protection of Erzhi Pill[J]. Acta Pharm Sin (药学学报), 2018, 53: 567–573. |
| [8] | Kitchen DB, Decornez H, Furr JR, et al. Docking and scoring in virtual screening for drug discovery:methods and applications[J]. Nat Rev Drug Discov, 2004, 3: 935–949. DOI:10.1038/nrd1549 |
| [9] | Yang X, Li YH, Qian HB, et al. Molecular mechanism of ursolic acid against rheumatoid arthritis based on network pharma cology and molecular docking[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 207–214. |
| [10] | Wang XJ, Lin ZJ, Zhang B, et al. Molecular docking analysis of xanthine oxidase inhibition by constituents of cichory[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 3818–3825. |
| [11] | Liu FH, Chen SJ, Ni WJ. Study on the computer virtual screening of antithrombotic active ingredients in Chuanxiong Rhizoma[J]. China Pharm (中国药房), 2017, 28: 2182–2186. |
| [12] | Wang ZY, Li CQ, Mu MJ, et al. Simultaneous determination of the content of danshensu, puerarin, daidzin and salvianolic acid B in Bushen Huoxue prescription by HPLC wavelength switching technology[J]. Chin J Pharm Anal (药物分析杂志), 2016, 36: 1020–1026. |
| [13] | Wu YL, Zhang HY. The protective effect of danshensu on renal injury in rats with SNP and its effect on NF-κB signaling pathway[J]. J Emerg Tradit Chin Med (中国中医急症), 2018, 27: 1917–1921. |
| [14] | Sun GX, Wu Y, Yang TT, et al. Dual referential fingerprint qualification method for dynamic technique criteria of Liuwei Dihuang Wan standard fingerprint by determination of 5 components and 6 wavelength fingerprints by high performance liquid chromatograpy[J]. Central South Pharm (中南药学), 2012, 10: 385–392. |
| [15] | Liu CM, Yang HX, Ma JQ, et al. Role of AMPK pathway in leadinduced endoplasmic reticulum stress in kidney and in paeonolinduced protection in mice[J]. Food Chem Toxicol, 2018, 122: 1016–1024. |
| [16] | Li H, Yao WF, Liu QN, et al. Application of UHPLC-ESI-QTOF-MS to identify multiple constituents in processed products of the herbal medicine Ligustri Lucidi Fructus[J]. Molecules, 2017, 22: 689. DOI:10.3390/molecules22050689 |
| [17] | Yao WF, Dai J, Zheng CZ, et al. Quality assessment of Fructus Ligustri Lucidi by the simultaneous determination of six com pounds and chemometric analysis[J]. J Sep Sci, 2015, 38: 1822–1827. DOI:10.1002/jssc.v38.11 |
| [18] | Nie Y, Yao WF. Study on the chemical components of Fructus Ligustri Lucidi[J]. J Nanjing Univ Tradit Chin Med (南京中医药大学学报), 2014, 30: 475–477. |
| [19] | Jiang YJ, Yao WF, Zhang L, et al. Analysis on chemical compo nents of Ligustrum lucidum by ultra performance liquid chroma tography-electrospray ionization-quadrupole-time of flight-mass spectrometry[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 2304–2308. |
| [20] | Anitha P, Anbarasu A, Ramaiah S. Gene network analysis reveals the association of important functional partners involved in anti biotic resistance:a report on an important pathogenic bacterium Staphylococcus aureus[J]. Gene, 2016, 575: 253–263. DOI:10.1016/j.gene.2015.08.068 |
| [21] | Li X, Song Y, Zhang P, et al. Oleanolic acid inhibits cell survival and proliferation of prostate cancer cells in vitro and in vivo through the PI3K/Akt pathway[J]. Tumour Biol, 2016, 37: 7599–7613. DOI:10.1007/s13277-015-4655-9 |
| [22] | Li DZ, Liu XM, Song CJ, et al. Research progress of PI3K/Akt signaling pathway and PTEN in diabetic nephropathy[J]. J Chengde Med Coll (承德医学院学报), 2018, 35: 69–73. |
| [23] | Álvarez-CillerosD, MartínMÁ, RamosS. Protective effects of (-)-epicatechin and the colonic metabolite 3, 4-dihydroxyphenyl acetic acid against glucotoxicity-induced insulin signalling blockade and altered glucose uptake and production in renal tubular NRK-52E cells[J]. Food Chem Toxicol, 2018, 120: 119–128. |
| [24] | Kim H, Kim SR, Je J, et al. The proximal tubular α7 nicotinic acetylcholine receptor attenuates ischemic acute kidney injury through Akt/PKC signaling-mediated HO-1 induction[J]. Exp Mol Med, 2018, 50: 40. DOI:10.1038/s12276-018-0061-x |
| [25] | Chen N. Effect of the way to invigorate the circulation of blood on patients with hyperprolactinemia due to kidney deficiency and blood stasis[J]. Guangming J Chin Med (光明中医), 2017, 32: 3587–3589. |
| [26] | Dorenkamp M, Müller JP, Shanmuganathan KS, et al. Hypergly caemia-induced methylglyoxal accumulation potentiates VEGF resistance of diabetic monocytes through the aberrant activation of tyrosine phosphatase SHP-2/SRC kinase signalling axis[J]. Sci Rep, 2018, 8: 1–13. DOI:10.1038/s41598-017-17765-5 |
| [27] | Cai JY, Li JH, Ding SH, et al. Progress in study of selective ERβ ligands[J]. Acta Pharm Sin (药学学报), 2015, 50: 658–667. |
| [28] | Zhang Y, Ji W, Zhou AF, et al. Estrogen regulates Th17/Treg cell immune balance to inhibit renal ischemia reperfusion injury[J]. Chin J Immun (中国免疫学杂志), 2018, 34: 1601–1606. |
| [29] | Lan LL, Jiang B, Liu MC, et al. Comparison of the establish ment of rat model of gouty nephropathy induced by yeast and adenine[J]. Chin J Comp Med (中国比较医学杂志), 2017, 27: 33–43. |
| [30] | Li S, Wang YY, Liu LR, et al. Role of focal adhesion kinase expression in renal tissues of type 2 diabetic rats[J]. Chin J Pathophys (中国病理生理杂志), 2013, 29: 1400–1405. |
| [31] | Anthony EG, Richard E, Lipkowitz MS, et al. Association of phosphodiesterase 4 polymorphism (rs702553) with blood pressure in the African American Study of Kidney Disease and Hypertension Genomics Study[J]. Pharmacogenet Genomics, 2013, 23: 442–444. DOI:10.1097/FPC.0b013e3283636840 |
| [32] | Jiang F, Yao N, Qian ZH, et al. The effect of eight compounds from Ligusrtum Lucidum Ait. on the glucose consumption of insulin resistance HepG2 cells[J]. Strait Pharm J (海峡药学), 2010, 22: 164–167. |
| [33] | Tong CC, Liu YE, Jin HX, et al. Protective mechanism of salidroside in the acute lung injury induced by LPS[J]. J Clin Emerg (临床急诊杂志), 2015, 16: 667–671. |
| [34] | Korotkov A, Broekaart DWM, van Scheppingen J, et al. Increased expression of matrix metalloproteinase 3 can be attenuated by inhibition of microRNA-155 in cultured human astrocytes[J]. J Neuroinflammation, 2018, 15: 211. DOI:10.1186/s12974-018-1245-y |
| [35] | Nomani H, Hagh-Nazari L, Aidy A, et al. Association between GSTM1, GSTT1, and GSTP1 variants and the risk of end stage renal disease[J]. Ren Fail, 2016, 38: 1455–1461. DOI:10.1080/0886022X.2016.1214054 |
| [36] | Zhu AN, Yang XX, Sun MY, et al. Associations between INSR and mTOR polymorphisms in type 2 diabetes mellitus and diabetic nephropathy in a Northeast Chinese Han population[J]. Genet Mol Res, 2015, 14: 1808–1818. DOI:10.4238/2015.March.13.9 |
| [37] | Tong F, Liu S, Yan B, et al. Quercetin nanoparticle complex attenuated diabetic nephropathy via regulating the expression level of ICAM-1 on endothelium[J]. Int J Nanomedicine, 2017, 12: 7799–7813. DOI:10.2147/IJN |
| [38] | Katyal T, Garg A, Budhiraja RD. Combination of daidzein, hemin and bms182874 halts the progression of diabetes-induced experi mental nephropathy[J]. Endocr Metab Immune, 2013, 13: 152–162. |
| [39] | Migliori M, Cantaluppi V, Mannari C, et al. Caffeic acid, a phenol found in white wine, modulates endothelial nitric oxide production and protects from oxidative stress-associated endo thelial cell injury[J]. PLoS One, 2015, 10: e0117530. DOI:10.1371/journal.pone.0117530 |
| [40] | Li CZ, Jin HH, Sun HX, et al. Eriodictyol attenuates cisplatininduced kidney injury by inhibiting oxidative stress and inflam mation[J]. Eur J Pharmacol, 2016, 772: 124–130. DOI:10.1016/j.ejphar.2015.12.042 |
| [41] | Bao L, Li J, Zha D, et al. Chlorogenic acid prevents diabetic nephropathy by inhibiting oxidative stress and inflammation through modulation of the Nrf2/HO-1 and NF-κB pathways[J]. Int Immunopharmacol, 2018, 54: 245–253. DOI:10.1016/j.intimp.2017.11.021 |
 2019, Vol. 54
2019, Vol. 54


