糖尿病是一种由于体内胰岛素分泌不足或生物效应降低所致的以糖代谢紊乱为主要特征的全身性代谢疾病, 其特点是肝葡萄糖输出异常和胰岛素抵抗[1, 2]。糖尿病的发病机制复杂, 可能与多种危险因素, 包括家族史、衰老、肥胖、高血压和能量摄入等有关[3], 作为典型的代谢性疾病, 其发生发展过程不仅包括糖、脂、蛋白质等多种物质的代谢异常, 同时还存在炎症反应、氧化应激及胃肠道菌群失调等病理变化[3, 4]。肠道菌群被视为置于宿主生物体内的“微生物器官”, 其数目约比所有人类细胞高出10倍, 它与许多复杂疾病相关联, 肠道菌群的组成可能影响食物的能量摄取、黏膜免疫、肠通透性和炎症等[5, 6], 可以对人体健康产生有害或有益的影响。有文献[7, 8]报道证明微生物群落在2型糖尿病的发展中起重要作用。调节异常的肠道微生物对于治疗糖尿病、肥胖症、心血管疾病、变态反应和炎症性肠病等多种疾病具有特殊的意义[9-11]。
桑叶为桑科(Moraceae)桑属植物桑(Morus alba L.)的干燥叶, 其性寒、味甘苦, 具有疏散风热、清肺润燥、清肝明目的功效, 是临床常用中药之一。桑叶在对于糖尿病及其并发症的治疗效果上已得到广泛认可, 并且桑叶中已知发挥降糖效果的主要是黄酮类、多糖类和生物碱类[12, 13]。现代研究表明, 桑叶黄酮具有降糖、降压、抗病毒、抗肿瘤和抗菌等多种生物活性; 桑叶多糖亦具有显著的降血糖和抑制血脂升高的作用; 而以1-脱氧野尻霉素(DNJ)及其系列衍生物为代表的桑叶生物碱是一种α-糖苷酶抑制剂, 具有显著的降血糖和抑制脂肪生成的活性[14-18]。本研究以自发性肥胖糖尿病模型的db/db小鼠为研究对象, 并基于16S rDNA测序技术, 分析桑叶有效成分对糖尿病小鼠肠道菌群的调节作用; 从肠道微环境的角度探讨桑叶多组分干预糖尿病的作用机制。
材料与方法 实验动物SPF级6~8周龄雄性db/db小鼠(35~40 g) 40只, db/m小鼠(15~20 g) 10只, 购自南京大学生物医药研究院, 许可证号SCXK (苏) 2015-0001, 饲养于南京中医药大学药物安全评价研究中心(SPF级), 常规饲料喂养, 自由饮食, 温度和湿度分别保持在(23 ± 2) ℃与(60 ± 2) %、光照周期为12 h。经南京中医药大学动物实验伦理委员会审查, 符合国家科学技术委员会发布的《实验动物管理条例》和卫生部发布的《医学实验动物管理实施细则》以及南京中医药大学实验动物伦理委员会有关章程, 可以实施实验。
试剂及仪器盐酸二甲双胍片购自中美上海施贵宝制药有限公司(批号: AA03572);甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, T-CHO)试剂盒购自南京建成生物工程研究所有限公司; 血糖试纸及血糖仪购自三诺生物传感股份有限公司。琼脂糖(75510-019, 美国英杰生命技术有限公司); EB-溴化乙锭清除液(EX328, 生工生物工程(上海)股份有限公司); E.Z.N.A.®soil试剂盒(Omega Bio-tek, 美国BioTek仪器有限公司); 脱氧核糖核苷三磷酸(dNTP, 10 mmol·L-1), 5× High GC Buffer (美国Sigma公司); AxyPrep DNA凝胶回收试剂盒(Axygen Biosciences, 美国Axygen公司); QuantiFluorTM-ST、QuantiFluor TB380 (美国Promega公司); Agencourt AMPure XP Beads试剂盒(A63881, 美国Beckmen Coulter公司); Quant-iT PicoGreen dsDNA分析试剂盒(P7589, 美国英杰生命技术有限公司); 高灵敏度DNA试剂盒(5067-4626, 美国Agilent科技公司)。乙腈和甲酸均为色谱纯, 购于Merck公司。桑叶采自镇江市江苏科技大学国家种植桑树圃, 经南京中医药大学段金廒教授鉴定为桑科植物桑的叶片, 桑叶生物碱、多糖和黄酮提取物为实验室自制[19], 其中生物碱提取物中主要含有DNJ和fagomine, 含量分别为27.7%和3.78%;多糖中含总多糖18.8%;黄酮中新绿原酸、绿原酸、隐绿原酸、芦丁、异槲皮苷和紫云英苷的含量分别为3.85%、3.43%、4.38%、3.56%、1.58%和1.02%。
RS232G紫外分光光度计(德国Eppendorf公司); DYY-6C电泳仪(北京六一生物科技有限公司); PCR仪2720、PCR仪9700型(美国应用生物系统公司); 凝胶成像系统、台式紫外分析仪(北京百晶生物技术有限公司); 生物分析仪(Agilent 2100, 美国Agilent科技有限公司); 荧光分析仪(FLx800, 美国BioTek仪器有限公司); Illumina Miseq高通量测序仪(美国Illumina公司); EPED超纯水机(南京易普易达科技发展有限公司)。
动物模型的建立db/db小鼠40只和db/m小鼠10只(空白组, control)适应性喂养18天, 期间测量其空腹血糖3次, 待血糖稳定且大于16.7 mmol·L-1后将db/db小鼠随机分为5组, 分别为模型组(model)、二甲双胍组(0.25 g·kg−1·d−1, metformin)、桑叶生物碱组(0.2 g·kg−1·d−1, MA)、桑叶黄酮组(0.6 g·kg−1·d−1, MF)和桑叶多糖组(0.36 g·kg−1·d−1, MP), 给药剂量参照实验室前期动物实验中使用的安全有效的剂量而定[19]。空白组与模型组灌胃等量的生理盐水。连续给药6周后, 收集新鲜粪便于-80 ℃条件下保存, 用于后续分析测定; 收集新鲜血液离心收集血清, 用于其他相关指标的测定。
生化指标检测分别于造模后1、2、3、4和6周末, 禁食12 h后尾静脉取血检测空腹血糖(fasting blood glucose, FBG)。按照试剂盒说明书的操作步骤, 检测血清中TG、T-CHO含量。
DNA抽提和PCR扩增称取粪便样品200 mg, 根据E.Z.N.A.® soil试剂盒说明书进行总DNA抽提, DNA浓度和纯度利用NanoDrop 2000进行检测, 利用1%琼脂糖凝胶电泳检测DNA提取质量; 用338F (5'-ACTCCTACGGGAGGCAGCAG-3')和806R (5'-GGA CTACHVGGGTWTCTAAT-3')引物对V3-V4可变区进行PCR扩增, 扩增程序为: 95 ℃预变性3 min, 27个循环(95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s), 最后72 ℃延伸10 min。扩增体系为20 μL, 5×FastPfu缓冲液4 μL, 2.5 mmol·L-1 dNTPs 2 μL, 引物(5 μmol·L-1) 0.8 μL, FastPfu聚合酶0.4 μL; DNA模板10 ng。
rDNA文库构建与高通量测序使用2%琼脂糖凝胶回收PCR产物, 利用AxyPrep DNA Gel Extraction Kit进行纯化, Tris-HCl洗脱, 2%琼脂糖电泳检测。利用QuantiFluor™-ST进行检测定量。根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2×300文库:首先连接“Y”字形接头, 使用磁珠筛选去除接头自连片段, 利用PCR扩增进行文库模板的富集, 最后以氢氧化钠变性, 产生单链DNA片段。
原始测序序列使用Trimmomatic软件质控, 使用FLASH软件进行拼接:设置50 bp的窗口, 如果窗口内的平均质量值低于20, 从窗口开始截去后端碱基, 去除质控后长度低于50 bp的序列; barcode需精确匹配, 引物允许2个碱基的错配, 去除模糊碱基; 根据重叠碱基overlap将两端序列进行拼接, overlap大于10 bp。去除无法拼接的序列, 最终获得每个样本的有效序列。
统计学方法运用LEfSe (LDA effect size, http://huttenhower.sph.harvard.edu/galaxy/root?tool_id=lefse_ upload)软件, 根据分类学组成对样本按照不同的分组条件进行线性判别分析(linear discriminant analysis, LDA), 寻找对样本划分产生显著性差异影响的群落及物种。应用Welch's t-test检验方法, 分别在门水平和属水平, 对空白组和模型组进行两组之间物种丰度的差异检验。对空白和模型组在OUT水平上, 基于euclideam距离算法进行主成分分析(principal component analysis, PCA), 并应用相似性分析(analysis of similarities, ANOSIM)和Adonis分析对PCA结果进行验证。ANOSIM是一种非参数检验, 用来检验组间(两组或多组)差异是否显著大于组内差异, 从而判断分组是否有意义; Adonis又称置换多因素方差分析(permutational MANOVA)或非参数多因素方差分析(nonparametric MANOVA), 用于分析不同分组因素对样品差异的解释度, 并使用置换检验对划分的统计学意义进行显著性分析。多组的组间差异显著性检验应用了单因素方差分析(one-way ANOVA), 多重检验校正方法为伪发现率(false discovery rate, fdr), 置信区间(confidence intervals, CI)计算方法为tukeykramer, 置信度选择0.95。使用Qiime软件及R语言绘制距离Heatmap图, 获得距离矩阵, 距离算法选择unweighted_ unifrac。
结果 1 生化指标饲养18天后, 模型组小鼠FBG均高于16.7 mmol·L−1, 表明模型成功, 其中空白组为4.48 mmol·L−1, 模型组为22.45 mmol·L−1。灌胃给药后, 各给药组具有不同程度的回调作用, 整体来看, 桑叶黄酮在前期降糖作用明显, 而多糖和生物碱在给药后期效果更为显著。第6周, 二甲双胍组、黄酮组、多糖组和生物碱组FBG值分别为17.78、20.42、16.5和17.22 mmol·L−1, 显著低于模型组(24.06 mmol·L−1)。TG、T-CHO在模型组显著增加, 各给药组相关指标向空白组回归。空白组、模型组、二甲双胍组、黄酮组、多糖组和生物碱组的TG含量分别为0.81、2.04、1.3、1.26、1.19和1.47 mmol·L−1, T-CHO含量分别为3.22、5.37、3.88、3.85、5.08和3.88 mmol·L−1。
2 序列长度分布通过Illumina Miseq测序得到原始序列插入片段长度为468 bp, 测序长度为PE300, 得到原始序列数目3367603*2, 最后一列为总碱基数目2027297006。优化序列数目3367603, 优化碱基数目1469109784, 优化序列平均长度436.247914021;序列长度分布在400~500 bp内, 如图 1所示。从序列长度的分布来看, 与16S rDNA V3-V4区序列长度大致吻合, 可用于后续分析。
|
Figure 1 High quality distribution of sequence length. MP: Mulberry polysaccharide; MA: Mulberry alkaloid; MF: Mulberry flavonoid |
利用UPARSE (vsesion 7.0 http://drive5.com/uparse/)软件, 按照97%相似性对非重复序列(不含单序列)进行OTU聚类, 得到OTU的代表序列; 使用UCHIME软件剔除嵌合体, 采用RDP classifier (http://rdp.cme.msu.edu/)贝叶斯算法对OTU代表序列进行分类学分析, 将得到的全部序列与相关数据库Silva (Release128 http://www.arb-silva.de)进行比对, 设置比对阈值为70%, 分别在各个分类水平:域(domain)、界(kingdom), 门(phylum)、纲(class)、目(order)、科(family)、属(genus)和种(species)统计各样本的群落组成。保留至少在6个样本中序列数都大于5的OTU, 按最小序列数抽平, 一共获得了324个OUT, 其中包括域: 1个; 界: 1个; 门: 10个; 纲: 17个; 目: 28个; 科: 40个; 属: 87个; 种: 140个。
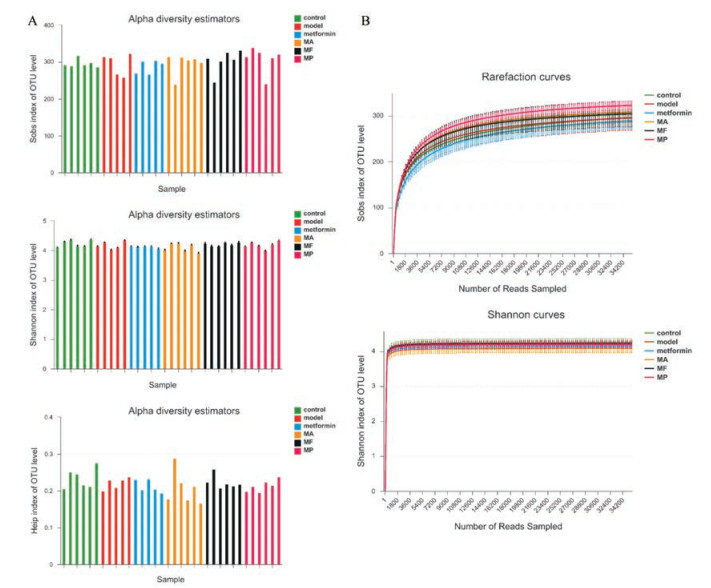
4 多样性分析及稀释曲线绘制利用mothur指数分析软件(version v.1.30.1 http://www.mothur.org/wiki/Schloss_SOP# Alpha_diversity)对样本计算微生物的多样性指数, 通过单样本的多样性(Alpha多样性)分析反映单个样本微生物群落的丰度和多样性。在OTU水平下计算Sobs指数(丰富度实际观测值)衡量菌落丰富度、Heip指数(群落均匀度指数)衡量菌落的均一性、Shannon指数(用来估算样本中微生物多样性的指数之一)评价样本的物种多样性, 如图 2A所示。结果表明, 各组之间菌群均具有较高的丰富度、多样性及均一性, 且多样性指数在各组之间无明显差异。
|
Figure 2 Diversity index (Sobs, Heip and Shannon index, A) and rarefaction curve (Sobs and Shannon index, B) of each group |
稀释曲线(rarefaction curve)主要利用各样本的测序量在不同测序深度时的微生物多样性指数构建曲线, 以此反映各样本在不同测序数量时的微生物多样性。它可以用来比较测序数据量不同的样本中物种的丰富度、均一性或多样性。如图 2B所示, Sobs指数的曲线趋向平坦, 说明测序数据量合理, 更多的数据量只会产生少量新的物种; Shannon指数曲线趋向平坦, 说明测序数据量足够大, 可以反映样本中绝大多数的微生物多样性信息。由此可见, 当前测序深度足以反映样本所包含的多样性, 继续增加测序深度已无法检测到大量的尚未发现的新OTU。
5 物种组成分析对各组中每个样本在门和属水平上的数量进行统计, 根据分类学分析结果, 可以得知不同分组上的群落结构组成情况; 绘制群落柱形图以表示在门和属分类学水平上的物种比例, 直观呈现各样本在某一分类学水平上含有何种微生物及样本中各微生物的相对丰度。在门水平上, 合并丰度小于0.1%的物种后, 各组主要存在厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、Saccharibacteria、软壁菌门(Tenericutes)、脱铁杆菌门(Deferribacteres)、疣微菌门(Verrucomicrobia)和蓝细菌(Cyanobacteria), 其中厚壁菌门和拟杆菌门占有较大比例。在属水平上, 合并丰度小于1%的物种后, 各组主要存在拟杆菌目S24-7 (Bacteroidales_S24-7)、毛螺菌科NK4A136 (Lachnospiraceae_NK4A136)、毛螺菌科(Lachnospiraceae)、乳酸杆菌属(Lactobacillus)等。其分布情况如图 3所示。

|
Figure 3 Community distribution at the Phylum and Genus level between different groups |
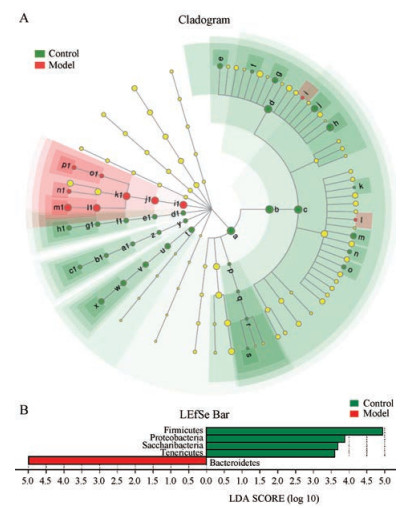
经LEfSe多级物种层级树图(图 4A)可以看出, 与正常组相比, 糖尿病模型组肠道菌群中门、纲、目、科和属分类水平上均发现差异菌群。在门水平下做LDA判别柱形图(图 4B), 厚壁菌门、拟杆菌、变形菌门、Saccharibacteria和软壁菌门的丰度对两组影响具有显著性差异。
|
Figure 4 LEfSe tree map of different classification (A) and LDA columnar graph (B). a: Firmicutes; b: Clostridia; c: Clostridiales; d: Lachnospiraceae; e: Lachnoclostridium; f: Tyzzerella; g: Roseburia; h: achospiraceae_NK4A136_group; i: Acetatifactor; j: norank_f_ Lachnospiraceae; k: Ruminococcaceae_UCG_005; l: Ruminococcaceae_UCG_010; m: Ruminococcaceae_UCG_014; n: Ruminococcaceae_UCG_004; o: Butyricicoccus; p: Erysipelotrichia; q: Erysipelotrichales; r: Erysipelotrichaceae; s: unclassified_f_Erysipelotrichaceae; t: Proteobacteria; u: Deltaproteobacteria; v: Desulfovibrionales; w: Desulfovibrionaceae; x: Desulfovibrio; y: Tenericutes; z: Mollicutes; a1: Mollicutes_RF9; d1: Saccharibacteria; h1: Candidatus_Saccharimonas; i1: Bacteroidetes; j1: Bacteroidia; k1: Bacteroidales; l1: Bacteroidales_S24_7_group; m1: norank_f_Bacteroidales_S24_7_group; n1: Rikenellaceae_RC9_gut_group |
此外, 在空白组与模型组中, 找出了具有显著性差异的5个门和10个属, 见表 1、2。在门水平上, 与空白组相比, 模型组中厚壁菌门减少, 拟杆菌门增加, 研究表明, 糖尿病大鼠肠道菌中厚壁菌门与拟杆菌门的比值与糖耐量成正相关性。
| Table 1 The relative abundance of species in the gut microbiota of control and model group mice at the Phylum level. n = 6, x± s. *P < 0.05, **P < 0.01 vs control group |
| Table 2 The relative abundance of species in the gut microbiota of control and model group mice at the Genus level. n = 6, x± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group |
由PCA三维图和PCA箱体图(图 5)可以看出模型组与空白组样品可以明显分离。

|
Figure 5 Maps of PCA 3D and PCA box at control and model group |
在属水平上, 选择在模型组和空白组有显著性差异的10个菌属进行进一步分析, 比较给药后群落在各组分布及其丰度的差异, 有8个菌种在给药后向空白组方向回调。对检验结果作图分析(图 6), 各组药物能不同程度地改善以上肠道菌群在糖尿病模型中的相对丰度, 其中生物碱调节的菌种较多, 对Bacteroidale拟杆菌属、Lachnospiraceae毛螺菌科、Lachnoclostridium和Butyricicoccus具有明显的调节作用, 效果较为显著; 黄酮组对Roseburia罗斯氏菌属和Candidatus_Saccharimonas的调节效果较好; 多糖组则对Lachnospiraceae毛螺菌科和Roseburia罗斯氏菌属的调节更明显。

|
Figure 6 Average relative abundance of different species in each group. n = 6, x± s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs control group; *P < 0.05, **P < 0.01 vs model group |
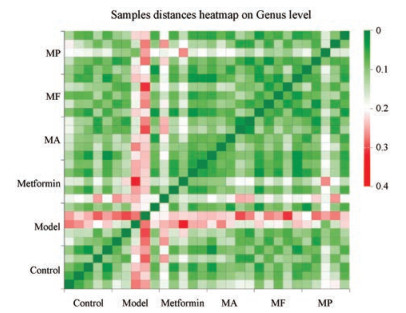
根据距离Heatmap图(图 7), 对样本间物种的丰度分布差异程度进行量化分析, 通过直观观察样本之间的距离发现, 模型组中样本与其他组中样本差异较大, 且有差异样本多于其余各组, 另外模型组的组内差异也较大, 说明在模型组中, 群落分布紊乱; 而在给予药物干预后, 与空白组之间差异变小, 提示桑叶多组分对糖尿病状态下的肠道菌群紊乱具有一定的调节作用。
|
Figure 7 Heatmap of the distance between samples in Genus level. The color indicates the similarity and difference of community composition among samples, and tends to be green, indicating that the community composition is similar; tends to be red, indicating that the community composition is quite different |
使用PICRUSt软件去除16S marker gene在物种基因组中的copy数目的影响, 通过每个OTU对应的greengene id, 获得OTU对应的COG (Cluster of Orthologous Groups)家族信息和KEGG (Kyoto Encyclopedia of Genes and Genomes)信息。根据COG数据库的信息, 从eggNOG数据库中解析到各个COG的描述信息以及其功能信息, 从而得到功能丰度谱。如图 8, 共发现与小鼠肠道菌群相关的功能25条, 其中糖转运与代谢; 转录; 功能预测; 氨基酸转运与代谢; 细胞壁/膜/包体生物合成; 复制、重组和修复; 翻译、核糖体结构和生物合成; 信号转导机制; 无机离子转运与代谢; 能量生产与转化等功能丰度较高, 尤其是糖转运与代谢功能。根据KEGG数据库的信息, 获得Pathway及其代谢通路的3个水平信息, 通过level 2筛选出丰度值前20的代谢通路(表 3), 其中包括膜转运、碳水化合物代谢、氨基酸代谢、复制与修复、能量代谢、翻译、因子和维生素的代谢、核苷酸代谢、细胞运动、细胞过程与信号传递、转录、脂质代谢、遗传信息处理、糖生物合成与代谢等。说明db/db小鼠肠道内环境失去平衡导致了体内上述相关通路发生紊乱, 而碳水化合物代谢、氨基酸代谢、能量代谢、脂质代谢及糖生物合成与代谢通路的异常又直接或间接地促进糖尿病的发展。
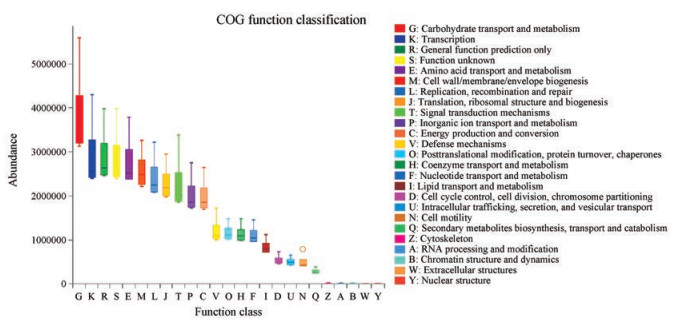
|
Figure 8 Metabolic function prediction of community samples |
| Table 3 Prediction of metabolic function from samples |
本研究通过16S rDNA测序的方法评价桑叶有效组分对自发性糖尿病的db/db小鼠肠道菌群的调节作用。db/db小鼠瘦素受体基因缺陷, 是研究2型糖尿病的良好动物模型。在小鼠出现严重的糖尿病症状后, 给予桑叶组分喂饲6周, 与空白组相比, 糖尿病模型组小鼠肠道内菌群从门到属分类水平均发生了相应变化, 可见糖尿病的发生发展与肠道菌群的失衡之间存在密切的关联。
值得一提的是, 在肥胖的db/db小鼠中, 厚壁菌门与拟杆菌门的比例显著增加, 已有报道[20]这一比例和糖耐量呈正相关。这与Zhao等[7]和Chen等[21]所报道的糖尿病状态下厚壁菌门增加拟杆菌门减少的结果相反, 而与Larsen和Schwiertz等[20, 22]所观察到的糖尿病和肥胖人群中厚壁菌门与拟杆菌门的比例减少的结果相似。Schwiertz认为这可能是由于厚壁菌门中的柔嫩梭菌(Clostridium leptum)在肥胖个体中比例小, 而拟杆菌在很大程度上不受身体质量指数(BMI)影响, 从而使得肥胖个体中厚壁菌门与拟杆菌门的比例减少。另外, 厚壁菌门中多数细菌是产丁酸盐菌, 丁酸盐是一种抗炎的短链脂肪酸盐, 可为肠黏膜提供营养, 增强肠黏膜免疫[10, 23-25], 这一菌群的减少破坏了肠道内环境的平衡, 从而加剧了糖尿病的进程。这一现象也说明了不能单从这两种菌群的变化来作为糖尿病发生的标志, 而是需要综合考虑到如体重、饮食、遗传背景、居住和总体健康等各种因素, 因此需要更多的临床研究来建立关于肠道微生物群对糖尿病及肥胖的影响程度的系统理论。
毛螺菌科和罗斯氏菌属同样是厚壁菌门中产生丁酸盐菌[26, 27]。在模型组中, Lachnospiraceae毛螺菌科和毛螺菌科NK4A136菌群丰度均小于空白组, 有报道称, 减少肠道微生物群成分中毛螺菌科比例可以减轻体重和预防体重增加[28], 这可能是肥胖个体机体自身调节的结果。Roseburia罗斯氏菌属在模型组中亦呈现出降低的趋势, 罗斯氏菌属除了产生丁酸盐这一重要作用外还具有从亚油酸中形成共轭亚油酸(conjugated linoleic acid, CLA)的能力, 而CLA表现出许多与抗肥胖和抗糖尿病作用相关的效果[29, 30]。此外, 与血糖血脂具有高度正相关的Desulfovibrio脱硫弧菌在模型组中显著升高, 关于脱硫弧菌的报道多见于溃疡性结肠炎相关的研究[31, 32], 它与结肠炎的发生呈正相关性, 临床上也常有糖尿病合并结肠炎发生的案例, 而脱硫弧菌是否与糖尿病之间存在关联尚需进一步的研究。
从整体来看, 生物碱对db/db小鼠的肠道菌群调节效果最为显著, 这与生物碱的降糖机制相吻合, 即通过抑制小肠中的α-葡萄糖苷酶, 降低餐后高血糖从而预防2型糖尿病并抑制脂质积累[17, 18]。综上, 桑叶中有效组分可有效调节糖尿病小鼠的血糖水平, 调控肠道微生态紊乱, 调节有益菌与有害菌之间的平衡, 使得疾病状态下的机体也能回到一个相对正常的肠道内环境, 这与桑叶的降糖机制息息相关, 但其深入机制尚需进一步研究。
| [1] | Golay A, Felber JP, Jequier E, et al. Metabolic basis of obesity and noninsulin-dependent diabetes mellitus[J]. Diabetes Metab Rev, 1988, 4: 727–747. DOI:10.1002/dmr.v4:8 |
| [2] | Fujimoto WY. The importance of insulin resistance in the pathogenesis of type 2 diabetes mellitus[J]. Am J Med, 2000, 108: 9–14. |
| [3] | Hu XQ, Thakur K, Chen GH, et al. Metabolic effect of 1-deoxynojirimycin from mulberry leaves on db/db diabetic mice using LC-MS based metabolomics[J]. J Agric Food Chem, 2017, 65: 4658–4667. DOI:10.1021/acs.jafc.7b01766 |
| [4] | Zhuang XX. The Metabonomic Study on Danzhijiangtang Capsule in Treatment of Type 2 Diabetes With Vascular Lesions Based on UPLC/QTOF-MS Method (基于UPLC/QTOF-MS技术的丹蛭降糖胶囊防治2型糖尿病血管病变的代谢组学研究)[D]. Anhui: Anhui University of Chinese Medicine, 2015. |
| [5] | Diamant M, Blaak EE, de Vos WM. Do nutrient-gut-microbiota interactions play a role in human obesity, insulin resistance and type 2 diabetes?[J]. Obesity Rev, 2011, 12: 272–281. DOI:10.1111/obr.2011.12.issue-4 |
| [6] | Cani PD, Delzenne NM. Gut microflora as a target for energy and metabolic homeostasis[J]. Curr Opin Clin Nutr Metab Care, 2007, 10: 729–734. DOI:10.1097/MCO.0b013e3282efdebb |
| [7] | Zhao X, Chen Z, Yin Y, et al. Effects of polysaccharide from Physalis alkekengi var. francheti on liver injury and intestinal microflora in type-2 diabetic mice[J]. Pharm Biol, 2017, 55: 2020–2025. DOI:10.1080/13880209.2017.1345953 |
| [8] | Cesaro C, Tiso A, Del Prete A, et al. Gut microbiota and probiotics in chronic liver diseases[J]. Digest Liver Dis, 2011, 43: 431–438. DOI:10.1016/j.dld.2010.10.015 |
| [9] | Ley RE, Peterson DA, Gordon JI. Ecological and evolutionary forces shaping microbial diversity in the human intestine[J]. Cell, 2006, 124: 837–848. DOI:10.1016/j.cell.2006.02.017 |
| [10] | Qin J, Li Y, Cai Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes[J]. Nature, 2012, 490: 55–60. DOI:10.1038/nature11450 |
| [11] | Wang Z, Klipfell E, Bennett BJ, et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease[J]. Nature, 2011, 472: 57–63. DOI:10.1038/nature09922 |
| [12] | Lin TB, Li YG, Lv ZQ, et al. Advances in the research and development on the synthesize utilization of mulberry resources[J]. Bull Sericulture (桑蚕通报), 2008, 39: 1–4. |
| [13] | Cheng FY, Ye SY. Research progress of mulberry leaves against diabetes mellitus[J]. J Pharm Pract (药学实践杂志), 2005, 23: 71–74. |
| [14] | Zhang LL, Wang YM, Xu M, et al. Antioxidant activity, phenol and flavonoid contents of fourteen mulberry varieties leaves[J]. Adv Mater Res, 2013, 781-784: 1454–1459. DOI:10.4028/www.scientific.net/AMR.781-784 |
| [15] | Li FM, Zhang GP, Zou XY, et al. Research progress of flavonoids in mulberry leaves[J]. China Sericulture (中国蚕业), 2015, 36: 1–4. |
| [16] | Su SL, Duan JA, Ouyang Z, et al. Progress on resource chemistry of the medicinal plants in genus Morus L. in China[J]. Mod Chin Med (中国现代中药), 2012, 14: 1–6. |
| [17] | Li YG, Ji DF, Zhong S, et al. 1-Deoxynojirimycin inhibits glucose absorption and accelerates glucose metabolism in strep tozotocin-induced diabetic mice[J]. Sci Rep, 2013, 3: 1377. DOI:10.1038/srep01377 |
| [18] | Deng MJ, Lin XD, Wen CW, et al. Metabolic changes in the midgut of Eri silkworm after oral administration of 1-deoxyno jirimycin:a 1H-NMR-based metabonomic study[J]. PLoS One, 2017, 12: e0173213. DOI:10.1371/journal.pone.0173213 |
| [19] | Ji T. The Study on Active Components Related to Diabetes Inmulberry Leaves and Its Action Mechanism (桑叶防治糖尿病的效应成分群及其作用机制研究)[D]. Nanjing: Nanjing University of Chinese Medicine, 2016. |
| [20] | Larsen N, Vogensen FK, van den Berg FWJ, et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J]. PLoS One, 2010, 5: e9085. DOI:10.1371/journal.pone.0009085 |
| [21] | Chen YQ, Yan X, Chen MJ, et al. Anti-diabetic activity of alcohol extracts from lessonia nigrescens and its effects on intestinal microflora in mice[J]. Biotechnol Bull (生物技术通报), 2017, 33: 162–169. |
| [22] | Schwiertz A, Taras D, Schafer K, et al. Microbiota and SCFA in lean and overweight healthy subjects[J]. Obesity, 2010, 18: 190–195. DOI:10.1038/oby.2009.167 |
| [23] | Dai XX, Cai HD, Su SL, et al. Regulatory effect of the leaves of Rehmannia glutinosa Libosch on intestinal microflora in diabetic nephropathy rats[J]. Acta Pharm Sin (药学学报), 2017, 52: 1683–1691. |
| [24] | Hamer HM, Jonkers D, Venema K, et al. Review article:the role of butyrate on colonic function[J]. Aliment Pharmacol Ther, 2008, 27: 104–119. |
| [25] | Louis P, Flint HJ. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine[J]. Fems Microbiol Lett, 2009, 294: 1–8. DOI:10.1111/fml.2009.294.issue-1 |
| [26] | Machiels K, Joossens M, Sabino J, et al. A decrease of the butyrateproducing species Roseburia hominis and Faecalibacterium prausnitzii defines dysbiosis in patients with ulcerative colitis[J]. Gut, 2014, 63: 1275–1283. DOI:10.1136/gutjnl-2013-304833 |
| [27] | Neyrinck AM, Possemiers S, Verstraete W, et al. Dietary modula tion of clostridial cluster XIVa gut bacteria (Roseburia spp.) by chitin-glucan fiber improves host metabolic alterations induced by high-fat diet in mice[J]. J Nutr Biochem, 2012, 23: 51–59. DOI:10.1016/j.jnutbio.2010.10.008 |
| [28] | Nicolau CD, Berg B, Rezzonico E, et al. The relationship between Lachnospiraceae in intestinal microflora and body weight: CN, 105142654 A[P]. 2015. |
| [29] | Devillard E, Mcintosh FM, Duncan SH, et al. Metabolism of linoleic acid by human gut bacteria:different routes for biosyn thesis of conjugated linoleic acid[J]. J Bacteriol, 2007, 189: 2566–2570. DOI:10.1128/JB.01359-06 |
| [30] | Benjamin S, Spener F. Conjugated linoleic acids as functional food:an insight into their health benefits[J]. Nutr Metab, 2009, 6: 36. DOI:10.1186/1743-7075-6-36 |
| [31] | Fox JG, Dewhirst FE, Fraser GJ, et al. Intracellular campylo bacter-like organism from ferrets and hamsters with proliferative bowel disease is a Desulfovibrio sp[J]. J Clin Microbiol, 1994, 32: 1229–1237. |
| [32] | Gosalbes MJ, Vázquez Castellanos JF, Angebault C, et al. Carriage of enterobacteria producing extended-spectrum β-lactamases and composition of the gut microbiota in an amerindian community[J]. Antimicrob Agents Chemother, 2016, 60: 507–514. DOI:10.1128/AAC.01528-15 |
 2019, Vol. 54
2019, Vol. 54


