病毒性出血热是一类严重危害公共安全和人类健康的传染疾病。目前已知沙粒病毒科(Arenaviridae)哺乳类沙粒病毒属(Mammarenavirus)中有多种病毒可致人出血热, 分别是拉沙病毒(Lassa virus, LASV)、卢约病毒(Lujo virus, LUJV)、马丘波病毒(Machupo virus, MACV)、瓜纳瑞托病毒(Guanarito virus, GTOV)、胡宁病毒(Junín virus, JUNV)、萨比亚病毒(Sabia virus, SABV)和查帕雷病毒(Chapare virus, CHPV)[1]。上述7种病毒均为A级病原, 活病毒须在生物安全4级实验室(BSL-4)进行操作[2]; 此外, 还有报道哺乳类沙粒病毒属中的白水阿罗约病毒(Whitewater Arroyo virus, WWAV)感染也可能致人出血热[3]。沙粒病毒是包膜病毒, 其基因组为双义编码RNA, 包括S和L两条链。L链编码基质蛋白Z和RNA聚合酶L; S链编码包膜糖蛋白GP和核蛋白NP, 其中包膜糖蛋白GP是唯一负责病毒进入宿主的病毒蛋白[4]。
沙粒病毒潜伏期一般为7~21天, 患者在感染早期多出现发烧、头痛、结膜炎、恶心、呕吐和腹泻等流感样症状, 后期可出现黏膜出血、休克及多器官衰竭, 部分患者还出现神经病变[5]。沙粒病毒致出血热具有发病快、致死率高的特点, 其中以拉沙病毒流行最广、危害最大, 疫区主要在西非[6, 7]。2018年爆发于尼日利亚的拉沙病毒疫情已确诊有588例感染患者、其中149人死亡, 致死率达25.4%[8]。马丘波病毒、瓜纳瑞托病毒、查帕雷病毒等新世界沙粒病毒主要流行于美洲, 致死率为15%~30%[1]。除胡宁病毒外, 迄今尚无针对其他沙粒病毒的疫苗或特效药物批准上市。在沙粒病毒流行疫区, 通常采用隔离患者的方法控制疫情扩散。利巴韦林(ribavirin)是广谱抗病毒药物, 也是目前唯一用于治疗拉沙病毒出血热的药物, 但其效果有限且不良反应显著[9, 10]。
天然产物是抗病毒药物的重要来源。本实验室曾发现柑橘属植物果皮提取物桔皮素可阻断多种沙粒病毒进入宿主细胞, 其抗拉沙病毒活性也经活病毒感染实验得到确认[11]。桔皮素是黄酮类化合物, 本研究以桔皮素为先导物, 对其34个结构类似物进行活性评价, 发现其中一个天然产物3, 5, 6, 7, 4'-五甲氧基黄酮也具有广谱抗沙粒病毒活性, 本研究明确了该化合物的作用机制并初步讨论了黄酮类化合物抗沙粒病毒活性的构效关系。
材料与方法 质粒密码子优化的8种出血热沙粒病毒GP基因(LASV-Josiah GP, Genbank NC_004296.1, 1 476 bp; LUJV GP, Genbank FJ952384.1, 1 365 bp; MACV-Carvallo GP, Genbank NC_005078.1, 1 491 bp; GTOV-S-56764 GP, Genbank AY572554.1, 1 440 bp; JUNV-XJ13 GP, Genbank FJ805378.1, 1 458 bp; SABV-SPH114202 GP, Genbank NC_006317.1, 1 467 bp; WWAV-9310141 GP, Genbank AF485264.1, 1 443 bp; CHPV-810419 GP, Genbank NC_010562.1, 1 455 bp)由北京义翘神州生物技术有限公司合成[12], 并克隆至pCMV3载体; 携带荧光素酶报告基因的HIV-1质粒(pNL4-3.Luc.R-E-)从美国NIH获得; 水泡性口膜炎病毒外壳糖蛋白(vesicular stomatitis virus glycoprotein, VSV-G)表达质粒由美国伊利诺伊大学Dr. Lijun Rong惠赠; pEGFP-N1质粒购自美国Clontech公司。
细胞人胚胎肾上皮细胞HEK293T和人脑星形胶质母细胞瘤细胞U-87 MG购自国家实验细胞资源共享平台(China Infrastructure of Cell Line Resource)。HEK293T细胞用含10%胎牛血清、100 u·mL-1青霉素、100 μg·mL-1链霉素的DMEM培养基培养, U-87 MG细胞用含10%胎牛血清、100 u·mL-1青霉素、100 μg·mL-1链霉素及1%非必需氨基酸的MEM培养基培养。
试剂荧光素酶检测试剂盒、CellTiter-Glo细胞活力检测试剂盒购自Promega公司; jetPRIME®转染试剂购自Polyplus transfection公司; HIV-1 p24 ELISA试剂盒购自北京义翘神州生物技术有限公司; ST-193购自MCE公司; 巴弗洛霉素A1购自LC Laboratories公司; 天然产物库(库容量526个)、多柔比星和地昔帕明盐酸盐购自上海陶素生化科技有限公司; DMSO购自美国Sigma公司; DMEM培养基、MEM培养基、胎牛血清、非必需氨基酸储液、青霉素/链霉素储液均购自美国Gibco公司。
CellTiter-Glo法检测化合物对细胞活力的影响按细胞数每孔8 000个将HEK293T细胞接种至96孔板中, 培养24 h后, 将受试化合物、阳性对照药多柔比星和DMSO (0.1% v/v)分别加至细胞培养液中。继续培养48 h后, 每孔加入CellTiter-Glo试剂并振荡混匀2 min, 于室温孵育10 min后, 测定各孔细胞的细胞存活率。以DMSO溶剂孔数值为100%细胞活力, 计算加药孔的细胞存活率[11]。
重组病毒制备和病毒定量转染前一天, 按照细胞数2×106接种HEK293T细胞至100 mm培养皿中。转染当天, 按照jetPRIME®转染试剂说明书所述方法将HIV-1核心质粒分别与各种沙粒病毒GP质粒或VSV-G质粒共转染, 转染后48 h的上清液中含有重组病毒, 收集上清并经0.45 μm滤膜过滤, 获得8种重组沙粒病毒(LASV-GP/HIV-luc、LUJV-GP/HIV-luc、MACV-GP/HIV-luc、GTOV-GP/HIV-luc、JUNV-GP/HIV-luc、SABV-GP/HIV-luc、WWAV-GP/HIV-luc、CHPV-GP/HIV-luc)和VSV-G/HIV-luc重组病毒, 所获得的重组病毒用HIV-1 p24 ELISA试剂盒定量[12, 13]。
化合物抗沙粒病毒活性检测感染前一天, 按每孔1.5×104个细胞将HEK293T细胞或U-87 MG细胞接种于48孔板中。感染前15 min, 将受试化合物、阳性对照药(ST-193和地昔帕明)加至细胞培养液中, 以等量DMSO (0.1% v/v)作为溶剂对照, 再加入假病毒(p24 0.8 ng·mL-1)。感染48 h后, 弃去细胞培养上清并裂解细胞, 测定细胞裂解液中的相对荧光素酶活性(relative luminescence units, RLUs), 以DMSO溶剂孔RLUs值为100%病毒感染, 计算加药孔的病毒感染率。
不同时间点加药检测化合物抗拉沙病毒的活性感染前一天, 按每孔1.5×104个细胞将U-87 MG细胞接种于48孔板中。感染前15 min将细胞置于4 ℃预冷, 随后加入LASV-GP/HIV-luc重组病毒, 4 ℃孵育1 h后, 洗去各孔中未结合的病毒并加入新鲜培养基继续培养。在病毒的吸附过程、吸附后及实验全程分别加入受试化合物和对照化合物。继续培养48 h后, 弃去上清, 裂解细胞, 测定细胞裂解液中的相对荧光素酶活性, 以DMSO溶剂孔RLUs值为100%病毒感染, 计算加药孔的病毒感染率[11]。
拉沙病毒包膜糖蛋白介导的细胞-细胞融合实验转染前一天, 按照细胞数2×106接种HEK293T细胞至100 mm培养皿中。次日, 按照jetPRIME®转染试剂说明书所述方法将3 μg pEGFP-N1质粒和3 μg pCMV3-LASV-GP质粒共转染至HEK293T细胞, 24 h后按每孔1.5×105个将被转染细胞铺至48孔板中。铺板后24 h, 吸出各孔上清并加入300 μL PBS (pH 4.6)酸化20 min, 吸弃上清, 加入新鲜培养基。在用pH 4.6 PBS处理前和/或处理过程中加入受试化合物, 在酸化后4 h用荧光显微镜(日本奥林巴斯公司IX71)观察并记录细胞-细胞融合现象[11]。
数据分析及统计方法用GraphPad Prism软件分析实验数据, 以浓度-感染率、浓度-细胞存活率作散点图并用非线性拟合得到量效曲线, 计算半数有效浓度(EC50)和半数细胞毒性浓度(CC50), 数据分析采用Student's t-test检验。
结果与讨论 1 抗拉沙病毒进入宿主细胞的黄酮类天然活性物质的发现黄酮类化合物是广泛存在的一类重要天然产物, 其生物活性广泛, 如抗氧化、抗炎、抗肿瘤和抗病毒活性(如HIV-1、抗流感病毒、疱疹病毒和HBV)[14, 15]。多甲氧基黄酮类化合物桔皮素(tangeretin, 图 1)是沙粒病毒进入宿主细胞广谱抑制剂, 该化合物是目前报道的唯一抗沙粒病毒黄酮类化合物[11]。本研究以桔皮素为先导物, 通过与市售天然产物库中黄酮类化合物进行结构比对, 获得34个桔皮素类似物。
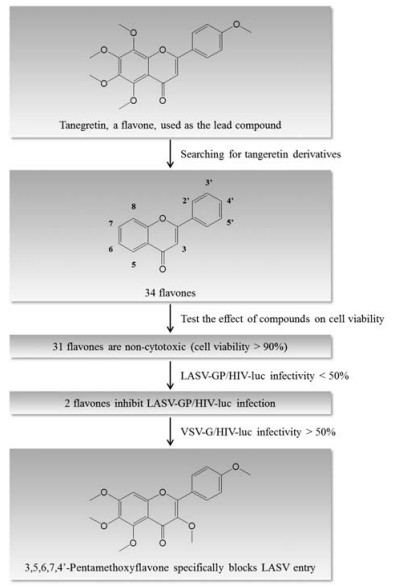
|
Figure 1 Identification of 3, 5, 6, 7, 4'-pentamethoxyflavone as a Lassa virus (LASV) entry inhibitor |
首先检测了受试化合物(终浓度为10 μmol·L−1)对细胞活力的影响。结果显示, 有3个化合物显示细胞毒性(7, 8-二羟基黄酮、去水淫羊藿黄素和夫拉平度的细胞毒性分别为62.76% ± 3.27%, 63.64% ± 8.46%和67.70% ± 4.77%), 其后, 本研究采用LASV-GP/HIV-luc体外感染模型对31个对细胞生长无显著影响的黄酮化合物(终浓度为10 μmol·L−1)的抗拉沙病毒进入宿主细胞活性进行评价(图 1和表 1)。结果显示, 化合物3, 5, 6, 7, 4'-五甲氧基黄酮(3, 5, 6, 7, 4'-pentamethoxyflavone)和去甲基川陈皮素(demethylnobiletin)可抑制LASV-GP/HIV-luc感染, 病毒感染率分别为31.91%和20.07% (表 1), 即抑制率分别为68.09%和79.93%。
| Table 1 Tangeretin derivates structures, cytotoxicity, and their activities against LASV-GP/HIV-luc and VSV-G/HIV-luc infection. *The active compounds were shown in shadow. **ST-193 was used as the reference compound for LASV-GP/HIV-luc infection assay. ***Doxorubicin was used as the reference compound for cell viability assay. Brief of substitutions in table: -glu: -glucoside; -man: -mannoside; -rha: -rhamnoside; -rut: -rutinoside. VSV: Vesicular stomatitis virus |
沙粒病毒包膜糖蛋白GP是唯一负责病毒进入宿主的病毒蛋白, LASV-GP/HIV-luc是以拉沙病毒GP为外壳包裹HIV核心的重组病毒, 该病毒仅能依赖LASV-GP与宿主细胞表面受体的特异性识别单次感染细胞, 荧光素酶报告基因可在被感染的细胞中表达, 通过检测其相对活性定量病毒感染水平[11, 12]。当荧光素酶活性下降时, 受试化合物可能影响如下环节:即化合物抑制了LASV-GP介导的进入过程, 或化合物抑制了病毒进入后HIV-1的逆转录、整合、转录过程, 或化合物直接抑制了荧光素酶的活性。为获得LASV特异性进入抑制剂, 本研究采用以水泡性口膜炎病毒外壳糖蛋白包裹HIV核心的重组病毒(VSV-G/HIV-luc)作为特异性对照模型进行评价。结果显示, 化合物3, 5, 6, 7, 4'-五甲氧基黄酮(10 μmol·L−1)对VSV-G/HIV-luc感染无显著性影响(图 1, 表 1), 提示该化合物是拉沙病毒进入宿主细胞的特异性抑制剂; 而去甲基川陈皮素(10 μmol·L−1)对VSVG/HIV-luc重组病毒感染有抑制作用, 感染率为30.03 % (表 1), 提示该化合物不是LASV感染宿主细胞的特异性抑制剂。
2 3, 5, 6, 7, 4'-五甲氧基黄酮可阻断拉沙病毒的融合过程拉沙病毒是典型的沙粒病毒, 其进入宿主细胞的过程包括GP1介导的病毒与宿主细胞受体的识别、吸附过程, 宿主细胞对病毒的内吞, 以及GP2介导的pH依赖型融合过程[16]。有研究显示, 在4 ℃条件下, 拉沙病毒可对宿主受体识别并吸附, 但不会发生病毒进入和膜融合过程[17]; 而当温度升至37 ℃后, 病毒对宿主细胞的感染随即恢复[17]。本研究通过在拉沙病毒感染的不同环节加入受试化合物, 并与已知机制的阳性药物比较, 考察3, 5, 6, 7, 4'-五甲氧基黄酮的作用环节。
本研究以拉沙病毒进入抑制剂ST-193和巴弗洛霉素A1 (bafilomycin A1)作为阳性对照。ST-193是拉沙病毒融合抑制剂, 可直接作用于拉沙病毒GP2序列, 稳定SSP-GP2空间构象, 抑制病毒的融合过程[18]; 巴弗洛霉素A1是通过内体膜上V型ATP酶(V-ATPase)活性, 抑制H+的内流, 抑制内体酸化从而阻断pH依赖型膜融合过程[19]。结果显示, 不论在拉沙病毒吸附过程加药、吸附后加药还是全程加药, ST-193均可显著降低LASV-GP/HIV的感染(图 2A); 巴弗洛霉素A1可抑制LASV-GP/HIV-luc吸附后感染, 而对LASV-GP/HIV-luc吸附过程无影响(图 2A)。与巴弗洛霉素A1相似, 在病毒吸附过程加入3, 5, 6, 7, 4'-五甲氧基黄酮对病毒的感染无影响, 而在病毒吸附后加药则对感染过程有显著抑制作用(P < 0.001, 图 2A), 提示3, 5, 6, 7, 4'-五甲氧基黄酮作用于拉沙病毒吸附后的环节, 即病毒的融合过程。
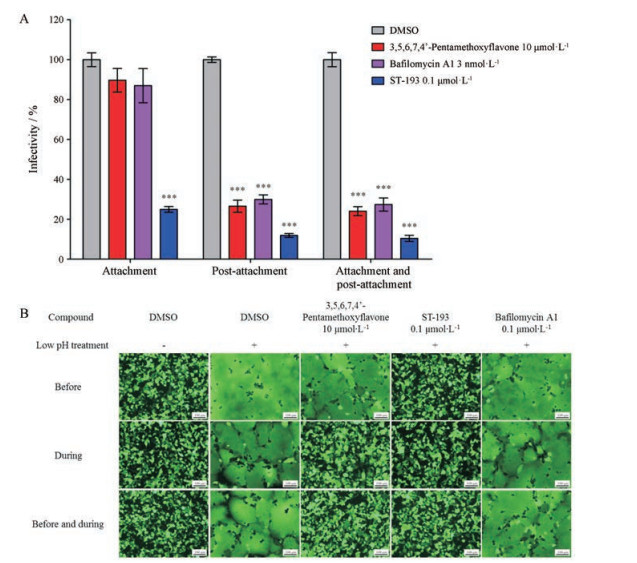
|
Figure 2 The compound 3, 5, 6, 7, 4'-pentamethoxyflavone blocks LASV GP-mediated fusion. A: Time-of-addition assay. The averages were from triplicate wells, and the error bars represented the standard deviation. The experiments were repeated once, and similar results were obtained. ***P < 0.001 vs DMSO group. B: The compound 3, 5, 6, 7, 4'-pentamethoxyflavone inhibits low-pH triggered LASV-GP-mediated cell-cell fusion. Syncytium was formed by low pH treatment of cells co-expressing LASV-GP and enhanced green fluorescent protein (EGFP). The panels correspond to representative fields observed. The experiment was repeated twice, and the same results were obtained |
拉沙病毒的GP1与细胞表面受体结合后, 细胞膜内陷形成内体进入胞浆, 随着内体中H+浓度升高[20], LASV-GP的空间构象发生改变, 疏水性融合肽暴露, 进而发生膜融合过程[16, 20-23]。为进一步确认3, 5, 6, 7, 4'-五甲氧基黄酮对拉沙病毒融合过程的抑制, 本研究采用LASV-GP诱导的细胞-细胞融合实验进行验证:首先向HEK293T细胞共转pEGFP-N1质粒和pCMV3-LASV-GP质粒, 使细胞表达绿色荧光蛋白和LASV-GP。当升高培养液的H+浓度时, 细胞表面LASV-GP构象改变, GP2疏水性融合肽暴露, 引起细胞-细胞融合, 该融合现象可通过荧光显微镜观察并记录。本研究以ST-193和巴弗洛霉素A1为对照药, 结果显示, 不论何时加入ST-193都呈可显著抑制LASV-GP介导的细胞-细胞融合(图 2B); 与之相反, 巴弗洛霉素A1对细胞膜外高H+浓度和LASV-GP介导的细胞-细胞融合过程无显著影响(图 2B); 当在酸化过程中加入3, 5, 6, 7, 4'-五甲氧基黄酮, 可显著抑制LASV-GP介导的细胞-细胞融合现象, 但在酸化前加药无效, 上述结果显示, 3, 5, 6, 7, 4'-五甲氧基黄酮是LASV融合抑制剂, 但作用机制与ST-193和巴弗洛霉素A1均不相同, 即3, 5, 6, 7, 4'-五甲氧基黄酮抑制LASV融合, 但不是通过稳定SSP-TM结构或抑制酸化的机制发挥作用。
3 黄酮类天然产物3, 5, 6, 7, 4'-五甲氧基黄酮具有广谱抗出血热沙粒病毒活性沙粒病毒科(Arenaviridae)一共包含40种病毒[24], 根据病毒的地理分布和病毒血清学可将其分为旧世界沙粒病毒(old world arenavirus, OWA)和新世界沙粒病毒(new world arenavirus, NWA)。旧世界沙粒病毒中拉沙病毒、卢约病毒, 以及新世界沙粒病毒中的马丘波病毒、白水阿罗约病毒、瓜纳瑞托病毒、胡宁病毒、萨比亚病毒和查帕雷病毒等8种病毒可致人出血热[1, 3]。
在发现3, 5, 6, 7, 4'-五甲氧基黄酮具有抗LASV活性后, 本研究考察了该化合物对另外7种致出血热沙粒病毒的广谱抗病毒活性。结果显示, 3, 5, 6, 7, 4'-五甲氧基黄酮可剂量依赖地降低LUJV-GP/HIV-luc、MACV-GP/HIV-luc、WWAV-GP/HIV-luc、GTOV-GP/HIV-luc、JUNV-GP/HIV-luc、SABV-GP/HIV-luc和CHPV-GP/HIV-luc等7种重组病毒对宿主细胞的感染, EC50在0.84~10.2 μmol·L−1之间(图 3和表 2)。
|
Figure 3 Activities of 3, 5, 6, 7, 4'-pentamethoxyflavone against entry of eight viral hemorrhagic fever-arenaviruses. U-87 MG cells were treated with 3, 5, 6, 7, 4'-pentamethoxyflavone (0.3-30 μmol·L-1, threefold dilutions) fifteen min prior arenavirus-GP/HIV-luc infection, and the luciferase acitivity was measured 48 h post-infection. LUJV: Lujo virus; MACV: Machupo virus; WWAV: Whitewater Arroyo virus; GTOV: Guanarito virus; JUNV: Junín virus; SABV: Sabia virus; CHPV: Chapare virus |
| Table 2 Summary of the activities of 3, 5, 6, 7, 4'-pentamethoxyflavone against entry of eight viral hemorrhagic fever-arenaviruses. *ST-193 was not detected for LUJV-GP/HIV-luc infection. Instead, desipramine hydrochloride was used as a reference compound, which gave an EC50 of 3.9 μmol·L-1. **TI was calculated as TI = CC50/EC50. EC50: Half maximal effective concentration; CC50: Half maximal cytotoxic concentration; TI: Therapeutic index |
目前虽未有抗沙粒病毒特效药, 但已有多个小分子沙粒病毒融合阻断剂报告, 其中苯磺酰胺类化合物ST-294可阻断新世界沙粒病毒融合过程, 但对拉沙病毒等旧世界沙粒病毒的感染无显著影响[25]; 苯并咪唑类化合物ST-193是广谱沙粒病毒融合阻断剂, 但对卢约病毒的感染无效[18]; 地昔帕明可阻断卢约病毒的感染, 但对胡宁病毒、萨比亚病毒和查帕雷病毒的感染无效[19]。本研究发现的3, 5, 6, 7, 4'-五甲氧基黄酮对8种出血热沙粒病毒的进入过程均有阻断作用, 有广谱抗沙粒病毒活性, 与现有活性化合物相比有明显优势。
4 黄酮类天然产物抗拉沙病毒的初步构效关系分析桔皮素是多甲氧基取代的黄酮类化合物, 3, 5, 6, 7, 4'-五甲氧基黄酮是以桔皮素为先导物, 通过对市售天然产物库中黄酮类化合物进行结构比对, 获得了34个桔皮素类似物进行评价而得到的广谱抗沙粒病毒进入活性物质。在表 1中, 根据34个黄酮化合物与桔皮素差异, 按相似度由高到低的顺序排列并进行了初步构效关系分析, 得出如下推论:
① 根据栀子黄素B (gardenin B)与桔皮素的结构差异和活性比较, 推测黄酮类化合物5位的-OCH3为抗拉沙病毒活性所必需;
② 根据川陈皮素(nobiletin)与桔皮素的结构差异和活性比较, 推测黄酮类化合物3'位若被-OCH3取代, 抗拉沙病毒活性可能会降低;
③ 根据3, 5, 6, 7, 4'-五甲氧基黄酮与桔皮素的结构差异和活性比较, 推测黄酮类化合物3位的-H和8位的-OCH3不是抗拉沙病毒所必需;
④ 根据第③条构效分析以及5, 7, 4'-三甲氧基黄酮(5, 7, 4'-trimethoxyflavone)与桔皮素的结构差异和活性比较, 推测黄酮类化合物6位的-OCH3为抗拉沙病毒活性所必需; 其他几个位置的取代基与抗拉沙病毒活性之间的关系, 尚待进一步研究。
天然产物是抗病毒药物的重要来源[26], 如从红厚壳属植物Calophyllum lanigerum中分离到的香豆素类化合物Calanolide A[27, 28]和海绵真菌来源的五环苯并倍半萜类化合物MXH-X73[29]被确认为HIV-1非核苷类逆转录酶抑制剂; 从栗豆树属植物Castanospermum australe中分离得到的生物碱castanospermin具有抗HCV的活性[30]; 齐墩果酸、合欢酸、白桦脂酸等三萜天然产物显示抗流感病毒和HIV-1的活性[31]。
黄酮化合物是广泛存在的一类重要天然产物, 桔皮素是富含于柑橘属植物果皮的一种黄酮化合物。本课题组前期研究发现并确认了桔皮素的抗沙粒病毒活性[11], 以此为基础, 本研究通过对桔皮素类似物的活性评价, 发现来源于菊科蚤草属植物[32]的3, 5, 6, 7, 4'-五甲氧基黄酮也具有抗拉沙病毒的活性, 且该化合物抗病毒的作用环节与桔皮素相同, 都是拉沙病毒融合抑制剂; 此外, 3, 5, 6, 7, 4'-五甲氧基黄酮抗沙粒病毒谱与桔皮素也一致, 即对包括拉沙病毒在内的8种沙粒病毒的感染过程均有阻断作用。
拉沙病毒、卢约病毒、马丘波病毒、白水阿罗约病毒、瓜纳瑞托病毒、胡宁病毒、萨比亚病毒和查帕雷病毒等8种沙粒病毒感染所致的病毒性出血热是严重危害公共安全和人类健康的传染病。此次发现的3, 5, 6, 7, 4'-五甲氧基黄酮及前期研究发现的桔皮素对上述沙粒病毒的感染过程均有阻断作用, 提示具有多甲氧基特征的黄酮类化合物有广谱抗沙粒病毒活性的可能。本研究结果不仅为应对致出血热沙粒病毒的药物研发提供了物质储备, 也为寻找和发现广谱抗沙粒病毒的天然产物提供了线索。
致谢: 感谢加拿大公共卫生局国家微生物实验室Xiangguo Qiu教授对本研究的大力支持和无私帮助。
| [1] | Sarute N, Ross SR. New world arenavirus biology[J]. Annu Rev Virol, 2017, 4: 141–158. DOI:10.1146/annurev-virology-101416-042001 |
| [2] | Dept, Health U.S. Biosafety in Microbiological and Biomedical Laboratories[M]. 5th ed. Centers for Disease Control and Preven tion, National Institutes of Health, USA, 2010: 246-265. |
| [3] | Enserink M. Emerging diseases. New arenavirus blamed for recent deaths in California[J]. Science, 2000, 289: 842–843. DOI:10.1126/science.289.5481.842 |
| [4] | Gunther S, Lenz O. Lassa virus[J]. Crit Rev Clin Lab Sci, 2004, 41: 339–390. DOI:10.1080/10408360490497456 |
| [5] | Yun NE, Walker DH. Pathogenesis of Lassa fever[J]. Viruses, 2012, 4: 2031–2048. DOI:10.3390/v4102031 |
| [6] | Coyle AL. Lassa fever[J]. Nursing, 2016, 46: 69–70. |
| [7] | Houlihan C, Behrens R. Lassa fever[J]. BMJ, 2017, 358: j2986. |
| [8] | Nigeria Centre for Disease Control. An Update of Lassa Fever Outbreak in Nigeria[EB/OL]. Disease Situation Reports[2018-12-09]. http://www.ncdc.gov.ng/diseases/sitreps/. |
| [9] | Roberts L. Nigeria hit by unprecedented Lassa fever outbreak[J]. Science, 2018, 359: 1201–1202. DOI:10.1126/science.359.6381.1201 |
| [10] | Crotty S, Cameron C, Andino R. Ribavirin's antiviral mechanism of action:lethal mutagenesis?[J]. J Mol Med, 2002, 80: 86–95. DOI:10.1007/s00109-001-0308-0 |
| [11] | Tang K, He S, Zhang X, et al. Tangeretin, an extract from Citrus peels, blocks cellular entry of arenaviruses that cause viral hemorrhagic fever[J]. Antiviral Res, 2018, 160: 87–93. DOI:10.1016/j.antiviral.2018.10.011 |
| [12] | Zhang X, Tang K, Guo J, et al. Establishment of evaluation system for a cell-based arenavirus entry inhibitor[J]. Acta Pharm Sin (药学学报), 2018, 53: 735–742. |
| [13] | Chen Q, Tang K, Zhang X, et al. Establishment of pseudovirus infection mouse models for in vivo pharmacodynamics evalua tion of filovirus entry inhibitors[J]. Acta Pharm Sin B, 2018, 8: 200–208. DOI:10.1016/j.apsb.2017.08.003 |
| [14] | Gong J, Zhang Y, Wu X. Advances in studies on antiviral activi ties of flavoids[J]. Chin Tradit Herb Drugs (中草药), 2008, 39: 623–627. |
| [15] | Kumar S, Pandey AK. Chemistry and biological activities of flavonoids:an overview[J]. ScientificWorldJournal, 2013, 2013: 162750. |
| [16] | Burri DJ, da Palma JR, Kunz S, et al. Envelope glycoprotein of arenaviruses[J]. Viruses, 2012, 4: 2162–2181. DOI:10.3390/v4102162 |
| [17] | Tai CJ, Li CL, Tai CJ, et al. Early viral entry assays for the identification and evaluation of antiviral compounds[J]. J Vis Exp, 2015, 105: e53124. |
| [18] | Larson RA, Dai D, Hosack VT, et al. Identification of a broadspectrum arenavirus entry inhibitor[J]. J Virol, 2008, 82: 10768–10775. DOI:10.1128/JVI.00941-08 |
| [19] | Tani H, Iha K, Shimojima M, et al. Analysis of Lujo virus cell entry using pseudotype vesicular stomatitis virus[J]. J Virol, 2014, 88: 7317–7330. DOI:10.1128/JVI.00512-14 |
| [20] | Li S, Sun Z, Pryce R, et al. Acidic pH-induced conformations and LAMP1 binding of the Lassa virus glycoprotein spike[J]. PLoS Pathog, 2016, 12: e1005418. DOI:10.1371/journal.ppat.1005418 |
| [21] | Shao J, Liang Y, Ly H. Human hemorrhagic fever causing arena viruses:molecular mechanisms contributing to virus virulence and disease pathogenesis[J]. Pathogens, 2015, 4: 283–306. DOI:10.3390/pathogens4020283 |
| [22] | Igonet S, Vaney MC, Vonrhein C, et al. X-ray structure of the arenavirus glycoprotein GP2 in its postfusion hairpin conforma tion[J]. Proc Natl Acad Sci U S A, 2011, 108: 19967–19972. DOI:10.1073/pnas.1108910108 |
| [23] | Willard KA, Alston JT, Acciani M, et al. Identification of residues in Lassa virus glycoprotein subunit 2 that are critical for protein function[J]. Pathogens, 2018. DOI:10.3390/pathogens8010001 |
| [24] | Wikipedia. Arenavirus[EB/OL].https://en.wikipedia.org/wiki/Arenavirus. |
| [25] | Bolken TC, Laquerre S, Zhang Y, et al. Identification and charac terization of potent small molecule inhibitor of hemorrhagic fever new world arenaviruses[J]. Antiviral Res, 2006, 69: 86–97. DOI:10.1016/j.antiviral.2005.10.008 |
| [26] | Dias DA, Urban S, Roessner U. A historical overview of natural products in drug discovery[J]. Metabolites, 2012, 2: 303–336. DOI:10.3390/metabo2020303 |
| [27] | Zheng D, Han L, Huang X, et al. Natural products in clinical trials:antiparasitic, antiviral and neurological drugs[J]. Acta Pharm Sin (药学学报), 2007, 42: 576–582. |
| [28] | Galinis DL, Fuller RW, McKee TC, et al. Structure-activity modifications of the HIV-1 inhibitors (+)-calanolide A and (-)-calanolide B[J]. J Med Chem, 1996, 39: 4507–4510. DOI:10.1021/jm9602827 |
| [29] | Ma X, Li L, Zhu T, et al. Phenylspirodrimanes with anti-HIV activity from the sponge-derived fungus Stachybotrys chartarum MXH-X73[J]. J Nat Prod, 2013, 76: 2298–2306. DOI:10.1021/np400683h |
| [30] | Whitby K, Taylor D, Patel D, et al. Action of celgosivir (6Obutanoyl castanospermine) against the pestivirus BVDV:implica tions for the treatment of hepatitis C[J]. Antivir Chem Chemother, 2004, 15: 141–151. DOI:10.1177/095632020401500304 |
| [31] | Si L, Meng K, Tian Z, et al. Triterpenoids manipulate a broad range of virus-host fusion via wrapping the HR2 domain prevalent in viral envelopes[J]. Sci Adv, 2018, 4: eaau8408. DOI:10.1126/sciadv.aau8408 |
| [32] | Williams C, Harborne J, Greenham J, et al. Variations in lipophilic and vacuolar flavonoids among European Pulicaria species[J]. Phytochemistry, 2003, 64: 275–283. DOI:10.1016/S0031-9422(03)00207-3 |
 2019, Vol. 54
2019, Vol. 54