2. 青岛海洋科学与技术试点国家实验室, 海洋药物与生物制品功能实验室, 海洋创新药物筛选与评价平台, 山东 青岛 266237;
3. 青岛海洋生物医药研究院, 山东 青岛 266071
2. Laboratory for Marine Drugs and Bioproducts, Innovation Center for Marine Drugs Screening and Evaluation, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. Marine Biomedical Research Institute of Qingdao, Qingdao 266071, China
酶在生物体内扮演着重要角色, 可以通过调节细胞活性、催化代谢反应维持机体正常功能和稳态平衡。酶活失衡是导致机体产生病理状态的重要原因, 通过调节酶活性可以达到治疗疾病的目的。因此酶成为治疗人类疾病的重要靶标[1]。酶抑制剂能特异性降低特定酶的活性。通过筛选发现酶抑制剂是新药开发的一个主要途径[2]。目前, 已成功用于药物开发的酶靶标种类繁多, 包括还原酶、水解酶、转移酶、裂解酶、异构酶、合成酶等[3]。2017年发表的一篇综述对FDA已批准药物按照其作用的靶标进行了统计, 发现2011~2015年间新获批的具有激酶活性调节作用的药物总计20个, 占新获批药物总数的28%[3]。以上数据表明, 以酶为靶标寻找新药的途径具有巨大潜力[4, 5]。药物筛选作为新药研究的关键步骤, 从天然来源或合成的化合物中筛选出高效的先导化合物, 评价其药用前景。大多数的药物筛选过程复杂, 成本高, 不适应大规模样品的同时筛选, 因此需要开发一种快速、低成本、高效率的酶抑制剂筛选方法。
采用质谱方法进行药物筛选时, 仅需消耗少量样品(< 1 μg)即可进行分析; 且不要求待测物具有发色基团, 无需进行荧光标记, 可避免荧光筛选体系中的化合物或基质产生自发荧光或者光散射, 导致假阳性或假阴性; 可以对化合物进行准确的质量表征, 适合分析复杂样品中微量的化合物, 并能对化合物进行确证[6]。质谱技术已经成为药物研发领域中非常重要的分析平台之一[7-10]。
酶抑制剂的体外筛选依据其机制主要分为基于活性的直接筛选和基于亲和相互作用的筛选(图 1)。亲和筛选是用MS及相关技术测定抑制剂与酶的结合情况来评价酶活性。活性筛选对比加入抑制剂后酶催化底物转化的转化率变化, 底物转化率越小表明抑制效果越好。本综述从亲和作用和活性作用两种不同的筛选策略进行阐述, 就近年来新发展的酶抑制剂筛选技术及其应用进行简要综述。
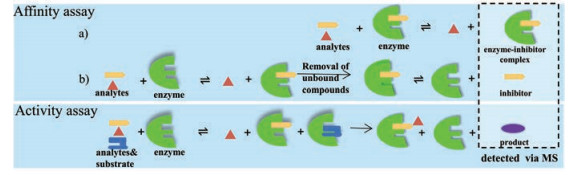
|
Figure 1 Two models for screening enzyme inhibitors by MS. Affinity-based assay detecting enzyme-inhibitor complexes and detecting inhibitors directly. Activity-based assay: detecting the substrate or product indirectly |
大多数药物进入人体后通过与相应的生物大分子结合发挥药效。利用酶抑制剂与酶之间存在的特异性亲和作用, 提出了酶抑制剂的亲和筛选策略。根据亲和筛选过程中检测对象的不同, 可将亲和筛选分为两类:第一类是直接检测小分子化合物与酶靶标形成的复合物, 有复合物的形成即说明该小分子化合物与酶靶标相结合。将待筛选的小分子化合物体系与靶标酶进行共孵育, 孵育后酶由于形成酶-抑制剂复合物而产生分子量的变化, 通过质谱来检测生成的复合物, 进而获得与酶结合的小分子的分子量及结构信息; 第二类直接检测复合物解离后的小分子抑制剂。酶与待筛选小分子化合物体系孵育后, 通过一定分离技术获得酶-抑制剂复合物, 然后将该复合物解离后, 对解离下来的特异性结合的小分子进行分析, 通过对比特异结合前后图谱的变化来间接推断具有亲和作用的活性成分。此类方法一般需要与各种分离技术联用, 如前沿亲和色谱、固定化酶磁珠法、表面等离子体共振技术和超滤等, 以达到检测解离后抑制剂的目的。
1.1 质谱检测酶-抑制剂复合物酶抑制剂特异性作用于酶的某些基团, 降低酶的活性甚至使酶完全丧失活性[11]。酶与抑制剂结合形成复合物后, 相应质荷比发生变化, 通过质谱分别得到酶以及酶-抑制剂复合物的分子量, 由此可推算出相应抑制剂的分子量。进一步比较酶抑制剂-复合物与酶的相对丰度大小还可以进一步推断抑制剂与酶结合能力的强弱[12]。
Poulsen等[13]在一种新发现的真菌代谢产物的结构基础上, 通过组合化学策略得到了一个结构类似的小型化合物库。他们采用ESI-FTMS检测发现该化合物库中的其中一种结构具有较强的亲和能力, 可以与牛碳酸酐酶Ⅱ (bCAⅡ)结合形成复合物。并在此基础上进一步对化合物库的筛选结果进行了分析, 对该类结构类似物的构效关系进行了阐述。Vu等[12]将bCAII分别加入到10种富含生物碱的植物提取物和8种海洋提取物中进行孵育, 然后用ESI-FTICR-MS分析, 检测产生的非共价复合物, 以鉴定天然产物提取物中的bCAII特异性抑制剂。PfRab11a是治疗疟疾的潜在靶标, Yang等[14]使用生物亲和质谱筛选方法, 针对该靶标筛选了192种植物粗提物和659个基于天然产物结构的碎片小分子化合物库, 从中发现Psydrax montigena的提取物arborside E可与PfRab11a产生弱结合。此研究表明, 用ESI-FTMS检测酶与抑制剂复合物来筛选潜在抑制剂的方法具有快速准确的特性。Gong[15]使用离子淌度质谱(ion mobility mass spectrometry, IM-MS)分析配体和蛋白的相互作用, 为质谱分析酶-抑制剂复合物提供了另一条思路。
质谱直接检测酶与抑制剂形成的复合物, 属于定性范畴。在此类应用中多采用高分辨质谱检测天然产物粗提物与靶标酶孵育液中的酶-抑制剂复合物, 可以直接从天然产物粗提取物中筛选出具有抑制效果的活性化合物并给出活性物质的分子量信息, 从而避免前期大量的以生物活性为标准的分离工作[12]。采用质谱手段直接检测酶-抑制剂复合物, 不需要将未结合的化合物与复合物进行分离, 也不需要将酶-抑制剂复合物进行解离, 更不需要对蛋白质或化合物进行标记, 且样品运行时间短, 每天可以筛选多达几百个粗提取物样品, 大大提高了筛选效率。
1.2 质谱检测复合物解离后抑制剂质谱可以通过检测酶-抑制剂复合物解离释放出的抑制剂, 间接发现与酶具有亲和作用的活性成分。再对特异结合的抑制剂进行分析获得对靶酶的亲和参数等信息。与检测酶-抑制剂复合物相比, 质谱直接检测复合物解离后的抑制剂的方法能获取抑制剂结构信息。本小节总结了固定化酶(前沿亲和色谱、固定化酶磁珠、表面等离子体共振技术)和超滤(在线解析、离线解析)相关技术与质谱联用的技术在酶抑制剂筛选方面的应用。
固定化酶-质谱联用通常是将酶固定在特定的载体上制备成仍有催化活性的酶衍生物, 加入抑制剂与之相互作用, 再采用高效液相或毛细管电泳分离技术使抑制剂从柱填料中被洗脱下来, 最后用质谱分析。通过酶的固定化技术可以允许酶多次使用, 大大降低了实验成本[16]。并且通过固定化酶与质谱联用, 可以在一次运行中筛选混合物中的抑制剂, 此方法具有高灵敏度和高通量测定的特性。常用的酶固定方法有吸附法、共价结合、交联法、光偶联法、等离子法和包埋法。吸附法通过氢键、疏水键等作用力将酶吸附于不溶性载体。共价结合法则是在酶蛋白分子上的功能基团和固定化载体表面上的反应基团之间形成共价键, 从而将酶固定在支持物上。共价固定过程可阻碍大分子的自由构象, 并且蛋白质和载体之间的非生物特异性相互作用可能导致蛋白质的变性, 因此对载体材料的性质以及其固定化方式要求较为严格。交联法通过使用双官能团或多官能团试剂使酶分子之间相互交联呈网状结构从而实现酶的固定化。光偶联法和等离子体法属于新型固定化方法。光偶联法使用光敏性单体聚合物进行包埋处理制备高活性的固定化酶。该方法条件温和, 因此获得的固定化酶往往有着比较高的酶活力。等离子体可以修饰载体材料表面, 从而实现活性基团引入, 达到固定化的目的。包埋法包括凝胶包埋法和微囊法两种。凝胶包埋法将酶分子包埋在凝胶高聚物的网格内, 常用凝胶包括聚丙烯酰胺、海藻酸钠、卡拉胶、胶原和明胶等。微囊法将酶封装在半透性聚合物膜的微囊中(如胶囊、脂质体和中空纤维), 主要包括界面沉淀法、界面聚合法和脂质体包埋法。包埋法的优点是反应条件温和、很少改变酶结构但是又很牢固。缺点是只有小分子底物和产物可以通过高聚物网架扩散, 对底物或者产物是大分子的酶并不适合。Lan[17]将血管紧张素转化酶采用反相微乳包埋法固定在磁性琼脂糖微球上, 用于筛选长蛇鲻酶解液中的活性多肽。金属有机框架材料(MOF)是近来发展起来的一类固定化载体, 具有较高的孔隙率和比表面积, 作为固定化酶的载体具有广阔的应用前景。Xu等[18]利用多孔MOF的CeO2材料作为固定化的载体, 固定在此载体上的激酶将底物肽进行磷酸化。采用MALDI MS定量方法分析磷酸化底物的量来评价蛋白激酶的活性和抑制作用。MOF材料的孔径大小一般小于1 nm, 而酶的大小一般在3~5 nm之间, 不能直接固载。因此扩大MOF作为固定化载体材料在酶抑制剂筛选领域的应用, 还有许多问题需要解决:设计孔径MOFs材料、设计不同功能化的MOFs材料以及研发环境友好的方式合成所需的生物分子MOFs体系等。已经报道的固体载体有聚合物颗粒、玻璃、膜、凝胶珠、溶胶-凝胶载体、多孔硅基质、多孔整体材料和顺磁性微粒等[19]。本小节总结前沿亲和色谱-质谱、固定化酶磁珠-质谱和表面等离子体共振技术-质谱(SPR-MS)三种不同酶固定化方式与质谱联用的方法。前沿亲和-质谱法是根据配体对酶的亲和力, 配体亲和力越大则被洗脱出的所需时间越长, 质谱检测根据保留时间推断抑制效果及根据分子量分析抑制剂; 固定化酶磁珠能特异性结合抑制剂并与质谱联用对抑制剂进行表征; 表面等离子体共振技术-质谱法是用SPR检测酶与抑制剂是否结合, 然后通过质谱对抑制剂鉴定。固定化酶筛选酶抑制剂主要缺点是固定化酶对底物的亲和力略有降低, 可能是由于酶固定化后, 活性中心的空间结构、氨基酸残基和电荷状态发生了改变; 或者在固定化酶的周围, 形成了能对底物产生静电的相互作用及立体影响的扩散层。
1.2.1 前沿亲和色谱-质谱(FAC-MS)前沿亲和色谱-质谱(frontier affinity chromatography-MS, FAC-MS)联用技术由Schreimer和Hindsgaul等[20, 21]于1998年首次提出, 用于研究酶与抑制剂之间的相互作用, 可求出分子间解离常数Kd, 同时对配体的亲和力大小排序。FAC-MS筛选酶抑制剂的基本流程是将酶固定在载体上, 用结合缓冲液平衡柱子, 然后使用含有配体的结合缓冲液平衡。待测配体连续流过固定化柱使其饱和并达平衡状态。与靶标酶结合的配体不断地被亲和力更强的配体置换, 配体与靶标酶亲和力越强则保留时间越长, 因而亲和力越强, 流出体积就越大, 通过合适的检测器就可得相应的流出曲线, 并计算得出解离常数Kd。FAC-MS技术需要使用空白标记物和指示剂。空白标记物对目标酶并没有亲和力, 最快被洗脱出来; 指示剂对目标酶具有已知的亲和力和已知的洗脱时间。在筛选过程中, 指示剂的保留时间的减少表明存在抑制率更高的活性物质。
de Moraes等[22]以人嘌呤核苷磷酸化酶(HsPNP)为靶标, 将HsPNP固定在环氧-二氧化硅(硅胶毛细管或SMC)和环氧聚合物(聚合物整体毛细管和PMC)的两种整体毛细管材料上, FAC-MS/MS方法筛选对人嘌呤核苷磷酸化酶(HsPNP)亲和力较高的化合物, 同时测定Kd值以鉴定新的抑制剂。Yuan等[23]将PAI-1蛋白固定在氨丙基-CPG上制备成PAI-1亲和柱, 然后将提取的天然产物用FAC-MS方法进行分析(图 2)。FAC-MS系统有两个进样口(A和B):进样口A注入含有样品的NH4Ac溶液, 进样口B注入甲醇。样品溶液通过进样口A连续注入亲和柱上, 流出液与进样口B的甲醇通过三通混合, 然后使用ESI-TOFMS进行分析。4种提取的天然产物, 黄曲霉毒素、大黄酸、珊瑚素和吉拉宁在PAI-1亲和柱中比对照化合物(corilagin)停留时间更长, 说明这4种天然产物与PAI-1较强的相互作用, 可能具有较好的抑制效果。
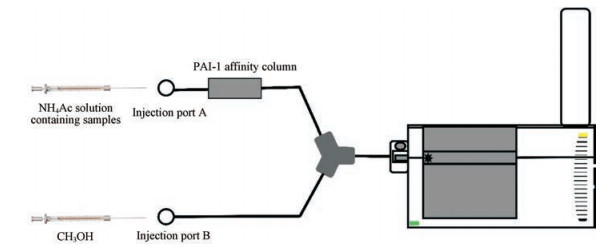
|
Figure 2 Schematic representation of the FAC-MS equipment and principle |
FAC-MS法可以从复杂的体系中一次性筛选多个化合物并对其抑制效果进行排序, 同时可以测定亲和保留的化合物的分子量, 是一种高效的筛选方法[24]。大大减少了筛选的时间成本[25, 26]。
1.2.2 固定化酶磁珠-质谱磁珠由于其操作稳定性, 低的非特异性结合和磁选分离的便利性, 被认为是酶的理想固定载体, 用固定化酶磁珠法从天然产物中筛选酶抑制剂被认为是理想的筛选方法。固定化酶磁珠法筛选酶抑制剂首先将酶固定在特定的能与酶结合的磁珠上, 然后待分析物与磁珠上的酶作用, 抑制剂与磁珠结合并通过施加磁铁使之沉淀于底部; 最后通过洗脱溶剂使抑制剂释放进而通过质谱表征。商品化磁珠的表面具有不同的反应基团, 常用的有氨基、羟基、羧基、巯基, 这些基团可与酶的非活性必需侧链基团偶联, 从而将酶固定在磁珠上。实验设计时, 往往需要根据欲固定的酶蛋白分子的结构特征, 选择合适的磁珠作为固定载体。例如, Wang等[27]比较了表面活性成分不同的商品化磁珠, 氨基磁珠、羧基磁珠和NHS磁珠对黄嘌呤氧化酶(XOD)的固定化能力。实验发现氨基磁珠可能通过激活戊二醛降低XOD和磁珠之间的空间位阻, 因此更适用于XOD的固定化。通过与对照品对比色谱保留时间、紫外吸收和质谱碎片, 从新鲜的姜根和黄芩根提取物中鉴定出12个与XOD结合较强的配体。直接使用共价结合方式开发化学修饰磁珠的过程成本较高且费时费力, 因此此类应用目前相对较少[28]。
Cao等[28]通过开环反应将凝血酶固定在Dynabeads® Epoxy磁珠上, 将丹参注射液与磁珠一起孵育。洗涤酶包被的磁珠, 与酶结合的分析物被洗脱, 然后进行超高效液相色谱-四极杆飞行时间串联质谱技术分析筛选丹参中凝血酶抑制剂。本实验使用扫描电子显微镜、透射电子显微镜和红外光谱表征凝血酶与磁珠的结合, 通过分析目标化合物的酶珠比和峰面积来确定酶活性。本实验优化了磁珠量、洗脱溶剂类型、孵育温度和时间等因素。
Tao等[29]使用1-(3-二甲基氨基丙基)-3-乙基碳二亚胺和N-羟基琥珀酰亚胺作为反应试剂, α-葡萄糖苷酶通过共价连接固定在羧酸封端的磁珠上, 用固定化酶磁珠法从桑叶中筛选α-葡萄糖苷酶抑制剂。该实验通过磁珠法同时分离和富集结合的化合物, 避免了繁琐的分离和纯化程序来鉴定纯活性化合物。用MS和NMR筛选并表征出药用植物桑蚕提取物中黄芪素和异槲皮素作为α-葡萄糖苷酶抑制剂。Li等[30]使用固定化酶谷胱甘肽磁性纳米颗粒与HPLC和MS联用, 快速筛选和鉴定黄连素中的α-淀粉酶抑制剂。
选择合适的可以作为酶固定化载体的磁珠的过程比较繁琐。但是磁珠质谱联用法与FAC-MS相比, 不需要使用指示剂, 且磁珠质谱联用法中固定化后的酶活性没有明显变化[28]。将磁珠法与质谱联用可以充分发挥其高选择性高稳定性的特性来筛选酶抑制剂。
1.2.3 表面等离子体共振技术-质谱(SPR-MS)表面等离子体共振技术(surface plasmon resonance, SPR)是一种广泛应用于研究分子间相互作用的分析技术, 它利用金属表面的表面等离子体波与检测光路间相互作用实现金属表面(比如玻璃表面的金或银镀层)状态的监测, 进而实现对表面反应状态的监测。当其他条件都相同时, SPR信号的变化直接源于芯片表面附近折射率的改变, 而折射率的变化又和结合在金属表面的生物分子质量成正比(酶-抑制剂的相互作用改变了传感器芯片表面的折射率)。因此可以通过获取生物反应过程中SPR角的动态变化, 得到生物分子之间相互作用的特异性信号[31, 32]。常见的传感器芯片是使用羧甲基化糊精共价附着在镀金玻璃板上。由于传感器的原理限制, SPR生物分析仪无法识别出化合物的种类, 同时SPR检测是非破坏性的, 所以经过SPR分析的蛋白和配体可以进一步用质谱对配体进行解析[33]。该方法难以辨别是否为特异性吸附。但是质谱可提供关于样品分子结构的重要信息, 与SPR技术形成很好的互补。SPR-MS联用技术可快速检测底物与配体之间相互作用并同时对配体进行鉴定。
通过改进SPR检测配体结合的特性, 并用MS进一步分析洗脱液[34]。实验中采取将牛胰蛋白酶固定在羧甲基葡聚糖基质的传感器芯片上, 用SPR检测茄科植物的水果或块茎中抑制剂和蛋白水解酶的结合, 然后结合上的抑制剂进一步从传感器芯片上洗脱出来用质谱进行表征。Kim等[35]采用简单的两步反应使两种PEG硫醇在金基底上形成表面杂化的自组装单层膜, 得到生物芯片。通过免疫捕获将人IgG以及β2-微球蛋白、IL6蛋白、C反应蛋白、前列腺特异抗原的抗体固定在生物芯片表面, 用于捕获目标抗原。样品处理后的生物芯片先进行SPR成像实验, 再进行后续的MALDI质谱分析。
1.2.4 超滤-质谱(UF-MS)超滤-质谱法(ultrafiltration-mass spectrometry, UF-MS)是一种将超滤装置与质谱技术相结合的方法。该方法利用亲和原理将具有潜在活性的小分子化合物的混合物与有生物活性的受体混合, 进而得到受体配体复合物和未与受体结合的小分子化合物的混合物。采用超滤法将未结合的小分子化合物分离, 再通过具有高灵敏度的高效液相色谱质谱联用技术来对与受体结合的活性小分子进行分离和鉴别。超滤质谱法能够快速地筛选和鉴定出能与生物靶分子结合的具有生物活性的小分子配体, 还能够比较不同小分子配体与靶分子的结合能力的大小。常用的超滤离心管滤膜材料有再生纤维素、Hydrosart、聚醚砜和三醋酸纤素, 可根据不同要求选用离心管以避免非特异性吸附。超滤质谱法具有分析特异性、灵敏度高、速度快和高通量等优点。这使得该技术在筛选特定的配体方面具有较强的优势。虽然超滤破坏小分子配体与大分子之间的弱结合, 但此方法具有简单快速的特点, 在天然产物中筛选酶抑制剂仍具有不可替代的作用。
接下来按照酶-抑制剂复合物是否经过在线质谱解析以释放抑制剂的步骤分为离线和在线两个方面对超滤质谱进行阐述。
超滤离线解析-质谱筛选酶抑制剂的步骤分3步: ①将化合物与酶进行孵育; ②通过超滤法将未结合的化合物进行分离; ③加有机溶剂让靶标酶-配体复合物变性, 使结合的配体解离, 最后用质谱进行检测。
Zhao等[36]选用乙酰胆碱酯酶(AChE)作为研究对象, 采用再生纤维素作为超滤膜, 甲醇作为洗脱剂, 将未与AChE结合的化合物洗脱。实验中优化酶浓度、培养时间、培养温度和助溶剂使化合物与AChE结合度更强。结果发现黄连根部提取物古伦朴碱、非洲防己碱、黄连碱、巴马汀和小檗碱对AChE有较好的抑制效果, 其中巴马汀IC50值为36.6 μmol·L-1。
Tao等[37]用亲和超滤对山楂叶总黄酮中的α-淀粉酶抑制剂进行研究。使用超滤膜将未结合的小分子物质与大分子物质进行分离, 并对超滤液进行分析。若加入α-淀粉酶时对应的小分子液相峰强度明显低于未加酶对照组, 则说明该物质与α-淀粉酶结合后被超滤膜截留。此外通过比较加淀粉酶组和变性淀粉酶组的液相色谱图还可以排除淀粉酶对目标化合物非特异性结合的可能性。最后使用质谱鉴定3个活性成分:槲皮素-3-O-鼠李糖基-(1→4)-葡萄糖基-(1→4)-鼠李糖苷、牡荆素-2''-葡萄糖苷和牡荆素-2''-鼠李糖苷。超滤方法的缺点是非特异结合的配体会影响与酶结合配体的质谱检测。Choi等[38]在筛选醌还原酶抑制剂时发现化合物与膜的非特异性结合产生的背景信号会对筛选结果产生干扰, 因此通过在配体-蛋白质解离步骤两次过膜减少非特异性的吸附。超滤质谱联用步骤可操控性强, 可针对不同天然产物进行酶抑制剂筛选研究, 例如葡萄糖苷酶抑制剂筛选等[39-41]。已有文献[42]对超滤-质谱应用于中药有效成分发现进行了全面的总结, 限于篇幅, 本文不再赘述。
解析电喷雾电离(DESI)在2004年由Cooks团队[43]提出, 可对酶-抑制剂复合物进行解析。首先将未结合靶蛋白的化合物用滤膜滤除, 然后直接用DESI-MS解离抑制剂-蛋白复合物并测定释放的抑制剂。该方法可直接用DESI解析复合物并用质谱检测与蛋白结合的小分子, 提供分子结构信息。
Yao等[44]孵育待筛化合物和DNA拓扑异构酶Ⅰ(DNA-Topo Ⅰ)以形成复合物, 然后通过离心和Ultracel-10再生纤维素滤膜过滤除去未结合的物质, 最后通过DESI-MS筛选与蛋白质结合的化合物。其中SN-38抑制剂对DNA-Topo Ⅰ复合物具有较强的结合亲和力。Fryčák等[45]利用DESI结合高分辨率MS和MS/MS, 检测样品中的多种5型磷酸二酯酶(PDE5)抑制剂。DESI-MS不仅减少了耗时的样品制备, 并且在检测中避免了基质的干扰, 从而有助于快速有效地筛选结合蛋白质的药物。
微透析技术也属于超滤的一种。微透析利用半透膜将小分子物质从样品转移至透析液中, 从而实现小分子物质的分离。微透析技术主要用于样品提取纯化。微透析技术最大的优点是可在基本上不破坏纯蛋白或者活细胞的情况下进行实时在线分析。例如, Wang等[46]利用微透析与LC-MS/MS实现在线联用, 在搭建的微透析装置中, G. jasminoides提取物和醛糖还原酶在缓冲液中形成复合物, 其中复合物由微透析探针膜保留, 未结合的化合物通过透析移除。这些透析液中的未与酶结合的化合物经液相分离和质谱定量分析, 通过比较化合物与醛糖还原酶结合前后化合物的色谱峰面积计算结合率, 明确G. jasminoides中某些化合物可以与醛糖还原酶发生相互作用。微透析采用半透膜为分离介质, 其膜寿命及渗析效果会受到样品复杂程度的影响, 对于复杂体系的分析依然存在挑战。
2 活性筛选酶反应中底物/产物转化率与酶的活性直接相关。活性筛选通过酶反应产物生成量或酶反应底物消耗量的变化来判断待筛选物质的抑制效果。按照酶反应是否进行在线反应将活性筛选分为两种:一是离线测定系统, 离线酶反应后再进行质谱检测; 二是在线分析系统, 使酶固定在在线的系统(毛细管、芯片)上, 然后用质谱检测反应前后底物或者产物的量。
2.1 离线测定系统离线测定系统的筛选流程首先是进行酶反应, 然后当反应达到一定的时间和一定的量之后进行淬灭, 最后通过质谱对产物或底物进行检测。LC-MS和LC-MS/MS在离线测定筛选酶抑制剂中占主导地位。离线测定系统通过各种质谱(MALDI、ESI及MS、MS/MS)筛选酶(脂肪酸合酶[47]、α-葡萄糖苷酶[48]和黄嘌呤氧化酶[49]等)抑制剂。离线测定系统筛选酶抑制剂方法模式比较单一。离线测定虽然速度较慢, 但其方法准确性较高, 对设备和技术要求相对比较小, 适合一般实验室进行筛选实验。此部分对离线测定的最新文献按其研究领域、酶的类型、酶所对应的抑制剂以及质谱类型来进行归纳总结, 如表 1[47-64]所示。
| Table 1 Off-line screening enzyme inhibitor based on MS, including research field, types of enzyme, discovered inhibitor and type of MS |
质谱在线分析系统筛选酶抑制剂通常与HPLC[65]、毛细管电泳[66]和微流控芯片等技术联用。在线分析系统具有自动化高的优势。
2.2.1 毛细管电泳-质谱(CE-MS)毛细管电泳(capillary electrophoresis, CE)具有分离效率高、分析速度快、消耗试剂少(仅纳升体积)等优点。毛细管电泳-质谱联用技术(CE-MS)将酶固定在毛细管柱头, 形成毛细管固定化酶微反应器, 然后与质谱仪器联用。CE-MS综合毛细管电泳的高分离能力和质谱的高灵敏度, 在食品药品分析领域有很广泛的应用[67]。毛细管进行酶实验归纳为3种:电泳调控微分析(EMMA)、毛细管进样端反应(at-inlet)、横向扩散测定(TDLFP)。EMMA法主要有2种模式:连续模式和区带模式。连续模式将一种反应物溶解于背景电解质并填充在毛细管中, 另一种反应物以进样的形式引入毛细管, 2种反应物在毛细管内充分反应, 然后加电压分离检测, 此模式所需试剂较多; 区带模式中, 酶与底物被依次注入毛细管中, 淌度小的先进样, 然后施加一段低电压, 因淌度的不同, 两区带相遇直至完全重叠, 充分反应后, 加高电压分离检测。毛细管进样端模式中, 酶反应发生在毛细管的进样端, 通过溶液中反应物在毛细管内轴向扩散彼此混合或者通过固定化酶反应器实现酶促反应。横向扩散测定技术以串联模式或者三明治模式将酶注入到毛细管的进样端, 反应物通过自由扩散相互混合而引发反应。
Wang等[68]通过利用底物与金属蛋白酶在电场中的不同电泳迁移率来进行混合从而触发酶反应。然后, 将反应物和产物分离并通过质谱检测。这种通过电泳混合反应的方法减少了稀释效应和区域展宽效应。固定化毛细管电泳反应器(ICER)显著提高酶在有机溶剂存在下的稳定性以及酶的重复利用性。Vilela等[69]使用戊二醛将β-分泌酶1 (BACE1)固定在熔融石英毛细管的内表面, 然后用淀粉样蛋白前体序列的肽JMV2236作为底物注入BACE1-ICER使产生特定分子量的产物进行定量检测, MS监测BACE1反应产物来进行酶抑制剂筛选。最后, 研究动力学参数(KMap)对该方法进行验证。Vanzolini等[70]将AChE固定于毛细管进口端形成固定化AChE微反应器, 底物与17种香豆素衍生物于ICER孵育特定时间后, 毛细管两段施加电压对未进行反应的底物和产物进行分离, 通过LC-IT-MS/MS检测产物进而监测AChE的反应情况。AChE-ICER的主要优点是酶活性恢复快和分析时间短。如果酶活性一旦减小或者失去活性, 可以用氯化钠溶液、盐酸溶液以及氢氧化钠溶液将毛细管冲洗10 min左右。
CE-MS联用技术筛选酶抑制剂在线研究酶反应动力学和抑制动力学, 仅需纳升体积的样品, 减小了试剂消耗量, 简化了测试步骤, 自动化程度高, 有望广泛应用于酶抑制剂的高通量筛选。
2.2.2 微流控芯片-质谱微流控技术将样品制备、反应、分离和检测等基本操作单元集成到微米尺寸芯片上, 进行全自动化分析在研究酶的动力学或寻找有效的酶抑制研究中。微流控芯片质谱技术将酶固定在微通道, 然后将底物注入到芯片反应位点, 并在连续流中进行反应。微流控技术筛选酶抑制剂具有耗样量低、分析速度快、成本低等优点[71, 72]。微流控芯片与MS联用综合了两种技术的优点, 解决了传统分析方法中的问题, 如效率、灵敏度和高通量等。Chip-MS界面广泛应用于各种生物研究和临床诊断中[73]。
de Boer等[74]将芯片的出口连接电喷雾质谱, 通过检测产物得出酶抑制参数。Iyer等[75]将凝血酶和因子Xa与底物注入芯片固定的位点, 蛇毒混合物经纳米液相色谱分离后注入芯片, 通过质谱检测器和荧光检测器联用鉴定和表征抑制剂。
近期, 芯片技术有较大突破, 例如在几秒内进行质谱检测的分离、多维分析、整合化学合成和分析的器件。然而, 微流控芯片技术仍然面临挑战, 特别是对于含量不丰富的成分, 需要进一步提高检测灵敏度。联合高分辨率质谱仪的开发可以在多维生化分析中开辟新的路线。这种综合多维分析系统有望成为一个关键技术[76]。鉴于最近的进展, 可以预见集成芯片的分析设备将成为酶抑制剂筛选的重要工具。
3 总结与展望以酶为靶标进行药物筛选是发现和寻找新药的重要环节之一。质谱以及相关技术的进步推动了通过寻找酶抑制剂来发现先导化合物的发展。质谱可提供酶活性信息、分析物质荷比信息、结构信息和抑制剂亲和力数据等, 并联合前沿亲和色谱、固定化酶磁珠法、表面等离子体共振技术、毛细管电泳和微流控芯片技术等技术最终实现快速筛选。质谱联用技术在酶抑制筛选领域发展迅速, 充分体现了各类技术和质谱的优势互补。将各类技术和质谱的强鉴别能力结合起来, 不仅减少了实验成本也节约了实验时间。虽然采用基于质谱的检测方案仍然存在基质效应影响定量以及部分离子源不耐盐等一些挑战。但相信随着酶抑制剂研究不断深入, 各类技术的不断革新, 质谱以及质谱联用技术强大的优势将成为通过酶抑制筛选新药最有前景的方法之一。
| [1] | Shanmuganathan M, Britz-McKibbin P. High quality drug screening by capillary electrophoresis: a review[J]. Anal Chim Acta, 2013, 773: 24–36. DOI:10.1016/j.aca.2013.01.061 |
| [2] | Rolland T, An MT, Charloteaux B, et al. A proteome-scale map of the human interactome network[J]. Cell, 2014, 159: 1212–1226. DOI:10.1016/j.cell.2014.10.050 |
| [3] | Santos R, Ursu O, Gaulton A, et al. A comprehensive map of molecular drug targets[J]. Nat Rev Drug Discov, 2016, 16: 19–34. |
| [4] | Bleicher KH, B hm H, Müller K, et al. A guide to drug discovery: Hit and lead generation: beyond high-throughput screening[J]. Nat Rev Drug Discov, 2003, 2: 369–378. DOI:10.1038/nrd1086 |
| [5] | Drews J. Drug discovery: a historical perspective[J]. Science, 2000, 287: 1960–1964. DOI:10.1126/science.287.5460.1960 |
| [6] | Wingfield J, Wilson ID. Advances in mass spectrometry within drug discovery[J]. J Biomol Screen, 2016, 21: 109–110. DOI:10.1177/1087057115623454 |
| [7] | Sun LN, Wu CY, Zhao SB, et al. Establishment of in vitro methods for evaluation of induction and inhibition of human CYP450 enzymes by drugs[J]. Acta Pharm Sin (药学学报), 2017, 12: 1924–1932. |
| [8] | He SF, Ju WZ, Hu HB, et al. Change of hepatic drug metabolism enzymes in rat depression model with kidney-yang deficiency[J]. Acta Pharm Sin (药学学报), 2017, 52: 258–263. |
| [9] | Zhou YM, Cui HQ, Yu XM, et al. Synthesis of benzimidazole and benzothiazole derivatives as a sirtuins 2 inhibitor[J]. Acta Pharm Sin (药学学报), 2017, 52: 773–778. |
| [10] | Li H, Han X, Li DW. Synthesis and anti-tumor activity of levofloxacin-thiadiazole histone deacetylase inhibitor conjugates[J]. Acta Pharm Sin (药学学报), 2017, 52: 582–591. |
| [11] | Copeland RA. Evaluation of Enzyme Inhibitors in Drug Discovery: a Guide for Medicinal Chemists and Pharmacologists[M]. 2nd Ed. Wiley-Interscience, 2013. |
| [12] | Vu H, Pham NB, Quinn RJ. Direct screening of natural product extracts using mass spectrometry[J]. J Biomol Screen, 2008, 13: 265–275. DOI:10.1177/1087057108315739 |
| [13] | Poulsen S, Davis RA, Keys TG. Screening a natural product-based combinatorial library using FTICR mass spectrometry[J]. Bioorg Med Chem, 2006, 14: 510–515. DOI:10.1016/j.bmc.2005.08.030 |
| [14] | Yang B, Feng YJ, Vu H, et al. Bioaffinity mass spectrometry screening[J]. J Biomol Screen, 2015, 21: 194–200. |
| [15] | Gong X. The Effect of Ligand on Protein Conformation: Insight From Ion Mobility Mass Spectrum (利用离子淌度质谱解析配体对蛋白质结构的影响)[D]. Nanjing: Nanjing University of Science & Technology, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10288-1017057135.htm |
| [16] | Zhu J, Yi X, Liu W, et al. Immobilized fusion protein affinity chromatography combined with HPLC-ESI-Q-TOF-MS/MS for rapid screening of PPARγ ligands from natural products[J]. Talanta, 2017, 165: 508–515. DOI:10.1016/j.talanta.2016.12.089 |
| [17] | Lan X. Study on Separation of Antihypertensive Peptides from Sauridaelongate by Magnetic Agrose Microspheres Immobilized Angiotensin Converting Enzyme (ACE) from Pig Lung (磁性琼脂糖微球固定化猪肺血管紧张素转化酶分离长蛇鲻降血压肽的研究) [D]. Nanning: Guangxi University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10593-1015436263.htm |
| [18] | Xu H, Liu M, Huang X, et al. A multiplexed quantitative MALDI MS approach for assessing activity and inhibition of protein kinases based on post-enrichment dephosphorylation of phosphopeptides by MOF-templated porous CeO2[J]. Anal Chem, 2018, 90: 9859–9867. DOI:10.1021/acs.analchem.8b01938 |
| [19] | Hu F, Zhang H, Lin H, et al. Enzyme inhibitor screening by electrospray mass spectrometry with immobilized enzyme on magnetic silica microspheres[J]. J Am Soc Mass Spectrom, 2008, 19: 865–873. DOI:10.1016/j.jasms.2008.02.016 |
| [20] | Schriemer DC, Bundle DR, Li L, et al. Micro-scale frontal affinity chromatography with mass spectrometric detection: a new method for the screening of compound libraries[J]. Angewandte Chem Inter Edit, 1998, 37: 3383–3387. DOI:10.1002/(ISSN)1521-3773 |
| [21] | Schriemer DC, Bundle DR, Li L, et al. Micro‐scale frontal affinity chromatography with mass spectrometric detection: a new method for the screening of compound libraries[J]. Angew Chem Int Ed, 1998, 37: 3383–3387. DOI:10.1002/(ISSN)1521-3773 |
| [22] | de Moraes MC, Temporini C, Calleri E, et al. Evaluation of capillary chromatographic supports for immobilized human purine nucleoside phosphorylase in frontal affinity chromatography studies[J]. J Chromatogr A, 2014, 1338: 77–84. DOI:10.1016/j.chroma.2014.02.057 |
| [23] | Yuan X, Hu D, Zhu W, et al. Application of frontal affinity chromatography combined on-line with mass spectrometry to screening PAI-1 inhibitors from traditional Chinese medicine[J]. Anal Methods, 2012, 4: 3744. DOI:10.1039/c2ay25696g |
| [24] | Calleri E, Temporini C, Caccialanza G, et al. Target-based drug discovery: the emerging success of frontal affinity chromatography coupled to mass spectrometry[J]. Chem Med Chem, 2009, 4: 905–916. DOI:10.1002/cmdc.v4:6 |
| [25] | Ng ESM, Yang F, Kameyama A, et al. High-throughput screening for enzyme inhibitors using frontal affinity chromatography with liquid chromatography and mass spectrometry[J]. Anal Chem, 2005, 77: 6125–6133. DOI:10.1021/ac051131r |
| [26] | Ng ESM, Chan NW, Lewis DF, et al. Frontal affinity chromatography-mass spectrometry[J]. Nat Protoc, 2007, 2: 1907–1917. DOI:10.1038/nprot.2007.262 |
| [27] | Wang T, Li D, Yu B, et al. Screening inhibitors of xanthine oxidase from natural products using enzyme immobilized magnetic beads by high-performance liquid chromatography coupled with tandem mass spectrometry[J]. J Sep Sci, 2017, 40: 1877–1886. DOI:10.1002/jssc.v40.9 |
| [28] | Cao J, Xu J, Liu X, et al. Screening of thrombin inhibitors from phenolic acids using enzyme-immobilized magnetic beads through direct covalent binding by ultrahigh-performance liquid chromatography coupled with quadrupole time-of-flight tandem mass spectrometry[J]. J Chromatogr A, 2016, 1468: 86–94. DOI:10.1016/j.chroma.2016.09.022 |
| [29] | Tao Y, Zhang Y, Cheng Y, et al. Rapid screening and identification of α-glucosidase inhibitors from mulberry leaves using enzyme-immobilized magnetic beads coupled with HPLC/MS and NMR[J]. Biomed Chromatogr, 2013, 27: 148–155. DOI:10.1002/bmc.v27.2 |
| [30] | Li Y, Xu J, Chen Y, et al. Screening of inhibitors of glycogen synthase kinase-3β from traditional Chinese medicines using enzyme-immobilized magnetic beads combined with high-performance liquid chromatography[J]. J Chromatogr A, 2015, 1425: 8–16. DOI:10.1016/j.chroma.2015.10.062 |
| [31] | Joshi S, Zuilhof H, van Beek TA, et al. Biochip spray: simplified coupling of surface plasmon resonance biosensing and mass spectrometry[J]. Anal Chem, 2017, 89: 1427–1432. DOI:10.1021/acs.analchem.6b04012 |
| [32] | Zhang Y, Li X, Nie H, et al. Interface for online coupling of surface plasmon resonance to direct analysis in real time mass spectrometry[J]. Anal Chem, 2015, 87: 6505–6509. DOI:10.1021/acs.analchem.5b01272 |
| [33] | Nedelkov D, Nelson RW. Surface plasmon resonance mass spectrometry: recent progress and outlooks[J]. Trends Biotechnol, 2003, 21: 301–305. DOI:10.1016/S0167-7799(03)00141-0 |
| [34] | Borch J, Roepstorff P. Screening for enzyme inhibitors by surface plasmon resonance combined with mass spectrometry[J]. Anal Chem, 2004, 76: 5243–5248. DOI:10.1021/ac049335f |
| [35] | Kim YE, Yi SY, Lee C, et al. Gold patterned biochips for on-chip immuno-MALDI-TOF MS: SPR imaging coupled multi-protein MS analysis[J]. Analyst, 2012, 137: 386–392. DOI:10.1039/C1AN15659D |
| [36] | Zhao H, Zhou S, Zhang M, et al. An in vitro AChE inhibition assay combined with UF-HPLC-ESI-Q-TOF/MS approach for screening and characterizing of AChE inhibitors from roots of coptis chinensis franch[J]. J Pharm Biomed, 2016, 120: 235–240. DOI:10.1016/j.jpba.2015.12.025 |
| [37] | Tao Y, Chen Z, Zhang YF. Characterization of α-amylase binding agents from hawthorn leaf using ultrafiltration and liquid chromatography tandem mass spectrometry[J]. Chin J Anal Chem (分析化学), 2013, 441: 229–234. |
| [38] | Choi Y, Jermihov K, Nam S, et al. Screening natural products for inhibitors of quinone reductase-2 using ultrafiltration LC-MS[J]. Anal Chem, 2011, 83: 1048–1052. DOI:10.1021/ac1028424 |
| [39] | Li B, Zong X, Zhang H, et al. Screening and structural characterization of MMP-2 inhibitor from Carthamus tinctorius L. using ultrafiltration liquid chromatography-mass spectrometry[J]. J Liq Chromatogr Relat Technol, 2014, 37: 2327–2336. DOI:10.1080/10826076.2013.830272 |
| [40] | Chen G, Tian Y, Guo M. Screening for inhibitors of topoisomerase Ⅰ from Lycoris radiata by combining ultrafiltration with liquid chromatography/mass spectrometry[J]. Rapid Commun Mass Spectrom, 2016, 30: 95–99. |
| [41] | Yang JR, Luo JG, Kong LY. Determination of α-glucosidase inhibitors from Scutellaria baicalensis using liquid chromatography with quadrupole time of flight tandem mass spectrometry coupled with centrifugal ultrafiltration[J]. Chin J Nat Med, 2015, 13: 208–214. |
| [42] | Wu S, Yang H, Li P. Application of the affinity ultrafiltration coupled with LC-MS technology in screening active components of traditional Chinese medicines[J]. Acta Pharm Sin (药学学报), 2016, 51: 1060–1067. |
| [43] | Takats Z, Wiseman JM, Gologan B, et al. Mass spectrometry sampling under ambient conditions with desorption electrospray ionization[J]. Science, 2004, 306: 471–473. DOI:10.1126/science.1104404 |
| [44] | Yao C, Na N, Huang L, et al. High-throughput detection of drugs binding to proteins using desorption electrospray ionization mass spectrometry[J]. Anal Chim Acta, 2013, 794: 60–66. DOI:10.1016/j.aca.2013.07.016 |
| [45] | Fryčák P, Hartmanová L, Lorencová I, et al. Screening of synthetic phosphodiesterase-5 inhibitors in herbal dietary supplements using transmission-mode desorption electrospray and high-resolution mass spectrometry[J]. J Mass Spectrom, 2016, 51: 358–362. DOI:10.1002/jms.3754 |
| [46] | Wang L, Liu S, Xing J, et al. Characterization of interaction property of multi-components in Gardenia jasminoides with aldose reductase by microdialysis combined with liquid chromatography coupled to mass spectrometry[J]. Rapid Commun Mass Spectrom, 2016, 30: 87–94. DOI:10.1002/rcm.7620 |
| [47] | Hopcroft PJ, Fisher DI. Development of a medium-throughput targeted LC MS assay to detect endogenous cellular levels of malonyl-CoA to screen fatty acid synthase inhibitors[J]. J Biomol Screen, 2015, 21: 111–116. |
| [48] | Yang H, Chan AL, LaVallo V, et al. Quantitation of alpha-glucosidase activity using fluorinated carbohydrate array and MALDI-TOF-MS[J]. Acs Appl Mater Inter, 2016, 8: 2872–2878. DOI:10.1021/acsami.5b12518 |
| [49] | Liu S, Xing J, Zheng Z, et al. Ultrahigh performance liquid chromatography-triple quadrupole mass spectrometry inhibitors fishing assay: a novel method for simultaneously screening of xanthine oxidase inhibitor and superoxide anion scavenger in a single analysis[J]. Anal Chim Acta, 2012, 715: 64–70. DOI:10.1016/j.aca.2011.12.003 |
| [50] | Song XS, Zhang J, Chen X, et al. Identification of DGAT2 inhibitors using mass spectrometry[J]. J Biomol Screen, 2015, 21: 117–126. |
| [51] | Haslam C, Hellicar J, Dunn A, et al. The Evolution of MALDI-TOF mass spectrometry toward ultra-high-throughput screening: 1536-Well Format and Beyond[J]. J Biomol Screen, 2015, 21: 176–186. |
| [52] | Cattaneo G, Ubiali D, Calleri E, et al. Development, validation and application of a 96-well enzymatic assay based on LC-ESI-MS/MS quantification for the screening of selective inhibitors against mycobacterium tuberculosis purine nucleoside phosphorylase[J]. Anal Chim Acta, 2016, 943: 89–97. DOI:10.1016/j.aca.2016.09.025 |
| [53] | Leveridge M, Collier L, Edge C, et al. A high-throughput screen to identify LRRK2 kinase inhibitors for the treatment of Parkinson's disease using rapid fire mass spectrometry[J]. J Biomol Screen, 2015, 21: 145–155. |
| [54] | Sun S, Kennedy RT. Droplet electrospray ionization mass spectrometry for high throughput screening for enzyme inhibitors[J]. Anal Chem, 2014, 86: 9309–9314. DOI:10.1021/ac502542z |
| [55] | Douxfils J, Pochet L, Lessire S, et al. Mass spectrometry in the therapeutic drug monitoring of direct oral anticoagulants. Useful or useless?[J]. Trends Anal Chem, 2016, 84: 41–50. DOI:10.1016/j.trac.2016.01.029 |
| [56] | Rohde G. Determination of rivaroxaban - a novel, oral, direct factor Xa inhibitor-in human plasma by high-performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 2008, 872: 43–50. DOI:10.1016/j.jchromb.2008.07.015 |
| [57] | Tao M, Zhang L, Guo Y. Dual-channel enzymatic inhibition measurement (DEIM) coupling isotope substrate via matrix-assisted laser desorption/ionization time of flight mass spectrometry[J]. J Am Soc Mass Spectr, 2018, 29: 2427–2435. DOI:10.1007/s13361-018-2054-3 |
| [58] | Ryu HW, Oh S, Curtis-Long MJ, et al. Rapid identification of cholinesterase inhibitors from the seedcases of mangosteen using an enzyme affinity assay[J]. J Agric Food Chem, 2014, 62: 1338–1343. DOI:10.1021/jf405072e |
| [59] | Cai T, Zhang L, Wang H, et al. Assisted inhibition effect of acetylcholinesterase with n-octylphosphonic acid and application in high sensitive detection of organophosphorous pesticides by matrix-assisted laser desorption/ionization Fourier transform mass spectrometry[J]. Anal Chim Acta, 2011, 706: 291–296. DOI:10.1016/j.aca.2011.08.035 |
| [60] | Musharraf SG, Bhatti MS, Choudhary MI, et al. Screening of inhibitors of angiotensin-converting enzyme (ACE) employing high performance liquid chromatography-electrospray ionization triple quadrupole mass spectrometry (HPLC-ESI-QqQ-MS)[J]. Eur J Pharm Sci, 2017, 101: 182–188. DOI:10.1016/j.ejps.2017.02.015 |
| [61] | Zhu L, Liu R, Liu T, et al. A novel strategy to screen inhibitors of multiple aminoglycoside-modifying enzymes with ultra-high performance liquid chromatography-quadrupole-time-of-flight mass spectrometry[J]. J Pharm Biomed, 2019, 164: 520–527. DOI:10.1016/j.jpba.2018.11.021 |
| [62] | Maher HM, Alzoman NZ, Shehata SM. Simultaneous determination of selected tyrosine kinase inhibitors with corticosteroids and antiemetics in rat plasma by solid phase extraction and ultra-performance liquid chromatography-tandem mass spectrometry: application to pharmacokinetic interaction studies[J]. J Pharm Biomed, 2016, 124: 216–227. DOI:10.1016/j.jpba.2016.03.013 |
| [63] | Lu H, Kopcho L, Ghosh K, et al. Development of a rapid fire mass spectrometry assay and a fluorescence assay for the discovery of kynurenine aminotransferase Ⅱ inhibitors to treat central nervous system disorders[J]. Anal Biochem, 2016, 501: 56–65. DOI:10.1016/j.ab.2016.02.003 |
| [64] | Xu Z, Liu R, Guan H. Dual-target inhibitor screening against thrombin and factor Xa simultaneously by mass spectrometry[J]. Anal Chim Acta, 2017, 990: 1–10. DOI:10.1016/j.aca.2017.07.063 |
| [65] | de Boer AR, Letzel T, van Elswijk DA, et al. On-line coupling of high-performance liquid chromatography to a continuous-flow enzyme assay based on electrospray ionization mass spectrometry[J]. Anal Chem, 2004, 76: 3155–3161. DOI:10.1021/ac035380w |
| [66] | Schejbal J, Slezáčková L, Řemínek R, et al. A capillary electrophoresis-mass spectrometry based method for the screening of β-secretase inhibitors as potential Alzheimer's disease therapeutics[J]. J Chromatogr A, 2017, 1487: 235–241. DOI:10.1016/j.chroma.2017.01.057 |
| [67] | Zhou ZG, Li M, Bai Y, et al. Recent developments in capillary electrophoresis-mass spectrometry[J]. Chin J Chromatogr (色谱), 2009, 27: 114. |
| [68] | Wang X, Dou Z, Yuan Y, et al. On-line screening of matrix metalloproteinase inhibitors by capillary electrophoresis coupled to ESI mass spectrometry[J]. J Chromatogr B, 2013, 930: 48–53. DOI:10.1016/j.jchromb.2013.04.038 |
| [69] | Vilela AFL, Cardoso CL. An on-flow assay for screening of β-secretase ligands by immobilised capillary reactor-mass spectrometry[J]. Anal Methods, 2017, 9: 2189–2196. DOI:10.1039/C7AY00284J |
| [70] | Vanzolini KL, Vieira LCC, Corrêa AG, et al. Acetylcholinesterase immobilized capillary reactors-tandem mass spectrometry: an on-flow tool for ligand screening[J]. J Med Chem, 2013, 56: 2038–2044. DOI:10.1021/jm301732a |
| [71] | Jian WS, Han LP, Chen ZG. Advances in enzyme inhibitor screening based on microfluidic technology[J]. Chem Res Appl (化学研究与应用), 2014, 12: 1825–1830. |
| [72] | Meller K, Szumski M, Buszewski B. Microfluidic reactors with immobilized enzymes-characterization, dividing, perspectives[J]. Sens Actuators B Chem, 2017, 244: 84–106. DOI:10.1016/j.snb.2016.12.021 |
| [73] | Feng X, Liu BF, Li J, et al. Advance in couping microfluidic chips to mass spectrometry[J]. Mass Spectrom Rev, 2015, 35: 535–557. |
| [74] | de Boer AR, Bruyneel B, Krabbe JG, et al. A microfluidic-based enzymatic assay for bioactivity screening combined with capillary liquid chromatography and mass spectrometry[J]. Lab Chip, 2005, 5: 1286. DOI:10.1039/b506559c |
| [75] | Iyer JK, Otvos RA, Kool J, et al. Microfluidic chip-based online screening coupled to mass spectrometry: identification of inhibitors of thrombin and factor Xa[J]. J Biomol Screen, 2015, 21: 212–220. |
| [76] | Ohla S, Belder D. Chip-based separation devices coupled to mass spectrometry[J]. Curr Opin Chem Biol, 2012, 16: 453–459. DOI:10.1016/j.cbpa.2012.05.180 |
 2019, Vol. 54
2019, Vol. 54


