2. 山西大学 化学化工学院, 山西 太原 030006;
3. 中国医学科学院药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China
中药配伍规律是中医辩证论治理论的具体体现和精髓, 探求复方配伍规律研究, 可在更高层次上认识复方配伍的科学内涵。随着化学分离技术的发展, 仅仅停留在中药饮片层次配伍的中药配伍研究已经不能满足中医药现代化发展的需求, 为了兼容“配伍艺术”与“精准药物”这两大核心, 王永炎和张伯礼院士[1]提出了以组分配伍研制现代中药的有效组分配伍研究新策略。中药有效组分[2]是指中药复方中具有相似化学性质或化学结构的对疾病具有治疗作用的一类或数类有效成分群, 中药有效组分配伍包括有效成分配伍和有效部位配伍两个层次, 本文从这两个层次出发, 探讨有效组分配伍剂量及配伍比例的变化所引起疗效甚至功效改变的“配伍艺术”, 为后续中药有效组分的配伍研究提供参考依据。
1 中药有效组分配伍模式君臣佐使、七情和合理论是中药复方配伍重要的配伍原则[3]。君臣佐使原则规定了复方中各配伍组分之间的关系; 七情和合理论则揭示相须相使配伍, 可以增强药效; 相畏相杀配伍, 能够减轻毒性, 而相须相使、相畏相杀配伍是中药复方配伍最常用的两种模式。借鉴中药复方配伍理论及结合组分配伍的现代研究, 中药有效组分配伍按照配伍对象的不同可分为以下几种形式。
1.1 源于中药经典复方的中药有效组分配伍中药复方因其复杂的化学成分, 使中药现代研究存在着作用机制难以解释、药效物质难以阐明的难点。将成分复杂且作用靶点复杂的复方研究由繁化简, 借助化学分离提取技术, 从中药复方中提取分离得到有效组分、无效组分及其他组分, 使中药复方配伍化简为中药复方有效组分之间的配伍, 这成为中药复杂作用机制研究的突破点、关键点。如赵宏宇等[4]对双参酮冠心片中3种有效组分(西洋参总皂苷、丹参总酚酸提取物、山楂叶提取物)进行配伍研究, 结果发现3种有效组分的配伍比例为1:1.5:1.5时治疗气虚血瘀型冠心病疗效最优, 初步找出双参酮冠心片治疗冠心病的药效物质基础, 为进一步阐述双参酮冠心片治疗心肌缺血的作用机制奠定基础。
1.2 源于经典药对的有效组分配伍目前, 针对药对配伍研究主要体现在中药药材-有效部位-有效成分配伍3个层次, 而有效部位、有效成分配伍更符合作用明确且成分相对清楚的“精准药对”配伍概念[5-7], 因此从经典药对中筛选有效组分并进行配伍研究成为揭示药对配伍机制科学内涵的重要手段。如Du等[8]基于代谢组学技术对治疗“百合病”的经典名方“知母百合汤”中核心药对—知母百合药对中有效部位(知母总皂苷、百合总皂苷)进行配伍研究, 结果显示, 与抑郁症相关的32种生物标志物中, 知母总皂苷、白芍总皂苷配伍组能显著性回调18种, 知母总皂苷、白芍总皂苷单用组仅各显著性回调2种和4种, 从代谢物的调节途径上阐述了知母总皂苷、白芍总皂苷配伍后的协同抗抑郁机制。
1.3 源于单一味药的有效组分配伍中药具有“天然组合化学库”的称号, 每味中药都可以看作是一个小复方, 而单味药中有效组分的组成和比例是固定的。单味药中有效组分组成或比例不同, 产生药理效应亦不同, 通过改变单味药中有效组分的比例以增强、扩展疗效可从中筛选出药效优良的现代新药。如许惠琴等[9]通过改变山茱萸中三萜酸、环烯醚萜苷和多糖3种有效组分的比例(1:2:2), 结果发现山茱萸中3种有效组分在此配比下具有保护血管内皮细胞, 防治糖尿病血管病变的作用, 其作用机制与抑制机体氧化应激有关; 丹参素和丹皮酚均来源于唇形科植物丹参中的有效单体成分, Chen等[10]对两者联合应用后发现, 丹参素与丹皮酚配伍后能通过降低氧化应激、改善血脂代谢来发挥对糖尿病肾病大鼠的保护作用。
1.4 根据药性理论发掘功效相似的中药有效组分配伍功效相似的中药药材在药性上也具有相同或相似的药性组合模式[11], 而药性理论是中药配伍理论的重要原则[12]。而对于中药有效组分的药性问题, 匡海学等[13]突破性提出“中药-味-气, 一药X味Y性(Y≤X)”的中药性味理论新假说, 阐明了中药性味的物质基础, 即中药(包括中药性味组分、性味拆分组分或化合物)同时具有性与味, 所以根据药性理论也可作为中药有效组分的配伍依据, 功效相似的中药有效组分也具有相同或相似的药性组合模式。针对某种疾病, 将药性或功效有某些共性的单味药中有效组分之间配伍能发挥增强药效的作用, 如赤灵芝的多糖类抗肿瘤活性组分和金菊花中三萜类抗肿瘤活性组分在一定程度上都可诱导人白血病HL-60细胞线粒体损伤和细胞凋亡, 将两者合用后其诱导作用明显增强[14]; 又如从钩藤中提取分离的钩藤总生物碱及从莱菔子中提取的莱菔子水溶性生物碱都具有抗高血压和保护血管的特性, 将两者配伍使用后其抗高血压作用和内皮血管保护作用显著提高[15]。
1.5 依据现代研究挖掘药理作用明确的标准物质间配伍中药因其化学成分及作用靶点的复杂性, 难以解释其作用机制, 使中药脱离了“精准药物”的范围, 这也成为制约中药国际化发展的瓶颈[16], 因此, 越来越多的医学科学家通过分离中药中单一化合物来试图突破这一发展瓶颈。而无论是单一化合物还是中药有效部位提取物, 都缺乏“配伍艺术”这一中药配方的重要核心[17], 为了兼容“精准药物”与“配伍艺术”这两大核心, 中药标准物质配伍成为中医药研究领域的热点。中药标准物质配伍, 是以中药药材中所含的药理作用明确的有效组分为基础, 将某些具有协同作用的标准物质进行配伍研究, 进而确定其最佳配伍比例[18]。如姜黄素是从姜科植物姜黄中提取得到的有效单体成分, 可抑制实验动物结肠癌细胞的增殖[19]; 印度蟾蜍皮肤衍生因子(BM-ANF1)是从蟾蜍等两栖动物的皮肤中提取的活性成分, 具有抗癌活性, 能诱导人白细胞HL-60细胞凋亡[20]。Giri等[21]发现, 两药具有协同作用, 两者配伍使用与单用相比能显著抑制结肠癌HCT-116细胞增殖。
2 中药配伍组分筛选方法中药复方的药效来源于其药效物质基础, 其疗效的发挥是复方内多种成分相互作用的结果, 而中药本身就是由多种成分组成的复杂化学成分库, 包括有效成分、无效成分、毒性成分和功能成分等, 如何从中药各配伍形式中筛选出有效组分进行配伍研究, 是中药有效组分配伍研究的基础也是整个配伍环节的关键点。
2.1 组分剔除法确定中药配伍有效组分组分剔除法[22]是借鉴基因敲除的思路, 通过从全方或单味药提取物中剔除某些组分, 判断其剩余组分的药效, 从而确定某个组分对方剂药效整体效应的影响, 进而确定有效组分。其具体设计思路如下:通过某些化学分离方法(如大孔吸附树脂法、色谱分离法等)对药效明确的中药复方提取物A分离得到n个组分, 分别为A1、A2、A3、……、An; 全方整体药效记为B, 从全方剔除组分A1的药效记为B1, 并以此类推, 通过方差分析等统计分析方法比较B与B1、B2、B3、……、Bn的药效差异, 根据预设的判据就可以评价复方提取组分中哪些组分为有效组分。如俞凌燕[23]在参麦方药效物质基础研究中, 借助组分剔除法以S180荷瘤小鼠肿瘤重量作为药效指标对肿瘤化疗起增效作用的参麦方的主要组分(人参二醇型皂苷、人参三醇型皂苷、麦冬多糖、麦冬皂苷)进行抗肿瘤有效组分筛选, 结果发现人参二醇型皂苷是参麦方对环磷酰胺化疗S180荷瘤小鼠抗肿瘤起增效作用的主要有效组分, 而麦冬皂苷是无效组分。人参二醇型皂苷、人参三醇型皂苷和麦冬多糖的配伍是参麦方组分对环磷酰胺化疗S180荷瘤小鼠起增效作用的有效配伍。
2.2 极性分段筛选配伍有效组分极性分段筛选设计[24]是通过归纳整方与单味药及其组分中物质的极性归属, 按照色谱分离方法等制备工艺分离得到各极性段并按照其功效组成来进行活性部位配伍的设计方法。如周玉枝等[25, 26]从逍遥散复方中根据极性不同分离得到7个不同极性部位, 从中得到石油醚部位及95%乙醇提取部位两个活性部位, 并对这两个活性部位进行配伍研究, 进一步阐明了逍遥散抗抑郁作用的药效物质基础。
2.3 根据与药效指标相关的成分谱筛选中药配伍组分中药活性成分不明确所引起的“黑箱问题”一直阻扰着中医药现代化发展, 如何从中药中发现这些活性成分, 如何去证实这些活性成分组合就是基于原中药复方挖掘出的可作为原复方的最好替代物, 成为中药发展的关键所在。而成分谱筛选就是将复方中各成分组合中的已知若干成分的“峰信号”与药效指标进行关联, 由此分析得出对药效指标影响较大的活性组分[7]。在从黄芪-山茱萸药对中筛选治疗糖尿病肾病的有效组分研究中, Duan等[27]创新性地运用了柱色谱分离技术和药效相关的成分谱筛选中药复方有效组分的方法, 即根据成分群中若干成分的“峰信号”与细胞实验中发生变化的“药效指标”进行Pearson相关分析, 由此得到与治疗该疾病密切相关的成分。
2.4 高通量筛选确定配伍有效组分针对中药成分复杂, 活性组分筛选困难的缺点, 杜冠华教授[28]提出了用高通量筛选技术发现中药活性成分, 再通过合理的配伍组合, 探讨中药的有效成分及有效配伍组合的筛选方法。高通量筛选[29]是以分子或细胞水平的药物筛选模型为基础, 结合药学、分子生物学和计算机科学等多种学科, 先快速分离获得复方中各种组分, 然后在96孔微板或更多孔微板上通过自动化操作技术及快速灵敏的检测手段进行实验筛选, 并运用计算机对数据结果进行分析研究, 具有快速、微量、自动化的特点, 大大加快了中药活性成分的发现及无效组分的剔除。如胡毅翔等[30]构建以肺部苦味受体TAS2R14为靶点的高通量筛选细胞模型对120种苦味中药提取物和单体化合物进行高通量筛选, 筛选得到柠檬苦素、芦丁和奎宁等3种单体成分具有潜在的TAS2R14受体激动活性, 可作为新型抗哮喘中药有效组分进行配伍研究。
2.5 PK/PD标志性成分(PK/PD markers)作为中药配伍候选组分PK/PD标志性成分[31]是指通过综合评价中药中所含成分的药代与药效动力学特征选择具有确切药理作用和适宜药代动力学特征的成分。而中药发挥药效作用的物质基础大多是在机体内具有适宜药代动力学特征的成分或其活性代谢物, 而对于药代配伍而言, 各配伍组分在体内吸收、分布、代谢、排泄等环节的相互作用, 可直接影响各组分的生物利用度等重要的药代动力学参数, 进而通过影响药效物质在体内的变化间接导致药理效应发生改变。因而, 通过PK/PD标志性成分进行中药组分配伍研究对于发现可代替原方的有效组分群具有重要意义。“葛根芩连汤”由葛根、黄连、黄芩、甘草4味中药组成, Qiao等[32]对“葛根芩连汤”中血浆暴露水平较高的42种成分进行药代动力学研究, 发现甘草可显著提高黄连中小檗碱的生物利用度, 其主要是受甘草中甘草酸的影响, 由此确定小檗碱、甘草酸为PK/PD标志性成分进行配伍研究。结果显示, 在血糖水平与胰岛素水平两个药效指标上, 甘草酸能显著增强小檗碱在2型糖尿病小鼠的抗糖尿病作用, 而单独使用甘草酸无显著抗糖尿病作用, 揭示甘草酸配伍小檗碱对增强“葛根芩连汤”抗糖尿病作用的体内过程机制。
2.6 借助网络药理学筛选可能的活性成分网络药理学是在系统生物学、多向药理学和网络分析学等学科的基础上提出的研究“药物-靶点-基因-疾病”关系的新方法、新策略, 具有整体性、系统性和动态性的特点, 这与中药多成分、多靶点、协同作用的原理不谋而合[33]。中药药效物质基础并不是中药中某一特定的活性成分, 其机制也不是作用于特定的某一靶点, 而是多个活性成分组成的有效成分群通过多靶点协同作用的结果, 其成分与成分间、成分与靶点间、靶点与靶点间存在着网状联系, 在网络药理学中通过构建“药物-成分-靶标-疾病”网络可对中药中药效物质成分进行功效预测, 而且, 已有众多应用网络药理学的方法预测中药潜在活性成分及作用靶点的研究, 借助网络药理学筛选可能的活性成分成为中药有效组分筛选的新思路[34-36]。如在“西黄方”治疗乳腺癌的作用机制研究中, Hao等[37]通过网络药理学方法预测“西黄方”中4种单味药(牛黄、麝香、乳香、没药)的成分-靶点网络图, 并得到“西黄方”治疗乳腺癌的2个关键靶点(ERα、HSP90), 根据这两个靶点与“西黄方”中主要成分的分子对接分数预测出影响这两个关键靶点的两类成分(没药中氟维司群类似物: 20α-hydroxy-4-pregnen-3-one、guggulsterol V、guggulsterol-I、guggulsterone M、guggulsterone; 乳香中五环三萜类成分: olibanumol I、acetyl-β-boswellic acid、acetyl-α-boswellic acid、β-boswellic acid), 推测这两类成分是“西黄方”抗乳腺癌的主要活性成分。
2.7 生物芯片技术筛选中药活性组分生物芯片技术筛选中药活性组分是利用药物靶点对中药组分进行高通量、快速筛选的高新技术, 包括基因芯片、蛋白芯片及芯片实验室3个研究方向[38]。具体方法是首先通过实验确证或文献调研得到具体作用靶标, 然后将相应的靶标蛋白、DNA、抗原、抗体以及细胞等生物活性材料以阵列方式固定于芯片上, 通过各中药组分是否与靶分子相互作用来筛选中药活性组分, 并借助高通量筛选实现对筛选药物的高通量、快速筛选。丹参被广泛用于治疗心血管系统疾病, 在其有效部位的研究中, Ren等[39]借助基因芯片技术, 研究丹参低极性部位、极性部位、总提取物对人脐静脉内皮细胞系(HUVEC)基因表达的影响, 结果表明丹参低极性部位能显著改变HUVCE细胞基因表达谱, 其对基因表达的影响显著大于另外两个部位, 并证明丹参低极性部位是丹参治疗血管异常增生疾病的主要有效部位。
2.8 生物色谱技术筛选中药活性组分生物色谱技术是基于细胞生物学、受体药理学、液相色谱学等学科, 以载体蛋白、受体、细胞膜等生物活性材料固定在固定相上, 利用待筛选物质与生物活性材料特异性结合原理筛选活性成分的新型色谱技术[40]。在中药活性成分筛选方面, 生物色谱技术将能与中药活性成分结合的生物活性材料作为固定相配基, 根据两者之间特异性结合的原理选择性保留活性成分, 排除无效成分, 从而实现筛选中药活性成分的目的[41]。如β1-肾上腺素受体拮抗剂已广泛用于心肌缺血、慢性心力衰竭的治疗, 在从吴茱萸中筛选潜在β1-肾上腺素受体拮抗剂的研究中, Xue等[42]结合β1-肾上腺素受体-细胞膜色谱与超高液相色谱-质谱技术筛选得到吴茱萸次碱和吴茱萸碱两个潜在β1-肾上腺素受体拮抗剂, 并通过体内外药理实验证实两者具有心肌缺血/再灌注损伤的药理活性。
3 配伍组分剂量的选择“汉方不传之秘在于量”, 配伍组分剂量的改变对临床疗效的影响较为显著, 甚至会产生截然相反的效果。如在黄芪调节血压作用的研究中, 小剂量黄芪(15 g以下)能升高血压, 而大剂量黄芪(35 g以上)反而具有降血压的作用[43]。因此在中药有效组分配伍的研究中, 先确定各组分适宜的剂量范围, 可为后续通过实验设计等方法对配伍比例进行合理配置提供剂量依据。
3.1 根据组分的浸膏率及所在原方的比例确定配伍剂量在“单味药-药对-复方”3个层次的配伍研究中, 其有效组分在此配伍环境的含量、比例是一定的, 根据有效组分在该药材的浸膏率及该药材的用量经验、该药材在复方中的用量, 即可推算出该有效组分在此配伍环境的用量。以此用量作为有效组分的配伍剂量可较全面地代表原方的配伍环境。如庞汗青等[44]在丹参不同有效部位配伍活血化瘀作用的研究中, 分别得到丹参总酚酸提取物、丹参总酮提取物和丹参提取物的浸膏率, 并根据丹参的用药经验折算出给予大鼠的生药给药量, 由此初步得出各有效部位的用药剂量, 为后续各有效部位的配比研究提供剂量范围。
3.2 根据量效关系确定各组分的配伍剂量目前, 量效关系研究是中药有效组分配伍剂量相关研究中最基本、最常见的有效手段。根据量效关系, 可建立有效组分对何种疾病有什么效应, 以及在多大的剂量下显示这种效应, 最终能确定有效组分的剂量范围, 为后续有效组分的配伍提供剂量依据。如刘天竹等[45]在东北天南星治疗肺癌有效组分(总生物碱、总黄酮、总多糖)配伍优化研究中, 通过MTT法检测各组分对人非小细胞肺癌细胞株Calu-1抑制率来考察各个组分的量效关系, 以各个组分的半数抑制浓度(IC50)作为各组分的中剂量给药量, 以此浓度递增、递减设计7个给药浓度水平数, 并运用均匀设计的实验设计方法分配配伍比例, 成功筛选出抗肺癌有效组分的最佳配伍组合, 证实了依据量效关系确定各组分配伍剂量的可靠性。
4 中药组分配比实验设计方法中药各组分用量和配伍比例是影响方剂疗效的两个重要因素, 中药组分配比研究是中药新复方研究的基础[46]。方剂中各药材配伍比例的变化常引起方剂主治功能发生变化, 如具“解肌发表, 调和营卫”之功效的桂枝汤、具“温脾和中, 缓急止痛”之功效的桂枝加芍药汤及主治“奔豚”的桂枝加桂汤, 这3味方剂都是由桂枝、芍药、炙甘草、生姜和大枣5味药材组成, 因各自的配伍比例不同所发挥的主治功效也截然不同[47]。所以, 确定配伍组分、配伍用量及配伍比例是方剂配伍研究的重要过程。目前针对有效部位配伍、有效成分配伍常用的实验设计方法有:正交设计、均匀设计、基线等比增减设计、正交均匀联合设计和正交T值法等。
4.1 正交设计正交设计[48]是一种通过正交试验表来设计多因素少水平试验的设计方法。正交设计能消除因素效应、交互效应等各种效应之间的相关性, 使各种效应对观测指标的影响具有整齐可比性。正交设计还可使各实验点在所设计的实验范围内均匀分散, 用尽量少的实验点反映整体实验的全面分布状况, 适用于各因素的水平数不多、范围不大的中药多组分之间的配比研究。如Li等[49]基于正交设计对生脉散中3种活性成分(人参皂苷Rb1、鲁斯可皂苷元、五味子素)抗心肌缺血作用进行配比研究, 筛选获得生脉散3种活性成分最佳配伍比例, 结果发现3种有效成分配伍疗效与生脉散全方疗效相当。章文红等[50]采用正交设计研究麻杏薏甘汤中薏苡仁、炙甘草、麻黄与杏仁配伍对苦杏仁苷含量的影响, 结果发现甘草能降低复方中苦杏仁苷的含量, 麻黄则能增加复方中苦杏仁苷的含量。
4.2 均匀设计均匀设计[51]是一种通过均匀设计表来设计多因素多水平试验的设计方法。与正交设计相比, 均匀设计抛弃了正交设计所具有的整齐可比性, 保留其均匀分散性, 使各实验点在所设计的实验范围内均匀分散。对于因素水平的选择, 均匀设计需遵循水平数大于因素数2倍的设计原则, 而对于各因素的水平数选择, 可根据配伍药材药效强弱相应的增加或减少各配伍药材的水平数。所以, 均匀设计最显著的特点是实验次数等于所有实验因素的最大水平数, 能最大程度地降低实验次数, 适用于多因素多水平的中药多复方之间的配伍研究。如Wu等[52]利用均匀设计法对治疗偏头疼的经典复方“吴茱萸汤”中4种与药效学指标成正相关的有效成分(人参皂苷-Rg1、人参皂苷-Rb1、吴茱萸碱、吴茱萸次碱)进行治疗小鼠偏头痛的有效成分配伍研究, 结果发现人参皂苷-Rb1和吴茱萸碱可能在改善小鼠偏头痛的治疗效果中起关键作用, 而人参皂苷-Rg1、吴茱萸次碱对药效学指标贡献较小; 又如Tong等[53]基于均匀设计研究黄芩汤活性组分(黄芪总皂苷、黄芪总黄酮、甘草酸、甘草总黄酮)抗肝纤维化配伍作用中, 根据羟脯氨酸含量和谷丙转氨酶活性2个药效指标并采用逐步回归法分析其最优配比组合, 结果发现黄芩总黄酮、甘草总黄酮没有在最优配比组合中出现, 揭示中药有效组分之间有增效或拮抗的可能。所以, 中药有效组分配伍并不是将药效组分简单组合、随意配比。
4.3 基线等比增减设计基线等比增减设计[54]是针对效应明确的2种中药组分之间的配比研究的实验设计方法, 设计原则是在总量恒定的前提下, 参与配伍的2种药物(如君药、臣药)以药典记载的配伍比例为基线, 其他实验点在基线两边均匀排列, 直至达到二者配伍的极限。如A、B两种药物配伍, 药物A以10%~30%递增, 药物B以10%~30%递减, 直至达到2种药物配伍的极限, 极限通常为单纯A药, 反之亦然。基线等比增减设计适用于效应明确的2种组分之间中药小复方配比研究。如盛艳梅等[55]在筛选黄芪多糖、黄芪皂苷免疫调节最佳配比中, 应用基线等比增减设计法设计黄芪多糖、黄芪皂苷配伍研究的5个配伍比例(10:0、4:1、3:2、1:4、0:10), 检测不同配比组合对小鼠血清中TNF-α含量、脾脏指数、胸腺指数的影响, 最后优选出黄芪多糖、黄芪皂苷最佳配伍比例为4:1;范冰冰等[56]在寻找麸煨木香的止泻作用物质基础中, 采用基线等比增减设计拟定木香烃内酯和去氢木香内酯之间11个组合配比, 结果发现木香烃内酯和去氢木香内酯配伍后抗腹泻作用明显优于单品, 且存在最佳配比。
4.4 正交均匀联合设计均匀设计相对于正交设计而言, 其最显著的特点是实验次数等于所有实验因素的最大水平数, 能最大程度地降低实验次数, 但是均匀设计的数据结果却必须借助专门的计算机分析软件对实验数据进行分析, 不能像正交设计一样可以对数据结果进行直观的分析; 而对于正交设计虽然能从很大程度上反映整体实验的全面分布状态, 但因其实验次数至少是各实验因素水平数的平方的特点, 过多的实验次数也从一定程度上限制了正交试验的应用。正交均匀联合设计[57]结合正交设计及均匀设计各自的特点, 使两种实验设计的优点充分发挥, 即能最大程度上减少实验次数, 又可以对实验结果全面直观的分析。正交均匀联合设计的实验步骤是先用均匀设计对多因素多水平的实验数据进行初筛, 对得到的相对优化的实验组合用相应大小的正交设计进行细筛, 最后用方差分析等对实验结果进行简单直观分析, 最终优选出最佳实验组合。唐春红等[58]通过实验验证了此方法在中药有效组分配伍应用的可行性。
4.5 正交T值法传统的正交试验通常使用方差分析及F值检验分析数据结果, 计算较为繁杂。为了简化分析数据, 优化实验设计, 孙卫民等[59]根据正交试验的设计原理及F值与T值的关系提出了“正交T值法”。实验设计步骤如下: ①主药分析的正交T值法—找出作用显著的主因素, 确定主药; ②辅药交互作用的正交T值法—以主药分析得到的作用效果显著的主因素为基础, 着重研究其他因素与主因素及相互之间的交互作用, 确定辅药; ③剂量选择的正交T值法—确定各因素的最佳配伍剂量。正交T值法改进了传统正交表中各因素之间交互作用的表达形式, 使之便于分析两配伍组分之间是协同作用还是相互拮抗, 适用于中药大复方中各药材的配比研究。如在治疗急性痛风性关节炎中药有效组分复方配伍研究中, 路占忠等[60]应用正交T值法优化白芍总苷、三七总皂苷、青藤碱、雷公藤多苷及人参皂苷5种中药有效组分配伍组合, 并由此得出白芍总苷、三七总皂苷、青藤碱在5种中药有效组分组合复方中发挥主导抗炎作用。
5 中药配伍组分配比优化研究中药组分配伍比例不同, 疗效甚至功效也会随之改变, 其潜在机制是配伍通过影响有效成分、有毒物质溶出率及其体内过程的变化来影响药效[61, 62], 因此, 配伍前后药效的变化规律可作为中药配伍组分最优配伍比例最直接的筛选依据。
5.1 基于复方配伍单个药效指标筛选最优配比目前, 针对单个药效指标筛选复方最优配比对分析方法可概括为两类[63]:直观分析及回归建模进行单目标优化。直观分析法是无需任何处理, 直接从实验数据结果中判断出最优组合的方法, 常用于正交设计、基线等比增减设计等具有“整齐可比”特点的实验设计中; 回归建模进行单目标优化, 是根据复方配伍比例及相应的药效指标之间的关系建立回归方程, 根据回归方程对单一药效指标进行优化, 最终预测出最优配比的实验方法, 而均匀设计、计算机直接实验设计因为不具备“整齐可比”特点, 不能用直接分析法直接判断出最优配比, 所以只能运用回归建模的方法分析数据。如黄丽萍等[64]基于均匀设计筛选“麻杏石甘汤”有效成分舒张离体器官平滑肌活性的最优配比研究中, 以“麻杏石甘汤”中3种有效成分(麻黄碱、苦杏仁苷、甘草酸)对乙酰胆碱诱发的豚鼠离体器官环收缩抑制率为药效指标, 通过建立多元线性逐步回归方程进行单目标优化, 根据回归方程预测其最优配伍组合, 并通过3次平行实验验证了预测结果的可靠性。
5.2 基于复方配伍多药效指标筛选最优配比中药复方因其化学成分的复杂性而引起作用靶点、药效指标的多样性, 杜冠华等[65]提出中药复方发挥作用的作用机制实际上是两个复杂系统之间的相互作用, 即药本身所含的有效物质之间组成复杂的物质系统与病理条件下中药复方作用靶点之间组成的复杂生物系统的相互作用而达到治疗疾病的作用。所以, 中药复方最大的优势就是通过多种有效物质之间相互组合、相互协同, 通过作用于多个靶点发挥多个药效来产生治病、防病的效果。因此, 对于复方剂量配比优化研究, 需从多药效指标出发, 整体全面地分析所能发挥最大药效指标的最优配比。针对多药效指标配比研究的具体方法有:模糊靶标识别法、综合权重法和ED-NM-MO三联法。
5.2.1 模糊靶标识别法根据中药“多成分、多靶点”且靶点高度关联的特点, Duan等[66]建立了针对中药“成分、多靶点”的模糊靶标识别法, 借鉴代谢组学常用的主成分分析(PCA)、偏最小二乘判别分析法(PLS-DA)等多维统计方法, 首先通过PCA法得到能反映尽可能多的药效指标整体效应的几个主成分, 以达到降维的目的, 再依据不同配比的“多成分”对这几个主成分的总贡献率筛选出最优配伍组合。以黄芪-山茱萸配伍治疗糖尿病肾病为例, 优化步骤如下: ①从配伍药材中分离多个有效组分—作为中药“多成分”; ②文献搜索总结能反映糖尿病肾病的多种致病指标, 包括其发病机制靶点—作为中药“多靶点”; ③对多种配伍组合进行药效学考察, 获得“多成分”治疗“多靶点”的数据结果; ④对各药效指标进行主成分分析, 找出能反映整体药效指标的几个主成分, 并进行PLS-DA分析; ⑤依据PLS-DA得分图中各配伍组与正常对照组之间的相对距离量化每个目标的总贡献, 最终确定最优配伍组合。
5.2.2 综合权重法中药多靶点的作用特点, 使中药有多个药效指标, 包括核心指标、重要指标及相关指标, 各药效指标对实验结果的影响程度有或轻或重的差异, 为了权衡各个药效指标对实验结果的影响, 马瑞娟等[67]建立了用综合权重法进行多目标优化的方法。综合权重法具体思路:根据所得的药效指标, 依据专家评估及对各个药效指标的不同要求, 确定核心指标、重要指标、相关指标及各个药效指标的权重系数, 然后用相应的数学公式计算出各配比组的综合权重评价分值及总分值范围, 由此评估所有药效指标的综合效应, 找出能使所有药效指标达到相对最优的最佳配比。如杨鸿等[68]基于LARS回归算法和综合权重系数法研究具有抗氧化作用的4种中药组分(甘草总黄酮、大戟花总黄酮、黄芪总苷、银杏叶提取物)清除体内DPPH和多环芳烃能力的最佳配比的研究中, 通过对以上2个药效指标进行权重分析, 整合成能反映2个抗氧化指标整体效益的综合指标, 根据最优综合指标确定4种中药组分的最优配比。
5.2.3 ED-NM-MO三联法ED-NM-MO三联法是王睿等[69]针对中药复方“多成分、多靶点、非线性”的特点提出运用实验设计(ED)、非线性建模(NM)和多目标优化(MO)三个相关联的过程对中药复方配伍研究进行多目标优化。以丹参-三七配伍研究为例[70]研究过程分三步: ① ED:基线等比增减设计确定丹参、三七不同配比; ② NM:对复方配比与所得的各药效学数据之间复杂的非线性关系建立数学模型; ③ MO:对第二步得到的丹参-三七配比与各药效间的数学模型, 用求Pareto最优解的思路得到针对多个药效的Pareto最优解集, 并采用归一化加权法对各药效指标进行加权处理, 根据权重结果得Pareto最优解集中的最优解, 从而确定丹参-三七的最优配比。
6 小结综上所述, 有效组分配伍既有传统配伍整体观与辩证论治的特点, 又有精准医学体系下药效物质明确、靶点相对清楚的优势, 其“配伍艺术”与“精准药物”相结合的巨大潜力, 必将成为中医药现代化研究的关键点、突破点。注重加强对中药有效组分的配伍研究, 有利于提高主效应, 减弱毒副效应, 对强化临床疗效、提高中药制剂工艺及质量标准水平具有深远的影响, 本文系统地阐述了有效组分配伍研究中的几个关键性问题(图 1), 为后续有效组分的配伍机制研究提供参考。
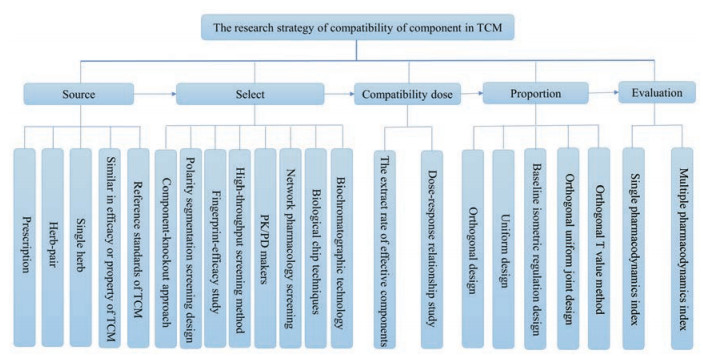
|
Figure 1 Summary of the research strategy of compatibility of component in traditional Chinese medicine (TCM) |
| [1] | Zhang BL, Wang YY. Basic research on key scientific problems of prescription-developing modern traditional Chinese medicine by compatibility of effective components[J]. Chin J Nat Med (中国天然药物), 2005, 3: 258–261. |
| [2] | Liu LM, Chen X, Yue GX, et al. Some thoughts on definition of "Chinese materia medica components"[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 2489–2495. |
| [3] | Shang HC, Zhang BL, Gao XM. Study on compatibility of prescription[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2002, 9: 6–9. |
| [4] | Zhao HY, Zhang CL, Liu XY, et al. Study on the proportion of active ingredients in drug combination of "Suang-Huang-Tong-Guang-Xin-Pian"[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2018, 29: 45–48. |
| [5] | Zhou MM, Hong YL, Lin X, et al. Recent pharmaceutical evidence on the compatibility rationality of traditional Chinese medicine[J]. J Ethnopharmacol, 2017, 206: 363–375. DOI:10.1016/j.jep.2017.06.007 |
| [6] | Zhang Y, Wu XD, Yang Y. Role of traditional compatibility and components compatibility under the background of precision medicine[J]. Acta Chin Med Pharmacol (中医药学报), 2018, 46: 7–10. |
| [7] | Duan Y, Pei K, Cai H, et al. A new strategy for exploring herb-pair investigation with a case study on Astragali Radix-Corni Fructus in treatment of diabetic nephropathy[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 3919–3926. |
| [8] | Du H, Wang K, Su L, et al. Metabonomic identification of the effects of the Zhimu-Baihe saponins on a chronic unpredictable mild stress-induced rat model of depression[J]. J Pharm Biomed Anal, 2016, 128: 469–479. DOI:10.1016/j.jpba.2016.06.019 |
| [9] | Xu HQ, Nong WH, Liu CD, et al. The effect of the best compatibility of components in Fruetus Corni of protecting the oxidative damage of vascular endothelial cells cultured in high glucose medium[J]. Chin Pharmacol Bull (中国药理学通报), 2011, 27: 1077–1080. |
| [10] | Chen Y, Liu Z, Zhou F, et al. Evaluating pharmacological effects of two major components of Shuangdan oral liquid:role of Danshensu and Paeonol in diabetic nephropathy rat[J]. Biomol Ther (Seoul), 2016, 24: 536–542. DOI:10.4062/biomolther.2015.191 |
| [11] | Sue J, Zhang BX, Yan SR, et al. Study on self-similarity of property combination mode of traditional Chinese medicines[J]. Chin J Chin Mater Med (中国中药杂志), 2014, 39: 2378–2381. |
| [12] | Sue J, Zhang YL, Gu H, et al. Theoretical model for compatibility of medicinal property combination of traditional Chinese medicines[J]. Chin J Chin Mater Med (中国中药杂志), 2015, 40: 3327–3330. |
| [13] | Kuang HX, Cheng W. Studies on the capability of properties and flavors of Chinese medicine to be split and combined-a new assumption on the theory of properties and flavors of Chinese medicine and the research method[J]. World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术:中医药现代化), 2009, 11: 768–771. |
| [14] | Kim KC, Kim JS, Son JK, et al. Enhanced induction of mitochondrial damage and apoptosis in human leukemia HL-60 cells by the Ganoderma lucidum and Duchesnea chrysantha extracts[J]. Cancer Lett, 2007, 246: 210–217. DOI:10.1016/j.canlet.2006.02.014 |
| [15] | Li Y, Yang W, Zhu Q, et al. Protective effects on vascular endothelial cell in N'-nitro-L-arginine (L-NNA)-induced hypertensive rats from the combination of effective components of Uncaria rhynchophylla and Semen Raphani[J]. Biosci Trends, 2015, 9: 237–244. DOI:10.5582/bst.2015.01087 |
| [16] | Liu CX. Reflections on TCM modernization and TCM international development[J]. China Pharm (中国药房), 2016, 27: 1441–1444. |
| [17] | Wang S, Hu Y, Tan W, et al. Compatibility art of traditional Chinese medicine:from the perspective of herb pairs[J]. J Ethnopharmacol, 2012, 143: 412–423. DOI:10.1016/j.jep.2012.07.033 |
| [18] | Sheng HG. Progress on model of component formula in Chinese medicine[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 349–352. |
| [19] | Rao CV, Rivenson A, Simi B, et al. Chemoprevention of colon carcinogenesis by dietary curcumin, a naturally occurring plant phenolic compound[J]. Cancer Res, 1995, 55: 259–266. |
| [20] | Jing Y, Ohizumi H, Kawazoe N, et al. Selective inhibitory effect of bufalin on growth of human tumor cells in vitro:association with the induction of apoptosis in leukemia HL-60 cells[J]. Jpn J Cancer Res, 1994, 85: 645–651. DOI:10.1111/cas.1994.85.issue-6 |
| [21] | Giri B, Gomes AR, Sengupta R, et al. Curcumin synergizes the growth inhibitory properties of Indian toad (Bufo melanostictus Schneider) skin-derived factor (BM-ANF1) in HCT-116 colon cancer cells[J]. Anticancer Res, 2009, 29: 395–401. |
| [22] | Yu LY, Wang Y, Fan XH, et al. Discovering active components from traditional Chinese medicine by component-knockout approach[J]. Chin J Chin Mater Med (中国中药杂志), 2009, 34: 336–339. |
| [23] | Yu LY. Study on Effective Substances in Shenmai Formula (参麦方药效物质基础研究)[D]. Hangzhou: Zhejiang University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10335-2010071940.htm |
| [24] | Wu X, Liao HB, Zhu XH, et al. The screening of active component with antineoplastic activity in vitro from the seeds of Amorpha fruticosa[J]. J Pharm Res (药学研究), 2016, 35: 449–452. |
| [25] | Zhou Y, Ren Y, Ma Z, et al. Identification and quantification of the major volatile constituents in antidepressant active fraction of Xiaoyaosan by gas chromatography-mass spectrometry[J]. J Ethnopharmacol, 2012, 141: 187–192. DOI:10.1016/j.jep.2012.02.018 |
| [26] | Ren YL, Jia GC, Ma ZJ, et al. Screening of antidepressant fractions from Xiaoyaosan[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2012, 23: 2689–2691. |
| [27] | Duan Y, Pei K, Cai H, et al. Bioactivity evaluation-based ultra high-performance liquid chromatography coupled with electrospray ionization tandem quadrupole-time-of-flight mass spectrometry and novel distinction of multi-subchemome compatibility recognition strategy with Astragali Radix-Fructus Corni herb-pair as a case study[J]. J Pharm Biomed Anal, 2016, 129: 514–534. DOI:10.1016/j.jpba.2016.07.043 |
| [28] | Du GH. Modern drug screening techniques approach on CMM[J]. World Sci Technol-Mod Tradit Chin Med (世界科学技术-中医药现代化), 2000, 2: 47–52. |
| [29] | Snowden M, Green DV. The impact of diversity-based, high-throughput screening on drug discovery:" chance favours the prepared mind"[J]. Curr Opin Drug Discov Dev, 2008, 11: 553–558. |
| [30] | Hu YX, Cai W, Zhang HH, et al. Establishment and application of screening model for anti-asthmatic natural active ingredients based on bitter taste receptors in lung tissue[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 775–780. |
| [31] | Hao HP, Zheng CN, Wang GJ. Thoughts and experimental exploration on pharmacokinetic study of herbal medicines with multiple-components and targets[J]. Acta Pharm Sin (药学学报), 2009, 44: 270–275. |
| [32] | Qiao X, Wang Q, Wang S, et al. A 42-markers pharmacokinetic study reveals interactions of berberine and glycyrrhizic acid in the anti-diabetic Chinese medicine formula Gegen-Qinlian decoction[J]. Front Pharmacol, 2018, 9: 622. DOI:10.3389/fphar.2018.00622 |
| [33] | Liu ZH, Sun XB. Network pharmacology:new opportunity for the modernization of traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2012, 47: 696–703. |
| [34] | Liu AL, Du GH. Network pharmacology:new guidelines for drug discovery[J]. Acta Pharm Sin (药学学报), 2010, 45: 1472–1477. |
| [35] | Yue SJ, Xin LT, Fan YC, et al. Herb pair Danggui-Honghua:mechanisms underlying blood stasis syndrome by system pharmacology approach[J]. Sci Rep, 2017, 7: 40318. DOI:10.1038/srep40318 |
| [36] | Zhao L, Wu YF, Gao Y, et al. Intervention mechanism of psychological sub-health by Baihe Dihuang Tang based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2017, 52: 99–105. |
| [37] | Hao J, Jin Z, Zhu H, et al. Antiestrogenic activity of the Xi-Huang formula for breast cancer by targeting the estrogen receptor α[J]. Cell Physiol Biochem, 2018, 47: 2199–2215. DOI:10.1159/000491533 |
| [38] | Zhai JP, Deng YY, Lang AD. Research advances in application of biochip in traditional Chinese medicine[J]. Pharm Biotechnol (药物生物技术), 2013, 20: 72–75. |
| [39] | Ren G, Fan X, Liang Q, et al. Screening and evaluation of traditional Chinese medicine by microarray expression analysis[J]. J Ethnopharmacol, 2013, 147: 564–569. DOI:10.1016/j.jep.2013.03.020 |
| [40] | Zhou SW, Qiu RQ, Gao CF, et al. Application of biochromatography in screening the bioactive components from traditional Chinese medicine[J]. Chin J Pharm (中国医药工业杂志), 2017, 48: 1692–1697. |
| [41] | Yang YX, Li SY, Zhang Q, et al. Applications of immobilization techniques in the screening of active constituents from traditional Chinese medicines[J]. Acta Pharm Sin (药学学报), 2017, 52: 198–205. |
| [42] | Xue H, Cheng Y, Wang X, et al. Rutaecarpine and evodiamine selected as β1-AR inhibitor candidates using β1-AR/CMC-offline-UPLC/MS prevent cardiac ischemia-reperfusion injury via energy modulation[J]. J Pharm Biomed Anal, 2015, 115: 307–314. DOI:10.1016/j.jpba.2015.07.022 |
| [43] | Tong XL, Wu YC, Ji HY, et al. Reestablishement of herbal dosage for classic formulae[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2009, 43: 1–4. |
| [44] | Pang HQ, Tang YP, Shi XQ, et al. Comparison on promoting blood effects of different effective parts of Salvia miltiorrhiza by principal component analysis and multi-attribute comprehensive index methods[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 3239–3247. |
| [45] | Liu TZ, Wang S, Li TJ, et al. Study on the efficacy components compatibility optimization of Arisaema amurense Maxim treating lung cancer based on uniform design[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2017, 29: 237–239. |
| [46] | Miao JX, Miao MS. Research status, problems and thinking of multi-component of Chinese medicine[J]. China J Chin Med (中医学报), 2012, 27: 1116–1119. |
| [47] | Zhou M, Hong YL, Lin X, et al. Recent pharmaceutical evidence on the compatibility rationality of traditional Chinese medicine[J]. J Ethnopharmacol, 2017, 206: 363–375. DOI:10.1016/j.jep.2017.06.007 |
| [48] | Zhu GQ, Teng HY, Huang P. Application of orthogonal experimental design method in medicine[J]. J Math Med (数理医药学杂志), 2007, 20: 568–569. |
| [49] | Li F, Fan XX, Chu C, et al. A strategy for optimizing the combination of active components based on Chinese medicinal formula Sheng-Mai-San for myocardial ischemia[J]. Cell Physiol Biochem, 2018, 45: 1455–1471. DOI:10.1159/000487572 |
| [50] | Zhang WH, Wang BH, Zhang XF, et al. Effect of compatibility of traditional Chinese medicine on the content of amygdalin in "Ma-Xing-Yi-Gan-Tang"[J]. Chin J Tradit Med Sci Technol (中国中医药科技), 2014, 21: 406–407. |
| [51] | Xu WJ, Zhou HH, Chen SD. Uniform design research on complex prescription of Chinese medicine[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2010, 16: 236–239. |
| [52] | Wu Y, Pan X, Xu Y, et al. Optimization of combinations of ginsenoside-Rg1, ginsenoside-Rb1, evodiamine and rutaecarpine for effective therapy of mouse migraine[J]. J Nat Med, 2016, 70: 207–216. DOI:10.1007/s11418-015-0960-2 |
| [53] | Tong X, Chen GF, Lu Y, et al. Uniform designed research on the active ingredients assembling of huangqi decoction for inhibition of DMN-induced liver fibrosis[J]. Chin J Integr Tradit West Med (中国中西医结合杂志), 2011, 31: 1389–1393. |
| [54] | Shang HC, Zhang BL, Wang YY, et al. A method for proportion screening of TCM small prescriptions[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2003, 9: 1–3. |
| [55] | Sheng YM, Chen L, Xie XL. Optimization of the best ratio of Astragalus polysaccharide and Astragalus saponin for immunomodulation based on increase-decrease baseline geometric proportion design method[J]. Chin J Hosp Pharm (中国医院药学杂志), 2016, 36: 59–62. |
| [56] | Fan BB, Zhao XM, Guo YH, et al. Optimization of the best ratio of Radix aucklandiae active monomer against diarrhea based on increase-decrease baseline geometric proportion design method[J]. Guide Chin Med (中国医药指南), 2017, 15: 14–15. |
| [57] | Tang CH, Cai SX. Application of the combined use of uniform experimental design and orthogonal experimental design in biomedicial engineering[J]. J Biomed Eng (生物医学工程学杂志), 2006, 23: 1228–1231. |
| [58] | Tang CH, Cai SX, Wang BC. Optimization of the best ratio of Ginkgo formulae based on combining uniform design with orthogonal design[J]. Chin Tradit Herb Drugs (中草药), 2005, 36: 63–64. |
| [59] | Sun WM, Sun RY. The orthogonal T value method for the study of traditional Chinese medicine prescriptions[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 1992, 8: 41–45. |
| [60] | Lu ZZ, Li ZB, Ma X, et al. Compound optimization of effective components of traditional Chinese medicine in treatment of acute gouty arthritis by orthogonal T value method[J]. Med Pharm J Chin People's Liberation Army (解放军医药杂志), 2016, 28: 33–41. |
| [61] | Yang Y, Zhang G, Sun Q, et al. Simultaneous determination of 8 compounds in Gancao-Ganjiang-Tang by HPLC-DAD and analysis of the relations between compatibility, dosage, and contents of medicines[J]. Evid Based Complement Alternat Med, 2017, 2017: 4703632. |
| [62] | Shi L, Tang X, Dang X, et al. Investigating herb-herb interactions:the potential attenuated toxicity mechanism of the combined use of Glycyrrhizae radix et rhizoma (Gancao) and Sophorae flavescentis radix (Kushen)[J]. J Ethnopharmacol, 2015, 165: 243–250. DOI:10.1016/j.jep.2015.02.022 |
| [63] | Wang R, Wang YY, Cheng ZH, et al. Current situation and prospects of optimization mathematic method for dose proportion of complex prescription[J]. J Beijing Univ Tradit Chin Med (北京中医药大学学报), 2005, 28: 8–11. |
| [64] | Huang LP, Wang TM, Yang HY, et al. Application of uniform design to screen active ingredient and its proportion of maxing Shigan decoction[J]. Liaoning J Tradit Chin Med (辽宁中医杂志), 2015, 42: 151–153. |
| [65] | Du GH, Wang YH, Zhang R, et al. Multi-target and multi-component pattern, a superficial understanding of the action mechanism of traditional Chinese medicine[J]. World Sci Technol-Mod Tradit Chin Med (世界科学技术-中医药现代化), 2009, 11: 480–484. |
| [66] | Duan Y, Pei K, Cai H, et al. Strategy of integrated evaluation on treatment of traditional Chinese medicine as 'interaction of system to system' and establishment of novel fuzzy target contribution recognition with herb-pairs, a case study on Astragali Radix-Fructus Corni[J]. Mol Cell Endocrinol, 2016, 434: 219–237. DOI:10.1016/j.mce.2016.07.006 |
| [67] | Ma RJ, Miao MS. A new method for evaluating the efficacy of Chinese medicine:the comprehensive weight coefficient method[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2011, 22: 569–572. |
| [68] | Yang H, Wu Y, Ma YY, et al. Study on compatibility of traditional Chinese medicine active constituents with antioxidant activity[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 1826–1829. |
| [69] | Wang R, Wang YY, Zhu JP, et al. ED-NM-MO trigeminy method for multi-objective optimization of compatibility for traditional Chinese medicine[J]. Chin J Basic Med Tradit Chin Med (中国中医基础医学杂志), 2005, 11: 887–889. |
| [70] | Wang R, Shang HC, Wang YY, et al. Multi-objective optimization research of the ratio of Danshen and Sanchi with ED-NM-MO trigeminy method[J]. Tianjin J Tradit Chin Med (天津中医药), 2006, 23: 242–247. |
 2019, Vol. 54
2019, Vol. 54


