2. 清华大学附属北京清华长庚医院神经内科, 北京 102218;
3. 国家药品监督管理局药品审评中心, 北京 100038
2. Department of Neurology, Beijing Tsinghua Changgung Hospital, Beijing 102218, China;
3. Center for Drug Evaluation, National Medical Product Administration, Beijing 100038, China
肌萎缩性侧索硬化(amyotrophic lateral sclerosis, ALS)是一种病因未明的选择性侵犯脊髓前角细胞、脑干运动神经核及锥体束的慢性进行性变性疾病。临床表现为上下运动神经元合并受损的体征, 是运动神经元病(motor neuron disease, MND)的最常见类型。ALS可由起初的肌无力、肌萎缩逐渐发展为构音障碍、吞咽困难和呼吸衰竭, 可伴有认知障碍。患者多在出现呼吸衰竭症状后的2~5年内死亡。ALS患者中, 大约65%发病起始于肢体, 20%~30%发病起始于延髓, 但大多数患者在疾病过程中会同时存在延髓和肢体两处体征。此外, 多达50% ALS患者可能具有额颞叶痴呆(frontotemporal dementia, FTD)的症状。ALS发病高峰期为70~74岁, 此后, 发病率迅速下降[1], 但生存期差异很大, 有些患者在几个月内死亡, 有些则可生存很多年[2]。ALS每年发病率在1/10万~3/10万, 患病率多在5/10万~7/10万, 是导致成年人瘫痪的常见疾病之一[3]。
ALS中90%是散发性肌萎缩性侧索硬化症(sporadic ALS, sALS), 10%是常染色体显性遗传的家族性肌萎缩性侧索硬化症(family ALS, fALS)[4]。在过去10年中, 人们已发现了超过30种与ALS相关的基因突变。其中约40% fALS是由于C9orf72基因六核苷酸(GGGGCC)的重复扩增; 20%是由于超氧化物歧化酶1 (superoxide dismutase 1, SOD1)基因突变; 编码TDP-43的TAR DNA结合蛋白基因(TARDBP)突变和FUS基因突变分别占4%;其他基因如p62 (SQSTM1)、ubiliquin-2 (UBQLN2)、TANK-结合激酶1 (TBK1)和视神经病变诱导基因(OPTN)等则少于1%[5]。其他未知病因引起的sALS具有遗传异质性, 导致表型多样性, 从而增加了疾病治疗的复杂性。
由于ALS患者发病年龄、发病部位、疾病进展的多样性, 相关上行或下行运动神经元的参与以及存在额颞叶痴呆(FTD)等情况, 导致其临床表现也呈现高度多样性。因此, 研究者需要更好地了解ALS发病机制, 以确定潜在的治疗靶点。到目前为止ALS的病因及确切的发病机制仍不明确, 但随着研究的不断进展, 人们已发现ALS可能涉及多种病理机制, 包括基因突变、谷氨酸兴奋性毒性、线粒体功能障碍、蛋白异常聚集、轴突转运受损、氧化应激、内质网应激、RNA错误加工以及神经炎症机制等[6]。目前ALS仍然缺乏有效治疗手段, 现有治疗方案主要集中在缓解症状以改善患者的生活质量[7, 8]。利鲁唑(riluzole)是第一个获美国FDA和欧盟批准用于治疗ALS的药物, 它仅能轻微地延缓疾病进展, 延长患者约2~3个月的生存时间[9]。依达拉奉(edaravone)是一种自由基清除剂和有效的抗氧化剂, 已于2017年5月6日经美国FDA批准上市[10]。依达拉奉对延缓ALS的进展有一定的作用[11]。因此, ALS作为一种高死亡率的疾病迫切需要找到有效的治疗方法来延缓或终止疾病的进展[12], 创新药物的研发需要建立稳定的、规范的、重现性好的药效学评价模型。目前新药临床试验的失败率很高, 即使在非临床研究表明治疗安全有效后, 仍然有超过80%的潜在治疗方法在临床试验中失败。在过去10年中, 大约有十几种治疗ALS的药物进入临床试验阶段, 这些药物都已证明可在既定的动物模型中改善疾病症状, 但除了利鲁唑和依达拉奉外, 其他药物均在临床试验中宣告失败, 其原因可能与非临床研究试验方案不完善有关, 导致从动物实验向临床转化困难。因此, 课题组在此综述中描述了ALS的非临床药效学研究动物模型建立及评价指标, 希望建立起严格规范化的ALS治疗药物的非临床药效学评价体系, 减少转化失败率。
1 ALS动物模型及评价指标 1.1 转基因动物模型各国学者从不同角度出发建立了很多用于研究ALS的动物模型, 其中应用基因工程得到的转基因动物模型得到了最为广泛的应用。转基因动物模型是理解ALS病理生理和测试有效治疗手段的重要工具。
1.1.1 SOD1转基因啮齿类动物模型SOD1G93A转基因小鼠是第一个真正建立的ALS模型, 并且仍然是当今ALS研究中使用最广泛的小鼠品系。随后的许多其他SOD1相关转基因模型是使用来自患者基因组片段的序列变体设计的, 包括人G37R突变[13]、人G85R突变[14]和小鼠G86R突变[15]。这些转基因小鼠在内源性SOD1启动子的控制下普遍表达高水平的突变SOD1。大多数SOD1基因突变小鼠能很好地模拟人ALS的病理表现, 小鼠可存在运动神经元丢失导致的致死性瘫痪、神经胶质增生及胞浆内的泛素化的SOD1包涵体[16]。将人fALS突变的SOD1基因转移至鼠, 这些转基因鼠在3~4个月开始出现类似人类ALS的症状, 并在4周内死亡[17]。敲除SOD1基因的小鼠不表现ALS症状, 但是表达突变的人SOD1 (G93A、G37R)转基因小鼠可以表现出与人ALS临床症状相似的运动神经元进展性变性、肌肉萎缩和寿命缩短[18]。因此一般采用SOD1基因突变的转基因小鼠进行ALS病因学机制研究和筛选有效的治疗药物。目前已建立了超过20个品系的SOD1基因不同突变位点、神经元特异或星型胶质细胞特异启动子的转基因大鼠和小鼠模型, 主要病理特征包括线粒体损伤、蛋白折叠错误和沉积、兴奋性毒性、氧化应激等。转基因动物总体表现为生存期短和肢体瘫痪。但是, 这些转基因动物之间具有不同的表型、发病年龄和存活时间, 这些差异可能归因于特定的基因突变位点、突变的SOD1表达水平、性别和遗传背景。总的来说, 雌性与雄性相比, 雌性小鼠具有发病时间延迟和存活期延长的特点, 在人类中也可观察到这些差异。根据研究, 在小鼠和人之间, 发病年龄与疾病进展速度可能存在反向相关性。例如, A4V突变是人类中导致疾病快速发展的最常见突变, 但在小鼠85周之前没有出现病理改变[19]; SOD1G93A突变在小鼠中可导致早期发病和快速进展, 在人类中却进展缓慢。但是, 小鼠和人类的D90A突变显示出极高的相似性, 纯合SOD1D90A小鼠表现出缓慢的疾病进展和膀胱障碍, 其与人类相同纯合突变表现一致。在一些小鼠模型中存在认知障碍, G37R突变的小鼠在8月龄时开始出现学习缺陷症状, SOD1G93A转基因小鼠在症状出现前也可表现出学习能力减弱和长期记忆障碍[20, 21]。疾病的严重程度依赖于转基因载量或拷贝数。既往研究显示SOD1G93A小鼠会自发地删除种系中的转基因拷贝数, 因此需要对每一代小鼠的基因拷贝数进行严格的监测。低拷贝转基因小鼠的病情缓慢发展过程与人类ALS更相似[22]。SOD1G93A小鼠已广泛用于非临床药效研究[23], FDA批准的药物利鲁唑和依达拉奉都是使用此模型发现了其重要的治疗作用[24, 25]。
在大鼠中只引入了H45R和G93A两种人类SOD1基因突变模型。这些大鼠表现出的ALS特征与SOD1转基因小鼠模型类似, 也存在上下运动神经元变性和相似的神经病理性改变。其中SOD1G93A大鼠与延髓ALS特征一致, 即在三叉神经、面神经和舌下神经核中有运动神经的丢失。大鼠由于其大小有利于鞘内或脑室内注射药物而常用于ALS的非临床研究[26]。然而, SOD1转基因啮齿类动物模型也存在许多弊端, 比如大部分动物不能模拟皮层运动神经元实质性变性, 而这却是人类ALS的一个基本特征[27]; 多达50% ALS患者会同时患有FTD, 但却未见于SOD1转基因动物模型。
SOD1G93A转基因小鼠模型是近年来常用的fALS疾病模型, 被认为是相关治疗研究的标准模型, 它能够在体内保持持续的应激状态从而导致脊髓内的星形胶质细胞和小胶质细胞的早期激活, 加速肌肉无力, 有助于研究者理解谷氨酸毒性、星形胶质细胞受累、轴突运输缺陷、线粒体异常、蛋白错误折叠和其他与疾病有关的细胞异常。以下将SOD1G93A转基因小鼠模型在体药物筛选评价体系作以详细介绍。
1.1.1.1 病理机制SOD1基因突变是1993年第一个被发现可引起fALS的病因[26], SOD1是一种结合Cu/Zn离子的超氧化物歧化酶, 是由两个单体组成的同源二聚体[28]。它能催化毒性超氧阴离子O2-转变成无毒的O2和H2O2。在fALS患者中, 往往可发现SOD1基因单点突变。现已发现166种与SOD1基因相关的突变, 突变主要发生在SOD1第1外显子的第4个丙氨酸突变为缬氨酸, 或者SOD1第93位甘氨酸突变为丙氨酸[18]。突变位点改变了对β-折叠形成十分关键而保守的相互作用和二聚体接触模式, 从而改变了该酶的空间构象, 而对酶催化功能改变不大[29]。因此这种错义突变引起的是SOD1蛋白的获得性毒性功能, 从而增加了损伤性氧自由基的产生, 而非造成SOD1催化活性的降低(功能丧失性突变)[30]。
当提出SOD1基因突变理论后, 获得毒性功能的SOD1被认为与ALS病理过程中的氧化应激作用密切相关。氧化应激是许多神经系统疾病包括ALS的病理学特征, 它源于氧代谢产生的活性氧(reactive oxygen species, ROS)的增加, 进而引起脂质、蛋白质、DNA损伤, 最终导致细胞死亡。因此, 通过抵消或降低细胞内ROS水平的药物可用于治疗ALS[31]。
线粒体可执行多种细胞过程, 如产生能量物质(ATP)、维持钙稳态、参与细胞代谢和细胞凋亡过程。线粒体功能障碍与SOD1小鼠模型密切相关, 表现在线粒体结构改变(线粒体破裂)、ROS产生增加、氧化应激及钙稳态失衡[32]。在ALS中, ROS的过度产生会导致促凋亡因子的释放, 引起神经退行性改变[33]。有假设认为在SOD1小鼠模型中存在损伤线粒体的自噬障碍, 自噬机制引起的损害和线粒体钙稳态的改变可能是导致运动神经元损伤的原因, 也可能是线粒体损伤所造成的结果[7]。
有研究认为, fALS有其“启动者”和“促进者”。由于SOD1基因突变所产生的氧自由基对蛋白质或者膜脂质造成的氧化攻击是疾病的起始因素, 这种损伤作用不断积累直到达到疾病的起始阈值, 此时运动神经元开始对环境中能引起兴奋性神经毒性作用的谷氨酸变得敏感, 谷氨酸能诱导大量的自由基产生、促进了脂质过氧化, 从而形成氧自由基产生和谷氨酸兴奋毒性的恶性循环, 形成瀑布式连锁反应, 对脊髓前角运动神经元造成不可逆性损害。虽然谷氨酸兴奋毒性被认为是该疾病的促进因素, 但是运动神经元死亡所涉及的通路目前仍未知[34]。
1.1.1.2 SOD1G93A转基因小鼠模型用于ALS药物非临床研究的评价指标SOD1G93A转基因小鼠模型的分组:选取雄性高表达SOD1G93A阳性小鼠[Jackson laboratory: B6SJL-Tg(SOD1*G93A)1Gur/J]和同窝阴性小鼠, 分别随机分为实验给药组或溶剂对照组等, 每组至少12只。在相对恒温(22~27 ℃)、恒湿(40%~50%)、12 h光照再12 h黑暗的无特殊病原菌的动物房中饲养, 自由进食。为了控制变量, 各组之间应保持年龄和体重平衡, 同窝小鼠数量和性别一致。如若实验药物具有性别特异性治疗效果或者药理作用, 则应采用50%雄性和50%雌性小鼠的实验设计。
体重及生存期:小鼠一般在90日龄时表现出疾病起始症状并在随后的30~60天左右死亡, 平均存活时间为134 ± 10天。小鼠在大约40~50天症状起始前会出现神经肌肉接头的退化, 小胶质细胞增生和轴突运输缺陷也出现在发病前并随着时间增加。实验开始的前60天每周观察2次小鼠情况, 60天后每日称重并观察转基因小鼠的精神状态、病情发展、存活情况, 发现步态异常或前后肢虚弱为ALS发病的起始点, 将小鼠向一侧放倒, 30 s内不能翻正(即ALSTDI评分4分), 即判定动物死亡。小鼠从出生到死亡的时间记录为生存期。
行为学变化: SOD1小鼠症状出现前和症状出现阶段可使用ALSTDI神经学评分进行评价。0分:当小鼠尾巴被悬吊时, 其后肢完全伸展远离外侧中线且能保持2 s, 悬吊2~3次; 1分:后肢瘫痪或部分瘫痪伸向外侧中线(无力)或尾部被悬吊时后肢震颤; 2分:在30 cm的步行过程中, 脚尖弯曲至少2次, 或脚的任何部分沿笼底/桌子拖动; 3分:强直性麻痹或最小关节运动, 脚不能产生向前运动, 出现肢体麻痹(通常为后肢); 4分:将小鼠向一侧放倒, 30 s内不能翻正。值得注意的是, 神经学评分应该与体重相结合以排除非ALS死亡, 真正的ALS死亡其体重应随着神经学评分的增加而逐渐减少, 如果小鼠在评分达到2分之前死亡, 可能并非死于ALS[35]。此外, 还可根据症状发展的阶段进行分期:症状前期:没有明显的运动异常(例如后肢正常伸展); 症状期:异常后肢伸展; 末期:出现肢体瘫痪(特别是后肢); 垂死期:将小鼠向一侧放倒, 30 s内不能翻正。
转棒实验(rotarod test):在小鼠60~70日龄时每周进行2次转棒实验测试小鼠的运动协调性、力量和平衡能力。正式实验前先训练小鼠2~3天。正式实验时, 小鼠在一个直径3.5 cm的转棒上适应30 s后, 启动转棒仪, 转速为16 r·min-1, 计时180 s, 记录小鼠第一次从棒上跌落的时间(潜伏期)以及3 min内的掉落次数。连续测定3次, 每次间隔1 h以上, 取平均值[36]。
握力实验(grip strength test):在小鼠60~70日龄时开始每周使用抓握力测量系统对小鼠的前后肢的抓握力进行测试, 首先让小鼠抓住前肢拉杆组件, 然后朝远离拉杆的方向垂直拉拽小鼠, 当小鼠松爪时, 最大力量会显示在相连控制单元的数字显示器上。之后让小鼠保持移动直至其后肢抓住第二拉杆组件, 同理按上述方法拉拽小鼠得到后肢抓握力。每只动物每个肢体应测试4次/周[2], 取平均值。
肌电图(electromyography, EMG)分析:电生理测试被认为是ALS小鼠疾病进展的标志物[37]。因此, 可使用Nicolet Viking Ⅳ (Nicolet, Charles, Missouri, USA) EMG记录仪测量肌电图。①自发电位:小鼠麻醉后, 同心针电极插入后肢腓肠肌肌腹中, 观察有无纤颤电位(常是一种无节律的双相棘波)和(或)正锐波(为一正相关形主峰向下的双相波, 仅见于失神经支配的肌肉)。②复合肌肉动作电位(compound muscle action potential, CMAP)的记录:小鼠麻醉后, 用加热灯维持小鼠正常体温, 刺激腰段脊旁坐骨神经, 记录电极插入后肢腓肠肌肌腹中。给予0.2 ms/1 Hz超强刺激, 记录CMAP, 测量峰值表示CMAP波幅。③运动单位数目估计(motor unit number estimation, MUNE)记录:小鼠麻醉后, 刺激腰段脊旁坐骨神经, 记录电极插入后肢腓肠肌肌腹中, 调整电极位置, 以最小刺激强度获得CMAP; 并获得刺激反应功能曲线, 保证起始部分和终止部分所包含的2~4个反应点位于同一水平, 根据刺激反应功能曲线确定采样区间。首先选择曲线中相邻2个反应点间波幅差距最大的部分, 作为第1个采样区间; 选择曲线中相邻2个反应点间波幅差距次大的部分, 作为第2个采样区间; 选择曲线上相邻2个反应点间波幅差距第3大的部分, 作为第3个采样区间; 最后选择曲线中相邻2个反应点间波幅差距最小的部分, 作为第4个采样区间。调整刺激强度, 使所获得的反应点均落于采样区间内, 然后进行采样, 采样时保证同一采样区间内至少存在连续且规律出现的两种类型的反应点, 否则应扩大采样区间的范围, 直至满足采样条件。同一采样区间可重复采样2~10次。结束某一采样区间采样的条件为:所得运动单位电位波幅的标准差小于均数的10%, 采样点直方图近似正态分布或略呈负性偏态分布。结束某一采样区间的采样后, 可获得该区间的采样范围和运动单位数目估计测值。重复上述采样步骤, 对下一个选定的采样区间进行检测, 直至完成全部4个采样区间的采样最终获得CMAP和MUNE。CMAP波幅的大小主要反映了周围神经轴索的功能, MUNE反映了有功能的运动单位的数量[38]。
脊髓组织学和运动神经元计数:小鼠麻醉后, 用生理盐水进行心脏灌流, L4~L5段脊髓用于组织病理学分析和免疫组化分析。将脊髓浸泡于多聚甲醛中4 ℃过夜, 随后用10%、20%、30%梯度的蔗糖溶液4 ℃依次分别处理24 h。之后进行石蜡包埋, 脊髓连续切片200张, 厚度为6 μm, 每7张取1张做尼氏染色。处理好的切片用显微镜明视野拍照后, 计数运动神经元。计数的运动神经元所在的区域为脊髓前角部分, 中央管以上的部分。运动神经元有明显的细胞核, 且直径在20 μm以上。
实验中为了深入阐明待测化合物的作用机制, 可在症状起始或末期时将其麻醉后处死并取材进行尼氏染色、H & E染色、免疫组化和Western blot等检测, 观察胶质细胞活化、氧化应激、轴突损伤、自噬改变、泛素阳性蛋白质聚集体等情况。
评价指标小结: ①体重; 生存期。②行为学评价指标: ALSTDI神经学评分; 转棒实验潜伏期; 跌落次数; 前后肢握力。③电生理学评价指标: CMAP波幅; MUNE。④病理学和生化评价指标:腰段脊髓前角运动神经元的数量; 轴突损伤情况; GFAP与Iba1的表达情况; LDH、HO-1、Caspase、LC3等水平。
1.1.2 TDP-43转基因啮齿类动物模型虽然SOD1小鼠模型模拟了许多ALS表型, 但它只能反映具有SOD1突变的fALS, 不能代表ALS的所有形式, 比如与ALS发生密切相关的病理性TDP-43的积累。虽然TDP-43突变相对较少, 占fALS的4%, 但它的发现标志着ALS遗传学的一个重大事件, 并由此产生了大约20个小鼠模型, 能模拟运动神经元丧失、蛋白质聚集和进行性肌肉萎缩等ALS的标志性特征[5, 39], 它们使用不同的启动子, 如小鼠朊病毒启动子(prion promotor, Prp)、小鼠Thy1.2启动子、CaMKII启动子或者细菌人工染色体和内源性启动子等。一些早期的实验使用Prp来构建野生型和过表达突变型(A315T和M337V) TDP-43转基因小鼠模型[40]。尽管使用不同的启动子所构建的模型在表征上略有差异, 但一般而言, 高表达突变型和野生型TDP-43 (> 2倍的小鼠内源性水平)的小鼠耐受性不好, 早期即可出现神经表型。而TDP-43表达水平相对较低时(1~1.5倍小鼠内源性水平), 小鼠表型严重程度较低[41]。转基因小鼠在特定神经元群中(额叶皮层V层锥体神经元和脊髓运动神经元)累积泛素化的病理性蛋白质聚集体, 主要表现为轴突和突触缺损、胞质内含物、步态异常、抓力降低及不同程度的脊髓病理改变。hTDP-43WT和hTDP-43G348C转基因小鼠在36~42周龄时可出现年龄相关性的进行性运动缺陷和与FTD相关的认知障碍。在10月龄的hTDP-43G348C小鼠中还可观察到TDP-43核和胞质包涵体。hTDP-43M337V、hTDP-43Q331K和hTDP-43WT转基因小鼠在3月龄时可发展为肢体震颤, 并逐渐发展为后肢紧缩。突变TDP-43转基因鼠, 尤其是Prp-Q331K转基因鼠, 可在转棒和握力实验中表现出缺陷。在TDP-43转基因小鼠模型中, 突变位点和小鼠表型之间没有明确的相关性, 而突变TDP-43的表达水平与表型严重程度相关。低蛋白表达可导致与年龄有关的运动功能障碍和TDP-43胞质积累, 但小鼠没有瘫痪[42]。高蛋白表达可导致早期发病和疾病快速进展, 但没有明确的运动神经元丢失和TDP-43神经元胞质包涵体。在临床症状中患者会随着时间的推移而进展性瘫痪, 然而在TDP-43突变小鼠中没有观察到这种现象。步态和握力测量表明, TDP-43突变小鼠的肌肉缺陷较为轻微, 并且尸检后发现动物死亡不是由于进行性肌肉萎缩, 而是由肠道平滑肌恶化引起的急性肠梗阻[43]。由于TDP-43的病理性聚集存在于大多数ALS (包括sALS和fALS)和FTD患者中, 因此使用TDP-43转基因动物模型适用于研究药物对ALS病理机制的影响, 但在TDP-43突变小鼠模型中, 以生存期作为检测指标发现的治疗ALS的潜在药物在临床试验中可能会面临挑战。
除了小鼠模型外, 目前也建立了几种TDP-43转基因大鼠模型。在最近的一项研究中使用两种不同的启动子:神经丝重链(NEF)启动子和胆碱乙酰转移酶(ChAT)启动子来诱导TDP-43M337V突变体在大鼠体内的表达。使用NEF启动子的转基因大鼠, 突变TDP-43的表达在8.5周龄时被完全激活, 在10~12周龄之间, 大鼠握力和活动能力开始降低, 并在13周龄时出现后肢瘫痪。大鼠在出现瘫痪时可观察到轴突退化、骨骼肌去神经支配和萎缩, 齿状回和下行运动神经元数量下降20%。在ChAT启动子控制下, 表达突变TDP-43M337V的转基因大鼠可见运动神经元变性更加严重。突变TDP-43的表达在8.5周龄之前就被完全激活, 随后一周内大鼠迅速丧失握力且移动性降低, 并在1.5周后可观察到瘫痪症状。与使用NEF启动子的M337V突变大鼠相似, 使用ChAT启动子的转基因大鼠也可观察到轴突退化和骨骼肌的去神经支配和萎缩, 然而运动神经元变性更为显著, 下行运动神经元数量减少60%, 且存活的运动神经元具有泛素化蛋白胞质聚集[44]。
Wegorzewska等[45]在2009年报道了Prp-TDP-43A315T小鼠模型的产生, 并在不久之后可从Jackson实验室获得, 供世界各地的研究人员使用, 是目前应用较多的TDP-43转基因动物模型。最初的报告表明, 这种Prp-TDP-43A315T转基因小鼠在3月龄之前是正常的, 随后在3~4月龄时开始出现步态异常, 大约在4.5月龄时出现体重下降, 并发展成独特的“游泳”步态, 即当他们无法支撑自己的身体离开地面时, 可以用前肢作为推进使身体向前滑动。最初报道的此转基因小鼠的寿命为154 ± 19天, 而当这些小鼠与C57BL6小鼠回交后, 其寿命也会缩短, 与C57BL6/J 100%同源的TDP-43A315T小鼠寿命平均为97 ± 11天。为了延续种族的繁殖, 一般选用与C57BL6/J 80%同源的TDP-43A315T小鼠更为合适。TDP-43A315T转基因小鼠在终末期阶段大约有20%的运动神经元损失, 在结肠肌间神经丛中表现出进行性神经变性, 是造成小鼠严重衰弱和死亡的原因。以下将对TDP-43A315T转基因小鼠模型在体药物筛选评价体系作详细介绍。
1.1.2.1 病理机制蛋白质错误折叠、聚集和降解异常是许多神经退行性疾病的病理特点, 通常表现为出现病理性的包涵体。ALS的一个主要病理特征是在神经元和胶质细胞的胞质中存在不溶性的泛素阳性包涵体。大约95% ALS患者中的包涵体都与RNA结合蛋白TDP-43相关[16]。由TARDBP基因编码的TDP-43蛋白是一种高度保守、广泛表达的核蛋白, 包含1个核定位信号(nuclear localization signal, NLS)、2个RNA结合基序和1个富含甘氨酸的区域(具有“朊病毒样”结构域并介导蛋白质和hnRNP的相互作用)。在这个富含甘氨酸的结构域内, 发现了ALS中与TDP-43相关的大多数致病性突变[46]。TDP-43的病理性聚集存在于大多数ALS和FTD患者中, 正常情况下, TDP-43存在于细胞核中, 在转录过程中发挥作用, 但错误折叠的TDP-43聚集在细胞质, 从而导致细胞核转录功能缺陷。因此, TDP-43被认为是ALS的一个关键致病蛋白, 其异常聚集也可能通过增加基本细胞成分的疏水性、产生氧化物质和抑制蛋白酶体来产生毒性[47, 48]。除TDP-43之外, FUS的细胞质聚集也存在于一些病例报道中。SOD1的错误折叠和聚集也是毒性最可能的来源。因此, 蛋白质的错误折叠和聚集(尤其是TDP-43)可能是ALS的一个有价值的研究方向, 为以此作为靶向的治疗药物提供了一个有前景的平台。
1.1.2.2 TDP-43A315T转基因小鼠模型用于ALS药物临床前研究的评价指标TDP-43A315T转基因小鼠模型的分组:选取TDP-43A315T雄性小鼠[Jackson laboratory: B6.Cg-Tg (Prnp-TARDBP*A315T) 95Balo/J]和非转基因同窝阴性小鼠, 分别随机分为实验给药组或溶剂对照组等, 每组至少12只。在相对恒温(22~27 ℃)、恒湿(40%~50%)、12 h光照再12 h黑暗的无特殊病原菌的动物房中饲养, 自由进食。
体重及生存期:与C57BL6/J背景80%同源的Prp-hTDP-43A315T雄性小鼠一般在90~95日龄时表现出疾病起始症状, 平均存活时间约为119 ± 18天。实验开始的前60天每周观察2次小鼠情况, 60天后每日称重并观察转基因小鼠的精神状态、病情发展、存活情况, 发现步态异常或前后肢虚弱为ALS发病的起始点, 将小鼠向一侧放倒, 30 s内不能翻正(即ALSTDI评分4分), 即判定动物死亡。小鼠从出生到死亡的时间记录为生存期。
行为学变化、转棒实验、握力实验肌电图分析、脊髓组织学和运动神经元计数, 及对作用机制的深入探讨:上述SOD1G93A转基因小鼠模型。
评价指标小结:同SOD1G93A转基因小鼠模型。
1.1.3 其他ALS相关转基因动物模型 1.1.3.1 FUS转基因啮齿类动物模型FUS最初被发现是由于其在染色体易位后的致癌特性, 导致截短的FUS蛋白与转录因子CHOP融合[49]。FUS可结合DNA和RNA, 主要定位于核内[50]。与TDP-43类似, FUS的主要功能与RNA代谢有关。人们已经发现与FUS相关的50多个突变, 约占fALS的4%和sALS的1%。目前已建立了几十种与FUS相关的小鼠模型, 包括FUS功能丧失模型、过表达转基因模型、基因敲入以及Cre诱导模型, 其中大多数破坏了FUS的NLS[51]。
将包含野生型或各种突变FUS的cDNA插入微管相关蛋白tau (Mapt)基因座中, 从而建立了一系列转基因小鼠品系。这些小鼠在被cre-重组酶激活之前, 插入的cDNA是沉默的。含有FUS突变形式的小鼠表现出神经肌肉接头异常, 随后发生运动神经元变性、胞质错误定位和蛋白聚集, 但小鼠不会瘫痪, 也不会发展至终末期疾病[52]。
过度表达FUS的转基因小鼠可显示出严重且具有侵袭性的ALS样表型。例如使用来自Prnp或Thy1基因的启动子能驱动转基因动物的神经元表达FUS的水平高于正常的内源水平。使用Thy1启动子表达含有NLS突变的FUS转基因半合子小鼠在2.5~4.5个月时迅速产生运动表型, 在发病后几天内死亡。FUS内含物主要存在于运动神经元、轴突及整个神经系统的其他神经元亚群中。在这些小鼠的脑干和脊髓中可见神经炎症反应[53]。目前对FUS的相关病理改变只有少数的临床描述, 其表型相关性很难确定。野生和突变FUS转基因大小鼠都有报道, 其中突变的转基因大鼠可发展成进行性麻痹和运动神经元丢失, 同时人野生型转基因大鼠皮层和海马有明显的神经元丢失, 并可发展为空间学习记忆障碍。
病理机制: FUS和TDP-43是多功能的DNA和RNA结合蛋白, 参与RNA转录、选择性剪接及mRNA稳定性调节, 这两种蛋白发生突变可能导致轴突运输异常或者由于核表达的减少造成与RNA加工过程有关的功能丧失[4]。因此RNA代谢异常可能是ALS的核心机制之一。与TDP-43一样, FUS主要定位于细胞核, 但在细胞应激时被运输到细胞质并结合其他mRNA, 形成无膜细胞器[54]。在正常条件下, 应力颗粒随细胞应激消退而消退, 但在突变FUS存在下, 应激颗粒可持续存在, 形成具有细胞毒性的聚集体[55]。
1.1.3.2 C9orf72啮齿类动物模型C9orf72内含子多聚GGGGCC(G4C2)六核苷酸包涵体是导致FTD-ALS最常见的遗传原因。有报道称C9orf72重复扩增小鼠模型具有泛素阳性包涵体, 但表型分析尚未完成[56]。C9orf72基因敲除小鼠没有导致任何运动神经元变性或存活率降低, 这表明C9orf72基因功能丧失不足以引起ALS[57]。
病理机制:研究表明, ALS存在异常的RNA剪切加工和蛋白质代谢(内质网应激和自噬)过程。而RNA剪切过程可参与所有的非SOD1介导的ALS疾病。其中C9orf72基因六核苷酸的重复扩增导致的ALS在fALS病例中的比例最高, 与RNA代谢的关系也最为密切。由于C9orf72基因的第一个内含子中含有过量的GGGGCC六核苷酸重复序列(hexanucleotide repeat expansion, HRE), HER长短在人群中具有多态性, 正常人群中GGGGCC的扩增次数少于23次, 高于23个重复就可能会诱导FTD或ALS的发生, ALS患者中拷贝数可高达5 000个。C9orf72的GGGGCC多拷贝重复可造成RNA的异常积累和定位。目前推测HRE参与FTD或ALS的可能机制为HRE结构导致C9orf72转录子在细胞内的积累, 并可能与DNA形成RNA/DNA杂交环(R-loop)引起RNA毒性。此外, FUS、TARDBP等基因也与RNA代谢相关。
C9orf72通过重复相关的非ATG翻译产生的二肽重复蛋白的毒性作用也被认为是导致C9orf72相关ALS的病理机制[58]。携带C9orf72突变的患者基因中存在异常长的GGGGCC重复扩增, 产生不存在于健康人体内的二肽重复蛋白, 从而对运动神经元产生毒性作用。最近有研究认为, 这种来自于RNA翻译生成的二肽重复蛋白才是C9orf72相关ALS产生毒性的主要原因, 但目前尚无定论[59]。
除此之外, 研究人员还建立了与VCP、UBQLN2和OPTN等基因相关的ALS动物模型, 由于目前对于这些模型的研究尚少, 因此在此综述中不做以具体阐述, 但随着研究的不断进步, 相信未来会研发出更符合ALS病理进展的动物模型。
1.2 基因敲除动物模型既往研究表明, 许多途径都可能参与TDP-43介导的神经变性, 除了由异常的胞质中不溶性的泛素阳性包涵体导致的毒性功能之外, TDP-43的核功能的丧失也被认为是ALS的关键病理机制之一, 目前认为TDP-43的毒性功能的增加和正常功能的丧失共同介导了TDP-43所致ALS的发生发展[60]。因此, 除了前述TDP-43相关转基因动物模型之外, 建立TDP-43基因敲除模型对于全面理解TDP-43介导的ALS的病理生理机制也是不可或缺的, 由此便开发出了TDP-43flox/flox/ VAChT-Cre (TDP CKO)基因敲除小鼠, 其特点是在运动神经元中特异性地删除TDP-43的表达。TDP CKO小鼠一般可在50周左右出现震颤, 这是运动功能障碍的最早症状, 在约60周时开始出现进行性体重减轻, 此时可检测到躯干和后肢的肌肉萎缩。从75周开始, TDP CKO小鼠在转棒实验中体现出的运动能力明显低于同窝对照小鼠, 从85周开始, TDP CKO小鼠的抓握力量也明显低于同窝对照小鼠。在100周时, TDP CKO小鼠的后爪步长的平均长度显著短于对照同窝小鼠。然而, TDP CKO小鼠的生存期与对照同窝小鼠相比没有明显改变[61]。
1.2.1 TDP-43flox/flox/VAChT-Cre基因敲除小鼠模型的分组选取TDP-43flox/flox/VAChT-Cre (运动神经元特异性TDP-43敲除: TDP CKO)和TDP-43flox/flox同窝对照小鼠, 分别随机分为实验给药组或溶剂对照组等, 每组至少12只。在相对恒温(22~27 ℃)、恒湿(40%~50%)、12 h光照再12 h黑暗的无特殊病原菌的动物房中饲养, 自由进食。
1.2.2 体重及生存期实验开始后每日称重并观察基因敲除小鼠的精神状态、病情发展、存活情况, 发现步态异常或前后肢虚弱为ALS发病的起始点, 将小鼠向一侧放倒, 30 s内不能翻正(即ALSTDI评分4分), 即判定动物死亡。小鼠从出生到死亡的时间记录为生存期。
1.2.3 行为学变化、转棒实验、握力实验肌电图分析、脊髓组织学和运动神经元计数, 及对作用机制的深入探讨同上述SOD1G93A转基因小鼠模型。
1.2.4 评价指标小结同SOD1G93A转基因小鼠模型。
1.3 自然发病动物模型可自发突变形成运动神经元疾病的啮齿类动物模型已有半个世纪的历史。在首次确定出第一个人类ALS突变蛋白质之前, 这种模型已被广泛用于探索疾病的病因。虽然这种啮齿类模型自发突变的染色体定位不具有与少数已知突变或染色体定位的人类疾病之间的遗传相似性, 但事实上大多数人类ALS病例的病因仍不明确, 表明这种自然发病动物模型仍有助于理解运动神经元的退行性过程。
在自然发病动物的ALS模型中, 出现最早和研究最多的是Wobbler小鼠。Wobbler小鼠由于常染色体隐性突变导致脊髓神经元退行性改变, 与ALS疾病的神经元受损和临床表现具有相似性, 因此被选为ALS模型进行研究[62]。Wobbler基因定位于11号染色体上[63], Vps54基因发生点突变, 但Wobbler小鼠确切的遗传缺陷机制尚未明确[64]。Wobbler小鼠的疾病症状可分成3个不同的阶段:症状前期、进展期和稳定期。症状前期从出生开始持续到大约3周龄, 此阶段小鼠基本没有表现出临床症状, 小鼠体重、握力、翻正反射和网格步行测试均显示正常。从3周龄到3月龄为进展期, 小鼠在此期会出现体重和肌肉力量下降、肌肉萎缩、摇摆步态和头部震颤等症状。从3月龄至小鼠死亡为稳定期, 特征为渐进性运动神经元变性进程发生停滞。Wobbler小鼠表现为选择性的运动神经元丢失和变性[65], 可见尼氏小体染色变弱, 胞体变大, 胞浆空泡样变性, 内质网、核糖体减少, 线粒体功能障碍, 胶质细胞增生, 泛素化蛋白质聚集, 轴突转运受损, 肌肉出现失神经性萎缩, 可见氨基酸和过氧化物的代谢异常, 临床体征特点主要是累及动物的前肢肌肉, 出生后出现行走摇晃和前爪无力, 渐到前爪瘫痪, 电生理研究显示动物前肢失神经表现。Wobbler小鼠模型因其神经元变性的特点, 适合于研究ALS疾病神经元变性的发病机制, 其症状发展迅速, 可重复性好, 易于监测运动障碍进展情况, 因此可作为ALS非临床药效学评价体系的可靠模型[65]。
1.3.1 Wobbler小鼠模型的分组使用具有Wobbler表型(基因型为wr/wr)的小鼠(Jackson laboratory: B6.B-Vps54wr/J)和具有正常表型(基因型为Wr/Wr和Wr/wr)的同窝小鼠, 分别随机分为实验给药组或溶剂对照组等, 每组至少12只。由于未检测到Wobbler小鼠中具有性别差异, 所有实验组可包括相同数量的雄性和雌性小鼠。在相对恒温(22~27 ℃)、恒湿(40%~50%)、12 h光照再12 h黑暗的无特殊病原菌的动物房中饲养, 自由进食。
1.3.2 体重及生存期自发突变纯合Wobbler小鼠(基因型为wr/wr)一般在3周龄时开始出现运动障碍, 与同窝对照鼠相比其体重降低40%~50%, 并且症状逐渐发展至3~5月龄时达到稳定状态, 平均存活时间约为3个月。实验开始后每周进行2次称重并观察转基因小鼠的精神状态、病情发展、存活情况, 发现步态异常或前后肢虚弱为ALS发病的起始点, 并记录到第11周。完成半定量评分(爪异常和步行异常测试)和定量评价(运动速度和握力测试)。在症状起始或第12周, 将其麻醉后处死并取材进行尼氏染色(颈部脊髓C2~C6, 厚度为30 μm)、H & E染色、免疫组化、免疫荧光或Western blot检测胶质细胞活化、氧化应激、轴突损伤、自噬改变、泛素阳性蛋白质聚集体等情况。小鼠从出生到死亡的时间记录为生存期。
1.3.3 半定量评分在疾病起始后每周进行1次半定量评分至第12周。按照爪的位置进行分级: 0级:正常; 1级:爪萎缩; 2级:爪弯曲; 3级:腕部向后弯曲; 4级:前肢屈曲挛缩(图 1)。
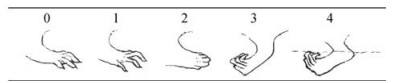
|
Figure 1 Semi-quantitative limb score of wobbler mice |
按照行走方式进行分级: 0级:正常; 1级:颤抖; 2级:摆动; 3级:弯曲爪行走; 4级:下颌行走(不用爪行走, 用下颌来支撑身体行走)。
1.3.4 定量评价运动时间测试:在小鼠出现起始症状后每周记录小鼠行走2.5英尺(0.762米)的时间, 连续测定3次, 取最短时间。
握力实验:在小鼠出现起始症状后每周使用抓握力测量系统对小鼠的前后肢的抓握力进行测试直至第12周, 具体操作步骤同SOD1G93A转基因小鼠模型的握力实验步骤。
1.3.5 评价指标小结① 体重; 生存期。②行为学评价指标:定量和半定量评分。③病理学和生化评价指标:颈段脊髓前角运动神经元的数量; 轴突损伤情况; GFAP与Iba1的表达情况; LDH、HO-1、Caspase、LC3等水平。
2 规范化ALS非临床研究需要注意的问题虽然目前对于ALS临床和神经病理学特征的研究已经取得了很大进展, 但从动物实验向临床的转化依旧十分困难, 这种失败至少在一定程度上是由于方法学的缺陷, 而不是模型本身固有的问题, 因此, 需制定ALS/MND动物研究的标准操作规程(standard operating procedure, SOP)。这些标准操作规程将有助于在未来几年内为其他神经系统疾病的转化研究制定SOP。因此, 课题组总结了如何更好地设计非临床药效学研究方案, 改进动物模型以克服转化缺陷的策略(表 1)[66]。这种规范化的动物模型建立措施可以最大限度地减少实验噪音, 从而帮助筛选真正能为患者带来治疗益处的药物。
| Table 1 Considerations for the establishment of standardized non-clinical animal models of amyotrophic lateral sclerosis (ALS)[66] |
① 排除不相关的动物。因与疾病无关的原因而死亡的动物(例如错误操作)不应计入结果中。动物排除及其原因应该有详细记录, 并需要提前在实验方案中予以规定。
② 性别平衡。雌性和雄性可对某些药效不清的药物表现出症状的差异。通常雄性动物的发病与死亡比雌性提前一周, 而这种差异很容易被当成为药物的效应。
③ 在同一实验组中将同窝动物分开, 减少同入一组可能带来的偏差。
④ 追踪基因。诱导疾病的基因通常不能稳定地遗传, 当致病基因丢失后, 会导致症状比实际更轻微或者药物比实际更有效。因此, 必须定期测定后代动物的基因型以确保致病基因的拷贝数没有减少。
⑤ 每组实验动物至少12只。对于旨在预测治疗益处的研究, 如延长生存期或延迟症状进展, 需要进行数学模拟。这需要根据在动物模型中观察到的变化以计算每个实验组应该分配多少动物。根据计算, 变化大的动物模型每组需要的动物数增加, 甚至数百只, 即使是均一性较好的动物模型每组也需要至少12只。
⑥ 每种测试药物至少设置3个剂量组, 为临床转化提供合理的剂量依据。在评估药物的疗效之前, 应测试动物的耐受剂量, 药物是否以所需剂量到达相关组织, 以及药物被代谢或降解的速度。
⑦ 非临床研究中多选用几个动物模型。在将受试物推进到临床试验之前甚至是在临床试验过程中, 应多选择几种转基因动物模型进行综合考察。
⑧ 受试物应在小规模的不同遗传背景动物中进行测试, 以确定遗传变异性对治疗效果的影响。
⑨ 试验设计合理。a.盲法。b.疾病起始。症状起始指标应经过充分验证, 稳定, 可重复, 如体重减轻和行为体征。c.疾病进展。疾病进展的定量测试(体重减轻、握力、转棒实验、步态分析、神经学评分)。d.生存期。对于(高拷贝) G93A动物的生存期研究, 每组至少应包含12只单一性别的动物。e.组织学。应包括最小n = 5~6的性别特定组的运动神经元计数。f.统计分析。选用适当的统计学方法。例如SOD1G93A模型具有多个变量, 因此选用Cox比例风险回归进行统计较为合适, 而常用的t检验/ANOVA分析不适合生存统计。
参考以上方法开展非临床药效学研究, 可以增加药物进入临床试验的成功率, 并提高了ALS动物模型的有效性和可重复性。
3 选择规范化研发模型的建议到目前为止, 人们已经建立了很多ALS相关的模型, 范围涉及体外生化系统、细胞培养系统、非脊椎动物、非哺乳类脊椎动物、啮齿类动物及最近出现的人类患者来源的干细胞模型。上述模型各有其发展优势和限制, 因此, 如何正确选择适宜的研究模型是实验能否取得成功的关键因素之一(表 2)。
| Table 2 Recommendations for the selection of animal models related to ALS[66] |
啮齿类动物模型仍然是ALS模型的金标准, 因为这种哺乳动物模型与人类具有相对较高的基因同源性, 其具体的机制研究与人体生理存在明显相关性, 不仅可用于研究ALS的潜在病理机制, 还可用于筛选新的治疗药物。然而, 与离体模型相比, 啮齿类动物模型的时间和花费较大, 且难以同时测试多种给药方案。对于fALS转基因动物模型, 表达低水平突变蛋白的SOD1G93A转基因小鼠疾病发展速率较慢, 生存期可延长到1年左右。这些小鼠的脊髓病变同没有出现空泡化改变的人ALS更为相似, 表现为运动神经元的丢失伴随胶质细胞增生及泛素化的路易小体和轴突肿胀的出现[67, 68]。病程较长的表达低水平人突变SOD1的转基因小鼠能更好地模拟人ALS, 可用这种模型进行ALS相关发病机制的研究。而病程进展较快的高表达鼠可能更应该用于潜在治疗药物的快速筛选, 可依据药物在高表达突变SOD1转基因鼠中表现出的治疗效益为标准来预测该药是否能成功应用于临床。
与SOD1转基因小鼠不同, 由于高表达TDP-43的转基因小鼠会过早死亡, 限制了高表达转基因小鼠系的产生, 因此TDP-43转基因小鼠的TDP-43蛋白表达量一般较低, 与SOD1转基因小鼠相比, 低水平表达TDP-43的转基因小鼠其中枢神经系统的病理表型较轻, 皮质或者脊髓运动神经元的丢失较少, 轴突数量和神经肌肉接头的神经支配通常仅受到轻微的影响。TDP-43转基因动物或者不会出现较早的死亡, 或者是由于与ALS发病病理无关的原因死亡。
从ALS患者中得到的诱导多能干细胞(iPSCs)并将其分化成为运动神经元已成为ALS研究的新途径。通过向患者来源的细胞中引入多能性基因, 已经可以从ALS患者中产生iPSCs[69]。这种方法容易建立, 可应用于患者特异性细胞治疗和研究而不需要特殊的伦理考虑[70]。其最大的优势在于不需要过度表达包含致病性ALS的突变基因, iPSCs可携带单个患者遗传背景的内源性基因突变, 本身具有疾病表型。此外, 这种方法既可以模拟fALS, 也可以模拟sALS。迄今为止已经开发了多种不同的技术通过遗传重编程产生iPSC系, 并且优化了多种直接转化方法以从ALS患者产生诱导的神经祖细胞(iNPC)和运动神经元。因此, iPSC来源的细胞可有效地用于筛选新的治疗药物。虽然目前应用iPSCs已经发现了与ALS相关的一些重要的致病机制和潜在的治疗靶点, 但这种技术仍然具有很多局限性。如干细胞之间或从同一个体分化的iPS克隆之间的表型有可能不一致, 这种现象称为克隆变异。如何克服克隆变异已成为优化细胞重编程技术的主要挑战之一[71, 72]。
4 中国ALS药物研究现状目前我国处于临床研究的治疗ALS的药物较少。2018年我国开发的创新药丁苯酞获得美国FDA治疗ALS孤儿药资格。文献资料显示, 非临床研究中丁苯酞对ALS动物模型有一定的治疗作用, 北京协和医院崔丽英教授正在主持开展ALS相关临床研究。北京大学樊东升教授探讨了粒细胞集落刺激因子(G-CSF)和肉苁蓉总苷(CTG)用于治疗ALS的临床疗效, 发现粒细胞集落刺激因子和肉苁蓉总苷可以通过激活几种保护途径起到抗凋亡作用, 刺激大脑中成体神经干细胞的神经元分化, 并具有长期改善作用, 可成为治疗ALS的很有潜力的候选药物。大连医科大学附属第一医院使用外周血单核细胞自体移植的方法考察使用干细胞治疗ALS患者的临床效果。
5 小结迄今为止, 尽管在理解ALS的遗传学和神经病理方面已取得了显著的进步, 但由于动物模型的缺陷、临床前研究方案不规范等因素的影响, ALS治疗药物的研发进展缓慢。虽然从多个模型得到的综合信息有助于研究者深入理解ALS的病理学机制, 并解决该领域的关键性问题, 但目前仍无动物模型能够完美复制ALS的病理特征。鉴于目前ALS的新药从动物实验向临床转化的高失败率, 严格设计规范化的非临床药效学评价体系成为非常关键的问题。规范化的非临床药效学评价方案可以增加药物进入临床试验的成功率, 并提高了ALS动物模型的有效性和可重复性。转化困难不仅仅存在于ALS研究这一个领域, 上述针对ALS临床前研究转化的措施对于阿尔茨海默病、帕金森氏病等神经退行性疾病的临床前动物研究也具有很大的借鉴意义。
| [1] | Mitchell JC, Constable R, So E, et al. Wild type human TDP-43 potentiates ALS-linked mutant TDP-43 driven progressive motor and cortical neuron degeneration with pathological features of ALS[J]. Acta Neuropathol Commun, 2015, 3: 36. DOI:10.1186/s40478-015-0212-4 |
| [2] | Fidler JA, Treleaven CM, Frakes A, et al. Disease progression in a mouse model of amyotrophic lateral sclerosis: the influence of chronic stress and corticosterone[J]. FASEB J, 2011, 25: 4369–4377. DOI:10.1096/fj.11-190819 |
| [3] | Zhang Z, Wang SS, Zhu TB, et al. Rg1 alleviates the damage in ALS model through regulation of miR153/Nrf2/HO-1[J]. Acta Pharm Sin (药学学报), 2018, 53: 546–552. |
| [4] | Ferraiuolo L, Kirby J, Grierson AJ, et al. Molecular pathways of motor neuron injury in amyotrophic lateral sclerosis[J]. Nat Rev Neurol, 2011, 7: 616–630. DOI:10.1038/nrneurol.2011.152 |
| [5] | Picher-Martel V, Valdmanis PN, Gould PV, et al. From animal models to human disease: a genetic approach for personalized medicine in ALS[J]. Acta Neuropathol Commun, 2016, 4: 70. DOI:10.1186/s40478-016-0340-5 |
| [6] | Johann S, Heitzer M, Kanagaratnam M, et al. NLRP3 inflammasome is expressed by astrocytes in the SOD1 mouse model of ALS and in human sporadic ALS patients[J]. Glia, 2015, 63: 2260–2273. DOI:10.1002/glia.v63.12 |
| [7] | Mathis S, Couratier P, Julian A, et al. Management and therapeutic perspectives in amyotrophic lateral sclerosis[J]. Expert Rev Neurother, 2017, 17: 263–276. DOI:10.1080/14737175.2016.1227705 |
| [8] | Rosen DR, Siddique T, Patterson D, et al. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis[J]. Nature, 1993, 362: 59–62. DOI:10.1038/362059a0 |
| [9] | Miller RG, Mitchell JD, Moore DH. Riluzole for amyotrophic lateral sclerosis (ALS)/motor neuron disease (MND)[J]. Cochrane Database Syst Rev, 2012, 3: 14. |
| [10] | Yoshida H, Yanai H, Namiki Y, et al. Neuroprotective effects of edaravone: a novel free radical scavenger in cerebrovascular injury[J]. CNS Drug Rev, 2006, 12: 9–20. DOI:10.1111/cns.2006.12.issue-1 |
| [11] | Martinez A, Palomo Ruiz MD, Perez DI, et al. Drugs in clinical development for the treatment of amyotrophic lateral sclerosis[J]. Expert Opin Investig Drugs, 2017, 26: 403–414. DOI:10.1080/13543784.2017.1302426 |
| [12] | Bucchia M, Ramirez A, Parente V, et al. Therapeutic development in amyotrophic lateral sclerosis[J]. Clin Ther, 2015, 37: 668–680. DOI:10.1016/j.clinthera.2014.12.020 |
| [13] | Wong PC, Pardo CA, Borchelt DR, et al. An adverse property of a familial ALS-linked SOD1 mutation causes motor neuron disease characterized by vacuolar degeneration of mitochondria[J]. Neuron, 1995, 14: 1105–1116. DOI:10.1016/0896-6273(95)90259-7 |
| [14] | Bruijn LI, Becher MW, Lee MK, et al. ALS-linked SOD1 mutant G85R mediates damage to astrocytes and promotes rapidly progressive disease with SOD1-containing inclusions[J]. Neuron, 1997, 18: 327–338. DOI:10.1016/S0896-6273(00)80272-X |
| [15] | Ripps ME, Huntley GW, Hof PR, et al. Transgenic mice expressing an altered murine superoxide dismutase gene provide an animal model of amyotrophic lateral sclerosis[J]. Proc Natl Acad Sci U S A, 1995, 92: 689–693. DOI:10.1073/pnas.92.3.689 |
| [16] | Saberi S, Stauffer JE, Schulte DJ, et al. Neuropathology of amyotrophic lateral sclerosis and its variants[J]. Neurol Clin, 2015, 33: 855–876. DOI:10.1016/j.ncl.2015.07.012 |
| [17] | Shibata N. Transgenic mouse model for familial amyotrophic lateral sclerosis with superoxide dismutase-1 mutation[J]. Neuropathology, 2001, 21: 82–92. |
| [18] | Gurney ME, Pu H, Chiu AY, et al. Motor neuron degeneration in mice that express a human Cu, Zn superoxide dismutase mutation[J]. Science, 1994, 264: 1772–1775. DOI:10.1126/science.8209258 |
| [19] | Siddique T, Deng HX. Genetics of amyotrophic lateral sclerosis[J]. Hum Mol Genet, 1996, 5: 1465–1470. DOI:10.1093/hmg/5.Supplement_1.1465 |
| [20] | Filali M, Lalonde R, Rivest S. Sensorimotor and cognitive functions in a SOD1G37R transgenic mouse model of amyotrophic lateral sclerosis[J]. Behav Brain Res, 2011, 225: 215–221. DOI:10.1016/j.bbr.2011.07.034 |
| [21] | Quarta E, Bravi R, Scambi I, et al. Increased anxiety-like behavior and selective learning impairments are concomitant to loss of hippocampal interneurons in the presymptomatic SOD1G93A ALS mouse model[J]. J Comp Neurol, 2015, 523: 1622–1638. DOI:10.1002/cne.23759 |
| [22] | McGoldrick P, Joyce PI, Fisher EM, et al. Rodent models of amyotrophic lateral sclerosis[J]. Biochim Biophys Acta, 2013, 1832: 1421–1436. DOI:10.1016/j.bbadis.2013.03.012 |
| [23] | Venkova-Hristova K, Christov A, Kamaluddin Z, et al. Progress in therapy development for amyotrophic lateral sclerosis[J]. Neurol Res Int, 2012, 2012: 187234. |
| [24] | Gurney ME, Fleck TJ, Himes CS, et al. Riluzole preserves motor function in a transgenic model of familial amyotrophic lateral sclerosis[J]. Neurology, 1998, 50: 62–66. |
| [25] | Ito H, Wate R, Zhang J, et al. Treatment with edaravone, initiated at symptom onset, slows motor decline and decreases SOD1 deposition in ALS mice[J]. Exp Neurol, 2008, 213: 448–455. DOI:10.1016/j.expneurol.2008.07.017 |
| [26] | Juranek JK, Daffu GK, Geddis MS, et al. Soluble RAGE treatment delays progression of amyotrophic lateral sclerosis in SOD1 mice[J]. Front Cell Neurosci, 2016, 10: 117. |
| [27] | Ozdinler PH, Benn S, Yamamoto TH, et al. Corticospinal motor neurons and related subcerebral projection neurons undergo early and specific neurodegeneration in hSOD1G93A transgenic ALS mice[J]. J Neurosci, 2011, 31: 4166–4177. DOI:10.1523/JNEUROSCI.4184-10.2011 |
| [28] | Gurney ME. The use of transgenic mouse models of amyotrophic lateral sclerosis in preclinical drug studies[J]. J Neurol Sci, 1997, 152: S67–S73. DOI:10.1016/S0022-510X(97)00247-5 |
| [29] | Aoki M. Amyotrophic lateral sclerosis: recent insights from transgenic animal models with SOD1 mutations[J]. Rinsho Shinkeigaku, 2004, 44: 788–791. |
| [30] | Rosser E, Grey R, Neal D, et al. Supporting clinical leadership through action: the nurse consultant role[J]. J Clin Nurs, 2017, 12: 4768–4776. |
| [31] | Indo HP, Davidson M, Yen HC, et al. Evidence of ROS generation by mitochondria in cells with impaired electron transport chain and mitochondrial DNA damage[J]. Mitochondrion, 2007, 7: 106–118. DOI:10.1016/j.mito.2006.11.026 |
| [32] | Kaus A, Sareen D. ALS patient stem cells for unveiling disease signatures of motoneuron susceptibility: perspectives on the deadly mitochondria, ER stress and calcium triad[J]. Front Cell Neurosci, 2015, 9: 448. |
| [33] | Zhu Y, Fotinos A, Mao LL, et al. Neuroprotective agents target molecular mechanisms of disease in ALS[J]. Drug Discov Today, 2015, 20: 65–75. DOI:10.1016/j.drudis.2014.08.016 |
| [34] | Pellegrini-Giampietro DE, Cherici G, Alesiani M, et al. Excitatory amino acid release and free radical formation may cooperate in the genesis of ischemia-induced neuronal damage[J]. J Neurosci, 1990, 10: 1035–1041. DOI:10.1523/JNEUROSCI.10-03-01035.1990 |
| [35] | Scott S, Kranz JE, Cole J, et al. Design, power, and interpretation of studies in the standard murine model of ALS[J]. Amyotroph Lateral Scler, 2008, 9: 4–15. DOI:10.1080/17482960701856300 |
| [36] | Garbuzova-Davis S, Kurien C, Thomson A, et al. Endothelial and astrocytic support by human bone marrow stem cell grafts into symptomatic ALS mice towards blood-spinal cord barrier repair[J]. Sci Rep, 2017, 7: 884. DOI:10.1038/s41598-017-00993-0 |
| [37] | Mancuso R, Osta R, Navarro X. Presymptomatic electrophysiological tests predict clinical onset and survival in SOD1G93A ALS mice[J]. Muscle Nerve, 2014, 50: 943–949. DOI:10.1002/mus.v50.6 |
| [38] | Feng X, Peng Y, Liu M, et al. DL-3-n-butylphthalide extends survival by attenuating glial activation in a mouse model of amyotrophic lateral sclerosis[J]. Neuropharmacology, 2012, 62: 1004–1010. DOI:10.1016/j.neuropharm.2011.10.009 |
| [39] | Liu YC, Chiang PM, Tsai KJ. Disease animal models of TDP-43 proteinopathy and their pre-clinical applications[J]. Int J Mol Sci, 2013, 14: 20079–20111. DOI:10.3390/ijms141020079 |
| [40] | Xu YF, Zhang YJ, Lin WL, et al. Expression of mutant TDP-43 induces neuronal dysfunction in transgenic mice[J]. Mol Neurodegener, 2011, 6: 73. DOI:10.1186/1750-1326-6-73 |
| [41] | Arnold ES, Ling SC, Huelga SC, et al. ALS-linked TDP-43 mutations produce aberrant RNA splicing and adult-onset motor neuron disease without aggregation or loss of nuclear TDP-43[J]. Proc Natl Acad Sci U S A, 2013, 110: E736–E745. DOI:10.1073/pnas.1222809110 |
| [42] | Swarup V, Phaneuf D, Bareil C, et al. Pathological hallmarks of amyotrophic lateral sclerosis/frontotemporal lobar degeneration in transgenic mice produced with TDP-43 genomic fragments[J]. Brain, 2011, 134: 2610–2626. DOI:10.1093/brain/awr159 |
| [43] | Hatzipetros T, Bogdanik LP, Tassinari VR, et al. C57BL/6J congenic Prp-TDP-43A315T mice develop progressive neurodegeneration in the myenteric plexus of the colon without exhibiting key features of ALS[J]. Brain Res, 2014, 1584: 59–72. DOI:10.1016/j.brainres.2013.10.013 |
| [44] | Huang C, Tong J, Bi F, et al. Mutant TDP-43 in motor neurons promotes the onset and progression of ALS in rats[J]. J Clin Invest, 2012, 122: 107–118. DOI:10.1172/JCI59130 |
| [45] | Wegorzewska I, Bell S, Cairns NJ, et al. TDP-43 mutant transgenic mice develop features of ALS and frontotemporal lobar degeneration[J]. Proc Natl Acad Sci U S A, 2009, 106: 18809–18814. DOI:10.1073/pnas.0908767106 |
| [46] | Kabashi E, Valdmanis PN, Dion P, et al. TARDBP mutations in individuals with sporadic and familial amyotrophic lateral sclerosis[J]. Nat Genet, 2008, 40: 572–574. DOI:10.1038/ng.132 |
| [47] | Neumann M, Sampathu DM, Kwong LK, et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis[J]. Science, 2006, 314: 130–133. DOI:10.1126/science.1134108 |
| [48] | Blokhuis AM, Groen EJ, Koppers M, et al. Protein aggregation in amyotrophic lateral sclerosis[J]. Acta Neuropathol, 2013, 125: 777–794. DOI:10.1007/s00401-013-1125-6 |
| [49] | Crozat A, Aman P, Mandahl N, et al. Fusion of CHOP to a novel RNA-binding protein in human myxoid liposarcoma[J]. Nature, 1993, 363: 640–644. DOI:10.1038/363640a0 |
| [50] | Gal J, Zhang J, Kwinter DM, et al. Nuclear localization sequence of FUS and induction of stress granules by ALS mutants[J]. Neurobiol Aging, 2011, 32: 2323. e27–40. DOI:10.1016/j.neurobiolaging.2010.06.010 |
| [51] | Nolan M, Talbot K, Ansorge O. Pathogenesis of FUS-associated ALS and FTD: insights from rodent models[J]. Acta Neuropathol Commun, 2016, 4: 99. DOI:10.1186/s40478-016-0358-8 |
| [52] | Sharma A, Lyashchenko AK, Lu L, et al. ALS-associated mutant FUS induces selective motor neuron degeneration through toxic gain of function[J]. Nat Commun, 2016, 7: 10465. DOI:10.1038/ncomms10465 |
| [53] | Shelkovnikova TA, Peters OM, Deykin AV, et al. Fused in sarcoma (FUS) protein lacking nuclear localization signal (NLS) and major RNA binding motifs triggers proteinopathy and severe motor phenotype in transgenic mice[J]. J Biol Chem, 2013, 288: 25266–25274. DOI:10.1074/jbc.M113.492017 |
| [54] | Rabouille C, Alberti S. Cell adaptation upon stress: the emerging role of membrane-less compartments[J]. Curr Opin Cell Biol, 2017, 47: 34–42. DOI:10.1016/j.ceb.2017.02.006 |
| [55] | Ramaswami M, Taylor JP, Parker R. Altered ribostasis: RNA-protein granules in degenerative disorders[J]. Cell, 2013, 154: 727–736. DOI:10.1016/j.cell.2013.07.038 |
| [56] | Ittner LM, Halliday GM, Kril JJ, et al. FTD and ALS--translating mouse studies into clinical trials[J]. Nat Rev Neurol, 2015, 11: 360–366. DOI:10.1038/nrneurol.2015.65 |
| [57] | Koppers M, Blokhuis AM, Westeneng HJ, et al. C9orf72 ablation in mice does not cause motor neuron degeneration or motor deficits[J]. Ann Neurol, 2015, 78: 426–438. DOI:10.1002/ana.24453 |
| [58] | Balendra R, Isaacs AM. C9orf72-mediated ALS and FTD: multiple pathways to disease[J]. Nat Rev Neurol, 2018, 14: 544–558. DOI:10.1038/s41582-018-0047-2 |
| [59] | Moens TG, Partridge L, Isaacs AM. Genetic models of C9orf72: what is toxic?[J]. Curr Opin Genet Dev, 2017, 44: 92–101. DOI:10.1016/j.gde.2017.01.006 |
| [60] | Lee EB, Lee VM, Trojanowski JQ. Gains or losses: molecular mechanisms of TDP43-mediated neurodegeneration[J]. Nat Rev Neurosci, 2011, 13: 38–50. |
| [61] | Iguchi Y, Katsuno M, Niwa J, et al. Loss of TDP-43 causes age-dependent progressive motor neuron degeneration[J]. Brain, 2013, 136: 1371–1382. DOI:10.1093/brain/awt029 |
| [62] | Boillee S, Peschanski M, Junier MP. The wobbler mouse: a neurodegeneration jigsaw puzzle[J]. Mol Neurobiol, 2003, 28: 65–106. DOI:10.1385/MN:28:1 |
| [63] | Pioro EP, Mitsumoto H. Animal models of ALS[J]. Clin Neurosci, 1995, 3: 375–385. |
| [64] | Resch K, Korthaus D, Wedemeyer N, et al. Homology between human chromosome 2p13.3 and the wobbler critical region on mouse chromosome 11: comparative high-resolution mapping of STS and EST loci on YAC/BAC contigs[J]. Mamm Genome, 1998, 9: 893–989. DOI:10.1007/s003359900890 |
| [65] | Dave KR, Bradley WG, Perez-Pinzon MA. Early mitochondrial dysfunction occurs in motor cortex and spinal cord at the onset of disease in the Wobbler mouse[J]. Exp Neurol, 2003, 182: 412–420. DOI:10.1016/S0014-4886(03)00091-8 |
| [66] | Ludolph AC, Bendotti C, Blaugrund E, et al. Guidelines for preclinical animal research in ALS/MND: a consensus meeting[J]. Amyotroph Lateral Scler, 2010, 11: 38–45. DOI:10.3109/17482960903545334 |
| [67] | Dal Canto MC, Gurney ME. Neuropathological changes in two lines of mice carrying a transgene for mutant human Cu, Zn SOD, and in mice overexpressing wild type human SOD: a model of familial amyotrophic lateral sclerosis (FALS)[J]. Brain Res, 1995, 676: 25–40. DOI:10.1016/0006-8993(95)00063-V |
| [68] | Dal Canto MC, Gurney ME. A low expressor line of transgenic mice carrying a mutant human Cu, Zn superoxide dismutase (SOD1) gene develops pathological changes that most closely resemble those in human amyotrophic lateral sclerosis[J]. Acta Neuropathol, 1997, 93: 537–550. DOI:10.1007/s004010050650 |
| [69] | Matus S, Medinas DB, Hetz C. Common ground: stem cell approaches find shared pathways underlying ALS[J]. Cell Stem Cell, 2014, 14: 697–699. DOI:10.1016/j.stem.2014.05.001 |
| [70] | Robinton DA, Daley GQ. The promise of induced pluripotent stem cells in research and therapy[J]. Nature, 2012, 481: 295–305. DOI:10.1038/nature10761 |
| [71] | Myszczynska M, Ferraiuolo L. New in vitro models to study amyotrophic lateral sclerosis[J]. Brain Pathol, 2016, 26: 258–265. DOI:10.1111/bpa.12353 |
| [72] | Yang S, He R, Zhang FY, et al. Application of cell co-culture techniques in central nervous system diseases[J]. Acta Pharm Sin (药学学报), 2016, 51: 338–346. |
 2019, Vol. 54
2019, Vol. 54


