2. 成都中医药大学附属医院中心实验室, 四川 成都 610072;
3. 成都市三勒浆药业集团, 四川 成都 610000;
4. 乳品营养与功能四川省重点实验室, 四川 成都 610000;
5. 四川大学化学学院, 四川 成都 610064
2. Central Laboratory, Teaching Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610072, China;
3. Sanajon Pharmaceutical Group, Chengdu 610000, China;
4. Sichuan Key Laboratory of Nutrition and Function of Dairy, Chengdu 610000, China;
5. College of Chemistry, Sichuan University, Chengdu 610064, China
鞣花酸(ellagic acid, EA)是一种天然存在的多酚化合物, 具有很强的抗氧化[1]和抗癌特性, 大量存在于各种浆果、干果和中药材中[2]。EA抗肿瘤活性主要归因于直接的抗增殖和凋亡作用。同时, 可抑制肿瘤细胞的迁移、细胞外基质的侵袭和血管生成, 还可增加肿瘤对化疗和放疗的敏感性[3, 4]。此外, EA还具有较强的抗炎[5]、保肝[6]、抗辐射[7]、降血脂[8]及保护神经系统[9]、预防糖尿病[10]和心血管疾病[11]等作用。鉴于其突出的抗癌作用和健康益处, 在欧美国家被作为潜在的抗肿瘤活性成分及食品、化妆品的补充膳食剂。
EA在纯水中极为难溶, 溶解度小于9.3 μg·mL-1 (pH 7.4)[12], 这与其特殊的平面结构有关(图 1)[13]。EA中苯环容易与其他EA分子的苯环形成疏水作用, 形成结晶。虽然分子中羟基有一定水溶性, 但分子间的氢键作用更倾向形成较为稳定的规则层状晶体结构[13, 14]。因此, 当EA以传统的固体制剂形式服用时, 体内吸收差[15]、生物利用度低[16], 被归为BCS Ⅳ类药物[17]。为提高其生物利用度, β-环糊精[17]、纳米囊泡[18]和固体分散体[19]被用于EA的增溶, 使其溶解度达到了39 μg·mL-1以上。但有趣的是, 一些果汁、保健饮品[20]和中药口服液中EA的含量远高于该数值[21]。本课题组发现中药三勒浆口服液中EA的含量高达500 μg·mL-1[22], 溶解度是纯水的50倍以上。这说明当EA以分子态存在于液体制剂时, 更能确保其药效的发挥。然而, 液体制剂普遍存在稳定性差的共性问题。EA分子在存放过程中逐渐析出, 转移形成沉淀, 导致药效的降低。这表明液体制剂中EA的增溶体系并不十分稳定。因此, 探寻中药口服液中EA分子态稳定储存的制剂学原理和调控策略非常必要。三勒浆口服液(Sanlejiang oral liquid, SOL)处方源于印度阿育吠陀医学及藏医名方三果汤(哲布松散), 由余甘子、诃子和毛诃子等比例组成。现代药理学研究表明, 该处方具有显著的抗氧化[23]、抗肿瘤[24]、抗牙龈炎[25]和降血脂[26]等药理作用, 成为风靡欧美的补充膳食剂。SOL在存放过程中不断形成沉淀物, 1~2个月后会在瓶底产生明显的片状沉淀, 其主要成分就是EA, 严重影响了产品的外观、活性及患者心理。基于上述特征, SOL被选择作为EA稳定性的研究对象。
|
Figure 1 Structure of ellagic acid (EA) |
一般地, 化学物质的溶解度随温度的升高而增加。但本课题组在研究中偶然发现, SOL存在低温下沉淀量明显少于室温的反常现象, 储存3个月仅有极少量的肉眼可见沉淀。因此, 本文以该反常现象为切入点, 在3个月储存期内探寻沉淀物的形成过程与证据。SOL分别在低温(4 ℃)、室温(25 ℃)与高温(40 ℃)条件下储存3个月, 采用沉淀物重量、上清液-沉淀物高效液相色谱(high performance liquid chromatography, HPLC)轮廓变化分析、沉淀物形态观察、稳定性指数、重均分子量、表面张力和黏度等表征方法, 从物理和化学两个角度分析EA分子稳定存在的制剂学原理, 以期阐明EA影响中药口服液澄清度的微观机制, 为EA的高效利用提供新的理论基础与调控策略。
材料与方法仪器 Shimadzu LC-20AT液相色谱仪(日本岛津公司); Milli-Q超纯水仪(美国Millipore公司); 马尔文粒径仪Zetasizer Nano S90 (英国马尔文公司); Turbiscan Lab Expert多重光稳定性分析仪(法国Formulation公司); DCAT-21表面张力分析仪(德国Dataphysics公司); DM-2500显微镜(德国莱卡公司); LVDV-1T型黏度计(上海方瑞仪器有限公司); KQ-500DE型数控超声仪(昆山市超声仪器有限公司); HGC-12A型氮吹仪(天津恒奥科技有限公司)。
药品和试剂 三勒浆口服液(四川华美药业有限公司, 批号: 1804001)。色谱级甲醇(美国Fisher公司); 色谱级甲酸、分析级甲醇、甲苯、盐酸、氢氧化钠、二甲基亚砜(dimethyl sulfoxide, DMSO) (成都科隆化学品公司); 对照品没食子酸(批号: 4051109, 纯度≥98%)、没食子儿茶素没食子酸酯(批号: PRF7072601, 纯度≥98%)、没食子儿茶素(批号: 14092403, 纯度≥98%)、儿茶素(批号: 14051602, 纯度≥98%)、表儿茶素没食子酸酯(批号: PRF805242, 纯度≥98%)、表没食子儿茶素没食子酸酯(批号: PRF15121022, 纯度≥98%)、柯里拉京(批号: PRF7102406, 纯度≥98%)、鞣花酸(批号: PRF7101305, 纯度≥98%)、诃子次酸(批号: AP8070902, 纯度≥98%) (成都普瑞法科技开发有限公司); 诃黎勒酸(批号: CHB171222, 纯度≥98%)、诃子酸(批号: CHB171226, 纯度≥98%)、没食子酸乙酯(批号: CHB171109, 纯度≥98%) (成都克洛玛生物科技有限公司)。
对照品溶液制备 精密称取各对照品适量, 加50%甲醇制成含没食子酸25 μg·mL-1、没食子儿茶素没食子酸酯62 μg·mL-1、没食子儿茶素36 μg·mL-1、儿茶素20 μg·mL-1、表儿茶素没食子酸酯56 μg·mL-1、表没食子儿茶素没食子酸酯92 μg·mL-1、柯里拉京132 μg·mL-1、鞣花酸116 μg·mL-1、诃子次酸104 μg·mL-1、诃黎勒酸42 μg·mL-1、诃子酸52 μg·mL-1和没食子酸乙酯32 μg·mL-1对照品溶液。
供试品溶液制备 取SOL (30 mL), 倒入离心管中, 在5 500 r·min-1条件下离心10 min。精密吸取1 mL上清液, 以50%甲醇稀释5倍, 作为上清液供试品。倾去多余上清液, 加入适量超纯水润洗沉淀物, 再次离心。如此重复两次, 倾去上清液, 沉淀以氮吹仪干燥, 称重后加入DMSO 20 mL超声溶解作为沉淀物供试品溶液。
储存过程上清液与沉淀物指纹图谱变化 实验以15天为间隔, 分别跟踪调查了90天内3种温度条件下(5、25和40 ℃) SOL的上清液和沉淀的指纹图谱。并对所采集的上清液和沉淀的EA峰面积进行提取分析。指纹图谱条件:色谱柱: Welchrom C18色谱柱(250 mm×4.6 mm, 5 μm); 流动相: 0.2%磷酸水-甲醇, 采用梯度洗脱, 洗脱程序: 0~6 min, 5%甲醇; 6~15 min, 5%~7%甲醇; 15~20 min, 7%~15%甲醇; 20~25 min, 15%~21%甲醇; 25~31 min, 21%~22%甲醇; 31~41 min, 22%甲醇; 41~47 min, 22%~28%甲醇; 47~51 min, 28%~32%甲醇; 51~57 min, 32%~38%甲醇; 57~70 min, 38%~45%甲醇; 70~80 min, 45%~65%甲醇; 检测波长为270 nm; 体积流量为1.0 mL·min-1; 柱温: 25 ℃; 进样量: 10 μL[22]。
储存前后上清液与沉淀物指纹图谱化学轮廓的变化 为研究SOL在室温及升温条件下的化学变化, 两种温度下储存90天前后的上清液HPLC数据分别使用偏最小二乘法判别分析(partial least squares discriminant analysis, PLS-DA)和S-plot多元统计方法进行分析差异标志物。按供试品制备方法项下制备上清液供试品。所有样品HPLC数据使用LC-solution软件版本1.22sp1 (日本岛津公司)处理。并将LC数据文件导入中药色谱指纹图谱相似度评价系统(版本2012 130723, 中国药典委员会)对齐并过滤数据。创建化合物峰表, 包括成分保留时间、分组和峰面积等信息。将每个样品的数据标准化并导入软件SIMCA-P 13.0 (瑞典Umetrics公司), 使用多元统计进行分析(S-plot、PLS-DA)并计算。S-plot图中每个点代表保留时间, X轴代表变量, 离原点越远的数据点的相对贡献度越大, S-plot图两端的点代表组间可信度最高的成分[27]。
水解鞣质模型溶液的制备 精密称取柯里拉京和诃黎勒酸对照品适量, 分别加入纯水配制为各含柯里拉京52.5 μg·mL-1、诃黎勒酸54.5 μg·mL-1的溶液。将溶液pH值调为3, 过0.22微孔滤膜即得模型溶液。首先使用HPLC指纹图谱方法获得两种溶液的初始色谱图, 并将各模型溶液分为3份, 称定重量, 置于5、25和40 ℃恒温环境下, 1周后取出并补足重量, 以同样方法获得HPLC指纹图谱。
多重光稳定性分析仪方法 多重光稳定性分析仪可实时获得样品透射光强度(transmission, T)、背散射光强度(backscattering, BS)、稳定性指数(turbiscan stability index, TSI)和粒径等重要的物理参数。TSI是反映样品稳定性的重要参数, TSI上升表示稳定性变差。样品中发生任何不稳定现象都会对T和BS信号强度产生细微影响。这种影响将被记录分析, 表征各种不稳定现象, 包括絮凝、分层及沉淀等。TSI将所有测量数据纳入其中进行计算, 可在短期内对样品稳定性进行预测和评估。
实验中样品在880 nm近红外光源下每5 min连续扫描24 h。扫描高度为50 mm, 平衡时间为20 min, 测试温度设定分别为5、25和40 ℃。光学参数设定如下:连续相光透射强度(T0)为99.99% (水), 分散相折射率(np)为1.36, 连续相折射率(nf)为1.33。数据使用Turbiscan Easy Sof软件(版本2.2.0.82, 法国Formulaction公司)处理, 计算公式如下[28]:
| $ {\rm{TSI}} = \sqrt {\frac{{\sum\limits_{i = 1}^i {{{({x_i} - {x_T})}^2}} }}{{n - 1}}} $ | (1) |
其中, xi为单次测量的平均透射率, xT为xi平均值, xT = (x1 + x2 + … xi + 1 … + xn)/ n, n为扫描次数。
粒径计算基于朗伯-比尔定律。透射光强度(T)与颗粒体积分数(φ)和平均粒径(d)之间的具体数学关系如下:
| $ T\left( {l, {r_i}} \right) = {T_0}{e^{ - \frac{{2{r_i}}}{l}}}, l\left( {d, \phi } \right) = \frac{{2d}}{{3\phi Qs}} $ | (2) |
其中, ri为电池的内径, T0为连续相的透射光强度, l为光子平均自由步长。
SOL不同温度下物理参数测定方法
显微观察及制片方法吸取少量SOL, 直接滴于载玻片上, 盖好盖玻片, 采用DP73型CCD图像采集和计算机图像分析系统完成普通显微观察及图像采集。
表面张力测定方法将仪器设置为5、25和40 ℃温度下, 加入SOL 30 mL, 温度平衡后使用Wilhelmy吊片法分别测定表面张力。
黏度测定方法将仪器分别设置为5、25和40 ℃温度下, 选择1号转子, 加入SOL 20 mL, 转速设为12 r·min-1, 分别测定黏度。
Zeta电位测定方法将仪器温度分别设置为5、25和40 ℃温度下, 置于马尔文Nano S90毛细管样品池中, 设定分散剂为水, 样品折光率为1.36, 并测定其zeta电位。
分子量测定方法 将仪器设置为5、25和40 ℃温度下, 置于马尔文Nano S90样品池中, 样品折光率为1.36, 标准物质为甲苯, 设置第1个样本为纯水, 其余分别稀释2~10倍, 依次测量含SOL 0、0.1、0.2、0.3、0.4和0.5的样品散射光强度, 将其与标准物(甲苯)产生的散射进行比较, 计算分子量。
统计学方法 统计数据处理使用的软件为SPSS V12.0版本, 统计方法为ANOVA单因素方差分析, P < 0.05具有统计学差异。
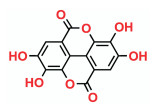
结果 1 化学稳定性测试 1.1 不同温度下SOL沉淀物的重量变化及分型通过离心沉淀量统计发现, 3种温度条件下低温的沉淀量明显低于室温和高温的沉淀量(图 2A), 表明低温有利于SOL的稳定性。室温下的上清液和沉淀指纹图谱(图 2B, C)可发现, EA在上清液中不断减少, 说明EA直接进入沉淀。通过换算比对发现, 上清液中损失的EA和沉淀中增加的EA并不一致, 沉淀中EA远多于上清液中损失的EA。因此, 推测EA来源可能有两种途径:一部分来自SOL中EA自身沉淀, 即上清液损失的EA量, 定义为物理沉淀; 另一部分可能来自于化学转化形成的沉淀, 因此沉淀中EA减去上清液中损失的EA定义为化学沉淀。计算公式如下:
| $ {S_{\rm{P}}} = {\rm{ }}5{\rm{ }}\left( {{p_0} - {p_n}} \right) $ |
|
Figure 2 The results of centrifugation and chromatographic data analysis under different temperature storage conditions within three months. A: Centrifugal sedimentation results; B: Supernatant chromatographic results at 25 ℃; C: Sedimentation chromatographic results at 25 ℃. Comparison of total ellagic acid precipitation, chemical precipitation and physical precipitation at 5 ℃ (D), 25 ℃ (E), 40 ℃ (F). GA: Gallic acid; CA: Chebulic acid; GC: Gallocatechin; C: Catechin; CL: Corilagin; GCG: Gallocatechin gallate; CLA: Chebulagic acid; EA: Ellagic acid |
其中, SP为EA物理沉淀量, p0为第0天时上清液色谱图中EA的峰面积, pn为第n天时上清液中EA的峰面积。
| $ {S_{\rm{c}}} = 2{P_n}/3{\rm{ }} - {S_{\rm{P}}} $ |
其中, Sc为EA化学沉淀量, pn为第n天时沉淀物色谱图中EA的峰面积。
EA物理沉淀量与化学沉淀量在低温(5 ℃)、室温(25 ℃)和高温(40 ℃)条件下的计算结果如图 2D~F。
在低温下, 沉淀物指纹图谱中显示的EA含量(总量)在45天内与物理沉淀量并不匹配, 计算出的化学沉淀为负值。这可能与EA形成的胶粒有关, 在这段时间内, EA胶粒有所聚集但并未形成沉淀, 因而在离心过程中EA并未完全进入沉淀, 但由于自身较大的粒径在制样过程中被滤膜拦截。45天后, 沉淀物总量和物理沉淀量基本相当, 几乎无化学沉淀, 沉淀物的产生只与自身物理不稳定性有关。
在室温与高温下, 沉淀物中既有EA的物理沉淀物, 也有化学沉淀物。随着储存时间的延长, 沉淀物中EA的含量不断增加。不同的是, 室温条件下, EA的物理沉淀量稍高于化学沉淀量; 而高温条件下, 物理沉淀量几乎没有上升, 说明物理沉淀量快速到达了溶解—沉淀平衡, 但EA的化学沉淀量持续上升, 且远高于物理沉淀量。上述结果表明, EA沉淀形成与温度密切相关, 低温显著抑制了其化学沉淀的形成, 同时也延缓了物理沉淀的产生。
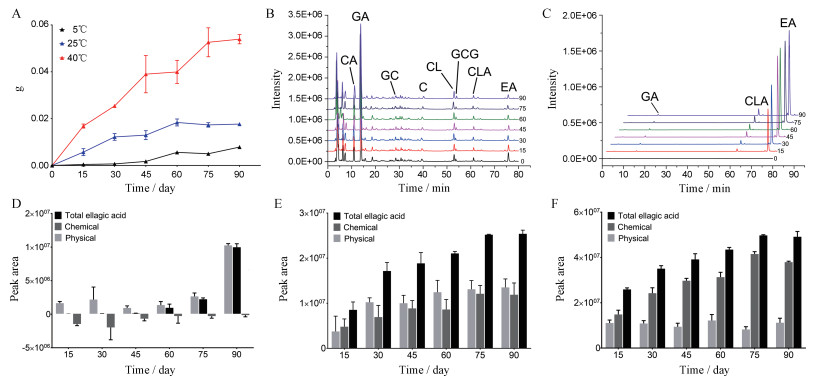
1.2 多元统计分析研究储存前后上清液的差异化合物PLS-DA分析结果见图 3A。室温下, R2X = 0.910, R2Y = 0.993, Q2 = 0.981说明模型质量良好。为防止过度拟合, 进行内部验证测试。设定排列为100, 室温下, R2 = (0.0, 0.326), Q2 = (0.0, -0.211)结果见图 3B。进一步采用S-plot寻找差异化学标志物。图 3C显示储存前后化学成分发生了显著变化。
|
Figure 3 The results of sanlejiang oral liquid (SOL) supernatant before and after storage at 25 ℃ and 40 ℃ by multivariate statistical analysis (PLS-DA, S-plot); A, D: PLS-DA results; B, E: Model validation results; C, F: S-plot results |
在室温下, 鉴定出6个显著变量, 分别为没食子酸(RT = 13.993)、鞣花酸(RT = 75.932)、没食子儿茶素(RT = 28.653)、柯里拉京(RT = 53.158)、诃黎勒酸(RT = 62.710)和儿茶素(RT = 39.984)。柯里拉京和没食子酸在储存后有所增加, 其余呈增加趋势的化合物未被鉴定出, 可能是水解或氧化反应产生的新化合物。
在高温下, 图 3D中R2X = 0.948, R2Y = 0.991, Q2 = 0.961, 模型质量良好。内部验证测试R2 = (0.0, 0.206), Q2 = (0.0, -0.232), 结果见图 3E。图 3F鉴定出7个显著变量, 分别为没食子酸(RT = 13.949)、诃子次酸(RT =11.239)、鞣花酸(RT = 75.907)、儿茶素(RT = 39.945)、没食子儿茶素(RT = 28.632)、柯里拉京(RT = 52.739)、诃黎勒酸(RT = 62.812)。结果表明, 高温下SOL化学变化表现更为复杂, EA和没食子酸的变化也更明显。从室温和高温结果分析可知, 诃黎勒酸和柯里拉京均具有较为明显的差异。这是由于SOL的pH值较低, 在2.5~3.5之间, 该条件下一些大分子水解鞣质由于具有不稳定的酯键, 可发生水解反应。其中, 诃黎勒酸首先水解生成柯里拉京和诃子次酸等物质[29], 而柯里拉京可继续水解, 产生了大量的EA和没食子酸[30]。这解释了实验中没食子酸和EA含量增加的现象, 水解生成的EA则由于物理不稳定性而产生了更多的沉淀物。
从图 3C中可以发现, 这种作用在室温条件下依然存在, 但由于温度降低抑制了反应, 故差异较高温更小。实验发现, 一些儿茶素类物质在温度上升的样品中显著降低。可能是类物质易在高温下聚合成缩合鞣质所导致。
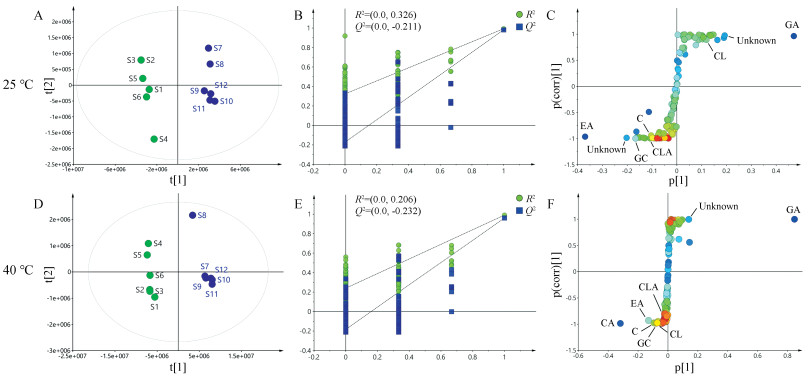
1.3 模型溶液验证实验结果如图 4所示。不同温度下(图 4A~C)两种对照品模型溶液均有不同程度的下降。诃黎勒酸溶液(图 4D~F)中发现有新生成的没食子酸和EA, 并呈上升趋势, 而柯里拉京溶液(图 4G~I)也是如此。实验还发现, 不同温度下降解速率与温度呈正相关, 这与上述结果一致。该实验进一步说明SOL中水解鞣质化学稳定性与温度有关, 并验证了诃黎勒酸和柯里拉京的化学不稳定性导致EA的产生。
|
Figure 4 Chromatogram of the corilagin and chebulagic acid model solution at 5 ℃ (A), 25 ℃ (B), 40 ℃ (C). Statistical results of chemical composition peak area in the chromatogram of the chebulagic acid model solution at 5 ℃ (D), 25 ℃ (E), 40 ℃ (F) and corilagin model solution at 5 ℃ (G), 25 ℃ (H), 40 ℃ (I) |
上述实验证明SOL物理和化学的稳定性与温度密切相关。低温抑制了化学降解, 因而化学稳定性提高, 但降温过程对提高物理稳定性机制尚未明确, 因此进一步考察了不同温度下SOL物性变化, 试图阐明其稳定机制。
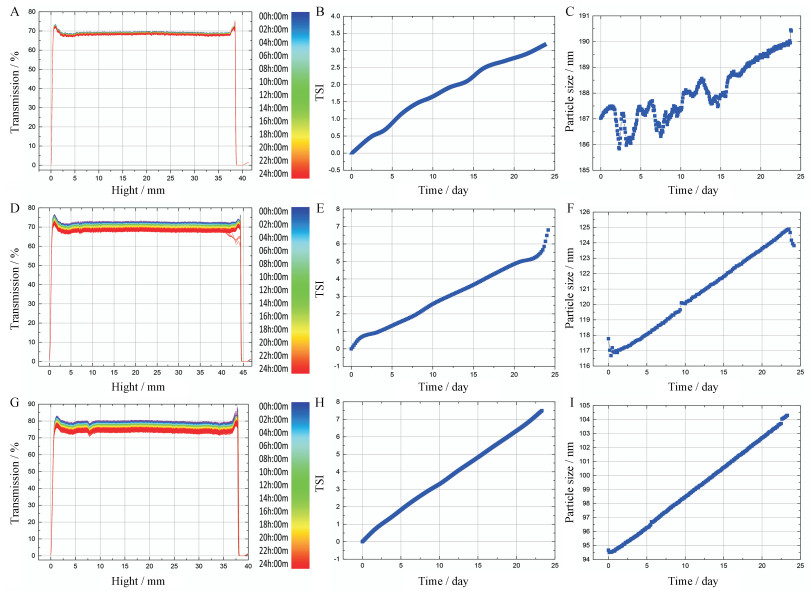
2.1 多重光稳定性分析仪分析不同温度下稳定性Turbiscan Lab结果如图 5所示, SOL的温度越低, 稳定性越高。低温降低了透光率(图 5A)、稳定性较高(图 5B)。虽然初始粒径较大, 但该温度下粒径在186~190 nm之间波动, 较为稳定(图 5C); 室温下透光率有一定增加, TSI和粒径呈直线上升的趋势, 稳定性较低温下降低(图 5D~F)。高温下SOL的情况(图 5G~I)与室温相似, 但稳定性更差。因此, 根据SOL不同温度下物理参数来看, 升温在一定程度上破坏了多酚分子缔合胶体结构, 使得部分EA分子失去多酚分子保护而沉淀; 降低温度使得SOL获得较大的初始粒径, 增大了多酚形成的缔合胶体缔合度[31], 保护了EA分子, 有利于其稳定性。
|
Figure 5 Turbiscan Lab results of different temperature experiments. A, B, C: Change results of transmittance, turbiscan stability index (TSI) and particle size at 5 ℃; D, E, F: Change results of transmittance, TSI and particle size at 25 ℃; G, H, I: Change results of transmittance, TSI and particle size at 40 ℃ |
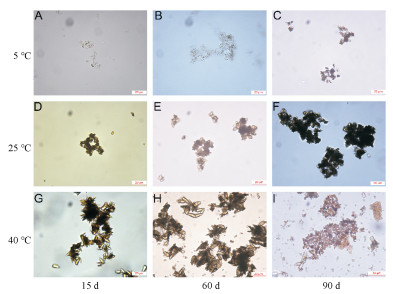
显微镜观察发现(图 6), 不同温度下沉淀形态及沉淀量均有明显差异。5 ℃下观察到SOL中有一定的细小的沙粒样聚集物(图 6A~C), 这可能是多酚和EA形成的缔合胶体聚集产生的部分不溶物质, 随时间延长有一定的增多。而25 ℃ (图 6D~F)和40 ℃ (图 6G~I)下SOL沉淀增长速度非常快。从结果中可见, 沉淀首先形成较小的半透明状晶体颗粒, 约1~5 μm。随着这种颗粒的增加, 有明显的聚集趋势, 颗粒与颗粒之间由于较大的表面能而首先产生小范围的聚集, 最后在90天内形成大面积的片状沉淀。该结果直观显示了EA的微观动态形成过程, 并反映了不同温度下的沉淀形成差异, 进一步说明降低SOL体系的温度有助于EA的稳定性。
|
Figure 6 Micrograph of SOL sediments at three temperatures at different time periods. A, B, C: SOL sedimentations in 15, 60, 90 days at 5 ℃; D, E, F: SOL sedimentations in 15, 60, 90 days at 25 ℃; G, H, I: SOL sedimentations in 15, 60, 90 days at 40 ℃ |
随着温度上升SOL的平均分子量降低(图 7A), 这与粒径的结果相一致, 说明温度降低缔合度增大。随着温度升高SOL的zeta电位绝对值下降(图 7B), 说明温度越高SOL越不稳定。在考察不同温度SOL表面张力时, 设置纯水作为对照, 结果发现SOL的表面张力显著低于水的表面张力(图 7C), 并且随着温度升高而有所降低。表面张力降低虽然有助于EA溶解, 但是这种作用力和缔合作用对EA的稳定增溶作用相对弱, 不足以抵抗升温产生的化学变化和其自身物理稳定性破坏。因此, 升温对EA稳定性依然不利。同样地, 黏度测试结果显示SOL明显高于水的黏度(图 7D), 温度越低黏度越高。黏度的升高抑制了分子间的碰撞几率, 使得EA分子或晶体之间的聚合沉淀速率降低, 进而抑制了物理沉降行为。从上述的平均分子量和zeta电位的结果可以看出, 升温会破坏胶体结构从而导致EA沉淀, 但低温条件下SOL分子缔合度增大, 黏度增大, 这增强了EA稳定性。

|
Figure 7 Physical parameters of SOL at 5, 25, 40 ℃; A: Average molecular weight; B: Zeta potential; C: Surface tension; D: Viscosity, n = 3, x ± s. *P < 0.05, **P < 0.01 |
一般而言, 中药的液体制剂在低温下更易形成沉淀, 其原因主要有两点:首先是悬浮颗粒的热运动减弱, 趋于沉降, 醇沉过程的冷藏处理便是如此; 其次是化学物质的溶解度降低, 成分析出, 如小檗碱、咖啡因等。EA极难溶于水, 但SOL中EA却呈现“低温易溶”的反常现象, 故本文对此展开研究。
以本文研究为基础, 从物理角度分析, 其主要作用可能有3种: ①多酚分子自身具有一定的表面活性作用[32]; ②缔合胶体对EA的增溶作用; ③溶液黏度的作用。从化学角度分析, 主要是低温抑制了鞣质的水解。多酚产生的表面活性作用已在实验中得到验证, 而这种作用是在较高温度下EA依然能够部分存在于上清液中的主要原因。缔合胶体增溶作用则是通过多酚分子间聚集而使得胶束变大, 加上SOL黏度的增加, 共同抑制了溶液中EA分子之间的碰撞和聚集, 减少了沉淀量。多酚形成的缔合胶体是一类特殊的胶体, 在一定条件下可以从真溶液到胶体溶液之间进行转换, 其影响因素主要有多酚浓度、pH值及温度。pH值越低、温度越低、多酚浓度越高, 则缔合度越高[31]。因此, 如何增强多酚胶体的缔合度及抑制水解作用是稳定性调控的关键所在。实验中SOL的zeta电位绝对值较低, 说明胶体并不稳定, 是否是溶液中的金属离子所致还需进一步研究。而pH值对SOL稳定性可能具有较大影响, 调节pH值不仅可以改变胶体缔合度, 还能控制水解, 但过高对胶体缔合度不利, 而过低则影响化学稳定性, 因此需从这两个角度出发找到合适的平衡点[28]。在此基础上, 适当增加溶液黏度也具有抑制沉淀的效果。综上, 保护缔合胶体、抑制水解作用是提高确保EA分子态稳定储存的关键。
实验发现低温下EA化学沉淀为负值, 为此本文研究了滤膜截留部分EA含量。取低温保存的SOL, 以上清液供试品制备方法进行操作, 取下滤头推注超出水反复清洗残液, 最后用甲醇溶解滤膜上的截留物并测定。结果发现, 滤膜EA含量约23.8 μg·mL-1, 证实滤膜对EA的截留导致了化学沉淀负值现象。
本文首次观察到EA在SOL低温下的稳定表现, 阐释了其微观稳定机制并提出相应对策, 对EA的稳定机制及调控策略进行了补充。研究阐明了EA储存过程中的稳定性由SOL的化学稳定性和物理稳定性的综合作用。该研究不仅为EA的高效利用提供了理论基础, 也对中药液体制剂的生产与品质优化具有重要的理论价值与实践意义。
| [1] | Zafrilla P, Ferreres F, Tomás-Barberán FA. Effect of processing and storage on the antioxidant ellagic acid derivatives and flavonoids of red raspberry (Rubus idaeus) jams[J]. J Agric Food Chem, 2001, 49: 3651–3655. DOI:10.1021/jf010192x |
| [2] | Usta C, Ozdemir S, Schiariti M, et al. The pharmacological use of ellagic acid-rich pomegranate fruit[J]. Int J Food Sci Nutr, 2013, 64: 907–913. DOI:10.3109/09637486.2013.798268 |
| [3] | Wang N, Wang ZY, Mo SL, et al. Ellagic acid, a phenolic compound, exerts anti-angiogenesis effects via VEGFR-2 signaling pathway in breast cancer[J]. Breast Cancer Res Treat, 2012, 134: 943–955. DOI:10.1007/s10549-012-1977-9 |
| [4] | Eskandari E, Heidarian E, Amini SA, et al. Evaluating the effects of ellagic acid on pSTAT3, pAKT, and pERK1/2 signaling pathways in prostate cancer PC3 cells[J]. J Cancer Res Ther, 2016, 12: 1266–1271. DOI:10.4103/0973-1482.165873 |
| [5] | El-Shitany NA, El-Bastawissy EA, El-Desoky K. Ellagic acid protects against carrageenan-induced acute inflammation through inhibition of nuclear factor kappa B, inducible cyclooxygenase and pro-inflammatory cytokines and enhancement of interleukin-10 via an antioxidant mechanism[J]. Int Immunopharmacol, 2014, 19: 290–299. DOI:10.1016/j.intimp.2014.02.004 |
| [6] | Keshtzar E, Khodayar MJ, Javadipour M, et al. Ellagic acid protects against arsenic toxicity in isolated rat mitochondria possibly through the maintaining of complex Ⅱ[J]. Hum Exp Toxicol, 2016, 35: 1060–1072. DOI:10.1177/0960327115618247 |
| [7] | Hseu YC, Chou CW, Kumar KJS, et al. Ellagic acid protects human keratinocyte (HaCaT) cells against UVA-induced oxidative stress and apoptosis through the upregulation of the HO-1 and Nrf-2 antioxidant genes[J]. Food Chem Toxicol, 2012, 50: 1245–1255. DOI:10.1016/j.fct.2012.02.020 |
| [8] | da Silva Pinto M, de Carvalho JE, Lajolo FM, et al. Evaluation of antiproliferative, anti-type 2 diabetes, and antihypertension potentials of ellagitannins from strawberries (Fragaria ananassa Duch.) using in vitro models[J]. J Med Food, 2010, 13: 1027–1035. DOI:10.1089/jmf.2009.0257 |
| [9] | Sanadgol N, Golab F, Mostafaie A, et al. Ellagic acid ameliorates cuprizone-induced acute CNS inflammation via restriction of microgliosis and down-regulation of CCL2 and CCL3 pro-inflammatory chemokines[J]. Cell Mol Biol, 2016, 62: 24–30. |
| [10] | Uzor PF, Osadebe PO. Antidiabetic activity of the chemical constituents of Combretum dolichopetalum root in mice[J]. Excli J, 2016, 15: 290–296. |
| [11] | Lin MC, Yin MC. Preventive effects of ellagic acid against doxorubicin-induced cardio-toxicity in mice[J]. Cardiovasc Toxicol, 2013, 13: 185–193. DOI:10.1007/s12012-013-9197-z |
| [12] | Bala I, Bhardwaj V, Hariharan S, et al. Analytical methods for assay of ellagic acid and its solubility studies[J]. J Pharm Biomed Anal, 2006, 40: 206–210. DOI:10.1016/j.jpba.2005.07.006 |
| [13] | Rossi M, Erlebacher J, Zacharias DE, et al. The crystal and molecular structure of ellagic acid dihydrate:a dietary anti-cancer agent[J]. Carcinogenesis, 1991, 12: 2227–2232. DOI:10.1093/carcin/12.12.2227 |
| [14] | McL Mathieson A, Poppleton BJ. The crystal structure of ellagic acid[J]. Acta Crystallogr B, 1968, 24: 1456–1461. DOI:10.1107/S0567740868004474 |
| [15] | Yan L, Yin P, Ma C, et al. Method development and validation for pharmacokinetic and tissue distributions of ellagic acid using ultrahigh performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS)[J]. Molecules, 2014, 19: 18923–18935. DOI:10.3390/molecules191118923 |
| [16] | Truchado P, Larrosa M, Garcia-Conesa MT, et al. Strawberry processing does not affect the production and urinary excretion of urolithins, ellagic acid metabolites, in humans[J]. J Agric Food Chem, 2012, 60: 5749–5754. DOI:10.1021/jf203641r |
| [17] | Bulani VD, Kothavade PS, Kundaikar HS, et al. Inclusion complex of ellagic acid with β-cyclodextrin:characterization and in vitro anti-inflammatory evaluation[J]. J Mol Struct, 2016, 1105: 308–315. DOI:10.1016/j.molstruc.2015.08.054 |
| [18] | Junyaprasert VB, Singhsa P, Suksiriworapong J, et al. Physicochemical properties and skin permeation of Span 60/Tween 60 niosomes of ellagic acid[J]. Int J Pharm, 2012, 423: 303–311. DOI:10.1016/j.ijpharm.2011.11.032 |
| [19] | Li B, Harich K, Wegiel L, et al. Stability and solubility enhancement of ellagic acid in cellulose ester solid dispersions[J]. Carbohyd Polym, 2013, 92: 1443–1450. DOI:10.1016/j.carbpol.2012.10.051 |
| [20] | Gudej J, Tomczyk M. Determination of flavonoids, tannins and ellagic acid in leaves from Rubus L. species[J]. Arch Pharm Res, 2004, 27: 1114–1119. DOI:10.1007/BF02975114 |
| [21] | Wang Z, Jin R, Wang JZ, et al. Determination of ellagic acid in Yunshi Ganmao Mixture made from Guizhou Miao medicine Geum japonicum[J]. J Tradit Chin Vet Med (中兽医医药杂志), 2018, 37: 61–63. |
| [22] | Jiang H, Zhao SY, Huang HZ, et al. HPLC fingerprint of Sanlejiang oral liquid and content determination of multi-components[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 3741–3747. |
| [23] | Gupta SK, Kalaiselvan V, Srivastava S, et al. Evaluation of anticataract potential of Triphala in selenite-induced cataract:in vitro and in vivo studies[J]. J Ayurveda Integr Med, 2010, 1: 280–286. DOI:10.4103/0975-9476.74425 |
| [24] | Peterson CT, Denniston K, Chopra D. Therapeutic uses of triphala in ayurvedic medicine[J]. J Altern Complement Med, 2017, 23: 607–614. DOI:10.1089/acm.2017.0083 |
| [25] | Kalaiselvan S, Rasool MK. The anti-inflammatory effect of triphala in arthritic-induced rats[J]. Pharm Biol, 2015, 53: 51–60. DOI:10.3109/13880209.2014.910237 |
| [26] | Saravanan S, Srikumar R, Manikandan S, et al. Hypolipidemic effect of triphala in experimentally induced hypercholesteremic rats[J]. Yakugaku Zasshi, 2007, 127: 385–388. DOI:10.1248/yakushi.127.385 |
| [27] | Zhang N, Li ZH, Zhao HW, et al. Study on Radix Scrophulariae for the treatment of hyperthyroidism rat model of yin deficiency based on urine metabonomics[J]. Acta Pharm Sin (药学学报), 2018, 53: 1843–1851. |
| [28] | Huang HZ, Zhao SY, Ke XM, et al. Study on the stability control strategy of Triphala solution based on the balance of physical stability and chemical stabilities[J]. J Pharm Biomed Anal, 2018, 158: 247–256. DOI:10.1016/j.jpba.2018.06.008 |
| [29] | Yoshida T, Fujii R, Okuda T. Revised structures of chebulinic acid and chebulagic acid[J]. Chem Pharm Bull, 1980, 28: 3713–3715. DOI:10.1248/cpb.28.3713 |
| [30] | Mao X, Wu LF, Zhao HJ, et al. Transport of corilagin, gallic acid, and ellagic acid from Fructus Phyllanthi Tannin fraction in Caco-2 cell monolayers[J]. Evid-Based Complement Alternat Med, 2016. DOI:10.1155/2016/9205379 |
| [31] | Friedman M, Jurgens HS. Effect of pH on the stability of plant phenolic compounds[J]. J Agric Food Chem, 2000, 48: 2101–2110. DOI:10.1021/jf990489j |
| [32] | Akhtar M, Murray BS, Afeisume EI, et al. Encapsulation of flavonoid in multiple emulsion using spinning disc reactor technology[J]. Food Hydrocolloid, 2014, 34: 62–67. DOI:10.1016/j.foodhyd.2012.12.025 |
 2019, Vol. 54
2019, Vol. 54


