2. 中山大学药学院(深圳), 广东 广州 510275
2. School of Pharmaceutics Science(Shenzhen), Sun Yat-sen University, Guangzhou 510275, China
恶性肿瘤严重威胁人类健康, 寻求有效治疗方法、提高治愈率是目前生物医学界关注的热点。传统的手术、化疗和放疗等治疗方法具有一定的局限性[1], 随着科技进步, 光热疗法已经成为一种新的癌症治疗手段。
光热治疗[2, 3]主要是利用致热源的热效应获得较高温度在肿瘤区积聚, 进而达到杀死肿瘤细胞的效果。黑磷(BP)是一种新型二维半导体材料, 近年来被发现可应用于生物医学领域[4], 一系列关于黑磷的研究[5]表明黑磷可用于癌症的光热治疗, 由黑磷为材料制备的黑磷量子点(BPQDs)[6]再度被证实具有高效的近红外光热效应, 可用于杀死肿瘤细胞。此外, 本课题组采用优化的液态剥离法制备黑磷纳米薄片, 研发了一种负载临床化疗药物多柔比星的黑磷纳米片载体系统[7]。由于黑磷纳米薄片表面易于功能化和较大的比表面积, 为化疗药物分子的大量吸附奠定基础; 优异的光学及光热转化性质使其在808 nm激光照射下能够产生局部高热, 可以用于肿瘤的光热治疗, 也能够驱动药物的释放; 对黑磷载药纳米薄片在生物体内的安全性研究表明, 黑磷载药纳米薄片具备很好的生物相容性; 研究中采用的生物响应调节的化疗-光热治疗联合治疗在免疫缺陷的裸鼠身上取得了强化的抑瘤效果。
自1988年第1个脂质体包裹的药物在美国进入临床试验, 脂质体的研究已经逐步深入, 如:紫杉醇脂质体[8, 9]、多西紫杉醇脂质体[10, 11]、顺铂脂质体[12, 13]和青蒿素长循环脂质体[14]等。脂质体因其自身的磷脂双分子层具备亲水的头部和疏水的尾部结构而形成微型囊泡结构, 适用于包裹脂溶性和水溶性药物[15-17]。此外, 脂质体还具备良好的生物相容性、可生物降解、低免疫原性、无毒、能被细胞摄取等特征, 目前被公认为良好的抗肿瘤纳米载药系统。
本研究通过超声、薄膜分散法[18, 19]制备载黑磷量子点脂质体并对其相关理化性质进行表征, 进一步评价该脂质体的宫颈癌的体外光热治疗效果。
材料与方法材料与试剂 黑磷晶体(南京牧科纳米科技有限公司); L-α-溶血卵磷脂、L-α-磷脂酰乙醇胺、4', 6-二脒基-2-苯基吲哚(DAPI)、Atto 532标记1, 2-二醇基-sn-甘油-3-磷酸乙醇胺(Atto 532 DOPE)、胆固醇、胆固醇聚乙二醇(cholesterol polyethylene glycol, cholesterol-PEG 600 (美国Sigma-Aldrich公司); N-甲基吡咯烷酮(NMP, 上海阿拉丁生化科技股份有限公司); 人宫颈癌细胞(HeLa, 美国ATCC细胞库); DMEM培养基(dulbecco's modified eagle medium)、胎牛血清、胰酶(美国Gibco公司); 钙黄绿素-AM和碘化丙啶溶液(Calcein-AM/PI, 北京义翘神州科技有限公司); CCK-8试剂盒(Cell Counting Kit, 上海碧云天生物技术有限公司)。
主要仪器 超声波细胞粉粹机(Sonics vibra-cell, 美国SONICS公司); 真空干燥箱(上海一恒科技有限公司); 电感耦合等离子体发射光谱仪(ArcosⅡMV, 德国SPECTRO公司); 透射电子显微镜(FEI Tecnai G2 spirit)、冷场发射扫描电子显微镜(HITACHI SU8010, 美国FEI公司); 纳米粒度及zeta电位仪(Nano ZS, 英国Malvern公司); 显微激光共聚焦拉曼光谱仪(Horiba LabRAM HR800, 法国HORIBA公司); 808 nm红外光激光器(北京艾纳捷光电科技有限公司); 激光共聚焦显微镜(FV1000, 日本Olympus公司); 荧光倒置显微镜(德国Leica公司)。
BPQDs制备及浓度测定 称取黑磷晶体20 mg, 缓慢加入50 mL NMP溶液充分研磨, 悬浮液转移至50 mL离心管。30%功率机械超声12 h, 工作和间歇时间各5 s, 300 W冰水浴超声10 h后7 000 r·min-1离心30 min, 吸上清, 20 000 r·min-1离心2 h, 得少量沉淀即BPQDs。取BPQDs样品液500 μL, 13 000 r·min-1离心1 h, 所得沉淀加双蒸水500 μL, 转移至5 mL耐热玻璃瓶, 加浓硝酸2 mL于通风橱内过夜消化, 次日敞口置于100 ℃。
恒温电热套加热, 当瓶内蒸发至500 μL液体时, 再加双蒸水2 mL继续蒸发, 至500 μL液体时, 加入4.5 mL双蒸水定容至5 mL, 用电感耦合等离子体发射光谱仪(ICP)测定样品磷浓度。以磷标液母液浓度(1 000 μg·mL-1)配制5、0.5、0.1、0.05和0.01 μg·mL-1磷浓度溶液绘制标准曲线, 待测样品测量值在标准曲线浓度范围内即可, 浓度过高则应稀释后再测定。
空白脂质体(liposome)制备 称取2.5 mg L-α-溶血卵磷脂和L-α-磷脂酰乙醇胺、2 mg PEG-胆固醇、1 mg胆固醇于2 mL EP管中, 加乙醇1 mL, 旋涡振荡混匀后移入25 mL圆底烧瓶中, 再加乙醇4 mL, 在40 ℃、140 r·min-1抽真空状态下旋蒸1 h, 将瓶取下用封口膜封口, 扎些许小孔, 真空干燥箱过夜干燥。次日取出, 加5 mL双蒸水置60 ℃恒温水浴水化5 h, 收集悬液4 ℃冰箱储存。实验时取样品原液10 μL稀释, 探头和水浴各超声10 min, 0.45 μm滤器过滤3次。
Liposome-BPQDs的制备及包封率测定 取BPQDs样品液1 mL, 13 000 r·min-1离心1 h, 弃上清得沉淀, 加入脂质体1 mL, 600 r·min-1常温过夜搅拌。次日冰水浴超声15 min (P = 300 W), 匀浆器来回用力杵250次以上, 即可得到liposome-BPQDs纳米粒。通过13 000 r·min-1高速离心至少1 h, 可以分离出较纯的liposome-BPQDs纳米粒, 加入ddH2O 1 mL充分溶解, 冰水浴超声20 min (P = 300 W), 可放置4 ℃冰箱保存。用0.45 μm过滤器过滤可得粒径较小的纳米粒。根据BPQDs原浓度, 计算200 μL脂质体溶液中BPQDs质量浓度为10、50、100、150、200、250、300和350 μg·mL-1所需加入的BPQDs量, 每个浓度设3个平行, 制备相应包被BPQDs的脂质体, 用200 μL空白脂质体作对照, 浓硝酸消化后统一测定磷浓度。计算包封率(encapsulation efficiency, EE), EE (%) = (1-C0/Cx)×100%, 其中, C0为200 μL空脂质体含游离磷总量, Cx为各个实验组200 μL liposome-BPQDs中含磷总量(其中x = 10、50、100、150、200、250、300、350)。
脂质体表征 分别取脂质体和liposome-BPQDs纳米粒原液10 μL, 加入ddH2O 90 μL稀释, 机械、水浴超声各15 min, 用0.45 μm滤器分别过滤1次和3次, 纳米粒度及zeta电位仪(Nano ZS)分别测空白脂质体(liposome)和liposome-BPQDs的粒径分布、聚合物分散性指数(polymer dispersity index, PDI)及电位; 同上法, 取过滤3次后的滤液10 μL滴加到铜网上, 真空干燥后用扫描电镜(scanning electron microscope, SEM)观测形貌; 同上法, 取过滤3次后的滤液10 μL滴加到铜网上, 静待3 min后吸去多余样品, 滴加10 μL醋酸铀染3 min, 再吸去多余染液, 用10 μL双蒸水洗2次, 3 min/次, 真空过夜干燥, 用透射电镜(transmission electron microscope, TEM)观测纳米粒形貌; 将脂质体、liposome-BPQDs纳米粒样品冰水浴超声15 min, 滴加10 μL样品于Si片上, 用显微镜激光共聚焦拉曼光谱仪测定633 nm波长下的拉曼光谱, 将所测样品同时置于室外通风、温度范围25 ℃~34 ℃和相对湿度80%~82%自然条件下, 再测第10、20天时各对应拉曼光谱。
脂质体光热效应比较 取BPQDs样品液2 mL, 13 000 r·min-1离心1 h, 弃上清得沉淀, 加入ddH2O 2 mL形成BPQDs水样, 再分别取2 mL脂质体、liposome-BPQDs液, 将3份样品分别转移至2 mL透明玻璃瓶中, 瓶盖半旋状态暴露于室外通风、温度范围25 ℃~34 ℃和相对湿度80%~82%自然条件下, 观察第1、4、7、10、14、18、21、25和35天样品颜色差异; 以30 μg·mL-1 BPQDs浓度再制另外3份2 mL样品, 用808 nm激光(P = 1 W·cm-2)分别测第1天及第1、2、3、4、5周后光热效应图谱。
细胞毒性检测 将HeLa细胞传代培养后接种到96孔板, 过夜培养细胞量达90%时, 弃旧培养基后分别加入无血清DMEM培养液50 μL, 再分别加入含0、5、10、20、50、80和100 μg·mL-1质量浓度BPQDs的liposome-BPQDs样品50 μL, 每个浓度设5个复孔, 置于37 ℃、5% CO2培养箱中孵育24 h, 每孔再分别加入CCK-8溶液10 μL, 37 ℃培养箱孵育4 h, 酶标仪测定450 nm处各孔吸光度(A)值, 取5个复孔均值, 计算细胞存活率(CL)。CL = (A实验组-A空白组)/(A对照组-A空白组)×100%。对照组为没加任何纳米粒的孔, 规定存活率为100%;空白组为只含培养基所对应的孔, 规定存活率为0。同上法加入含0、1、5、10、15、20和30 μg·mL-1质量浓度BPQDs的liposome-BPQDs样品50 μL, 每个浓度孔重复6个, 用808 nm激光(P = 1 W·cm-2)辐照各孔10 min, 然后分别孵育12和24 h, 检测计算对应细胞毒性。
HeLa细胞摄取 荧光脂质体制备:在脂质体制备所需样品充分溶解前, 另加0.05 mg Atto532 DOPE, 得到红色荧光脂质体; 制备Cy5.5标记的BPQDs:取BPQDs样品液1 mL, 13 000 r·min-1离心1 h, 弃上清得沉淀后加入ddH2O 1 mL, 加入1 μL Cy5.5, 常温600 r·min-1搅拌过夜。次日取出, 13 000 r·min-1离心30 min, 弃上清, 加ddH2O重复洗3次, 最后得沉淀即为Cy5.5标记的BPQDs, 同上法可得到Cy5.5标记的liposome-BPQDs。在T25培养瓶中传代培养HeLa细胞至第3代时接种到12孔板, 置于37 ℃、5% CO2培养箱中过夜培养, 次日每孔弃掉旧培养基, 加入不含胎牛血清的DMEM培养基1 mL和Cy5.5标记的liposome-BPQDs 200 μL, 孵育3 h后弃旧培养液, 用1×磷酸盐缓冲液(PBS)洗3次, 5 min/次, 再用4%多聚甲醛固定10 min, PBS冲洗3次, DAPI染核15 min, 再用PBS洗2次, 粘片干燥后用激光共聚焦显微镜观察HeLa细胞对纳米粒的摄取效果。
HeLa细胞凋亡检测 将HeLa细胞传代培养后接种到12孔板, 过夜培养细胞量达70%时, 弃旧培养基后加入无血清DMEM培养液800 μL, 再分别加入含0、5、10、20、30和40 μg·mL-1质量浓度BPQDs的liposome-BPQDs样品200 μL, 置于37 ℃、5% CO2培养箱中孵育3 h, 用808 nm激光(P = 1 W·cm-2)光照各样品10 min, 每孔再分别加入AM和PI各1.5 μL, 37 ℃、5% CO2培养箱中孵育2 h, 收样制片后用荧光倒置显微镜观察细胞凋亡情况。
结果 1 脂质体和载黑磷量子点脂质体的表征在SEM下黑磷晶体呈片状堆叠结构(图 1a), BPQDs (图 1b)直径大多分布在5~20 nm内, 容易聚集形成大颗粒; liposome (图 1c)和liposome-BPQDs (图 1d)呈椭球状或球状, 直径约在100~150 nm内; TEM结果显示liposome (图 1e)直径约100~120 nm, liposome-BPQDs (图 1f)直径约90~110 nm。粒径及电位结果(图 1g~i)表明用0.45 μm滤器过滤3次后脂质体(liposome #3和liposome-BPQDs #3)粒径比过滤1次所得的脂质体(liposome #1和liposome-BPQDs #1)粒径小, liposome粒径为(101.9±7.3) nm, zeta电位(-16.3±1.23) mV, PDI约为0.282±0.008; liposome-BPQDs粒径为(104.2±0.35) nm, zeta电位(-11.3±3.01) mV, PDI约为0.217±0.007。表征结果表明, 所制备的liposome-BPQDs在水溶剂中能够较稳定地分散, 该纳米粒的大小有助于作为药物载体富集在肿瘤细胞中并长期滞留发挥高通透性和滞留效应(EPR效应)。
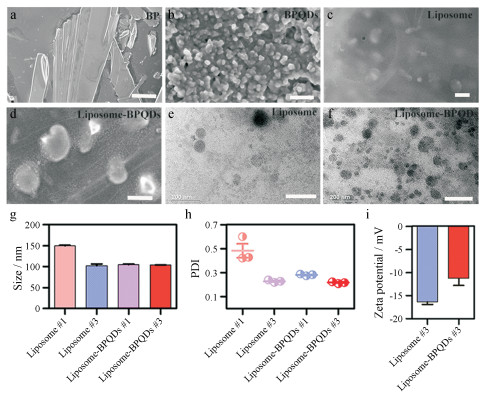
|
Figure 1 Characterization of liposome and liposome-BPQDs. a: Scanning electron microscope (SEM) image of black phosphorus (BP) single crystal particles (scale bar, 15 μm); b: SEM image of BPQDs (scale bar, 150 nm); c: SEM image of liposome (scale bar, 200 nm); d: SEM image of liposome-BPQDs (scale bar, 200 nm); e: Transmission electron microscope (TEM) image of liposome (scale bar, 200 nm); f: TEM image of liposome-BPQDs (scale bar, 200 nm); g, h, i: The particle size distributions, polymer dispersity index (PDI), zeta potential of liposome and liposome-BPQDs with 0.45 μm filters for one time (liposome #1, liposome-BPQDs #1) and three times (liposome #3, liposome-BPQDs #3). BPQDs: black phosphorus quantum dots |
黑磷单晶颗粒样品(图 2a), 尺寸0.1 mm~1 cm, 制备成BPQDs, 其粒径约为5~15 nm, 为进一步探究liposome对BPQDs包封平衡时BPQDs的浓度, 用超速离心法分离liposome-BPQDs和游离BPQDs, 通过ICP测定磷浓度, 根据公式计算包封率。由图可知, 随BPQDs浓度增加, 包封率逐渐增大, 当质量浓度达到250 μg·mL-1左右时脂质体的包封量达到最大平衡量(图 2b), 此时脂质体的包封率为(84.40±2.13) %。
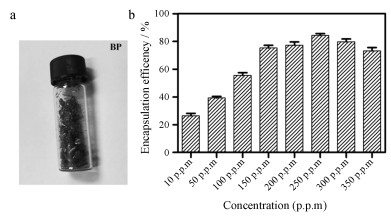
|
Figure 2 Encapsulation efficiency of liposome. a: Image of black phosphorus (BP) single crystal particles; b: Encapsulation efficiency of liposome with different concentrations (10, 50, 100, 150, 200, 250, 300, 350 p.p.m) of BPQDs. The concentration of 10 p.p.m BPQDs is equal to 10 μg·mL-1 BPQDs |
如图 3a所示, 随着天数增加, BPQDs水样中颜色变化较明显, 说明BPQDs正在逐步降解, 空气中氧气、二氧化碳和水等分子可将黑磷(BP)部分氧化分解生成磷酸根离子和亚磷酸根离子等小分子产物。正常条件下BP应该避光、干燥保存。Liposome水溶液颜色几乎没有变化, 说明liposome在水溶液体系中较稳定, liposome-BPQDs样品液颜色有变浅趋势, 但程度上小于BPQDs水样, 说明该脂质体在自然条件下的稳定性较BPQDs好。在波长633 nm下测定的拉曼光谱中BPQDs第10和20天中间峰值位点的蓝移结果表明BPQDs随时间而发生振动变化(图 3b), liposome-BPQDs与BPQDs相比峰值位点变化量明显较小(图 3c), 说明该脂质体稳定性较好。
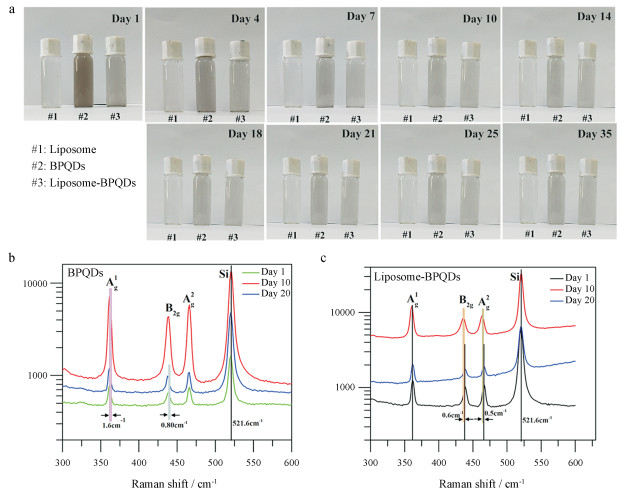
|
Figure 3 Degradation and Raman spectroscopy of BPQDs and liposome-BPQDs. a: Images of the color differences of the samples 2 mL liposome, BPQDs water sample (30 μg·mL-1), liposome-BPQDs water sample (with the same concentration of 30 μg·mL-1 BPQDs) observed on the 1st, 4th, 7th, 10th, 14th, 18th, 21st, 25th and 35th days under natural conditions of outdoor ventilation, temperature range of 25 ℃-34 ℃ and relative humidity of 80%-82%; b: The corresponding Raman spectra of 633 nm wavelength of 1 mL BPQDs, liposome-BPQDs water sample measured on the first day (day 1), the 10 th day (day 10), and the 20 th day (day 20) under the same natural conditions of outdoor ventilation, temperature range of 25 ℃-34 ℃ and relative humidity of 80%-82% |
初始BPQDs为30 μg·mL-1, 用808 nm近红外激光(P = 1 W·cm-2)分别连续光照10 min测200 μL liposome、BPQDs和liposome-BPQDs在第1天(day 0)及1、2、3、4和5周的光热图谱。图 4a~f结果一致表明, liposome光热效应较弱, BPQDs具有较好的光热效应, liposome-BPQDs光热效应较BPQDs弱, 但随天数增加, 3周后两者光热效应强度呈现逆转, 说明BPQDs在自然条件下由于降解使光热效应逐步减弱, 而liposome-BPQDs因为脂质体的稳定性包被, 内含BPQDs物质降解速率较慢。图 4g~i是3种物质自身的光热效应随时间变化图, 同样表明脂质体在水溶液中具有较强的稳定性, liposome-BPQDs光热效应减弱速度小于BPQDs水溶液, 进一步表明liposome-BPQDs在水溶剂中稳定性较好。
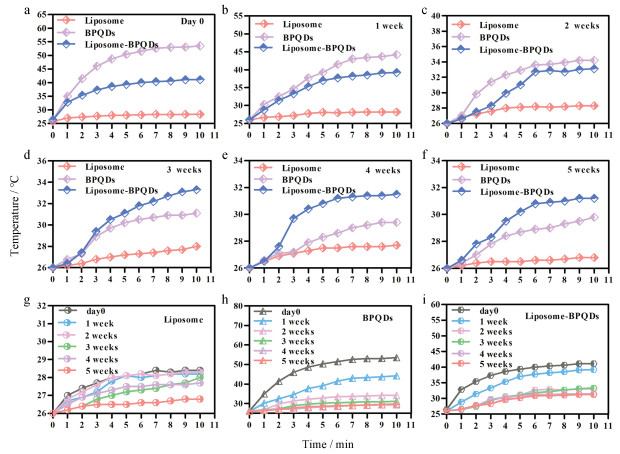
|
Figure 4 Comparison of photothermal effects of BPQDs and liposome-BPQDs. a-i: The photothermal effect spectra of the samples of 2 mL liposome, BPQDs water sample (30 μg·mL-1), liposome-BPQDs water sample (with the same concentration of 30 μg·mL-1 BPQDs) measured by 808 nm laser (P = 1 W·cm-2) on the first day (day 0), 1 week, 2 weeks, 3 weeks, 4 weeks and 5 weeks after exposed the natural conditions of outdoor ventilation, temperature range of 25 ℃-34 ℃ and relative humidity of 80%-82% |
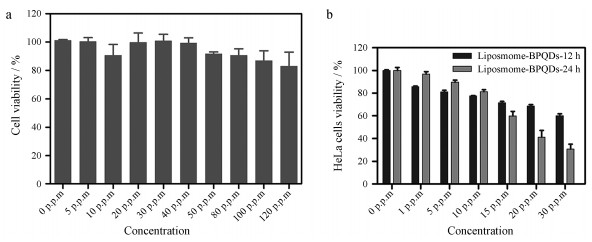
将不同浓度liposome-BPQDs分别与HeLa细胞置37 ℃、5% CO2培养箱中孵育24 h和808 nm激光辐照10 min后置37 ℃、5% CO2培养箱中孵育12和24 h后, 检测对应的细胞相对存活率。如图 5a, 载不同黑磷量子点浓度(0、5、10、20、30、40、50、80、100和120 μg·mL-1)脂质体与HeLa细胞孵育24 h后, 细胞相对存活率均在85%以上, 说明该纳米粒在载BPQDs质量浓度0~120 μg·mL-1内对HeLa细胞活性没有太大影响, 表明该浓度范围内liposome-BPQDs对HeLa细胞无伤害用, 可为宫颈癌的体内研究提供材料支持。HeLa细胞与载不同黑磷量子点浓度(0、1、5、10、20和30 μg·mL-1)脂质体孵育4 h后, 808 nm激光(P = 1 W·cm-2)辐照10 min, 再置于37 ℃、5% CO2培养箱中分别孵育12和24 h所对应的细胞存活率, 如图 5b所示。结果表明, 激光辐射后细胞的存活率普遍下降, 当liposome-BPQDs中BPQDs质量浓度为0~10 μg·mL-1时孵育24 h对于细胞的伤害程度与孵育12 h无明显差异, BPQDs浓度为15 μg·mL-1时, 孵育24 h对细胞的伤害程度明显大于孵育12 h, 当BPQDs质量浓度达到30 μg·mL-1时, 细胞存活量已降低到30%左右, 这说明载适宜浓度BPQDs的脂质体具有的光热辐射确实有助于杀死癌细胞。
|
Figure 5 Cytotoxicity test for liposome-BPQDs. a: The relative viability of HeLa cell after incubated with liposome-BPQDs with different concentrations (0, 5, 10, 20, 30, 40, 50, 80, 100, 120 μg·mL-1) of BPQDs in 37 ℃, 5% CO2 incubator for 24 h; b: The relative viability of HeLa cell after incubated with liposome-BPQDs with different concentrations (0, 1, 5, 10, 20, 30 μg·mL-1) of BPQDs in 37 ℃, 5% CO2 incubator for 12 h (liposome-BPQDs-12 h), 24 h (liposome-BPQDs-24 h) after irradiated with the 808 nm laser (P = 1 W·cm-2) for 10 min |
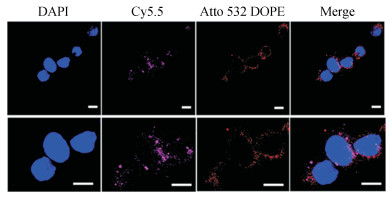
激光扫描共聚焦显微镜(CLSM)观察HeLa细胞对脂质体的摄取, 如图 6所示。DAPI染核, Cy5.5标记BPQDs, Atto 532 DOPE标记脂质体, 结果表明HeLa细胞能较好地摄入liposome-BPQDs, 其主要分布在细胞质内。liposome-BPQDs被HeLa细胞摄取主要是依靠受体介导的细胞内吞作用或与细胞膜融合过程而进入细胞内, 脂质体制备中添加胆固醇聚乙二醇(cholesterol-PEG 600), 由于PEG的修饰作用, 更有助于该脂质体与细胞膜表面的受体结合, 从而有助于该纳米粒较多地被HeLa细胞摄入, 表明该纳米粒可作为良好的药物载体被肿瘤细胞摄取, 并用于肿瘤的光热治疗。
|
Figure 6 Uptake of liposome-BPQDs nanopaticles by HeLa cells. Observation of cellular uptake of liposome-BPQDs (250 μL) by confocal laser scanning microscope (CLSM) with DAPI staining of HeLa cells nuclei, Cy5.5-labelled BPQDs, Atto 532 DOPE-labelled liposomes (all scale bars, 10 μm) |
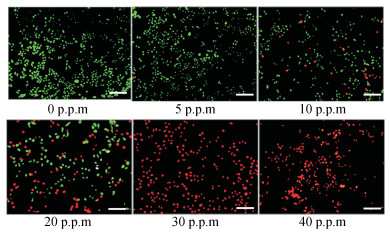
利用荧光倒置显微镜观察HeLa细胞凋亡情况, 如图 7所示。经Calcein-AM/PI双染后, 绿色荧光区域代表活细胞, 红色荧光区域代表死细胞, 随liposome-BPQDs中BPQDs浓度增加, 细胞死亡率逐步增大, 当BPQDs浓度在0~20 μg·mL-1内, 细胞存活量较大, 当浓度为30 μg·mL-1时, 可看到细胞几乎全部凋亡, 说明BPQDs在30 μg·mL-1浓度下已具有良好的光热效应, 可杀死肿瘤细胞。此结果表明BPQDs可作为一种新型纳米材料用于肿瘤光热疗法。本研究中, 脂质体包被BPQDs得到的纳米粒稳定性优于BPQDs。Liposome-BPQDs因为黑磷具有良好的光热效应特征, 可作为一种新型的纳米载药体系应用于抗肿瘤光热治疗中。
|
Figure 7 Apoptosis detection of HeLa cells. The aoptosis of HeLa cells observed by fluorescence inversion microscopy after incubated with liposome-BPQDs with different concentrations (0, 5, 10, 20, 30, 40 μg·mL-1) of BPQDs in 37 ℃, 5% CO2 incubator for 2 h after irradiated with the 808 nm laser (P = 1 W·cm-2) for 10 min. Cells stained with Calcein-AM/PI, the green fluorescence region represents living cells and the red fluorescence region represents dead cells.(all scale bars, 100 μm) |
脂质体纳米载药系统在近些年的药物研发和肿瘤治疗研究中被广泛应用。传统的脂质体具有稳定性较差的缺陷, 因此在制备新型的脂质体载药系统时, 为提高脂质体的稳定性, 可加入不同的修饰物, 如甲氧基聚乙二醇2000-二硬脂酸磷脂酰乙醇胺(mPEG2000-DSPE)、聚氧化乙烯(PEO)、环糊精、壳聚糖和聚氧乙烯脱水山梨醇单油酸酯(Tween-80)等对脂质体表面进行修饰[20-22]。聚乙二醇(PEG)亲水性质可有助于提高脂质体的相对稳定性及靶向载药在体内的长效循环[23]。为避免表面电荷影响载药脂质体体内循环时间[24], 本研究所制备脂质体为中性脂质体, 胆固醇为该脂质体合成必备原料之一, cholesterol-PEG 600表面带电荷为0, 且部分化学结构与胆固醇相似, 因此, 本研究在脂质体的表面采用cholesterol-PEG 600修饰, 不仅对BPQDs包封量没有阻碍, 而且也能实现PEG修饰效果, 减缓脂质体载药纳米粒被机体免疫系统识别和吞噬。本研究通过薄膜分散法、超声和过滤法制备liposome-BPQDs纳米粒, 探究其理化性质及应用于宫颈癌光热治疗的效果。
实验结果表明, 制备的liposome-BPQDs粒径小于200 nm, 符合文献[25]报道纳米药物载体易被细胞摄取的粒径范围, 也意味着本研究中cholesterol-PEG 600修饰的liposome-BPQDs可以很好地通过EPR效应在肿瘤部位富集, 避免被网状内皮系统清除。BPQDs具有良好的光热效应、无毒和可生物降解特征。Liposome-BPQDs具有良好的光热效应且稳定性优于BPQDs。细胞摄取实验表明, HeLa细胞可以有效摄取liposome-BPQDs纳米粒, 说明该纳米粒可作为相对稳定的载药体系应用于肿瘤的光热治疗。
本研究制备的liposome-BPQDs具备脂质体和BPQDs双重优势, 具有较好的光热效应及较稳定的理化性质, 脂质体包被有助于提高BPQDs的稳定性。以HeLa细胞摄取和凋亡检测为研究切入点, 未来的研究可以在载黑磷量子点脂质体体系基础上载入更多不同的药物, 实现多药物共载机制, 还可将光热疗法、化疗和免疫治疗等抗肿瘤治疗方法综合应用实现多模式治疗, 进一步提升对肿瘤细胞的有效杀伤力。
| [1] | Wang HH, Fu ZG, Wen N, et al. The applications and prospects of doxorubicin-photodynamic combination therapy in malignant tumors[J]. Chin J Geriat Dentist (中华老年口腔医学杂志), 2018, 16: 51–54, 60. |
| [2] | Bilici K, Muti A, Duman FD, et al. Investigation of the factors affecting the photothermal therapy potential of small iron oxide nanoparticles over the 730-840 nm spectral region[J]. Photochem Photobiol Sci, 2018, 17: 1787–1793. DOI:10.1039/C8PP00203G |
| [3] | Li Y, Wang X, Gao L, et al. Aptamer-conjugated gold nanostars for targeted cancer photothermal therapy[J]. J Mater Sci, 2018, 53: 14138–14148. DOI:10.1007/s10853-018-2668-7 |
| [4] | Shao JD, Xie HH, Huang H, et al. Biodegradable black phosphorus-based nanospheres for in vivo photothermal cancer therapy[J]. Nat Commun, 2016, 7: 12967. DOI:10.1038/ncomms12967 |
| [5] | Ren X, Li Z, Huang Z, et al. Environmentally robust black phosphorus nanosheets in solution:application for self-powered photodetector[J]. Adv Funct Mater, 2017, 27: 1606834. DOI:10.1002/adfm.201606834 |
| [6] | Li Y, Liu Z, Hou Y, et al. Multifunctional nanoplatform based on black phosphorus quantum dots for bioimaging and photodynamic/photothermal synergistic cancer therapy[J]. ACS Appl Mater Interfaces, 2017, 9: 25098–25106. DOI:10.1021/acsami.7b05824 |
| [7] | Tao W, Zhu X, Yu X, et al. Black phosphorus nanosheets as a robust delivery platform for cancer theranostics[J]. Adv Mater, 2017, 29: 1603276. DOI:10.1002/adma.201603276 |
| [8] | Ramadass SK, Anantharaman NV, Subramanian S, et al. Paclitaxel/epigallocatechin gallate coloaded liposome:a synergistic delivery to control the invasiveness of MDA-MB-231 breast cancer cells[J]. Colloids Surf B Biointerfaces, 2015, 125: 65–72. DOI:10.1016/j.colsurfb.2014.11.005 |
| [9] | Ruttala HB, Ko YT. Liposome encapsulated albumin-paclitaxel nanoparticle for enhanced antitumor efficacy[J]. Pharm Res, 2015, 32: 1002–1016. DOI:10.1007/s11095-014-1512-2 |
| [10] | Tagami T, Kubota M, Ozeki T. Effective remote loading of doxorubicin into DPPC/poloxamer 188 hybrid liposome to retain thermosensitive property and the assessment of carrier-based acute cytotoxicity for pulmonary administration[J]. J Pharm Sci, 2015, 104: 3824–3832. DOI:10.1002/jps.24593 |
| [11] | Das A, Adhikari C, Nayak D, et al. First evidence of the liposome-mediated deintercalation of anticancer drug doxorubicin from the drug-DNA complex:a spectroscopic approach[J]. Langmuir, 2016, 32: 159–170. DOI:10.1021/acs.langmuir.5b03702 |
| [12] | Wang L, Yang CQ, Wang J. Assemble of magnetic nanoparticles into the structure of cisplatin liposome[J]. Acta Pharm Sin (药学学报), 2011, 46: 592–598. |
| [13] | Catanzaro D, Nicolosi S, Cocetta V, et al. Cisplatin liposome and 6-amino nicotinamide combination to overcome drug resistance in ovarian cancer cells[J]. Oncotarget, 2018, 9: 16847–16860. |
| [14] | Yu YL, Zheng ZY, Yi CC, et al. Preparation and in vitro evaluation of artemisinin loaded long-circulating liposomes[J]. Acta Pharm Sin (药学学报), 2018, 53: 1002–1008. |
| [15] | Baek JS, Cho CW. A multifunctional lipid nanoparticle for co-delivery of paclitaxel and curcumin for targeted delivery and enhanced cytotoxicity in multidrug resistant breast cancer cells[J]. Oncotarget, 2017, 8: 30369–30382. |
| [16] | Battaglia L, Serpe L, Foglietta F, et al. Application of lipid nanoparticles to ocular drug delivery[J]. Expert Opin Drug Deliv, 2016, 13: 1743–1757. DOI:10.1080/17425247.2016.1201059 |
| [17] | Xia S, Tan C, Zhang Y, et al. Modulating effect of lipid bilayer-carotenoid interactions on the property of liposome encapsulation[J]. Colloids Surf B Biointerfaces, 2015, 128: 172–180. DOI:10.1016/j.colsurfb.2015.02.004 |
| [18] | Silva R, Ferreira H, Little C, et al. Effect of ultrasound parameters for unilamellar liposome preparation[J]. Ultrason Sonochem, 2010, 17: 628–632. DOI:10.1016/j.ultsonch.2009.10.010 |
| [19] | Zhang H. Thin-film hydration followed by extrusion method for liposome preparation[M]//D'Souza GGM. Liposomes: Methods and Protocols. New York: Humana Press, 2017, 1522: 17-22. |
| [20] | Lee JS, Hwang SY, Lee EK. Imaging-based analysis of liposome internalization to macrophage cells:effects of liposome size and surface modification with PEG moiety[J]. Colloids Surf B Biointerfaces, 2015, 136: 786–790. DOI:10.1016/j.colsurfb.2015.10.029 |
| [21] | Zhang XB, Hou XP. Comparative efficacy and distribution of evans blue liposome modified with DSPE-PEG, Tween 80, and Brij35[J]. J Chin Pharm Sci, 2003, 12: 71–75. |
| [22] | Wang H, Zhao P, Liang X, et al. Construction of a novel cationic polymeric liposomes formed from PEGylated octadecyl-quaternized lysine modified chitosan/cholesterol for enhancing storage stability and cellular uptake efficiency[J]. Bioethanol Bioeng, 2010, 106: 952–962. |
| [23] | Yang F, Qin A, Li J, et al. Targeting and long circulating drug delivery system base on mannose-conjugated PEG-modified nano-liposomes for tumor chemotherapy[J]. Acta Laser Biol Sin (激光生物学报), 2017, 26: 334–341. |
| [24] | Yang YF, Xie XY, Yang Y, et al. A review on the influences of size and surface charge of liposome on its targeted drug delivery in vivo[J]. Acta Pharm Sin (药学学报), 2013, 48: 1644–1650. |
| [25] | Soppimath KS, Aminabhavi TM, Kulkarni AR, et al. Biodegradable polymeric nanoparticles as drug delivery devices[J]. J Control Release, 2001, 70: 1–20. DOI:10.1016/S0168-3659(00)00339-4 |
 2019, Vol. 54
2019, Vol. 54


