2. 山西大学化学化工学院, 山西 太原 030006;
3. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
柴胡轻清辛散, 疏肝解郁; 白芍酸寒收敛, 养血柔肝。柴胡-白芍药对是疏肝解郁、调畅情志最基础的配伍药对。Shi等[1]运用数据挖掘技术对中药专利复方治疗抑郁症的用药规律进行分析, 发现柴胡和白芍的使用频数分别处于第一和第三位, 常用的药对中柴胡-白芍药对居首位。柴胡、白芍为多个抗抑郁疗效确切的复方柴胡舒肝散和四逆散等的君、臣药[2, 3], 本课题组近年来通过成分归属和血清药物化学等方法对逍遥散抗抑郁的物质基础进行研究, 发现柴胡和白芍对逍遥散抗抑郁作用贡献最大[4, 5]。即从物质基础层次阐明了柴胡-白芍药对在逍遥散中占有重要地位, 然而该药对在逍遥散中发挥重要作用的药理机制尚不明确。现代研究表明, 柴胡-白芍药对作为整体使用具有明确的抗抑郁作用[6], 然而对该药对抗抑郁机制的相关报道较少, 有待于深入研究。因此, 为探究其在逍遥散中核心地位的药理机制, 本文将通过行为学、代谢组学和通路分析展开对柴胡-白芍药对、逍遥散的抗抑郁作用及机制研究。
代谢组学通过研究机体整体代谢网络变化阐释疾病发病机制及药物作用机制[7], 通过研究代谢物变化来反映机体整体变化, 与中医药的整体辩证观息息相关, 近年来在揭示中药发挥药效及作用机制的研究中起到了重要作用[8]。代谢组学因其方法的灵敏性在中药品质评价、化学组分比较和药效差异性研究[9, 10]方面应用越来越广泛。在药效评价方面, 代谢组学技术相比于行为学指标更加灵敏, 故本文采用代谢组学技术评价柴胡-白芍药对在逍遥散方中药效及作用机制中的贡献。
材料与方法仪器及试剂 BRUKER 600 MHz AVANCE Ⅲ超导核磁共振波谱仪(瑞士); TGL-16高速台式冷冻离心机(湖南湘仪离心机仪器有限公司); 旋转蒸发仪(德国艾卡集团); 冷冻干燥机(宁波新芝生物科技股份有限公司); 恒温鼓风干燥箱(上海琅玕实验设备有限公司); 蔗糖(天津市风船化学试剂科技有限公司); 水合氯醛(天津市大茂化学试剂厂)。
药物 柴胡(批号: 1708255131, 产地河北)、白芍(批号: 1710436111, 产地安徽)、当归(批号: 1711583111, 产地甘肃)、麸炒白术(批号: 1709657141, 产地浙江)、茯苓(批号: 1711307132, 产地安徽)、炙甘草(批号: 1710013151, 产地新疆)、薄荷(批号: 1712017121, 产地江苏)、干姜(批号, 1706792101, 产地广西)药材饮片均购于河北安国市祁澳中药饮片有限公司; 盐酸文拉法辛胶囊(规格: 25 mg/粒, 批号: 130101, 厂家:成都康弘药业集团股份有限公司)。
动物 健康雄性SPF级SD大鼠(180±20 g)购于北京维通利华实验动物技术有限公司, 许可证号: SCXK (京) 2016-0011。实验期间动物保持自由饮水和进食, 饲养环境温度为(24±1) ℃, 湿度为(55±5) %, 12 h明暗交替光照, 实验前适应性饲养1周。动物实验获得山西大学伦理委员会的批准。
药物制备 分别取逍遥散(柴胡、白芍、当归、麸炒白术、茯苓、炙甘草、干姜、薄荷为6:6:6:6:6:3:2:2)、柴胡-白芍药对和阴性对照(逍遥散扣除柴胡、白芍)用10倍量70%乙醇浸泡1 h后回流提取2次, 每次2 h, 合并提取液, 静置后滤过, 将滤液旋转浓缩, 冷冻干燥, 干燥后称量所得粉末质量, 计算产率(逍遥散、柴胡-白芍药对、阴性对照提取物浸膏得率分别为21.78%、15.90%、25.55%), 4 ℃冰箱保存备用。全部药物使用之前用蒸馏水配制成溶液, 超声溶解。
分组与给药 经体重、旷场实验、糖水偏爱实验测试后, 选择指标相近的大鼠108只, 随机分为9组, 分别为空白组(C, control), 模型组(M, model), 阳性药组(P, Positive, 盐酸文拉法辛35 mg·kg-1), 逍遥散高、低剂量(XYS-H、XYS-L生药量46、23 g·kg-1)柴胡-白芍药对低、高剂量(BP-H、BP-L生药量15、7.5 g·kg-1)组, 阴性对照高、低剂量(NC-H、NC-L生药量31、15.5 g·kg-1)组。各给药组按照10 mL·kg-1对大鼠进行灌胃给药, 空白组和模型组灌胃给予等量的蒸馏水。
CUMS抑郁模型的复制 参照Willner等[11]方法并结合本实验前期研究[12], 建立大鼠CUMS抑郁模型。空白组大鼠正常饲养, 不接受任何刺激。其余各组接受28天造模程序, 主要包括热刺激、4 ℃冰水游泳、超声刺激、夹尾、昼夜颠倒、足底电击、禁水(24 h)、束缚和禁食(24 h)等。每组动物每天随机给予一种刺激, 同1种刺激累计使用不超过4次。每种应激的具体操作方法如下:热刺激, 大鼠置于45 ℃恒温电热烘箱中, 计时10 min后取出; 4 ℃冰水游泳, 将大鼠置于装有4 ℃冰水的有机玻璃缸(高50 cm, 直径20 cm)中, 水深约15 cm, 以大鼠刚触及缸底为宜, 游泳5 min后捞出, 毛巾擦干以避免痉挛等现象发生, 待大鼠各项体征平稳后归笼; 超声刺激, 功率为60 W的超声刺激3 h; 夹尾, 大鼠身体固定, 暴露尾部, 用夹子夹住距尾根部1 cm处持续2 min (发出哀叫即可, 避免过度夹伤); 昼夜颠倒, 白天将大鼠置于黑暗空间中, 持续12 h, 夜晚将大鼠置于白炽灯照射的明亮空间中, 持续12 h; 足底电击, 将大鼠置于足底电击箱中, 设置电压为32 V, 每隔10 s电击一次, 每次持续2 s, 共10次; 禁水, 剥夺饮水24 h; 束缚, 将大鼠置于550 mL矿泉水瓶中, 使其不能自由活动, 持续3 h; 禁食, 剥夺食物24 h。
行为学检测
体重实验 在实验的第0、7、14、21和28天分别称大鼠体质量。
旷场实验[13] 在实验的第0、7、14、21、28天分别进行旷场实验。旷场实验装置底部(100 cm×100 cm×40 cm)被分成25个相等的正方形。首先, 将大鼠放置在旷场实验装置底部中心方格内1 min以适应环境。观察大鼠穿越横(3爪以上跨入即可)格数和直立(两前肢离地面1 cm即可)次数。记录后4 min内大鼠穿越数量和直立次数。在每只大鼠实验之后, 用乙醇溶液清洁旷场装置并于干燥后进行下一次旷场实验。
糖水偏爱实验 糖水偏爱实验根据文献[14]报道, 实验前对每只大鼠给予1%蔗糖水和日常饮水进行糖水偏爱实验训练。每只大鼠(单笼饲养)同时放置2个水瓶, 第一个24 h同时放置2瓶1%蔗糖水, 第二个24 h期间, 给予1瓶1%蔗糖水和1瓶日常饮用水。训练结束之后, 进行12 h的禁水禁食, 之后测定12 h内的糖水消耗量, 大鼠自由选择饮用。分别在第0天进行糖水偏爱率的基线测定, 第28天进行糖水偏爱率实验。称取大鼠饮水前后水瓶的质量, 计算大鼠的糖水偏爱率。糖水偏爱率=糖水饮用质量/(糖水饮用质量+日常饮用水质量)。
强迫游泳实验 强迫游泳实验参考文献[15], 实验装置为圆柱形有机玻璃容器(高50 cm, 直径20 cm), 水深30 cm、温度(25±1) ℃。第28天对每只大鼠进行15 min的强迫游泳训练。第29天进行强迫游泳实验, 每只大鼠适应2 min, 记录后4 min的不动时间。大鼠为保持头部在水面以上而避免下沉的漂浮且无明显的挣扎现象, 亦记录为不动时间。
血清样本的收集 最后一次给药后, 对大鼠禁食24 h后进行麻醉后腹主动脉取血, 室温静置30 min, 4 ℃环境下以3 500 r·min-1离心10 min, 取上清, 置于-80 ℃冰箱储存, 以待进行核磁分析。
1H NMR代谢组学数据采集
血清1H NMR样本的制备 将血清样本在4 ℃环境下缓慢解冻, 精密吸取450 μL置于EP管中加入D2O 350 μL, 涡旋30 s, 4 ℃环境下以13 000 r·min -1离心20 min, 取上清550 μL置5 mm核磁管中。
1H NMR测试条件 BRUKER 600 MHz AVANCE Ⅲ超导核磁共振波谱仪采集数据(25 ℃), 采用Carr-Purcell-Meiboom-Gill脉冲序列。具体参数如下:检测谱宽12 345.7 Hz, 扫描次数为64, 脉冲时间14 μs, 采样时间2.654 s, 弛豫时间1.0 s, 采样数据点65 536, 采样间隔40.5 s。
1H NMR图谱处理 血清核磁图谱采用MestReNova (version 11.0 Mestrelab Research, Santiago de Compostella, 西班牙)软件处理。所有谱图均进行手动相位、基线调整。以肌酐化学位移δ 3.04 (-CH3)为标准进行校正, 以δ 0.01对化学位移δ 0.72~8.47区间进行积分, 对其中残余水峰(化学位移δ 4.45~4.88)区域切除不进行积分, 以消除残余水峰的影响。将积分数据进行面积归一化处理, 产生数据矩阵, 导入Excel用于多元统计分析。
数据统计分析 处理后的数据采用SIMCA-P 13.0软件进行PCA主成分分析, 进而使用PLS-DA, OPLS-DA正交偏最小二乘判别分析法的V-S-plot图结合VIP > 1及t检验(P < 0.05)确定潜在生物标志物。使用生物学数据库HMDB (http://www.hmdb.ca/)、BMRB (http://www.bmrb.wisc.edu/)等进行生物标志物的鉴定, 并使用Met PA (http://metpa.metabolomics.ca)进行代谢通路分析。
结果 1 行为学检测 1.1 体重实验第0天, 各组别之间没有明显的差异。第28天, 与空白组相比, 模型组大鼠体重显著性减少(P < 0.001), 表明CUMS模型复制成功; 给予药物后, 与模型组相比, 逍遥散高低剂量组(P < 0.01, P < 0.01)、药对高低剂量组(P < 0.05, P < 0.05)、阴性对照高低剂量组(P < 0.01, P < 0.01)均显著性增加(图 1)。提示柴胡-白芍药对单独使用时同样能显著增加大鼠的体重。
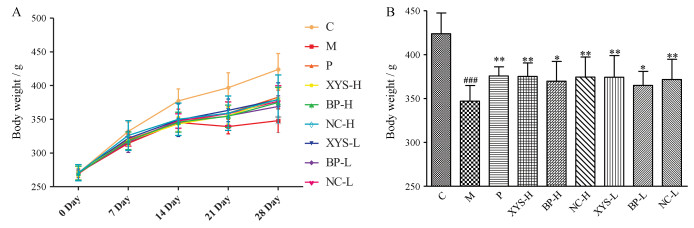
|
Figure 1 The data of rats' weight of C (control), M (model), P (positive), XYS-H (high-dose Xiaoyaosan), BP-H (high-dose Radix Bupleuri-Radix Paeoniae Alba), NC-H (high-dose negative control), XYS-L (low-dose Xiaoyaosan), BP-L (low-dose Radix Bupleuri-Radix Paeoniae Alba), NC-L (low-dose negative control); The trend of rats' weight in 28 days (A) and weight of rats on 28 day (B). n = 10, x ± s. ###P < 0.001 vs C; *P < 0.05, **P < 0.01 vs M |
第28天, 与空白组相比, 模型组大鼠的穿越格数显著减少(P < 0.001);给予药物后, 与模型组大鼠相比, 逍遥散高低剂量组(P < 0.001, P < 0.01)、药对高低剂量组(P < 0.01, P < 0.01)、阴性对照高低剂量组(P < 0.01, P < 0.05)均穿越格数显著性增多(图 2A)。与空白组相比, 模型组大鼠的直立次数显著减少(P < 0.001);给予药物后, 与模型组大鼠相比, 逍遥散高低剂量组(P < 0.01, P < 0.01)、药对高低剂量组(P < 0.01, P < 0.05)直立次数显著增多, 阴性对照仅高剂量组(P < 0.05)显著增多(如图 2B)。结果说明柴胡-白芍药对能够改善抑郁大鼠的旷场活动情况, 穿越格数高剂量组回调效果稍差于逍遥散, 低剂量与逍遥散相当; 直立次数高剂量回调效果与逍遥散相当, 低剂量稍差于逍遥散。

|
Figure 2 The numbers of crossing (A) and rearing (B) of C, M, P, XYS-H, BP-H, NC-H, XYS-L, BP-L and NC-L in open field test. n = 10, x ± s. ###P < 0.001 vs C; *P < 0.05, **P < 0.01, ***P < 0.001 vs M |
第28天, 与空白组相比, 模型组大鼠糖水偏爱率显著性减少(P < 0.001)。给予药物后, 与模型组大鼠相比, 逍遥散高低剂量组(P < 0.01, P < 0.01)、药对高低剂量组(P < 0.01, P < 0.05)糖水偏爱率均显著性升高, 阴性对照仅高剂量组(P < 0.05)显著性升高(图 3A)。结果说明柴胡-白芍能够显著提升抑郁大鼠的糖水偏爱率, 且高剂量回调效果与逍遥散相当, 低剂量稍差与逍遥散。
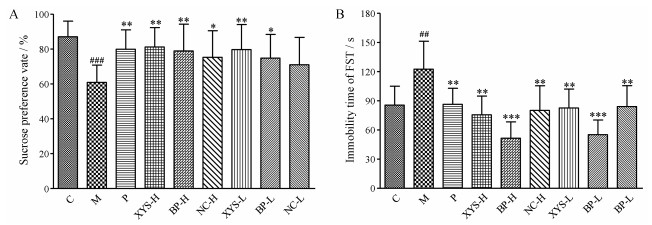
|
Figure 3 The sucrose preference rate (A) of C, M, P, XYS-H, BP-H, NC-H, XYS-L, BP-L and NC-L in the sucrose preference test (A); The immobility time (B) of C, M, P, XYS-H, BP-H, NC-H, XYS-L, BP-L and NC-L in the forced swimming test (B). n = 10, x ± s. ##P < 0.01, ###P < 0.001 vs C; *P < 0.05, **P < 0.01, ***P < 0.001 vs M |
第28天, 与空白组相比, 模型组大鼠强迫游泳不动时间显著性延长(P < 0.001);给予药物后, 与模型组相比, 逍遥散高低剂量组(P < 0.01, P < 0.01)、药对高低剂量组(P < 0.001, P < 0.001)、阴性对照高低剂量组(P < 0.01, P < 0.01)大鼠强迫游泳不动时间均显著减少(图 3B)。结果说明柴胡-白芍药对显著缩短抑郁大鼠强迫游泳的不动时间, 且高、低剂量组回调效果均优于逍遥散。
2 1H NMR代谢组学 2.1 核磁图谱归属空白大鼠血清典型1H NMR谱图如图 4, 结合文献[16]报道和HMDB (http://www.hmdb.ca/)、BMRB (http://www.bmrb.wisc.edu/)等数据库对图谱进行分析, 共指认出34种内源性代谢产物, 结果如表 1。
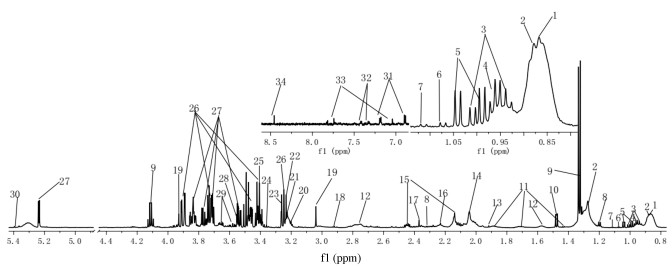
|
Figure 4 Typical 1H NMR spectrum of serum samples from control rat. The serial numbers in the figure 4 are consistent with those in the table 1 |
| Table 1 Assignments of 34 metabolites form rat serum |
通过1H NMR图谱成分归属获得血清中内源性代谢物信息, 为寻找潜在的与抑郁症相关生物标志物, 首先采用无监督的PCA方法, 从得分散点图可以看出空白组和模型组可明显分开(图 5A); 构建PLS-DA模型排列实验(图 5B), 所有左侧排列均低于右侧原始值且相交于负半轴(R2 = 0.994、Q2 = 0.815), 表明CUMS大鼠模型复制成功、可靠, 可用于发现能够表征与抑郁相关的潜在生物标志物; 进而进行有监督的OPLS-DA (图 5C)确定与抑郁相关的潜在生物标志物。V-S-plot图(图 5D)中变量对分类的重要程度由VIP (variable importance in the projection)值的大小来衡量, 变量离原点越远, VIP值越大。将VIP > 1且P < 0.05作为筛选潜在生物标志物的判定标准。对空白组、模型组、阳性药组、逍遥散组、药对组及阴性对照组进行OPLS-DA分析, 比较逍遥散、药对和阴性对照对生物标志物的回调效果(图 5E, 5F)。
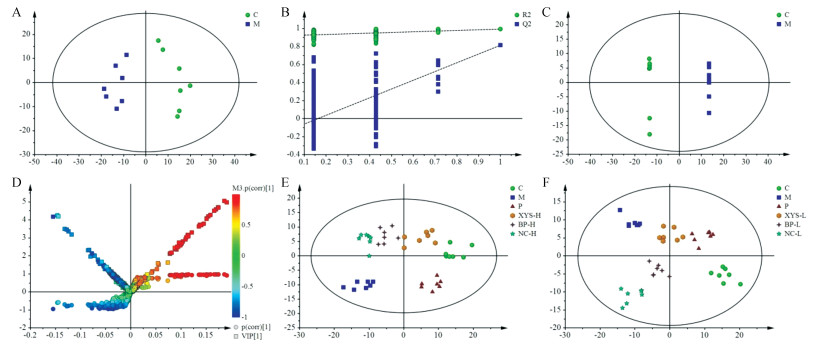
|
Figure 5 PCA scores plots (A) of rat serum from C and M, permutation test form PLS-DA (B); OPLS-DA scores plot (C), V-S-plot (D), OPLS-DA scores plot of C, M, P, XYS-H, BP-H and NC-H (E), OPLS-DA scores plot of C, M, P, XYS-L, BP-L and NC-L (F) |
通过对空白组和模型组进行OPLS-DA分析, 筛选出15种与抑郁症相关的潜在生物标志物。与空白组相比, 模型组大鼠血清中高密度脂蛋白、3-羟基丁酸、丙氨酸、谷氨酰胺、胆碱、β-葡萄糖、甘氨酸、和α-葡萄糖8种代谢物含量升高; 低密度脂蛋白、异亮氨酸、乳酸、丙酮、丙酮酸、肌酸和氧化三甲胺7种代谢物含量降低。与模型组比较, 逍遥散能显著回调高密度脂蛋白、低密度脂蛋白、异亮氨酸、谷氨酰胺、3-羟基丁酸、丙氨酸、丙酮、丙酮酸、肌酐、胆碱、氧化三甲胺和α-葡萄糖等12种潜在生物标志物; 药对能够显著回调其中高密度脂蛋白、异亮氨酸、谷氨酰胺、丙氨酸、丙酮酸、肌酐、氧化三甲胺和α-葡萄糖等8种潜在生物标志物; 阴性对照能够显著回调其中高密度脂蛋白、异亮氨酸、丙氨酸、丙酮酸、肌酐和α-葡萄糖等6种潜在生物标志物。综上可见, 在标志物调节数量上, 柴胡-白芍药对能对复方所调节的大部分标志物具有显著回调作用。在标志物的调节程度上, 柴胡-白芍药对对标志物的调节程度与复方基本一致(图 6)。而阴性对照在标志物的调节数量及程度均不及柴胡-白芍药对。揭示柴胡-白芍药对在逍遥散对抑郁症相关生物标志物的调节中起到重要作用。

|
Figure 6 Comparison of relative peak areas of the potential biomarkers associated with depression, which could be regulated by XYS, BP and NC. The relative peak areas of metabolites were obtained from 1H NMR analysis of serum. n = 7, x ± s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs C; *P < 0.05, **P < 0.01, ***P < 0.001 vs M |
将通过1H NMR找到的15种与抑郁症相关的生物标志物以及逍遥散、药对和阴性对照显著回调的生物标志物输入metaboanalyst (http://www.Metaboanalyst.ca)数据库中进行代谢通路分析。如图 7A, 横坐标Pathway impact表示由拓扑分析所计算出的代谢通路重要性值, 纵坐标-log (p)表示代谢通路富集分析的显著性水平。本研究中将代谢通路影响值大于0.1的通路视为与抑郁相关的代谢通路, 共筛选得到5条代谢通路, 分别为甘氨酸、丝氨酸和苏氨酸代谢; 缬氨酸、亮氨酸和异亮氨酸的生物合成; 丙氨酸、天冬氨酸和谷氨酸代谢; 丙酮酸代谢; 糖酵解或糖异生。在CUMS模型影响的5条代谢通路中, 逍遥散和药对均能调节其中的4条代谢通路, 且对不同代谢通路的重要性值和显著性水平一致(图 7B、7C); 阴性对照仅主要参与了其中3条代谢通路(图 7D)。说明柴胡-白芍药对在逍遥散方中通过调节代谢通路发挥抗抑郁起主要作用。
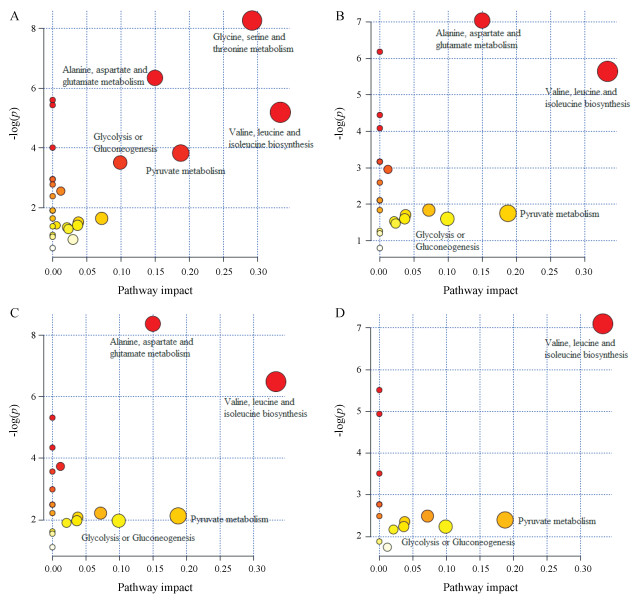
|
Figure 7 Summary diagram of pathway analysis with Met-PA. The metabolic pathways associated with depression (A); Regulation of metabolic pathway of XYS (B); Regulation of metabolic pathway of BP (C); Regulation of metabolic pathway of NC (D) |
柴胡、白芍配伍使用最早出现在汉代张仲景的《伤寒论》中。柴胡、白芍配伍, 以白芍之酸敛制柴胡之辛散, 用柴胡之辛散又制白芍之酸敛, 一散一收, 是疏肝解郁常用的配伍药对[17]。逍遥散出自于宋·太医局主持编写的《太平惠民和剂局方》, 全方由柴胡、白芍、当归、麸炒白术、茯苓、炙甘草、干姜和薄荷组成, 是疏肝解郁的经典名方, 其中以柴胡为君药, 白芍为臣药。本研究以CUMS模型大鼠为研究对象, 考察药对、逍遥散和阴性对照对抑郁大鼠的行为学的影响, 从行为学层面探究柴胡-白芍对逍遥散发挥抗抑郁作用的贡献; 利用代谢组学技术阐明柴胡-白芍药对的抗抑郁作用机制, 从对生物标志物回调强度揭示药对对逍遥散抗抑郁作用的贡献; 通过代谢通路分析验证该药对在逍遥散中的重要地位。
通过代谢通路分析发现, 柴胡-白芍药对发挥抗抑郁作用的机制主要是改善大鼠体内氨基酸代谢(丙氨酸, 天冬氨酸和谷氨酸代谢; 缬氨酸、亮氨酸和异亮氨酸合成)以及能量代谢(丙酮酸代谢、糖酵解或糖异生)。缬氨酸、亮氨酸与异亮氨酸同为支链氨基酸, 是人体内丰富的必需氨基酸, 缬氨酸、亮氨酸和异亮氨酸的生物合成途径在调节机体应激、蛋白质的合成与代谢、糖代谢、能量代谢和肌肉代谢平衡中都起重要作用[18, 19]。本研究通过与抑郁症相关的代谢通路发现:与空白组相比较, 抑郁模型组大鼠的缬氨酸、亮氨酸和异亮氨酸的生物合成途径发生紊乱, 这与文献[20, 21]报道的一致。柴胡-白芍药对、逍遥散及阴性对照可通过此途径发挥抗抑郁作用。
谷氨酸是一种重要的兴奋性神经递质, 而谷氨酸含量的升高可能会诱发神经毒性[22], 而谷氨酰胺在生物体内可在谷氨酰胺酶的作用下转化为谷氨酸, 且丙氨酸可通过丙氨酸转氨酶生成谷氨酸[23], 本研究发现CUMS造模可引起大鼠体内谷氨酰胺和丙氨酸含量的升高, 机体可能通过丙氨酸转氨酶和谷氨酰胺酶的作用导致谷氨酸水平的升高, 造成神经损伤导致抑郁的发生。柴胡-白芍药对和逍遥散的代谢通路分析提示两者可能调节丙氨酸、天冬氨酸和谷氨酸代谢来发挥抗抑郁作用。
丙酮酸代谢、糖酵解和糖异生是生物体能量代谢的重要途径, 丙酮酸是多种物质之间相互转化和代谢的枢纽物质, 在有氧氧化过程中由葡萄糖氧化而成, 进而进入线粒体参与三羧酸循环实现糖、脂肪和氨基酸之间的相互转化并为机体供能; 没有线粒体的成熟红细胞则完全依赖糖酵解供应能量; 在缺氧环境下, 丙酮酸通过糖酵解途径被还原成乳酸, 为机体迅速提供能量; 而神经、白细胞、骨髓等代谢极为活跃, 即使在不缺氧情况下也常由糖酵解提供能量[24]。因而丙酮酸代谢途径在机体的能量代谢中具有重要作用。通路分析发现柴胡-白芍、逍遥散和阴性对照可改善抑郁大鼠的丙酮酸代谢。
综上, 本研究从行为学、代谢组学和代谢通路3个层面探究柴胡-白芍药对对逍遥散发挥抗抑郁贡献的药理机制, 发现由君药柴胡和臣药白芍组成的药对在复方逍遥散发挥抗抑作用中起到重要的作用。柴胡-白芍可能通过调节氨基酸代谢和能量代谢发挥抗抑郁作用, 体现了中药多成分、多靶点发挥药效的特点。
| [1] | Shi XL, Chen GH, Zhao XF, et al. Study on the patterns of Chinese medicine patent formulas treating depression based on date mining[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2013, 24: 2822–2824. |
| [2] | Wang Y, Fan R, Huang X. Meta-analysis of the clinical effectiveness of traditional Chinese medicine formula Chaihu-Shugan-San in depression[J]. J Ethnopharmacol, 2012, 141: 571–577. DOI:10.1016/j.jep.2011.08.079 |
| [3] | Wang YT, Tan QR, Sun LL, et al. Possible therapeutic effect of a traditional Chinese medicine, sinisan, on chronic restraint stress related disorders[J]. Neurosci Lett, 2009, 449: 215–219. DOI:10.1016/j.neulet.2008.10.100 |
| [4] | Liu JL, Yang L, Cui J, et al. Preliminary study on serum pharmacochemisty of petroleum ether fraction in ethanol extract from Xiaoyao Powder based on UPLC-PDA[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 2816–2822. |
| [5] | Wang Y, Gao SM, Li R, et al. Antidepressant-like effects of the Radix Bupleuri and Radix Paeoniae Alba drug pair[J]. Neurosci Lett, 2016, 633: 14–20. DOI:10.1016/j.neulet.2016.09.001 |
| [6] | He J, Gao XX, Tian JS, et al. Analysis on chemical constituents in Bupleuri Radix and Paeoniae Radix Alba by UPLC-MS and their contribution to Xiaoyao powder[J]. J Shanxi Med Univ (山西医科大学学报), 2018, 49: 375–382. |
| [7] | Puchades-Carrasco L, Pineda-Lucena A. Metabolomics in pharmaceutical research and development[J]. Curr Opin Biotechnol, 2015, 35: 73–77. DOI:10.1016/j.copbio.2015.04.004 |
| [8] | Yang YZ, Deng Y, Yang XJ, et al. Application of metabonomics in TCM research[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2018, 25: 132–135. |
| [9] | Tong JH, Wang YX, Sun H, et al. Study on the pharmacodynamic differences between Hangmaidong and Chuangmaidong based on metabonomics[J]. Acta Pharm Sin (药学学报), 2014, 49: 451–1456. |
| [10] | Jiao ML, Li ZY, Zhang FS, et al. Comparison between Astragalus membranaceus var. mongholicus and Hedysarum polybotrys based on ITS sequences and metabolomics[J]. Acta Pharm Sin (药学学报), 2015, 50: 1625–1631. |
| [11] | Willner P. Validity, reliability and utility of the chronic mild stress model of depression:A 10-year review and evaluation[J]. Psychopharmacology, 1997, 134: 319–329. DOI:10.1007/s002130050456 |
| [12] | Tian JS, Shi BY, Xiang H, et al. 1H-NMR-based metabonomic studies on the anti-depressant effect of genipin in the chronic unpredictable mild stress rat model[J]. PLoS One, 2013, 8: e75721. DOI:10.1371/journal.pone.0075721 |
| [13] | Zhang T, Zhao F, Zhang X, et al. Antidepressant effect of Compound Chaigui prescription and its mechanism of regulating 5-HT metabolic pathway[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 1338–1344. |
| [14] | Wu S, An SC, Chen HL, et al. Orbital frontal cortex D1 dopamine receptor modulate glutamate and NMDA receptor in depression induced by chronic unpredictable mild stress[J]. Acta Psychol Sin (心理学报), 2014, 46: 69–78. |
| [15] | Shi HS, Zhu WL, Liu JF, et al. PI3K/Akt signaling pathway in the basolateral amygdala mediates the rapid antidepressant-like effects of trefoil factor 3[J]. Neuropsychopharmacol, 2012, 37: 2671–2683. DOI:10.1038/npp.2012.131 |
| [16] | Zhao FF, Gao L, Qin XM, et al. The intervention effect of licorice in d-galactose induced aging rats by regulating the taurine metabolic pathway[J]. Food Funct, 2018, 9: 4814–4821. DOI:10.1039/C8FO00740C |
| [17] | Chen SL, Chen XD. Clinical application of combined use of Radix Bupleuerl and Radix Paeoniae Alba[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2007, 41: 71–74. |
| [18] | Li YY, Man SL, Li J, et al. The antitumor effect of formosanin C on HepG2 cell as revealed by 1H NMR based metabolic profiling[J]. Chem-Biol Interact, 2014, 220: 193–199. DOI:10.1016/j.cbi.2014.06.023 |
| [19] | Cui JJ, Liu YT, Hu YH, et al. NMR-based metabonomics and correlation analysis reveal potential biomarkers associated with chronic atrophic gastritis[J]. J Pharm Biomed, 2017, 132: 77–86. DOI:10.1016/j.jpba.2016.09.044 |
| [20] | Jia HM, Feng YF, Liu YT, et al. Integration of 1H NMR and UPLC-Q-TOF/MS for a comprehensive urinary metabonomics study on a rat model of depression induced by chronic unpredictable mild stress[J]. PLoS One, 2013, 8: e63624. DOI:10.1371/journal.pone.0063624 |
| [21] | Liu XJ, Zhou YZ, Li ZF, et al. Anti-depressant effects of Xiaoyaosan on rat model of chronic unpredictable mild stress:a plasma metabonomics study based on NMR spectroscopy[J]. J Pharm Pharmacol, 2012, 64: 578–588. DOI:10.1111/j.2042-7158.2011.01412.x |
| [22] | Mohan MA, Gangurde SU, Kadam VR. Protective effect of Solanum torvum on monosodium glutamate-induced neurotoxicity in mice[J]. Indian J Nat Prod Resour, 2017, 8: 351–359. |
| [23] | Yao WB, Yang H. Biochemistry (生物化学)[M]. Beijing: People's Medical Publishing House, 2011: 289-299. |
| [24] | Yao WB, Yang H. Biochemistry (生物化学)[M]. Beijing: People's Medical Publishing House, 2011: 218-230. |
 2019, Vol. 54
2019, Vol. 54


