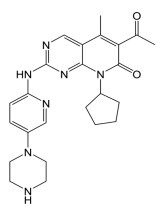
自20世纪80年代开始, 我国乳腺癌的发病率和死亡率一直呈上升趋势。乳腺癌发病率已经成为女性恶性肿瘤的第一位, 对女性身心健康造成了极大威胁[1-3]。帕博西尼化学名为乙酰基-8-环戊基-5-甲基-2-(5-哌嗪-1-基-吡啶-2-基氨酸)-8H-吡啶并[2, 3-d]嘧啶-7-酮[4], 结构式如图 1。帕博西尼自2015年2月3日上市以来, 与来曲唑联用治疗雌激素受体阳性(estrogen receptor, ER+)和人表皮生长因子受体2阴性(human epidermal growth factor receptor, HER2-)的妇女晚期乳腺癌, 成为绝经期妇女晚期乳腺癌患者的一线治疗有效药物[5-7]。它是一种抑制4/6细胞周期蛋白依赖性激酶(cyclin-dependent kinase, CDK)对成视网膜母细胞瘤蛋白(retinoblastomaprotei, Rb)磷酸化作用的抑制剂, 通过阻断细胞由生长期(G1期)到DNA复制期(S期)来切断DNA的合成从而发挥药效[8-10]。相比于前两代CDKs抑制剂, 帕博西尼的选择性更高并且药效更显著[11]。专利文献[4]中已公开报道帕博西尼具有晶型A和晶型B两种晶型, 其中较为稳定的晶型A被认为是抗癌药的有效晶型。制备过程较为复杂, 若制备过程中稍有不当将会导致药物以混晶或无定型形式存在。
|
Figure 1 Structure of palbociclib (Mr 447.53) |
对于同质异晶体的研究, 常借助于DSC、SEM和PXRD, 在相关文献[12-14]中已有较多报道。因此, 本文先通过这三种方法分别对帕博西尼的两种晶型进行表征, 初步建立了定性分析方法。帕博西尼在制备过程中常以A/B混晶的形式出现, 而有效晶型是A晶型, 为了确保药品质量, 需要一种切实有效的方法来测定帕博西尼中晶型A和晶型B的含量。本文采用X-射线粉末衍射单峰法中的峰面积法和峰高法对晶型A和晶型B的混晶体系进行定量分析研究, 取得了可行的解决办法, 为药物质量控制提供保障和科学依据。
材料与方法单峰法原理 单峰法对样品的信息要求小, 方法的灵敏度高。当固体药物为几种晶型的混合物时, 其PXRD图谱也是由这几种晶型的衍射图谱叠加而成, 且其衍射峰强度也会随着几种晶型比例的改变而呈现出正相关的趋势[15]。在本文中, 首先配制一系列质量百分比不同的帕博西尼晶型A和晶型B的二相体系混合物。在同样的条件下收集混合物的X-射线衍射图谱, 获得晶型A与晶型B的衍射强度比值, 使衍射强度与混合物中各晶型含量呈一定的线性关系, 从而得到晶型A与晶型B的标准曲线。据此, 可根据标准曲线获得未知样品帕博西尼晶型A和晶型B的含量。
仪器 天津天马衡基仪器有限公司的FA2004型电子天平; 河南太康科教器材厂的SHB-3型循环水式多用真空泵; 日本理学公司的D/max 2500VL/PC型阳极转靶X射线衍射仪; 日本电子公司的JSM-5610型扫描电子显微镜; Analysis Diamond差示扫描量热仪(Perkin Elmer, 美国)。
材料 帕博西尼样品由南京卡文迪许生物工程技术有限公司提供。
差示扫描量热法分析(DSC) 称取样品约2.0 mg放入铝坩埚中密封, 将坩埚放入DSC中进行测试, 以氮气为保护气(气体流量60 mL·min-1), 将样品平衡至25 ℃, 然后以10 ℃·min-1的扫描速率升温至300 ℃, 自然冷却。
扫描电子显微镜法分析(SEM) 分别取帕博西尼A晶型和B晶型样品粘结在样品座上, 镀膜处理后放置于扫描电子显微镜下观察形态结构。测定条件:加速电压5 kV, 放大倍数2 000倍。
X-射线粉末衍射法分析(PXRD) 测定条件:管压: 40 kV; 管流: 200 mA。Cu-Kα辐射, 石墨弯晶单色器, DS = SS = 1°, RS = 0.15 mm。扫描方式:连续扫描。
实验样品的预处理 将帕博西尼A晶型样品和B晶型样品分别过200目筛, 使得粒径大小尽量一致, 便于充分混合, 减小误差。
实验样品的配制过程 配制不同比例混晶体系。本文采取研磨混合的方法来配制用于定量分析的二元混合物。按照一定比例(总量300 mg)分别于分析天平上称取帕博西尼晶型A和晶型B的样品, 如表 1, 置于玛瑙研钵中研磨混合, 编号N1~N14, 共14个样品。
| Table 1 The proportion of form-A and form-B in the mixed crystal system of palbociclib. N1-N14: The name of 14 samples of different proportions |
数据的采集 将制备好的混合样品(N1~N14)在相同的实验条件下进行X-射线衍射扫描测定。测试时, 将样品置于硼玻璃样品架填充区(20 mm×20 mm×0.2 mm), 使粉末试样均匀填充于样品架中, 填实后用玻璃片轻压制片, 最后制得的试样表面应与样品架表面齐平。比例相同的样品制样3次, 测定3次。取3次试样结果的平均值来建立标准曲线。
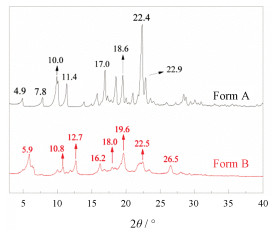
定量模型标准曲线的建立 帕博西尼晶型A和晶型B各有不同的特征峰。A晶型在2θ = 4.9°、7.8°、10.0°、11.4°、17.0°、18.6°、22.4°和22.9°处有特征峰, 2θ = 22.4°处为最强峰; 而B晶型在2θ = 5.9°、10.8°、12.7°、16.2°、18.0°、19.6°、22.5°和26.5°处有特征峰, 2θ = 5.9°处为最强峰。因A晶型在2θ = 17.0°和22.4°处峰与B晶型的峰有重叠, 所以选取A晶型在2θ = 22.9°处峰作为定量分析的特征峰。选取B晶型的最强峰, 即2θ = 5.9°处峰作为定量分析的特征峰。
采集数据后将所得的图谱用Jade分析软件处理, 得到帕博西尼晶型A和晶型B特征峰的峰高强度和峰面积积分强度, 根据公式(1)计算出晶型B与晶型A+晶型B的强度比, 并以晶型B的质量百分含量对衍射强度比作标准曲线。
| $ {X_{\rm{B}}} = \frac{{{I_{\rm{B}}}}}{{{I_{\rm{A}}} + {I_{\rm{B}}}}} $ | (1) |
式中XB为衍射强度比; IB为B晶型的峰强度; IA为A晶型的峰强度。
检测限和定量限 本文利用检测限(LOD)和定量限(LOQ)两个指标来测试峰面积法和峰高法的灵敏度[16]。计算公式见式(2)和式(3):
| $ {\rm{LOD}} = 3.3\sigma /S $ | (2) |
| $ {\rm{LOQ}} = 10\sigma /S $ | (3) |
式中σ为标准误差, 使用的是标准曲线截距的标准误差; S为标准曲线的斜率。文中使用Origin软件对两条标准曲线(峰面积法和峰高法)进行计算和分析。
结果 1 差示扫描量热法分析(DSC)帕博西尼A晶型和B晶型的DSC曲线如图 2所示。从曲线上看, A晶型和B晶型都仅有一个吸热峰, 测量得到的A晶型的熔点和热焓分别为266.4 ℃和96.0 J·g-1, B晶型的熔点和热焓分别为270.5 ℃和97.9 J·g-1。由此可以看出, 两种晶型的熔点和热焓都比较接近, 采用DSC法定性鉴定其结果区分不够明显。

|
Figure 2 DSC curves of palbociclib form-A and form-B. Peak: Melting point; Delta H: The enthalpy change |
帕博西尼晶型A和晶型B的扫描电镜结果如图 3所示, 晶型A与晶型B的形貌完全不同, 晶型A分层为块状, 而晶型B为针状。结果与文献[4]一致, 可根据此方法来鉴别帕博西尼晶型A与晶型B。

|
Figure 3 SEM image of palbociclib form-A(A) and palbociclib form-B(B) |
从图 4和表 2中可以看出, 晶型A与晶型B各有不同的特征峰。A晶型在2θ = 4.9°、7.8°、10.0°、11.4°、17.0°、18.6°、22.4°和22.9°处有特征峰, 而B晶型在2θ = 5.9°、10.8°、12.7°、16.2°、18.0°、19.6°、22.5°和26.5°处有特征峰, 与专利报道的结果基本一致[4], 误差在±0.2°范围内, 可据此来鉴别晶型A与晶型B。同时, 不同的特征峰也可作为帕博西尼晶型A与晶型B定量分析的基础。
|
Figure 4 Different characteristic peaks of palbociclib form-A and form-B in PXRD patterns |
| Table 2 The comparison of palbociclib and patent |
根据X-射线粉末衍射峰面积法和峰高法测定了N1~N14样品的晶型A与晶型B的特征峰强度数据, 由式(1)可计算出峰面积标准曲线方程为y = 0.842 75x - 0.001 21, 峰高标准曲线方程为y = 0.909 64x - 0.002 32。两种方法的R2值分别为0.986 17和0.985 83, 两组曲线均取得了较好的线性关系, 其中峰面积法的线性关系较好。
5 检测限和定量限检测限(LOD)和定量限(LOQ)可用来测试方法的灵敏度, 根据公式(2)和公式(3)可计算出峰面积标准曲线中B晶型的检测限和定量限分别为1.17%和3.92%, 峰高标准曲线中B晶型的检测限和定量限分别为1.19%和3.97%, 峰面积法比峰高法灵敏度更高。
讨论在X-射线衍射的定量分析中, 通常每个物相选取一条特征衍射峰采集数据。该衍射峰和其他物相的衍射峰不可发生重叠, 尽可能选择独立且强度较高的特征峰, 另外制样时还要避免择优取向等原因造成强度不稳定、出现偏差的现象。本实验中因晶型A在2θ = 17.0°和22.4°与晶型B的峰发生重叠, 所以选取了晶型A在2θ = 22.9°处峰作为定量分析的特征峰。选取B晶型的最强峰, 即2θ = 5.9°处峰作为定量分析的特征峰。
本实验中, 帕博西尼晶型B极易黏附在研钵壁上。在对晶型A和晶型B进行研磨混合时, 应采取适中的力度进行。用力过大会导致样品黏附在玛瑙研钵壁上, 从而造成数据不准确。
本文在定性分析帕博西尼两种晶型的基础上, 建立了基于PXRD峰面积法和峰高法的定量分析方法。在药物帕博西尼的合成工艺中, 杂质的含量通常在较低范围内波动。因此, 本实验配制了杂质晶型B在有效晶型A中含量为1%到18%的样品, 而并非常量分析时1%到100%的样品, 可更有针对性的对低杂质含量进行定量分析。本文所采用的方法可快速准确的鉴定出帕博西尼A晶型和B晶型并对其进行定量测定, 可应用于批量分析工作, 为药物质量控制提供保障和科学依据。
| [1] | Chen W, Zheng R. Incidence, mortality and survival analysis of breast cancer in China[J]. Chin J Clin Oncol (中国肿瘤临床), 2015, 42: 668–674. |
| [2] | Zheng Y, Wu C, Zhang M. The epidemic and characteristics of female breast cancer in China[J]. China Oncol (中国癌症杂志), 2013, 23: 561–569. |
| [3] | Cicenas J, Kalyan K, Sorokinas A, et al. Highlights of the latest advances in research on CDK inhibitors[J]. Cancers, 2014, 6: 2224–2242. DOI:10.3390/cancers6042224 |
| [4] | Chekal BP. Solid forms of a selective CDK4/6 inhibitor: US, WO2014/128588[P]. 2014-08-28. |
| [5] | Bell T, Crown JP, Lang I, et al. Impact of palbociclib plus letrozole on pain severity and pain interference with daily activities in patients with estrogen receptor-positive/human epidermal growth factor receptor 2-negative advanced breast cancer as first-line treatment[J]. Curr Med Res Opin, 2016, 32: 959–965. DOI:10.1185/03007995.2016.1157060 |
| [6] | Finn RS, Grown JP, Lang I, et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18):a randomised phase 2 study[J]. Lancet Oncol, 2015, 16: 25–35. DOI:10.1016/S1470-2045(14)71159-3 |
| [7] | Liu S, Xu J, Cui Y, et al. Palbociclib-a new drug approved for advanced breast cancer[J]. Prog Pharm Sci (药学进展), 2015, 39: 634–640. |
| [8] | Tempka D, Tokarz P, Chmielewska K, et al. Downregulation of PARP1 transcription by CDK4/6 inhibitors sensitizes human lung cancer cells to anticancer drug-induced death by impairing OGG1-dependent base excision repair[J]. Redox Biol, 2018, 15: 316–326. DOI:10.1016/j.redox.2017.12.017 |
| [9] | Fang H, Huang D, Yang F, et al. Potential biomarkers of CDK4/6 inhibitors in hormone receptor-positive advanced breast cancer[J]. Breast Cancer Res Treat, 2018, 168: 287–297. DOI:10.1007/s10549-017-4612-y |
| [10] | Liu M, Liu H, Chen J. Mechanisms of the CDK4/6 inhibitor palbociclib (PD 0332991) and its future application in cancer treatment[J]. Oncol Rep, 2018, 39: 901–911. |
| [11] | Wang SS, Yu HY. Palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor positive, HER2 negative, advanced breast cancer significantly improve progression-free survival[J]. J Evid Based Med (循证医学), 2015, 15: 146–148. |
| [12] | Zhao YN, Chen XQ, Zhu K, et al. Thermostability and crystal structure of anticancer drug dasatinib[J]. Acta Pharm Sin (药学学报), 2011, 46: 1104–1107. |
| [13] | Huang R, Wang T, Yang X, et al. Characterization of taste-masking dry emulsion of azithromycin by in vitro and in vivo evaluation[J]. Acta Pharm Sin (药学学报), 2017, 52: 795–801. |
| [14] | Li G, Su GQ, Xu QW, et al. A new crystal form of nateglinide[J]. Acta Pharm Sin (药学学报), 2001, 37: 532–534. |
| [15] | Yang XP. The development and application of X-ray diffraction[J]. J Shanxi Norm Univ (山西师范大学), 2007, 21: 72–76. |
| [16] | Lu J, Fu LY, Wang X. Discussion on the detecting methods for limit of detection and limit of quantification in validation of analytical method[J]. Drug Stand China (中国药品标准), 2012, 13: 33–35. |
 2019, Vol. 54
2019, Vol. 54


