2. 南京中医药大学附属医院, 江苏 南京 210029;
3. 陕西中医药大学, 陕西 咸阳 712000;
4. 步长制药有限公司, 陕西 西安 710000
2. The Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, China;
3. Shaanxi University of Traditional Chinese Medicine, Xianyang 712000, China;
4. Buchang Pharma, Xi'an 710000, China
随着社会老龄化进程加快, 多药治疗已经成为现在医学治疗的主要模式, 因此带来潜在的中西药相互作用已经成为合理用药的关注点[1]。据一项回顾性研究30 397例住院患者的医嘱发现:心血管疾病用药和抗菌药物是使用率最高的药物[2]。尤其是老年人, 机体免疫较弱, 并发基础疾病较多, 住院期间常见并发细菌感染, 因此同一疗程中同时出现这两类药物的几率较高[3-7]。在中国, 活血化瘀类中药注射剂已成为治疗心脑血管疾病的重要补充用药, 43.46%的心血管疾病患者用药模式以中西药结合为主, 其中以丹红注射液(Danhong injection, DHI)为代表[8]。
DHI活血化瘀、通脉舒络的疗效确切, 在临床上已被广泛应用于治疗如冠心病、缺血性脑梗塞等多种心脑血管疾病, 并已形成了临床应用专家共识[9]。但在其临床联合用药方面的研究报道, 除了与阿司匹林药物的相互作用外[10-13], 仍相对较少。
本课题组前期对江苏省中医院2013~2015年住院患者医嘱信息进行回顾性研究发现: DHI常与头孢类抗菌药物联合用药, 其中以三代头孢菌素头孢曲松(ceftriaxone, CFTX)为代表[14], 1 233名同时使用DHI和抗菌药物的患者中有179名患者使用了CFTX。而文献[15]报道DHI与头孢类抗菌药物联合用药可能发生不良反应, 且在江苏省不良反应监测中心收集的DHI不良反应报告中, 存在与CFTX联合用药的情况。前期文献[16]报道CFTX血清白蛋白结合率较高, 而DHI中的酚酸类成分如丹酚酸D、迷迭香酸、紫草酸和丹酚酸B等血清白蛋白结合率也较高[17-19], 两药联用可能会竞争性结合血清白蛋白, 发生药动学相互作用。更有文献[20]报道, CFTX因能与华法林竞争性结合血清白蛋白, 而增加华法林的抗凝功效。因此本研究在前期临床数据统计的基础上, 设计联合用药方案, 考察CFTX对DHI在成年雄性SD大鼠体内药动学和抗血栓、抗凝血及抗血小板药效的影响。
材料与方法药品和试剂DHI (步长制药有限公司, 批号16091002), 注射用头孢曲松钠(上海罗氏公司, 批号SH1843), p-香豆酸(p-CA, 含量≥98%, 南京元宝山色谱有限公司, 批号151228), 丹酚酸D (SaD, 含量≥98%, 成都曼思特生物科技有限公司, 批号16031810), 迷迭香酸(RA, 含量≥98%, 中国食品药品检定研究院, 批号111871-201505), 丹酚酸B (SaB, 含量≥98%, 中国食品药品检定研究院, 批号111562-201515), 内标(internal standard, IS)氯霉素(LMS, 含量≥98%, 中国食品药品检定研究院, 批号111562-201515), 色谱纯乙腈(ACN)购于美国天地公司; 甲酸购自德国默克公司。超纯水由纯水制备系统Milli-Q Direct-Q5制备。血栓烷素B2 (TXB2)、大鼠血小板膜糖蛋白Ⅱb/Ⅲa (GP Ⅱb/Ⅲa)、大鼠P选择素(P-selectin / CD62p)、大鼠血管性血友病因子(vWF) ELISA试剂盒, 购自南京金益佰公司(规格96T), 生产批号分别为jeb-13505、jeb-13951、jeb-13755、jeb-13388。
仪器和设备 AcquityTM UHPLC-TQ-MS, 配备ESI离子源和MassLynx 4.1质谱工作站软件(Waters公司, 美国), STA-R Evolution全自动血凝仪(Stago公司, 法国), PerkinElmer EnSpire多功能酶标仪(Thermo Fisher公司, 美国)。
实验动物 雄性SD大鼠40只, 体重230±15 g, 购自南通大学(动物生产许可证号SCXK-2014-0001), 饲养温度22±2 ℃, 相对湿度50%±20%, 标准大鼠饲料自由饮食, 适应饲养7 d后开始每天固定时间给药, 在药动学实验前24 h禁食。所有动物实验均通过南京中医药大学动物伦理审查。
实验设计与给药方案 临床CFTX和DHI给药方式主要为静脉滴注, 由于大鼠静脉滴注给药存在较大难度, 因此本实验给药采用尾静脉注射。临床给药剂量CFTX 1.0 g·d-1, DHI 40.0 mL·d-1。由于CFTX和DHI都是开瓶后室温条件6 h内稳定[21, 22], 因此所用药物均为现配现用。用0.9%灭菌氯化钠溶液(生理盐水)配制CFTX (50.0 mg·mL-1), 而DHI开瓶现用。按临床统计数据设计联合用药方式: DHI最常见用药天数为14 d, CFTX最常见用药天数为7 d, 两者常见联合用药时间为7 d, 因此选择7 d作为联合用药时间进行研究, 即先使用DHI 7 d, 从第8 d起联合使用CFTX 7 d。联合给药方式为序贯给药, 在静脉注射CFTX后, 立即静脉注射DHI。
雄性SD大鼠随机分为3组, 每组8只: DHI单独用药组设置为1组(DHI 14 d), DHI联合用药组分别为2组(DHI联用CFTX 14 d + 7 d), 另设3组(空白对照)。根据实验动物和人单位面积给药量相等的原则, 按人平均体重70 kg计算, 按公式计算大鼠的给药剂量, 得到CFTX的剂量应为90.0 mg·(kg·d)-1, DHI的剂量为4.16 mL·(kg·d)-1。第1~7 d, 第1组和第2组尾静脉注射DHI, 第3组尾静脉注射生理盐水; 第8~14 d, 第1组尾静脉注射DHI, 第2组给药CFTX和DHI, 第3组继续尾静脉注射生理盐水。为减少给药体积对血药浓度的影响, 生理盐水用于补充DHI单独用药组和空白对照组不足的药物体积。
第13 d晚上禁食, 第14 d给药前从大鼠的眼眶取全血0.5 mL, 以9:1的比例加入枸橼酸钠抗凝剂, 用全自动血凝仪测定国际化标准比值(INR)、凝血酶原时间(PT)、凝血酶时间(TT)、活化部分凝血活酶时间(APTT)和纤维蛋白原(FIB)。第14 d在给药前0 min和给药后的5、10、15、20、30、40 min, 1、1.5和2 h从眼眶采血0.25 mL, 加入肝素化的1.5 mL EP管中, 4 000 r·min-1离心5 min, 取上清得血浆, −30 ℃保存。第15 d大鼠处死前, 腹主动脉取血3 mL后置于室温放置4 h, 3 000 r·min-1离心10 min, 取上清得血清, −80 ℃保存, 第16 d用ELISA试剂盒测定TXB2、GP Ⅱb/Ⅲa、CD62p、vWF。
UHPLC-TQ-MS测定大鼠血浆中DHI酚酸类成分的浓度 超高效液相色谱柱选用Waters BEH C18柱(2.1 mm×100 mm, 1.7 μm), 流动相为0.4%甲酸水溶液(A) (4:1 000, 0.104 mol·L-1)和ACN (B), 梯度洗脱设置如下: 0~2.0 min (5%~20% B), 2.0~5.0 min (20%~95% B), 5.0~5.5 min (95%~95% B), 5.5~6.0 min (95%~5% B)。流速设置为0.4 mL·min-1, 柱温35 ℃, 自动进样体积2 μL, 进样温度设置4 ℃。
质谱分析采用负离子(ESI-)和多反应监测(MRM)模式。检测参数设置为:毛细管电压3.0 kV, 源温150 ℃, 脱溶剂气温度500 ℃, 锥孔气流量50 L·h-1, 干燥气流速度1 000 L·h-1, 碰撞气流量0.15 mL·min-1。各待测酚酸成分的保留时间(tR)和质谱条件参数见表 1。
| Table 1 The retention time (tR) and the optimal detection parameters of p-coumaric acid (p-CA), salvianolic acid D (SaD), rosmarinic acid (RA) and salvianolic acid B (SaB) in Danhong injection (DHI) and IS (ESI-) |
血浆样品前处理方法 取血浆样品50 μL, 加入LMS (IS)溶液10 μL, 涡旋30 s混匀, 再加入ACN 150 μL沉淀蛋白, 涡旋3 min混匀后4 ℃、12 000 r·min-1离心5 min, 取上清170 μL, 40 ℃氮气吹干后, 用50% ACN溶液50 μL复溶, 涡旋1 min混匀, 4 ℃、12 000 r·min-1离心5 min, 取上清2 μL进样。
标准溶液配制和质控(QC)样品配制 精密称量p-CA、SaD、RA、SaB对照品适量, 用50% ACN溶解, 从各对照品储备液中取1.0 mL混匀, 得到混合对照品储备溶液, 使终质量浓度分别为50.05、47.51、120.01和268.75 μg·mL-1。IS溶液称取适量LMS对照品, 用50% ACN溶解, 使终质量浓度为9.93 μg·mL-1。进一步将混合对照品储备液梯度稀释成对照品工作液。
血浆标准溶液的配制 取空白血浆50 μL, 加入各对照品工作液10 μL和LMS (IS)溶液10 μL, 涡旋30 s混匀, 再加入ACN 150 μL, 涡旋3 min混匀后4 ℃、12 000 r·min-1离心5 min, 取上清170 μL, 40 ℃氮气吹干后, 用50% ACN溶液50 μL复溶, 涡旋1 min混匀, 4 ℃、12 000 r·min-1离心5 min, 取上清2 μL进样。各待测成分的血浆标准溶液浓度范围分别为: p-CA 0.02~10.00 μg·mL-1, RA 0.047~24.00 μg·mL-1, SaD 0.15~9.50 μg·mL-1, SaB 0.10~53.75 μg·mL-1。
QC对照品溶液的配制 精密称取适量p-CA、SaD、RA、SaB对照品并用50% ACN溶解, 得到混合对照品溶液, 再稀释成定量下限(LLOQ)、低(L)、中(M)、高(H)的质控对照品溶液。
QC样品溶液的配制 取适量p-CA、SaD、RA、SaB混合对照品溶液, 稀释成5倍定量下限(LLOQ)、低(L)、中(M)、高(H) 4个QC浓度的质控对照品溶液。取空白血浆50 μL, 加入稀释好的各浓度质控对照品溶液10 μL和LMS (IS)溶液10 μL, 涡旋30 s混匀, 再加入ACN 150 μL, 涡旋3 min混匀后4 ℃、12 000 r·min-1离心5 min, 取上清170 μL, 40 ℃氮气吹干后, 用50% ACN溶液50 μL复溶, 涡旋1 min混匀, 于4 ℃、12 000 r·min-1离心5 min, 取上清2 μL进样。
空白基质处理后再加对照品的配制 取空白血浆50 μL, 加入LMS (IS)溶液10 μL, 涡旋30 s混匀, 再加入ACN 150 μL, 涡旋3 min混匀后4 ℃、12 000 r·min-1离心5 min, 取上清170 μL, 40 ℃氮气吹干后, 加入50% ACN溶液40 μL复溶, 再加入稀释好的各浓度质控对照品溶液10 μL, 涡旋1 min混匀, 4 ℃、12 000 r·min-1离心5 min, 取上清2 μL进样。
全自动血凝仪测定凝血四项 取加入枸橼酸钠抗凝的全血样本, 按照全自动血凝仪使用说明进样, 测定INR、PT、TT、APTT和FIB。
ELISA试剂盒测定血小板指标 次日取血清样本解冻至室温, 按照TXB2、GP Ⅱb/Ⅲa、CD62p、vWF的ELISA试剂盒说明书操作步骤进行操作, PerkinElmer EnSpire多功能酶标仪450 nm检测样本吸光度, 计算指标浓度。
统计学分析 血浆样品中药物的PK参数分析和生物等效性分析采用DAS 3.2.8软件(中国药理学会), 显著性分析采用SPSS 22 ANOVA分析或非参数检验, P < 0.05表示有显著性差异, P < 0.01表示有极显著性差异。绘图软件采用GraphPad Prism 6。
结果 1 方法学实验结果表明, 血浆内源性物质不干扰样品测定, 待测成分与LMS (IS)的保留时间互不干扰, 如图 1所示, 说明该分析方法的专属性较好。
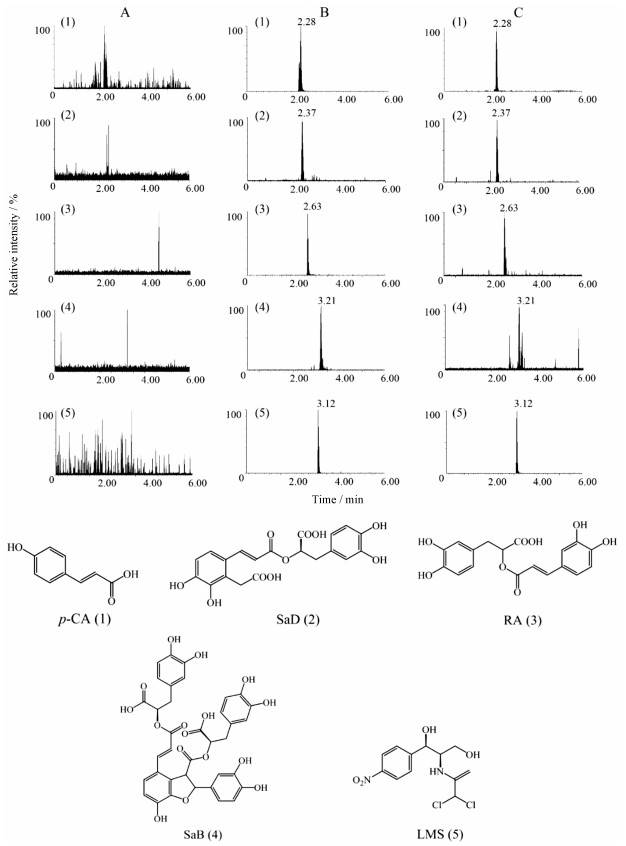
|
Figure 1 Total ion chromatogram (TIC) of p-CA, SaD, RA, SaB in DHI in negative mode. A: Blank plasma; B: Plasma standards and IS; C: Plasma samples |
进样血浆标准溶液, 以待测样品目标化合物峰面积与内标峰面积的比值对血浆中p-CA、SaD、RA、SaB的浓度进行线性回归, 得到血浆中各成分的线性回归方程如表 2所示, 线性关系良好。
| Table 2 The linear regression calibration and LLOQ of the components in DHI |
精密度与准确度按照质控样品项下分别制备LLOQ和LQC、MQC和HQC 4个质控样品, 平行5份, 每个样品连续进样5针, 分别测定日内和日间精密度及准确度, 结果显示: p-CA、SaD、RA和SaB的日内、日间精密度RSD均 < 14.86%, 准确度在84.84%~91.36% (n = 5), 表明该分析方法的精密度与准确度较好。
提取回收率结果显示: p-CA、SaD、RA和SaB的提取回收率在86.13%~93.71%, 表明该样品前处理方法提取回收率较好。基质效应按照方法项下分别制备LQC、MQC和HQC的混合对照品溶液和QC样品, 平行5份进样, 结果根据内标归一化法公式计算, 显示基质效应在87.34%~92.42%, 表明该样品前处理方法基质影响较小。稳定性实验结果表明含药血浆在室温8 h, 4 ℃下24 h、7 d和−30 ℃下30 d条件下, 反复冻融3次的稳定性较好。
2 DHI中各成分的药时曲线和PK参数第14 d大鼠尾静脉注射给予DHI溶液后, 血浆中各酚酸类成分的药时曲线见图 2, PK参数见表 3、表 4。
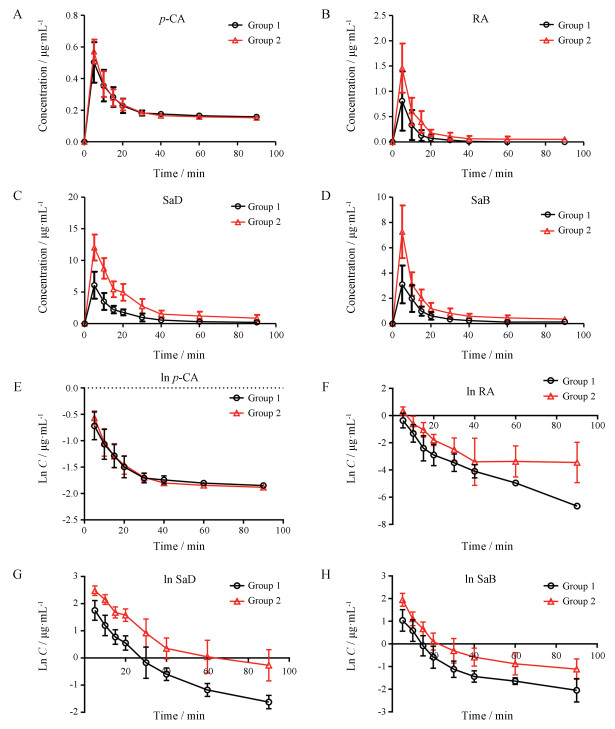
|
Figure 2 The concentration-time curve of the phenolic acids in DHI (n = 6, x ± s). A: The concentration-time curve of p-CA in Group 1 (DHI-14 d) and Group 2 (DHI+CFTX-14 d+7 d); B: The concentration-time curve of RA in Group 1 (DHI-14 d) and Group 2 (DHI+CFTX-14 d+7 d); C: The concentration-time curve of SaD in Group 1 (DHI-14 d) and Group 2 (DHI+CFTX-14 d+7 d); D: The concentration-time curve of SaB in Group 1 (DHI-14 d) and Group 2 (DHI+CFTX-14 d+7 d); E-H: The ln concentration-time curve of p-CA, RA, SaD and SaB in Group 1 (DHI-14 d) and Group 2 (DHI+CFTX-14 d+7 d) |
| Table 3 The pharmacokinetic parameters of the phenolic acids in DHI used alone or combined with ceftriaxone (CFTX) in rats. n = 6, x ± SD |
| Table 4 The bioequivalence analysis of phenolic acids in DHI. (n = 6, CI = 90 %) |
运用DAS 3.2.8生物等效性模块计算在90%置信区间, 联合用药组与单用药组各酚酸类成分的Cmax和AUC0-t是否在80%~125%内, 结果如表 4所示。p-CA的Cmax显示不等效, 但AUC0-t等效; 而RA、SaD、SaB的Cmax、AUC0-t在90%置信区间的生物等效性统计结果均显示不等效。而联合用药组和单用药组各成分的tmax没有显著性差异。RA、SaD和SaB均为DHI的主要药效成分。大鼠体内PK实验结果表明: DHI使用7 d后, 再与CFTX联用7 d, 将显著增加DHI的药效成分RA、SaD和SaB在大鼠体内的最高血药浓度和体内暴露量, 这将可能会影响DHI的药效。由于抗凝血、抗血栓和抗血小板是DHI的主要功效, 因此本文进一步考察了CFTX与DHI联合用药对SD大鼠体内抗凝血、抗血栓和抗血小板药效的影响。
4 CFTX对DHI体内抗凝血、抗血栓和抗血小板功能的影响SD大鼠体内抗凝血结果见图 3A~E显示:联合用药组与单用DHI组比较, 大鼠体内INR值升高21.27% (P < 0.01), PT、TT、APTT分别显著增加8.75% (P < 0.05)、31.23% (P < 0.01)和24.54% (P < 0.01), 而FIB没有显著性差异。表明在DHI-14 d的治疗过程中加入CFTX后, 可显著增加DHI在大鼠体内的抗凝血作用。
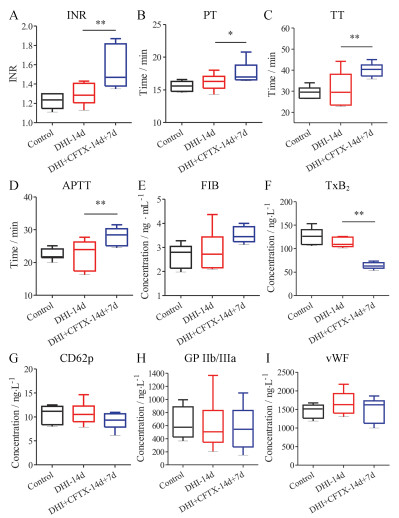
|
Figure 3 The influence of anticoagulation, antithrombosis and antiplatete effects of DHI by CFTX on SD rats (n = 8, x ± s). *P < 0.05, **P < 0.01 vs Group 1 (DHI-14d). INR: International normalized ratio; PT: Prothrombin time; TT: Thrombin time; APTT: Activated partial thromboplastin time; FIB: Fibrinogen; TXB2: Thromboxane B2; CD 62p: P-selectin; GP Ⅱb/Ⅲa: Platelet membrane glycoprotein Ⅱb/Ⅲa; vWF: von Willebrand factor |
体内抗血栓结果如图 3F显示:联合用药组与DHI-14 d组比较, 大鼠体内血清TXB2水平降低43.48% (P < 0.01), 表示在DHI-14 d的治疗过程中加入CFTX, 并联用7 d后, CFTX可显著增加DHI在大鼠体内的抗血栓功效。
血小板膜蛋白CD62p和GP Ⅱb/Ⅲa是血小板被激活时的表达在血小板膜表面的特异性蛋白, 在血小板静息状态下是不表达的, 因此两者可作为血小板活化的特异性标志物。而vWF是由内皮细胞和巨噬细胞合成, 储存在血管内皮细胞的W-P小体和血小板颗粒中, 可同时与胶原纤维和血小板结合的中介。可以结合活化的血小板的vWF受体上, 黏附在胶原纤维上, 形成血栓, 得以止血。SD大鼠体内抗血小板结果如图 3中G-I所示: DHI+CFTX-14d+7d组与DHI-14d组比较, 大鼠体内血清CD62p、GPⅡb/Ⅲa和vWF水平有下降趋势, 表示在DHI-14d的治疗过程中第8 d加入CFTX联用, 有增加DHI抗血小板药效的趋势。
讨论中药注射剂临床应用的安全性一直被密切关注, 其联合用药现象十分复杂, 并受到严格监管, 大部分品种限用于二级及以上医院住院部和ICU被明确诊断有相应适应症的患者[23]。DHI用于心脑血管疾病患者, 而这类患者多为老年人, 机体免疫功能较低, 并发疾病频繁, 住院期间并发感染的几率高, 常见与抗菌药物联用[14]。在DHI不良反应的医嘱中, 也常见DHI与抗菌药物联用。然而DHI与抗菌药物的药物相互作用研究相对浅显, 多见于考察体外两药配伍后形成不溶性微粒[15], 但是临床输液已禁止这种配伍形式, 因此与体外相互作用相比, 体内相互作用的研究更贴合临床实际情况。
Li等[24]已对DHI在不同物种体内的处置过程进行了系统的研究, 结果表明DHI给药后, 丹参素、SaD、紫草酸和p-CA在大鼠血中暴露水平较高, 连续7 d静脉输注, 这些成分在体内没有明显蓄积。本实验结果也与此接近。但由于在本实验设计中, CFTX对丹参素和紫草酸在大鼠体内血药浓度的影响并不显著; 且在后期实验中进一步考察CFTX对丹参素和紫草酸尿液排泄的影响, 发现CFTX对丹参素和紫草酸的排泄也没有显著影响, 因此丹参素和紫草酸的体内过程没有体现在本文的实验结果中。
本次PK实验结果表明:在SD大鼠体内, 与单用药组相比, 联合用药组DHI中RA、SaD和SaB的Cmax和体内暴露量显著增加, 生物等效性统计结果显示在90%置信区间不等效。这可能与CFTX和DHI中有效成分竞争性结合血清白蛋白及竞争性抑制肾脏摄入型转运体——有机阴离子转运蛋白OAT1和OAT3有关。
DHI中的RA、SaB和SaD主要经过尿液排泄, 其中SaD主要以原形排泄, 而RA和SaB是在经历Ⅱ相代谢后, 再经过尿液排泄。但是在静脉注射DHI后4 h内, 有相当的成分来不及被代谢, 就随着大鼠尿液被排泄了, 这点在后期检测尿液中药物成分时已经得到了证实。在尿液排泄的过程中, 只有与蛋白结合的药物才能通过肾脏摄入型转运体进入肾小管上皮细胞, CFTX、RA、SaD和SaB都是蛋白结合率较高的化合物, 根据文献报道, 除SaD目前没有研究外, CFTX、RA和SaB都能够抑制OAT1和OAT3。在体外HEK293-hOAT1和HEK293-hOAT3细胞中, CFTX的抑制常数分别为0.23和4.39 μmol·L-1[25], RA的抑制常数为0.35和0.55 μmol·L-1, 而SaB的抑制常数为22.2和19.8 μmol·L-1[26]。由于CFTX在体内血药浓度高于DHI中的任何一种成分, 且体内消除缓慢, 很可能会与DHI中的RA和SaB竞争性抑制OAT1和OAT3, 影响RA和SaB的尿液排泄, 进一步影响RA和SaB的血药浓度。但具体机制仍需进一步实验研究。
而药效实验结果表明: CFTX还可增强DHI抗凝血和抗血栓的作用。DHI对高脂血症模型大鼠有显著的抗凝血、抗血栓和抗血小板作用[27], 并有广泛的抗炎作用, 能够有效降低脂多糖刺激引起的系统性炎症反应模型大鼠血清中iNOS、COX-2、IL-1β、IL-6、MCP-1和TNF-α的水平[28], 其中RA、SaD和SaB都是DHI抗系统炎症反应的主要成分[29]。本实验结果表明: DHI联合使用CFTX能够显著降低SD大鼠血清TXB2水平, 表现出增强抗血栓作用, 这可能与CFTX协同DHI干预COX-2途径生成TXB2有关。CFTX与DHI联用也有降低IL-1β、IL-6和TNF-α水平的趋势, 但没有显著性差异, 因此这部分实验结果没有在本文中体现, 出现这些结果的原因可能与本实验所用的健康SD大鼠有关。具体机制仍需进一步实验研究。
综上所述, 在健康大鼠体内, CFTX既能在PK方面增加DHI中酚酸类成分RA、SaB和SaD的血药浓度和体内暴露量, 又能在PD方面协同DHI增强抗凝血和抗血栓的作用。但由于疾病模型和健康大鼠存在差异, 因此该结论是否适用于疾病模型大鼠, 仍需设计实验验证。虽然通过前期文献考察, CFTX和DHI在大鼠和人体内的过程比较接近, 但大鼠与人仍存在种属差异, 因此两者联用在人体内是否可能出现和大鼠体内相似的PK和PD结果, 也有必要开展相关临床研究, 以保证患者的联合用药安全。
| [1] | Peng B, Li JR, He R. The research status of herb-drug interactions[J]. World Sci Technol Mod Tradit Chin Med Mater Med (世界科学与技术-中药现代化), 2010, 12: 260–264. |
| [2] | Gurwitz JH, Field TS, Harrold LR, et al. Incidence and preventability of adverse drug events among older persons in the ambulatory setting[J]. JAMA, 2003, 289: 1107–1116. DOI:10.1001/jama.289.9.1107 |
| [3] | Ning DX, Yang XY, Liu NA, et al. Hospital infection in 326 patients with cardiovascular disease:analysis and tactics[J]. Chin J Nosocomiol (中华医院感染学杂志), 2006, 16: 152–153. |
| [4] | Kuang YT, Xu J, He HS. Incidence of nosocomial infections in department of cardiovascular medicine of tertiary hospitals in Hangzhou[J]. Chin J Nosocomiol (中华医院感染学杂志), 2013, 23: 310–312. |
| [5] | Wang YY, Kou JL, Gao Y, et al. Species and antibiotics resistance of pathogens isolated from hospitalized senile patients with cardiovascular disease[J]. Chin J Nosocomiol (中华医院感染学杂志), 2011, 21: 2112–2114. |
| [6] | Li Y, Zuo YL. Risk factors for pulmonary infections in patients with cardiovascular diseases[J]. Chin J Nosocomiol (中华医院感染学杂志), 2012, 22: 2050–2052. |
| [7] | Wang FY. Causes and countermeasures for pulmonary infections in hospitalized patients with cardiovascular diseases[J]. Chin J Nosocomiol (中华医院感染学杂志), 2013, 23: 1012. |
| [8] | Li GH, Jiang HY, Xie YM, et al. Analysis of traditional Chinese medicine syndrome, traditional Chinese medicine and western medicine in 84697 patients with coronary heart disease based on big data[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 3462–3468. |
| [9] | Chinese Academy of Integrated Traditional Chinese and Western Medicine brain and mind Tongzhi Specialized Committee, Chinese Medical Doctor Association Expert Committee on Integrated Traditional Chinese and Western Medicine. Consensus of Chinese experts on clinical application of Danhong Injection[J]. Chin J Integr Med (中国中西医结合杂志), 2018, 38: 389–397. |
| [10] | Li JP, Guo JM, Huan YQ, et al. The mixture of Salvia miltiorrhiza-Carthamus tinctorius (Danhong injection) alleviates low-dose aspirin induced gastric mucosal damage in rats[J]. Phytomedicine, 2016, 23: 662–671. DOI:10.1016/j.phymed.2016.03.006 |
| [11] | Wang YY, Xu QS. Effects of Danhong Injection on antiplatelet and gastric mucosal injury of aspirin in patients with coronary heart disease[J]. Shandong Med J (山东医药), 2018, 34: 44–47. |
| [12] | Li XL, Zhang F, Li WX, et al. Interaction between Danhong injection and aspirin based on human liver microsome CYP 1A2[J]. Chin J New Drug (中国新药杂志), 2018, 27: 1034–1039. |
| [13] | Tang JF, Zhang F, Li WX, et al. Interactions between Danhong injection and aspirin based on CYP 2C9 isoform enzyme[J]. Chin Tradit Pat Med (中成药), 2018, 40: 1700–1704. |
| [14] | Zhang Q, Ju WZ, Guo JM, et al. Rationality analysis of clinical application of Danhong injection in affiliated hospital of Nanjing University of Chinese medicine from 2013 to 2014[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 748–754. |
| [15] | Li JP, Guo JM, Duan JA, et al. Literature study of drug combination type and incompatibility of Traditional Chinese Medicine injections[J]. Chin J Pharmacov (中国药物警戒), 2014, 11: 432–438. |
| [16] | Popick AC, Crouthamel WG, Bekersky I. Plasma protein binding of ceftriaxone[J]. Xenobiotica, 1987, 17: 1139–1145. DOI:10.3109/00498258709167406 |
| [17] | Zhang Q, Dai GL, Ju WZ, et al. Determination of binding rates of human plasma protein with seven bioactive components in Danhong injection[J]. Chin Pharmacol Bull (中国药理学通报), 2017, 33: 712–719. |
| [18] | Shao X, Ai N, Xu DH, et al. Exploring the interaction between Salvia miltiorrhiza and human serum albumin:insights from herb-drug interaction reports, computational analysis and experimental studies[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2016, 161: 1–7. DOI:10.1016/j.saa.2016.02.015 |
| [19] | Jing CJ, Chen XH, Liu X, et al. Determination of the binding rate of rat plasma protein with salvianolic acid B[J]. Acta Pharm Sin (药学学报), 2010, 45: 343–346. |
| [20] | Thomas RC, Stephanie B. Elevated international normalized ratio values associated with concomitant use of warfarin and ceftriaxone[J]. Am J Health-Syst Pharm, 2011, 68: 1603–1605. DOI:10.2146/ajhp100681 |
| [21] | Yu J, Yang LH, Hu CQ, et al. Degradation test of ceftriaxone sodium and structure identification of its degradation products[J]. Central South Pharm (中南药学), 2014, 12: 106–109. |
| [22] | Li JP, Liu Y, Guo JM, et al. A comprehensive strategy to evaluate compatible stability of Chinese medicine injection and infusion solutions based on chemical analysis and bioactivity assay[J]. Front Pharmacol, 2017, 8: 1–12. DOI:10.3389/fphar.2017.00833 |
| [23] | Ministry of Human Resources and Social Security of the People's Republic of China. Drug catalogue of National Basic Medical Insurance, Industrial Injury Insurance and Birth Insurance (2017)[EB/OL]. Beijing, 2017[2017-02-21]. http://www.mohrss.gov.cn/SYrlzyhshbzb/shehuibaozhang/zcwj/yiliao/201702/t20170223_266775.html. |
| [24] | Li MJ, Wang FQ, Huang YH, et al. Systemic exposure to and disposition of catechols derived from Salvia miltiorrhiza roots (Danshen) after intravenous dosing Danhong injection in human subjects, rats, and dogs[J]. Drug Metab Dispos, 2015, 43: 679–690. DOI:10.1124/dmd.114.061473 |
| [25] | Michio T, Ellappan B, Shinichi N, et al. Interaction of human organic anion transporters with various cephalosporin antibiotics[J]. Eur J Pharmacol, 2002, 438: 137–142. DOI:10.1016/S0014-2999(02)01306-7 |
| [26] | Wang L, Jurgen V, Douglas HS. Cumulative organic anion transporter-mediated drug-drug interaction potential of multiple components in Salvia miltiorrhiza (Danshen) preparations[J]. Pharm Res, 2014, 31: 3503–3514. DOI:10.1007/s11095-014-1437-9 |
| [27] | Fan HJ, Li M, Yu L, et al. Effects of Danhong injection on platelet aggregation in hyperlipidemia rats[J]. J Ethnopharmacol, 2018, 212: 67–73. DOI:10.1016/j.jep.2017.10.017 |
| [28] | Gao LN, Cui YL, Wang QS, et al. Amelioration of Danhong injection on the lipopolysaccharide-stimulated systemic acute inflammatory reaction via multi-target strategy[J]. J Ethnopharmacol, 2013, 149: 772–782. DOI:10.1016/j.jep.2013.07.039 |
| [29] | Jiang XQ, Lv B, Li P, et al. Bioactivity-integrated UPLC/Q-TOF-MS of Danhong injection to identify NF-κB inhibitors and anti-inflammatory targets based on endothelial cell culture and network pharmacology[J]. J Ethnopharmacol, 2015, 174: 270–276. DOI:10.1016/j.jep.2015.08.026 |
 2019, Vol. 54
2019, Vol. 54


