2. 天津药物研究院释药技术与药代动力学国家重点实验室, 天津 300193
2. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
诺氟沙星为第三代氟喹诺酮类抗菌药, 具广谱抗菌作用, 尤其对需氧革兰阴性杆菌的抗菌活性高, 诺氟沙星作为杀菌剂, 对肠杆菌科的大部分细菌都具有杀菌作用, 并且对青霉素耐药的淋病奈瑟菌、流感嗜血杆菌和卡他莫拉菌等多重耐药菌亦具抗菌活性, 临床主要用于治疗泌尿道感染、胃肠道感染及全身轻中度感染性疾病。其通过作用于细菌DNA螺旋酶的A亚单位, 抑制DNA的合成和复制而导致细菌死亡[1-3]。
目前, 有关人血浆样品中诺氟沙星的含量分析方法研究, 国内外已有报道, 采用的方法有微生物法、紫外法、高效液相色谱法。Zhang等[4]运用微生物琼脂扩散法测定人血和尿中诺氟沙星的含量, 操作繁琐、耗时费力。Qu等[5]用紫外法测定血浆中诺氟沙星的含量, 灵敏度为1.6 μg·mL-1。Chen等[6]采用高效液相色谱法研究健康受试者给予诺氟沙星注射液后血药浓度和尿药排泄量的经时变化过程, 定量下限为275 μg·mL-1, 灵敏度低, 所用血浆体积为500 μL。Luan等[7]采用高效液相色谱法考察诺氟沙星注射剂在体内的药代动力学行为, 灵敏度为0.12 μg·mL-1。Helmy[8]运用高效液相色谱法测定诺氟沙星在人血浆样品中的含量, 灵敏度为0.05 μg·mL-1。Al-Rashood等[9]采用高效液相色谱法进行诺氟沙星片在人体的生物等效性评价, 血浆用量为200 μL。
目前, 我国诺氟沙星口服制剂包括片剂、胶囊剂等。拥有生产批号的已有上百个, 重新建立符合现代分析方法验证要求的快速、灵敏、可靠的人血浆样品分析方法至关重要, 本实验首次运用LC-MS/MS测定人血浆中的诺氟沙星的含量, 定量下限为10 ng·mL-1, 灵敏度高。生物样品前处理采用了蛋白沉淀, 操作简单方便, 重现性好。所用血浆样品的体积小(50 μL), 大大节省了血浆用量。样品分析时间短, 可以实现短时间内大量样品的处理分析, 节省了样品分析时间, 可以更好的应用于诺氟沙星在人体的药代动力学研究, 也可为当前生物等效性研究提供可靠的方法学参考。
材料与方法药品与试剂 诺氟沙星对照品(纯度99.5%, 批号130450-2.1206)、环丙沙星对照品(纯度84.2%, 批号1304512011203)均购于中国食品药品检定研究院; 甲醇(色谱级)购于美国Fisher公司; 无水甲酸(优级纯, 批号20150515)购于天津市光复精细化工研究所; 去离子水由实验室自制。诺氟沙星片(规格: 100 mg/片)由日本杏林制药株式会社生产。
仪器 日本Shimadzu公司生产的Prominence 20A液相色谱仪, 配备LC-20AD型输液泵, DGU-20A3型脱气机, CTO-20A型柱温箱, SIL-20A型自动进样器; Sciex TRIPLE QUADTM 4000 Q-TRAP型三重四极杆串联质谱仪(美国Applied Biosystems公司), 配有ESI离子源及Analyst1.5.2数据处理软件; XS105型分析天平(瑞士METTER TOLEDO公司); TARGINTMVX-Ⅱ型多管涡旋振荡器(北京踏锦科技有限公司); 17R台式高速冷冻离心机(美国Thermo Scientific); BM-40型纯水制备系统(北京中盛茂源科技发展有限公司)。
色谱条件 色谱柱为Symmetry® C18柱(100 mm×4.6 mm, 5 μm); 柱温为40 ℃。流动相中有机相A: 0.3%甲酸-甲醇溶液, 水相B: 0.3%甲酸-5%甲醇水溶液。梯度洗脱: 0~1 min: 85% B; 1~3.5 min: 85%~5% B; 3.5~8 min: 5% B; 6.1~8 min: 85% B; 流速为0.45 mL·min-1, 仪器运行时间为8 min, 进样5 μL。
质谱条件 采用ESI电喷雾离子化源, 多反应(MRM)正离子检测模式进行定量检测, 诺氟沙星和内标环丙沙星的检测离子对分别为m/z 320.3→302.1、m/z 332.3→314.1;卷帘气: 18 psi; 碰撞气: 8 psi; 喷雾电压: 4 500 V; 源温度: 500 ℃。
对照品溶液的配制 精密称取适量诺氟沙星对照品于100 mL量瓶中, 加入稀释溶剂(0.1%甲酸-甲醇溶液)溶解并定容, 得诺氟沙星质量浓度为100 μg·mL-1的标准储备液。用稀释溶剂(0.1%甲酸-甲醇溶液)逐级稀释得到系列标准工作液, 质量浓度分别为0.2、0.4、1、2、4、10、20 μg·mL-1, 质控工作液的质量浓度分别为0.5、3.2和16 μg·mL-1。精密称取适量环丙沙星对照品于10 mL量瓶中, 加入甲醇溶解并定容, 得环丙沙星质量浓度为1 mg·mL-1的内标储备液, 用甲醇稀释得400 ng·mL-1的内标工作液。
校正标样的配制 精密吸取空白人血浆475 μL, 加入系列标准工作液或质控工作液25 μL, 得到质量浓度范围为10~1 000 ng·mL-1的标准曲线样品, 以及质量浓度为25、160、800 ng·mL-1的质控样品。
生物样品处理方法 向50 μL含药人血浆中加入甲醇100 μL和内标环丙沙星(400 ng·mL-1)工作液100 μL, 涡旋1 min, 4 ℃ 12 000 r·min-1离心10 min。取上清液100 μL于内插管中, 4 ℃ 12 000 r·min-1离心5 min, 进样5 μL进行LC-MS/MS定量分析。
方法学验证
选择性 取6个不同来源的人空白血浆, 除不加内标溶液(改加同等体积的甲醇)外[10], 其余按“生物样品处理方法”项下操作, 进行LC-MS/MS分析。通过比较人空白血浆样品、LLOQ样品和人口服诺氟沙星片后的血浆样品, 考察该方法的特异性。
进样残留情况 为考察进样残留情况, 按曲线最高浓度、空白人血浆样品的顺序进样分析, 考察残留情况。
线性范围与定量下限 配制并处理标准曲线样品进行LC-MS/MS分析, 以待测物浓度(X, ng·mL-1)为横坐标, 待测物与内标物峰面积比值(Y)为纵坐标, 采用加权最小二乘法(权重为1/x2)进行回归运算, 标准曲线的回归方程为Y = aX+b。
以血浆标准曲线的最低浓度点作为定量下限(LLOQ), 按“生物样品处理方法”项下操作, 考察3个分析批, 每批6样本, 应用当批校正曲线计算批内和批间的精密度以及准确度。
准确度与精密度 配制并处理浓度为25、160、800 ng·mL-1的质控样品。按“生物样品处理方法”项下操作, 进行LC-MS/MS分析。连续考察3个分析批, 每批、每个浓度6样本。应用当批校正曲线计算各QC样品的测得浓度, 考察分析方法的准确度和精密度。
基质效应和回收率 配制浓度为25、160、800 ng·mL-1质控血浆样品, 按“生物样品处理方法”项下操作, 每一浓度平行测定6样本, 得峰面积(A); 将人空白血浆样品按“生物样品处理方法”项下操作, 取上清液氮气吹干后, 用相应浓度溶液样品复溶, 进样得峰面积(B), 每一浓度平行测定6样本; 将浓度为25、160、800 ng·mL-1溶液样品进样得峰面积(C), 每一浓度平行测定6样本。计算公式为:诺氟沙星回收率 = A/B×100%, 基质效应 = B/C×100%;同法计算内标回收率和基质效应。
稳定性 配制浓度为25、800 ng·mL-1的血浆样品, 分别考察室温放置5 h、-20 ℃冻存42天、-20 ℃室温3次冻融循环、处理后自动进样器6 ℃放置47 h的稳定性, 按“生物样品处理方法”项下操作, 各浓度水平均为6样本[11,12]。配制质量浓度为25、800 ng·mL-1的含药全血, 分别于0 h、室温放置2 h后离心, 取血浆按“生物样品处理方法”项下操作, 考察诺氟沙星在全血中的稳定性, 各浓度水平均为6样本。
临床药代动力学研究 本研究经柳州市工人医院医学伦理委员会的批准, 可应用于人体内诺氟沙星的药代动力学研究。经过严格筛选, 选取8名中国健康成年受试者进行单次口服诺氟沙星片的药动学实验, 受试者于给药日早上开始进餐30 min后口服诺氟沙星片100 mg (规格: 100 mg/片)。分别于给药前0 h和给药后0.25、0.5、0.75、1、1.25、1.5、1.75、2、3、4、6、8、10、12、24 h采集血样至肝素钠抗凝管中, 在4 ℃, 3 000 r·min-1条件下离心10 min, 分离血浆, 保存于-20 ℃, 运送到本实验室进行样品检测。
结果 1 质谱分析在上述质谱条件下, 诺氟沙星和内标环丙沙星主要产生m/z 320.3、m/z 332.3的[M+H]+峰。选择性对[M+H]+峰进行产物离子扫描, 诺氟沙星和环丙沙星的主要离子碎片为m/z 302.1和m/z 314.1。将这些主要碎片作为定量分析时检测的产物离子。待测物和内标的产物离子扫描质谱图见图 1。
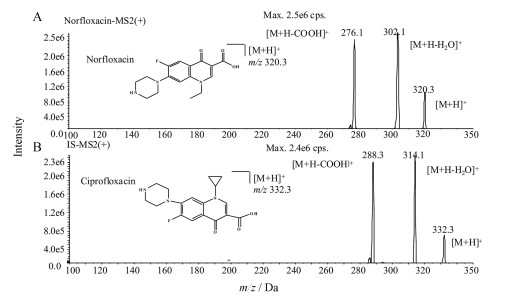
|
Figure 1 The chemical structures and product ion mass spectrum of the [M+H]+ ions of norfloxacin (A), ciprofloxacin (B) (internal standard) |
空白血浆样品的色谱图见图 2A; LLOQ样品的代表性色谱图见图 2B; 人给药3.5 h后样品的代表性色谱图见图 2C。诺氟沙星和内标环丙沙星的色谱保留时间分别为4.61 min和4.66 min。结果表明干扰组分的响应低于当批次LLOQ待测物响应的20%及内标响应的5%, 表明人血浆中的内源性物质不干扰待测物和内标的定量分析。
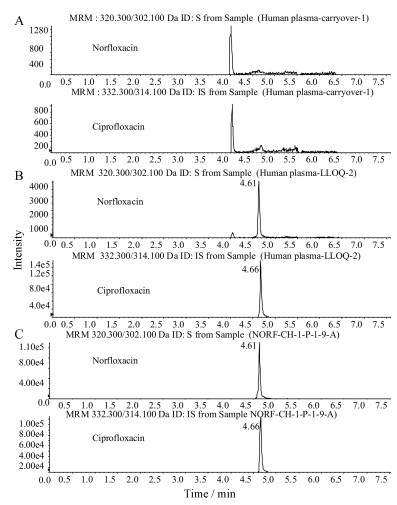
|
Figure 2 Representative MRM chromatograms of norfloxacin and ciprofloxacin in human plasma. A: Blank human plasma sample; B: Blank human plasma spiked with norfloxacin (LLOQ, 10 ng·mL-1) and IS (400 ng·mL-1); C: A human plasma sample collected at 3.5 h after the oral administration of norfloxacin (100 mg) in human |
为考察进样残留情况, 曲线最高浓度进样之后, 分析空白人血浆样品。结果显示, 空白人血浆中干扰组分的响应低于当批次LLOQ待测物响应的1/5, 内标响应的1/20, 不影响人血浆中诺氟沙星浓度的定量分析。
2.3 线性范围和定量下限线性范围为10~1 000 ng·mL-1的典型回归方程为Y = 0.001 57X + 0.000 859, r2 = 0.999 5。结果表明诺氟沙星在10~1 000 ng·mL-1的范围内线性关系良好。
LLOQ样品的代表性色谱图见图 2B。在LLOQ浓度下, 诺氟沙星色谱峰的信噪比(S/N) > 10, 准确度平均为97.9%, 批内精密度为3.99%~5.48%, 批间精密度为6.32%, 表明本方法测定人血浆中诺氟沙星浓度的定量下限(LLOQ)可以达到10 ng·mL-1。
2.4 准确度与精密度诺氟沙星各浓度水平QC样品的准确度平均在96.6%~97.8%之间, 批内精密度在2.11%~4.23%之间, 批间精密度(RSD)在2.64%~7.23%之间, 均符合有关生物样品分析方法验证的要求。
2.5 基质效应和回收率诺氟沙星在25、160、800 ng·mL-1 3个浓度水平上的内标归一化的基质效应分别为97.0%、100%、105%, 基质效应的CV%小于4.52%, 说明基质效应不会对样品的分析产生影响。诺氟沙星在25、160、800 ng·mL-1 3个质控浓度水平上的回收率在74.3%~77.1%之间, 总体回收率的CV%为1.88%;内标的平均回收率为77.6%, 结果说明回收率较高, 不会对样品的分析产生影响。
2.6 稳定性诺氟沙星的含药血浆在室温放置5 h、-20 ℃冻存42天、-20 ℃室温3次冻融循环、处理后自动进样器6 ℃放置47 h等各项条件下稳定性良好, 准确度在88.8%~101%之间。诺氟沙星的含药全血室温放置2 h稳定, 准确度在96.3%~100%之间。
2.7 人体药代动力学研究采用WinNonlin 7.0软件, 非房室模型计算药代动力学参数, 8名健康成年受试者单次口服100 mg诺氟沙星片后, 诺氟沙星的平均血药浓度-时间曲线见图 3。相应的药动学参数见表 1。
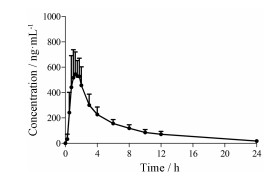
|
Figure 3 Mean plasma concentration of norfloxacin over time after oral administration of norfloxacin tablet 100 mg in 8 healthy adult volunteers |
| Table 1 The pharmacokinetic parameters of norfloxacin after oral administration of norfloxacin (100 mg/tablet) in human. n = 8 |
诺氟沙星结构中同时含有羧基和氨基, 属于酸碱两性化合物[13]。色谱与质谱行为容易受pH值影响, 因此, 在建立LC-MS/MS分析方法时, 对色谱、质谱条件以及样品处理方法进行了优化。
在一定的流动相条件下, 诺氟沙星在Symmetry® C18色谱柱上有较好的保留, 应用反相色谱柱时, LC-MS/MS分析方法应用的有机相主要为甲醇和乙腈, 实验发现诺氟沙星在甲醇中的信号要比在乙腈中高, 选用甲醇作为有机相。流动相的酸度对诺氟沙星的分离和保留有显著影响, 本研究通过实验发现流动相中加入0.3%甲酸可得到对称尖锐的峰形, 待分析组分的色谱行为较好。同时甲酸有利于诺氟沙星的离子化, 可以得到较高的检测灵敏度。并对流速(0.50、0.45 mL·min-1)以及洗脱方式(等度、梯度)进行了优化, 发现0.45 mL·min-1的流速下进行梯度洗脱, 可以有效改善峰前延, 峰形更好。
对质谱条件进行优化, 尽可能的使待测物信号强度达到最高。在优化过程中比较诺氟沙星正、负两种离子化方式的响应值, 发现诺氟沙星在ESI源正离子条件下信号强度优于负离子, 生成准分子离子[M+H]+m/z 320.3。二级扫描模式下发现m/z 276.1和m/z 302.1两个子离子的响应较高。因此在其他参数不变的情况下对320.3→276.1和320.3→302.1两个离子对进行比较, 发现320.3→302.1的响应较高, 被选中进行质谱参数优化。
诺氟沙星结构中同时含有羧基和氨基, 显酸、碱两性, 易溶于酸、碱溶液中, 在中性溶液中溶解度较小[14]。实验选择0.1%甲酸甲醇溶液配制诺氟沙星溶液。本研究在提取方法的选择过程中, 尝试了蛋白沉淀与液液萃取, 分别使用乙腈和甲醇作为蛋白沉淀剂, 液液萃取分别尝试了甲基叔丁基醚和乙酸乙酯, 发现与甲醇沉淀比较, 液液萃取回收率较低, 乙腈沉淀基质效应影响较大, 本研究用甲醇对血浆样品进行蛋白沉淀, 操作简单方便, 并且基质效应影响低、回收率高。
在生物样品的分析过程中, 选取与诺氟沙星理化性质相近、结构相似、保留时间较为接近的环丙沙星作为内标, 内标的选择对于保证测定结果的准确性尤为重要。
查阅相关文献[9,15-18]发现, 健康志愿者口服诺氟沙星400 mg后, 达峰浓度在1 000~2 000 ng·mL-1内, 本实验给予100 mg的诺氟沙星片, 故设定的线性范围为10~1 000 ng·mL-1, 满足了实际测样的高浓度需求, 避免了对样品再进行稀释处理; 所有受试人体的AUC0-t/ AUC0-∞的比例均大于80%, 也满足实际测样的低浓度需求, 保证能够实施完整的人体生物样本浓度研究。
根据相关文献报道[4,19], 健康人单剂量口服400 mg的依诺沙星、氧氟沙星和诺氟沙星后, 与体内暴露量相关的Cmax和AUC以氧氟沙星最高, 其次是依诺沙星和诺氟沙星。此外, 氧氟沙星的t1/2最长, 消除速率最慢, 诺氟沙星t1/2相对较短, 依诺沙星的消除半衰期小于氧氟沙星, 大于诺氟沙星, 消除速率介于两者之间。同时发现3种药物的表观分布容积较大, 表明可能在多数组织的组织/血浆比较高, 有待于进一步比较研究。
中国药典2015年版《生物样品定量分析方法验证指导原则》[20]和欧洲EMEA 2011版指导原则中对分析方法验证的要求基本一致, 故本文建立的分析方法严格遵守2015年版药典中规定的《生物样品定量分析方法验证指导原则》, 并对该方法的选择性、残留、线性、准确度、精密度、灵敏度、稳定性、基质效应等项目进行了系统的方法学验证, 可满足药物临床药代动力学研究的技术要求。此外, 本分析方法可靠, 能够准确测定人血浆中诺氟沙星的浓度, 评价诺氟沙星在健康人体内的药代动力学行为, 可用于支持该药物仿制药的生物等效性评价。
| [1] | Abou-Taeb NH, EI-Wasseef DR, EI-Sherbiny DT, et al. Multiobjective optimization strategy based on desirability functions used for the microemulsion liquid chromatographic separation and quantification of norfloxacin and tinidazole in plasma and formulations[J]. J Sep Sci, 2015, 38: 901–908. DOI:10.1002/jssc.201401203 |
| [2] | Sousa J, Alves G, Fortuna A, et al. Development and validation of a fast isocratic liquid chromatography method for the simultaneous determination of norfloxacin, lomefloxacin and ciprofloxacin in human plasma[J]. Biomed Chromatoqr, 2011, 25: 535–541. DOI:10.1002/bmc.1480 |
| [3] | Maia MB, Martins IL, Cunha AN, et al. Validation of a reversed-phase high-performance liquid chromatography method with fluorescence detection for the bioequivalence study of norfloxacin in plasma samples[J]. Ther Drug Monit, 2008, 30: 341–346. DOI:10.1097/FTD.0b013e3181671609 |
| [4] | Zhang J, Zhang YY, Yu JC, et al. Pharmacokinetics study on three fluoroquinolones[J]. Chin J Antibiot (中国抗生素杂志), 1993, 18: 334–337. |
| [5] | Qu JW, Lang YM, Li YQ, et al. Pharmacokinetic study of norfloxacin injection[J]. Chin J Mod Appl Pharm (现代应用药学), 1994, 11: 1007–7693. |
| [6] | Chen XJ, Liu XQ, Huang SK, et al. Pharmacokinetics of norfloxacin by constant rate infusion[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 1992, 8: 82–86. |
| [7] | Luan LB, Zhu JB. Comparison of the pharmacokinetics of norfloxacin injection and norfloxacin capsule in normal human volunteers[J]. Acta Pharm Sin (药学学报), 2000, 35: 147–150. |
| [8] | Helmy SA. Simultaneous quantification of linezolid, tinidazole, norfloxacin, moxifloxacin, levofloxacin, and gatifloxacin in human plasma for therapeutic drug monitoring and pharmacokinetic studies in human volunteers[J]. Ther Drug Monit, 2013, 35: 770–777. DOI:10.1097/FTD.0b013e318297b6b0 |
| [9] | Al-Rashood KA, Al-Khamis KI, EI-Sayed YM, et al. Bioequivalence evaluation of norfloxacin 400 mg tablets (Uroxin and Noroxin) in healthy human volunteers[J]. Biopharm Drug Dispos, 2000, 21: 175–179. DOI:10.1002/(ISSN)1099-081X |
| [10] | Zhang RY, Gu Y, Zhang AJ, et al. Determination of obeticholic acid in rat plasma by liquid chromatography-tandem mass spectrometry (LC-MS/MS)[J]. Acta Pharm Sin (药学学报), 2018, 53: 271–277. |
| [11] | Shen JL, Zan B, Chen XY, et al. Simultaneous determination of fosaprepitant and its metabolite aprepitant in human plasma by liquid chromatography-tandem mass spectrometry[J]. Acta Pharm Sin (药学学报), 2018, 53: 121–126. |
| [12] | Li T, Wan YW, Wan YL, et al. LC-MS quantification and pharmacokinetics of the multi-constituents of Huang qin Tang in rat plasma after different single oral doses[J]. Acta Pharm Sin (药学学报), 2013, 48: 917–924. |
| [13] | Tian Y, Zhang ZJ, Li J, et al. Multiresidue determination of fluoroquinolones in eggs by solid phase extraction-LC-MS/MS[J]. J China Pharm Univ (中国药科大学学报), 2010, 41: 60–65. |
| [14] | Jiao HY, Xu FG, Tian Y, et al. Determination of fluoroquinolones multiresidue in milk by solid phase extraction-LC-MS/MS[J]. J China Pharm Univ (中国药科大学学报), 2009, 40: 62–66. |
| [15] | Khiljee S, Ahmad M, Murtaza G, et al. Bioequivalence evaluation of norfloxacin tablets based on in vitro-in vivo correlation[J]. Park J Pharm Sci, 2011, 24: 421–426. |
| [16] | Lontos S, Shelton E, Anqus PW, et al. A randomized controlled study of trimethoprim-sulfamethoxazole versus norfloxacin for the prevention of infection in cirrhotic patients[J]. J Diq Dis, 2014, 15: 260–267. DOI:10.1111/cdd.2014.15.issue-5 |
| [17] | Stein GE. Review of the bioavailability and pharmacokinetics of oral norfloxacin[J]. Am J Med, 1987, 82: 18–21. |
| [18] | Maia MB, Martins IL, do-Nascimento DF, et al. Validation of a reversed-phase high-performance liquid chromatography method with fluorescence detection for the bioequivalence study of norfloxacin in plasma samples[J]. Ther Drug Monit, 2008, 30: 341–346. DOI:10.1097/FTD.0b013e3181671609 |
| [19] | Tan L, Li Ke. Determination of four fluoroquinolones in human plasma by high performance liquid chromatography[J]. J China Pharm Univ (中国药科大学学报), 1994, 25: 328–331. |
| [20] | Chinese Pharmacopoeia Commission. Guiding Principles for Quantitative Analysis of Biological Samples[S]// Chinese Pharmacopoeia (中国药典), 2015ed. Beijing: China Medical Science Press, 2015. |
 2019, Vol. 54
2019, Vol. 54


