2. 解放军总医院第五医学中心全军中医药研究所, 北京 100039;
3. 北京中医药大学中药学院, 北京 100029;
4. 成都中医药大学药学院, 四川 成都 611137
2. China Military Institute of Chinese Medicine, the Fifth Medical Centre, Chinese PLA People's Liberation Army General Hospital, Beijing 100039, China;
3. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100029, China;
4. College Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
随着中草药及其相关产品在国内外使用日趋广泛, 加之我国药品不良反应监测体系的不断完善及大众药品安全性意识的不断提升, 中药不良反应(事件)尤其是传统无毒中药的不良反应(事件)成增多趋势, 引起各界的关注。白鲜皮(Cortex Dictamni)为芸香科植物白鲜Dictamnus dasycarpus Turcz.的干燥根皮, 是临床常用的清热燥湿、祛风解毒的中药, 而含有白鲜皮的中成药也广泛用于治疗湿热疮毒、黄水淋漓、湿疹风疹、疥癣疮癞和风湿热痹等[1-4]。通过调研发现目前有30多种含有白鲜皮的中成药制剂, 其中文献[5-7]报道复方青黛丸、克银丸和痔血胶囊等可导致肝损伤。国家药品不良反应监测中心在2008年提醒大众需警惕痔血胶囊所引起的肝损伤, 而痔血胶囊由白鲜皮和苦参组成, 其中根据文献[8,9]报道苦参在临床上可用于治疗慢性肝炎, 推测白鲜皮可能是痔血胶囊中导致肝损伤的主要原因。另外, 2014~2016年有两家医院报告了20多例白鲜皮导致肝损伤的病例[10]。而本课题组前期研究发现白鲜皮致肝损伤的总体发病率较低, 可能存在易感人群, 综合考虑白鲜皮肝损伤可能为特异质肝损伤[11]。本课题组前期利用脂多糖(lipopolysaccharide, LPS)介导的药物特异质肝损伤评价模型等研究证实了何首乌和壮骨关节丸诱导的肝损伤为免疫特异质肝损伤[12]。基于此, 本文采用LPS介导的特异质肝损伤评价模型, 研究白鲜皮对大鼠肝脏损伤的作用, 以期为白鲜皮的临床安全合理用药提供科学依据。
材料与方法动物 雄性SD大鼠, SPF级, 180~200 g, 由北京维通利华实验动物技术有限公司提供(合格证号: SCXK- (京) 2016-0006;伦理审批号: IACUC-2018-008)。饲养于中国人民解放军总医院第五医学中心实验动物中心, 分笼饲养, 自由饮水、进食, 室温(25±2) ℃, 通风良好, 环境安静, 室内保持12 h照明, 12 h黑暗, 并定期用紫外灯光消毒。
药物与试剂 白鲜皮(批号: 17072201)购于北京绿野药业有限公司, 经中国人民解放军总医院第五医学中心肖小河研究员鉴定为芸香科植物白鲜(Dictamnus dasycarpus Turcz.)的干燥根皮。LPS (批号: 057M4013V, Sigma公司); 水合氯醛(批号: 20170719, 国药集团化学试剂有限公司); 福尔马林固定液(批号: 20180309, 北京益利精细化学品有限公司); 血清谷丙转氨酶(alanine transaminase, ALT)、天冬氨酸氨基转氨酶(aspartate aminotransferase, AST)、直接胆红素(direct bilirubin, DBIL)、总胆红素(total bilirubin, TBIL)和总胆汁酸(total bile acid, TBA)试剂盒(南京建成生物技术有限公司); ELISA试剂盒(北京达科为生物技术有限公司)。其他所用试剂均为分析纯。
仪器 FW-500高速万能粉碎机(北京科伟永兴仪器有限公司); ME204电子天平(梅特勒-托利多仪器有限公司); Neofuge1600R低温台式高速离心机(上海力申科学仪器有限公司); SynergyH2全功能微孔板检测仪(美国BioTek公司); 爱华KPJ-1A生物组织摊片烤片机(天津天利航空有限公司); Leica 2016石蜡切片机(上海莱卡仪器有限公司); Nikon E200光学显微镜。
药品的制备 白鲜皮水提物(Cortex Dictamni aqueous extract, AE)制备:取1 kg白鲜皮药材, 加10倍量蒸馏水加热回流, 煮沸2 h, 过滤, 重复两次, 滤液合并, 旋转蒸发仪80 ℃浓缩至200 mL, 即得含生药量5 g·mL-1的AE, 临用前加生理盐水配制成相应浓度(按生药量配制)。白鲜皮醇提物(Cortex Dictamni ethanol extracts, EE)制备:取1 kg白鲜皮药材, 加20倍量85%乙醇加热回流, 煮沸1 h, 过滤, 重复两次, 滤液合并, 旋转蒸发仪50 ℃浓缩至200 mL, 即得含生药量5 g·mL-1的EE, 临用前加生理盐水配制成相应浓度(按生药量配制)。
白鲜皮急性毒性实验 将SD大鼠50只随机分为5组(n = 10):正常对照组、AE高剂量组、EE高剂量组, 高剂量组分别设2个剂量组, 给药剂量为25和50 g·kg-1。大鼠称重, 连续3天给药组灌胃不同剂量的AE和EE, 对照组灌胃生理盐水, 第3次灌胃后6 h使用10%水合氯醛(给药体积为3 mL·kg-1)麻醉大鼠, 下腔静脉取血, 4 ℃、3 500 r·min-1离心15 min, 取上清; 取大鼠肝脏组织1.5 cm×1 cm×0.5 cm, 立即浸入10%中性福尔马林缓冲溶液固定, 剩余肝组织放入-80 ℃冰箱冻存。
基于LPS模型的白鲜皮肝损伤评价 将SD大鼠60只随机分为6组(n = 10):正常对照组、LPS组(给药剂量为2.8 mg·kg-1)、AE组、EE组、AE联合LPS给药组、EE联合LPS给药组, AE和EE给药剂量均为4.2 g·kg-1。其余同上述“白鲜皮急性毒性实验”部分。
肝功能指标检测 取大鼠血清, 按照试剂盒说明书(酶标仪法)检测并计算血清ALT、AST、TBIL、DBIL、TBA的活力。
肝脏病理学检测 取10%福尔马林溶液固定的大鼠肝组织1.5 cm×1 cm×0.5 cm, 常规病理切片, HE染色后显微镜下观察。
TUNEL染色 采用TUNEL标记法检测分析肝细胞凋亡情况, 具体操作参照试剂盒说明书进行, 以细胞核固缩呈不规则形、被染成棕褐色或分解成数块为阳性细胞。
细胞因子检测 取大鼠血清, 按照ELISA试剂盒说明书(酶标仪法)检测肝脏组织炎症细胞因子肿瘤坏死因子(tumor necrosis factor, TNF-α)、白细胞介素-1β (interleukin-1β, IL-1β)和白细胞介素-6 (interleukin-6, IL-6)。
靶点收集 通过中药台湾数据库(TDT, http://tcm.cmu.edu.tw/)获得白鲜皮所含的化学成分结构, 再依据相似性比较, 通过中草药活性成分数据库(HIT, http://lifecenter.sgst.cn/hit/)和治疗靶点数据库(TTD, http://bidd.nus.edu.sg/group/cjttd/)筛选靶点, 收集白鲜皮的作用靶点构建白鲜皮成分-成分靶点网络。上述所有靶点均通过UniProt数据库中的UniProtKB搜索功能(http://www.uniprot.org/)获取其官方的UniProt ID信息, 并用于后续网络构建。
网络构建与通路分析 为了更合理地阐明白鲜皮中化学成分与免疫之间的关系, 通过人类基因和基因表型综合数据库(OMIM, http://www.omim.org/)筛选免疫相关的基因和蛋白靶点, 对其进行网络药理学分析。通过PPI (http://www.genome.jp/kegg/)分析, 将白鲜皮的化学成分、成分对应的靶点、免疫对应的靶点和交互蛋白对应的靶点连接成“成分-靶点-疾病”网络。利用Cytoscape 2.8.3软件将以上网络进行可视化分析, 每个点的度、接近中心度两个拓扑参数通过CentiScaPe 1.2进行评估, 选择以上两个拓扑参数值满足分别大于所有点中位数值2倍的靶点, 作为白鲜皮免疫相关的目的靶点。
统计学分析 采用SPSS 17.0统计软件进行分析, 计量资料多组间比较采用单因素方差分析(one-way ANOVA), 两组间比较用t检验, 以P < 0.05表示具有显著性差异。
结果 1 肝功能变化从图 1可以看出, 与正常对照组比较, 分别单独灌胃AE或EE中、高剂量(给药剂量分别为25和50 g·kg-1)组ALT、AST、DBIL均无明显变化(P > 0.05)。单独给予大鼠EE 50 g·kg-1剂量组后TBIL与对照组相比显著升高(P < 0.01), 这提示高剂量EE可能使胆红素代谢障碍, 进而导致肝胆疾病[13,14]。AE (50 g·kg-1)、EE (25 g·kg-1)、EE (50 g·kg-1)均可使TBA显著升高(P < 0.05), 提示给予大鼠中、高剂量AE或EE后, 肝脏的排泄功能或肠-肝循环也可能受到不同程度的影响。
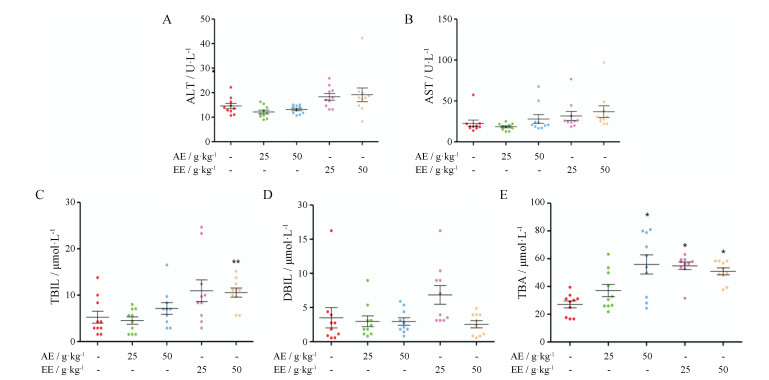
|
Figure 1 Influence of 25, 50 g·kg-1 of Cortex Dictamni aqueous extract (AE) or Cortex Dictamni ethanol extracts (EE) on plasma alanine transaminase (ALT) (A), aspartate aminotransferase (AST) (B), total bilirubin (TBIL) (C), direct bilirubin (DBIL) (D), total bile acid (TBA) (E) activities. "25", "50" represent intragastric administration of 25, 50 g·kg-1 of AE or EE. n = 10, x± s. *P < 0.05, **P < 0.01 vs control group |
由图 2可以看出, 与正常对照组比较, 单独灌胃AE或EE (给药剂量均为4.2 g·kg-1)组、单独尾静脉LPS组ALT、AST、TBIL、DBIL和TBA活力均无明显变化(P > 0.05);而与LPS组比较, AE、EE与LPS联合给药组, 各项指标均有不同程度升高, 其中AE与LPS联合给药组ALT (P < 0.001)、AST (P < 0.001)、TBA (P < 0.05)、DBIL (P < 0.05)以及EE与LPS联合给药组ALT (P < 0.01)、AST (P < 0.05)、DBIL (P < 0.01)均显著升高, 另AE与LPS联合给药组ALT、AST显著高于EE与LPS联合给药组(P < 0.05)。
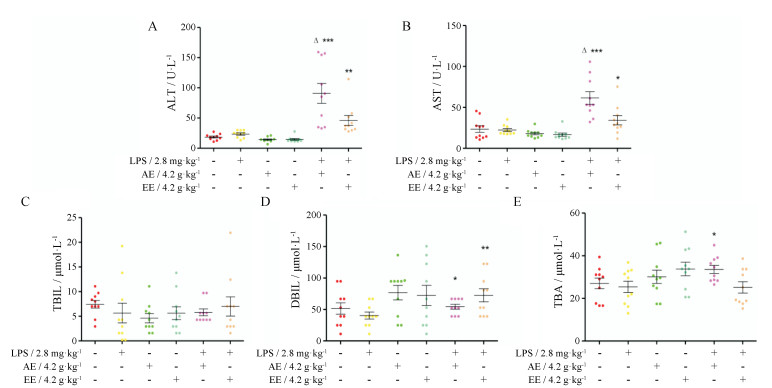
|
Figure 2 Influence of co-treatment with lipopolysaccharide (LPS, 2.8 mg·kg-1) and 4.2 g·kg-1 of AE or EE on plasma ALT (A), AST (B), TBIL (C), DBIL (D), TBA (E) activities. n = 10, x± s. *P < 0.05, **P < 0.01 vs LPS group; △P < 0.05 vs EE + LPS group |
上述结果说明, 单独给予AE、EE最高剂量达50 g·kg-1时并不能导致肝脏损伤; 而4.2 g·kg-1AE、EE与LPS联合给药时, 即可造成肝损伤, 证明AE或EE所致肝损伤与机体免疫状态有关, 免疫应激状态会增加其致肝损伤的易感性, 且AE损伤程度较EE更严重。
2 肝组织病理学改变在光镜下(图 3), 正常对照组肝小叶结构清晰, 肝细胞大小及形态正常, 肝细胞索自中央静脉呈放射状排列, 无炎症细胞浸润, 无明显的组织学病变; AE或EE (剂量分别为4.2、25和50 g·kg-1)可见肝细胞索自中央静脉呈放射状排列, 伸向肝小叶周边部, 肝窦内见红细胞, 偶见炎细胞浸润; LPS组可见汇管区炎症细胞增多, 无显著病理学改变; AE或EE (剂量均为4.2 g·kg-1)与LPS联合给药时可见肝小叶排列紊乱, 肝细胞呈单个或不规则岛屿状或团块状坏死。上述结果表明, AE、EE与LPS联合给药可诱导肝脏损伤。
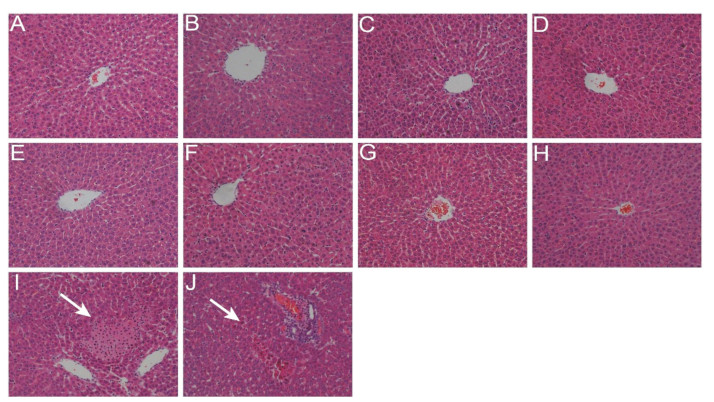
|
Figure 3 Effect of AE or EE on histologic change of hepatic tissue of rats. A: Control group; B: LPS group; C: AE (4.2 g·kg-1) group; D: AE (25 g·kg-1) group; E: AE (50 g·kg-1) group; F: EE (4.2 g·kg-1) group; G: EE (25 g·kg-1) group; H: EE (50 g·kg-1) group; I: AE (4.2 g·kg-1) + LPS group; J: EE (4.2 g·kg-1) + LPS group. HE staining (×200) |
TUNEL结果显示(图 4):正常对照组、AE或EE (剂量为4.2 g·kg-1)组均无明显肝细胞凋亡; LPS组偶见凋亡细胞; 而AE或EE (剂量均为4.2 g·kg-1)与LPS联合给药组肝细胞凋亡显著。该结果提示, AE或EE联合LPS可导致肝细胞凋亡。
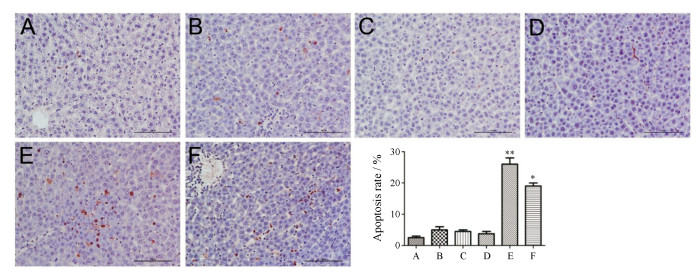
|
Figure 4 Effect of AE and EE on hepatocytes apoptosis in liver tissue detected with TUNEL staining (×200). A: Control group; B: LPS group; C: AE (4.2 g·kg-1) group; D: EE (4.2 g·kg-1) group; E: AE (4.2 g·kg-1) + LPS group; F: EE (4.2 g·kg-1) + LPS group; n = 10, x± s. *P < 0.05, **P < 0.01 vs LPS group |
ELISA法测定大鼠血浆中TNF-α、IL-1β和IL-6水平结果见图 5, 与正常对照组相比, AE或EE (剂量分别为4.2、25和50 g·kg-1)组均无明显差异; LPS组均高于正常对照组(P < 0.001);与LPS组相比, AE联合LPS组(4.2 g·kg-1)组显著升高(P < 0.05), EE联合LPS组(4.2 g·kg-1)组则无明显差异。结果提示, AE (4.2 g·kg-1)联合LPS可引起免疫炎症反应。
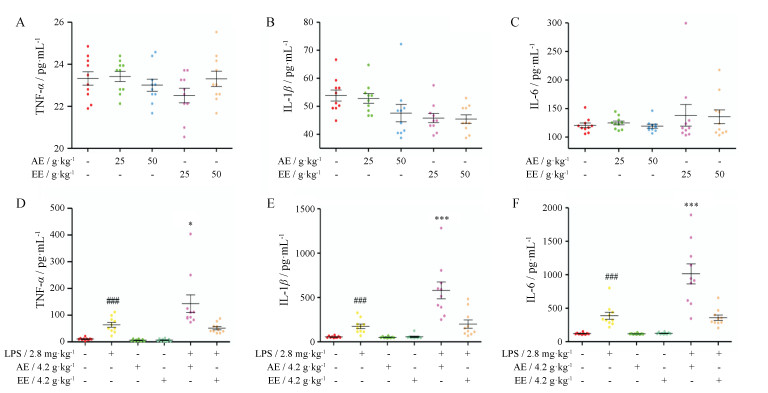
|
Figure 5 Effect of inflammatory cytokine on 4.2, 25, 50 g·kg-1 AE or EE induced liver injury. A-C represent the influence of 25, 50 g·kg-1 of AE or EE on plasma tumor necrosis factor (TNF-α), interleukin-1β (IL-1β), interleukin-6 (IL-6). "25", "50" represent intragastric administration of 25, 50 g·kg-1 of AE or EE. D-F represent the influence of co-treatment with LPS and 4.2 g·kg-1 of AE or EE on plasma TNF-α, IL-1β, IL-6. n = 10, x± s. *P < 0.05, ***P < 0.001 vs LPS group; ###P < 0.001 vs control group |
基于数据库构建方法, 共筛选出白鲜皮中46个化学成分、110个靶点蛋白、258个免疫相关蛋白靶点和702个交互蛋白。
5.2 “药物-靶点-疾病”之间交互网络的构建网络药理学预测白鲜皮与免疫相关的交互网络, 采用不同颜色和形状的图形使其可视化(图 6):黄色方形代表药物与免疫的靶点, 是白鲜皮导致免疫应激的最重要的靶点蛋白; 黄色圆点代表炎症直接作用靶点; 红色三角形代表白鲜皮中的被预测出的活性化合物; 蓝色圆点代表白鲜皮成分的直接作用靶点; 紫色圆点代表连接白鲜皮成分与疾病靶点的交互蛋白。

|
Figure 6 The biological target network related of Cortex Dictamni and "Cortex Dictamni ingredient-target-disease" network |
经CentiScaPe 1.2对网络中所有点的拓扑参数(degree、betweenness centrality和closeness centrality)进行分析, 得出3个拓扑参数中位数均值的2倍, 分别为3.02、0.41和0.07。选择每个靶点的3个拓扑参数值均大于中位数均值2倍的靶点作为白鲜皮对免疫调节的重要靶点蛋白, 最终筛选出15个靶点满足以上条件, 详见表 1。其中, 半胱天冬酶-8、半胱天冬酶-3、白细胞介素6受体的β亚单位、白细胞介素6、TNF受体关联因子3、TNF受体关联因子6、TNF受体关联因子2、nuclear factor NF-κB p100 subunit、NF-κB抑制剂α、NF-κB必需调节因子或与白鲜皮所致肝损伤相关。
| Table 1 The related topological parameters of Cortex Dictamni in the treatment of immune |
在ArrayTrack v.3.5.0通路富集分析中, 筛选出19条通路与白鲜皮中成分与免疫调节相关, 如表 2所示。其中部分通路如细胞凋亡、TNF、NF-κB、RIG-I受体、丙型肝炎、Toll样受体、MAPK、HTLV-I感染、NOD样受体、胞浆DNA传感通路、T细胞受体、B细胞受体、NAFLD和PI3K-Akt等信号通路都展示出具有直接或间接参与免疫调节的作用, 其中细胞凋亡、TNF和NF-κB等信号通路可能在白鲜皮致免疫特异质肝损伤中起到了关键作用。
| Table 2 The pathways of Cortex Dictamni in the treatment of immune |
药物性肝损伤主要有固有型肝损伤和特异质型肝损伤[15,16], 前者由药物本身及其代谢产物对机体产生直接损伤作用, 损伤程度与剂量、时间具有相关性; 而后者主要与机体因素相关, 具有偶发性和隐匿性, 是药物与机体特定状态的综合作用结果[17-19]。而中药特异质肝损伤由于其复杂性和特殊性, 长期以来一直被忽视, 但近年来, 一些传统“无毒”中药的特异质肝损伤问题越来越受到大众的关注。目前免疫炎症假说、基因多态性假说等都较为全面地揭示了特异质肝损伤地发病特点及机制, 但这些假说主要针对的是化学药物。而本课题组提出的中药特异质肝损伤免疫应激“三因致毒”机制假说, 则更加符合中药特异质肝损伤的特点, 为中药特异质肝损伤的客观辨识和临床评价提供了理论依据。
白鲜皮是治疗湿疹风疹、湿热疮毒的临床常用中药, 2015版《中国药典》规定其日用剂量为5~10 g, 文献[20,21]报道白鲜皮在正常小鼠水平检测的LD50为48.2 g·kg-1, 而临床偶见白鲜皮致肝损伤的报道, 且往往与白鲜皮使用剂量和时间没有明确相关性[22], 故推测白鲜皮所致的肝损伤可能为特异质肝损伤。目前无毒剂量的LPS介导的药物特异质肝损伤评价模型已成功应用于曲伐沙星、舒林酸、氟烷、氯丙嗪、野百合碱、雷尼替丁、双氯芬酸、胺碘酮、何首乌和壮骨关节丸等药物的特异质肝损伤评价[23-30]。因而, 本文采用LPS介导的特异质肝损伤模型, 探讨白鲜皮致特异质肝损伤作用。实验结果表明, 白鲜皮单独给药各组的主要肝功能指标AST和ALT、肝组织病理学及肝细胞凋亡均未见显著改变, 而在LPS模型中, 4.2 g·kg-1白鲜皮即可导致转氨酶显著升高, 肝组织病理及肝细胞凋亡检测也显示大面积肝细胞变性及坏死。综上所述, 在免疫应激状态下, 白鲜皮可导致特异质肝损伤。
通过大量文献调研发现, 白鲜皮常用的入药方式有两种:一种是入汤剂或泡水服用, 另一种是在含白鲜皮的中成药制剂中用乙醇提取, 如痔血胶囊的提取工艺是全方85%乙醇回流提取[31-33]。因此, 本文在考虑白鲜皮导致特异质肝损伤的同时, 分别比较白鲜皮不同溶剂提取物所致肝损伤的差异性。实验结果显示, 在LPS模型基础上, AE和EE均可以导致ALT、AST不同程度的升高, 且AE的升高程度大于EE。肝细胞凋亡检测数据也显示AE和EE联合LPS组存在不同程度的细胞凋亡。另外, 炎症因子检测结果显示TNF-α、IL-1β和IL-6只在AE联合LPS组中表达量显著升高, 提示在免疫应激条件下, AE可促进炎症因子的表达。有文献[34-36]报道, LPS可激活肝脏巨噬细胞, 并通过与LBP、CD14、MD-2和TLR4等蛋白结合, 释放大量TNF-α、IL-1β、IL-6等细胞因子及炎症介质, 从而产生一系列炎症反应并造成肝脏损伤, 其中, 已知IL-1β、TNF-α在多种药物诱导的免疫特异质肝损伤中发挥重要的作用, 而IL-6表达水平与免疫性损伤密切相关, 调控IL-6的基因表达可以有效控制炎症性疾病的发生[37-40]。综上, 在免疫应激状态下, AE和EE均可以导致特异质肝损伤, 而AE所致肝损伤程度较EE更重。
网络药理学是在网络生物学与多向药理学的基础上提出的, 其多个靶点、多个途径形成的相互协同、相互制约的网络思想能很好地为研究药物作用机制提供思路[41-43]。本文筛选出白鲜皮调控的15个靶标及19条通路在免疫炎症中发挥重要作用, 这些结果映射了白鲜皮调控的多个免疫相关靶标和通路与其肝损伤相关。本实验在数据库中筛选出了白鲜皮46个化学成分, 并通过网络药理学预测细胞凋亡、TNF、NF-κB等信号通路和免疫反应相关性较大, 而文献[44-46]报道, 上述通路中多种免疫炎症因子如TNF-α、IL-1β和IL-6等与肝细胞凋亡密切相关, 故以此3条通路为切入点, 进一步寻找白鲜皮诱导免疫特异质肝损伤的易感成分及作用靶标。
综上所述, 本实验基于LPS模型研究发现, 白鲜皮在较低剂量(4.2 g·kg-1)即可引起大鼠肝脏损伤和组织病理学改变, 且AE所致肝损伤较EE更重, 而对于正常动物白鲜皮给药剂量达50 g·kg-1仍未见明显肝损伤表现, 表明机体免疫应激状态增加了白鲜皮肝损伤的易感性从而导致免疫特异质肝损伤, 这为白鲜皮临床肝损伤风险防控提供了依据, 有力提升了临床安全合理用药水平。尽管已经通过临床和基础研究证实了白鲜皮致免疫特异质肝损伤作用, 但具体致肝损伤物质还有待进一步研究, 同时对其导致免疫特异质肝损伤的易感因素有待临床验证。
| [1] | Liu L, Guo LN, Yu CL, et al. Advances in studies on the chemical components and pharmacological activities of Cortex Dictamni[J]. Chin Tradit Pat Med (中成药), 2016, 38: 2657–2665. |
| [2] | Zhang MF, Shen YQ. Research advances on pharmacology of Cortex Dictamni[J]. Anti-Infect Pharm (抗感染药学), 2012, 9: 95–99. |
| [3] | Xu ML, Wang LL, Li L, et al. Protective effects of aqueous extract of Cortex Dictamni on myocardial ischemia reperfusion injury in rats[J]. Acta Lab Anim Sci Sin (中国实验动物学报), 2013, 21: 47–52. |
| [4] | Jia XL, Liu H, Li Y, et al. Research status of biological characteristics, chemical components and pharmacological effects of Dictamnus dasycarpus Turcz[J]. Heilongjiang Sci (黑龙江科学), 2018, 9: 42–43. |
| [5] | Li XY, Li CQ, Zhang ZM, et al. Study on traditional Chinese medicine-induced liver injury: from theory to clinical analysis[J]. Trans Med J (转化医学杂志), 2015, 4: 244–249. |
| [6] | Su LM, Ai J, Kong XH. Acute hepatitis caused by Keyin wan[J]. Adv Drug React J (药物不良反应杂志), 2012, 14: 61–63. |
| [7] | Cheng H, Wu SY. Severe liver damage caused by Zhixue capsules[J]. Adv Drug React J (药物不良反应杂志), 2009, 11: 298. |
| [8] | Wang XJ, Chen CW, Fu QC, et al. Drug-induced liver injury related with Zhixue capsules: an analysis of 30 gregarious patients[J]. Chin Hepatol (肝脏), 2009, 14: 287–290. |
| [9] | Yang WH, He J. Analysis of 5 reports of acute liver damage induced by Zhixue capsule[J]. Chin J Pharmacov (中国药物警戒), 2010, 7: 375–376. |
| [10] | Liu YH, Zhou YY, Sun HM, et al. The serum enzyme and pathological characteristics of Cortex Dictamni induced liver injury[J]. China Mod Med (中国当代医药), 2017, 24: 7–11. |
| [11] | Huang YX, Guo YM, Zhou YF, et al. Cortex Dictamni powder-induced liver injury based on integrated evidence chain[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 600–606. |
| [12] | Li CY, Li XF, Tu C, et al. The idiosyncratic hepatotoxicity of Polygonum multiflorum based on endotoxin model[J]. Acta Pharm Sin (药学学报), 2015, 50: 28–33. |
| [13] | Woreta TA, Alqahtani SA. Evaluation of abnormal liver tests[J]. Med Clin North Am, 2014, 98: 1–16. DOI:10.1016/j.mcna.2013.09.005 |
| [14] | Yang CG, Xu Y, Lü BT, et al. Enzymatic determination for total bile acids in serum and its clinical application[J]. Chin J Clin Lab Sci (临床检验杂志), 1997, 15: 323–327. |
| [15] | Zhang SY, Zhu XG, Zhang GP, et al. Study on acute and chronic toxicities of polygoni multiflori radix praeparata extracts[J]. J Toxicol (毒理学杂志), 2013, 274: 261–264. |
| [16] | Wang JB, Zhang L, Guo YM, et al. Causality assessment strategies and methods for Chinese medicines-induced liver injury[J]. Acta Pharm Sin (药学学报), 2018, 53: 920–928. |
| [17] | Navarro VJ, Senior JR. Drug-related hepatotoxicity[J]. N Engl J Med, 2006, 354: 731–739. DOI:10.1056/NEJMra052270 |
| [18] | Björnsson ES, Bergmann OM, Björnsson HK, et al. Incidence, presentation, and outcomes in patients with drug-induced liver injury in the general population of Iceland[J]. Gastroenterology, 2013, 144: 1419–1425. DOI:10.1053/j.gastro.2013.02.006 |
| [19] | Bai ZF, Gao Y, Zuo XB, et al. Progress in research on the pathogenesis of immune regulation and idiosyncratic drug-induced liver injury[J]. Acta Pharm Sin (药学学报), 2017, 52: 1019–1026. |
| [20] | Wang L, Li Z, Li L, et al. Acute and sub-chronic oral toxicity profiles of the aqueous extract of Cortex Dictamni in mice and rats[J]. J Ethnopharmacol, 2014, 158: 207–215. DOI:10.1016/j.jep.2014.10.027 |
| [21] | Wu XX, Wu LM, Fan JJ, et al. Cortex Dictamni extract induces apoptosis of activated hepatic stellate cells via STAT1 and attenuates liver fibrosis in mice[J]. J Ethnopharmacol, 2011, 135: 173–178. DOI:10.1016/j.jep.2011.03.010 |
| [22] | Zhao W, Wolfender JL, Hostettmann K, et al. Antifungal alkaloids and limonoid derivatives from Dictamnus dasycarpus[J]. Phytochemistry, 1998, 47: 7–11. DOI:10.1016/S0031-9422(97)00541-4 |
| [23] | Waring JF, Liguori MJ, Luyendyk JP, et al. Microarray analysis of lipopolysaccharide potentiation of trovafloxacin-induced liver injury in rats suggests a role for proinflammatory chemokines and neutrophils[J]. J Pharmacol Exp Ther, 2006, 316: 1080–1087. |
| [24] | Tang JF, Wang XY, Wen Q, et al. Idiosyncratic hepatotoxicity evaluation of Zhuangguguanjie wan mediated by immune stress[J]. Acta Pharm Sin (药学学报), 2017, 52: 1033–1040. |
| [25] | Poulsen KL, Olivero-Verbel J, Beggs KM, et al. Trovafloxacin enhances lipopolysaccharide-stimulated production of tumor necrosis factor-α by macrophages: role of the DNA damage response[J]. J Pharmacol Exp Ther, 2014, 350: 164–170. DOI:10.1124/jpet.114.214189 |
| [26] | Eguchi A, Wree A, Feldstein AE. Biomarkers of liver cell death[J]. J Hepatol, 2014, 60: 1063–1074. DOI:10.1016/j.jhep.2013.12.026 |
| [27] | Kolarski V, Todorov A, Petrova D. Cytokines and the liver in health and disease[J]. Vutr Boles, 2000, 32: 19–24. |
| [28] | He LZ, Yin P, Meng YK, et al. Study on the mechanism of PPAR-γ dependent immunological idiosyncrasy liver injury induced by Polygonum multiflorum[J]. Acta Pharm Sin (药学学报), 2017, 52: 1027–1032. |
| [29] | Li CY, Tu C, Gao D, et al. Metabolomic study on idiosyncratic liver injury induced by different extracts of Polygonum multiflorum in rats integrated with pattern recognition and enriched pathways analysis[J]. Front Pharmacol, 2016, 7: 483. |
| [30] | Wang JB, Cui HR, Bai ZF, et al. Precision medicine-oriented safety assessment strategy for traditional Chinese medicines: disease-syndrome-based toxicology[J]. Acta Pharm Sin (药学学报), 2016, 51: 1681–1688. |
| [31] | Fan QY, Zhao BS, Zhang JX, et al. Analysis on drug factors for hepatotoxicity of Zhixue capsule[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 150–157. |
| [32] | Li L, Zhou YF, Li YL, et al. In vitro and in vivo antioxidative and hepatoprotective activity of aqueous extract of Cortex Dictamni[J]. World J Gastroenterol, 2017, 23: 2912–2927. DOI:10.3748/wjg.v23.i16.2912 |
| [33] | Mcrae CA, Agarwal K, Mutimer D, et al. Hepatitis associated with Chinese herbs[J]. Eur J Gastroenterol Hepatol, 2002, 14: 559–562. |
| [34] | Zhang ZF, Zhao HW, Chai X, et al. Effect of Hedyotis diffusae herba on dextran sulphate sodium-induced chronic ulcerative colitis in mice[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 3520–3525. |
| [35] | Liu HM, Han YZ, Guo YM, et al. The protection effects of Liuweiwuling tablets against concanavalin A-induced acute immunological liver injury in mice[J]. Chin Pharmacol Bull (中国药理学通报), 2017, 33: 133–139. |
| [36] | Li C, Niu M, Bai Z, et al. Screening for main components associated with the idiosyncratic hepatotoxicity of a tonic herb, Polygonum multiflorum[J]. Front Med, 2017, 11: 253–265. DOI:10.1007/s11684-017-0508-9 |
| [37] | Kwak A, Lee Y, Kim H, et al. Intracellular interleukin (IL)-1 family cytokine processing enzyme[J]. Arch Pharm Res, 2016, 39: 1556–1564. DOI:10.1007/s12272-016-0855-0 |
| [38] | Schmidt-Arras D, Rose-John S. IL-6 pathway in the liver: from physiopathology to therapy[J]. J Hepatol, 2016, 64: 1403–1415. DOI:10.1016/j.jhep.2016.02.004 |
| [39] | Luyendyk JP, Lehman-McKeeman LD, Nelson DM, et al. Coagulation-dependent gene expression and liver injury in rats given lipopolysaccharide with ranitidine but not with famotidine[J]. J Pharmacol Exp Ther, 2006, 317: 635–643. DOI:10.1124/jpet.105.096305 |
| [40] | Zhang L, Bai ZF, Li CY, et al. Study on idiosyncratic liver injury and content of cis-2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-D-gluc side in radix Polygoni multiflori Preparata[J]. Acta Pharm Sin (药学学报), 2017, 52: 1041–1047. |
| [41] | Chai X, Meng YK, Bai ZF, et al. Mechanism of anti-hepatitis B virus activity of tonkinensis based on biological targets network[J]. Acta Pharm Sin (药学学报), 2018, 53: 396–402. |
| [42] | Liu R, Li XY, Li YZ, et al. Network toxicology and its application in predicting the toxicity of traditional Chinese medicine[J]. Drug Eval Res (药物评价研究), 2018, 41: 709–715. |
| [43] | Ma ZJ, Li Q, Zhao KJ, et al. Dynamic serum metabolomics study of liver injury in rats caused by Polygonum multifulorum[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 152–156. |
| [44] | Mohamed MS, Bishr MK, Almutairi FM, et al. Inhibitors of apoptosis: clinical implications in cancer[J]. Apoptosis, 2017, 22: 1487–1509. DOI:10.1007/s10495-017-1429-4 |
| [45] | Herr AB. Evolution of an allosteric "off switch" in apoptotic caspases[J]. J Biol Chem, 2018, 293: 5462–5463. DOI:10.1074/jbc.H118.002379 |
| [46] | Liang H, Yang X, Liu C, et al. Effect of NF-κB signaling pathway on the expression of MIF, TNF-α, IL-6 in the regulation of intervertebral disc degeneration[J]. J Musculoskel Neuron Interact, 2018, 18: 551–556. |
 2019, Vol. 54
2019, Vol. 54


