2. 北京中医药大学, 北京 100029
2. Beijing University of Chinese Medicine, Beijing 100029, China
溃疡性结肠炎(ulcerative colitis, UC)是一种病因尚不十分清楚的慢性非特异性结肠炎症, 具有多层次、多变量等复杂病性[1]。病理改变以结肠溃疡糜烂为主, 具有弥散性、浅表性、连续性的特点, 病程漫长, 伴反复发作[2]。目前多认为, 溃疡性结肠炎与遗传、感染、环境、饮食、免疫等多方面因素有关[3]。近年来, 溃疡性结肠炎的发病趋势日益严重, 研究其作用机制对于临床治疗具有积极的指导意义。在本课题组对溃疡性结肠炎的前期研究中发现, 溃疡性结肠炎的发病机制除了与炎症密切相关外, 还可能与氧化应激有关[4,5]。Nrf2通路是目前发现的抗氧化应答反应的重要防御信号通路, 能够调控下游多种抗氧化酶和Ⅱ相解毒酶的表达[6]。本实验通过观察黄芩汤对UC大鼠结肠组织核因子E2相关因子Nrf2 (nuclear factor erythroid-2-related factor 2)、血红素氧化酶1 (heme oxygenase, HO-1)、氧化还原酶1 (NAD[P]H: quinone oxidoreductase 1, NQO-1)以及细胞因子的检测, 探讨其治疗UC的作用机制。
材料与方法仪器 电子天平(上海天平仪器厂)、TY-80A/S脱色摇床、Varioskan Flash全波长扫描多功能酶标仪(赛默飞世尔科技有限公司)、美国Bio-Rad电泳仪(Kigen公司)、J-30I Beckman高速离心机(美国Beckman公司)、GL-8B涡旋混合器(海门市其林贝尔仪器制造有限公司)、XDS-1B倒置显微镜(重庆光电仪器有限公司)、轮转式病理切片机(深圳市汇沃科技有限公司)。
动物 健康SD雄性大鼠, SPF级, 体重180~200 g, 由中国食品药品检定研究院提供, 许可证号: SCXK (京) 2014-0013。饲养环境保持温度(23±1.5) ℃, 相对湿度(45±15) %。实验方案经中国中医科学院中药研究所伦理委员会审议同意并批准。
药品与试剂 黄芩(Scutellaria baicalensis Georgi)、芍药(Paeonia lactiflora Pall)、炙甘草(Glycyrrhiza uralensis Fisch)、大枣(Ziziphus jujuba Mill)购自北京同仁堂公司, 经中国中医科学院中药研究所李先端研究员鉴定后, 储存于本实验室。参照《伤寒论》组方及课题组的前期研究[5], 黄芩汤的制备由黄芩、芍药、甘草和大枣配伍而成, 按照3:2:2:2的比例, 称取一定量的药材, 加药材总重量10倍体积的水, 煎煮1 h后, 趁热过滤药液; 药渣加8倍体积的水继续煎煮1 h, 合并两次药液, 浓缩成1 g·mL-1药液。其质量经指纹图谱相似度和多成分含量分析控制, 提取率约为36%, 与对照图谱相似系数为0.998, 主要含黄酮和萜类化合物, 其中主要成分质量分数黄芩苷为10.094%, 汉黄芩苷为2.334 3%, 千层纸素A-苷为0.953 3%, 黄芩素为0.411 4%, 汉黄芩素为0.149 8%, 千层纸素A为0.093 8%, 甘草素二糖苷为0.790 6%, 甘草苷为0.344 4%, 异甘草素二糖苷为0.036 1%, 甘草素为0.032 2%, 异甘草苷为0.060 7%, 异甘草素为0.003 5%。
柳氮磺胺吡啶(salazosulfapyridine, SASP)肠溶片(批号: 20130506, 上海中西三维药业有限公司), 2, 4, 6-三硝基苯磺酸(2, 4, 6-trinitrobenzenesulfonic, TNBS, Sigma公司), 过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-px)、髓过氧化物酶(myeloperoxidase, MPO)、超氧化物歧化酶(superoxide dismutase, SOD)试剂盒(南京建成生物科技有限公司), 免疫组化及DAB显色试剂盒(武汉博士德生物工程有限公司), 兔抗鼠Nrf2单克隆抗体、兔抗鼠HO-1单克隆抗体、兔抗鼠NQO-1单克隆抗体(Santa Cruz公司)。
模型制备及分组 采用Morris等[7]报道的方法制备溃疡性结肠炎大鼠模型。将Wistar大鼠60只, 禁食不禁水24 h, 用1%戊烷巴比妥钠腹腔麻醉(4 mg/100 g)后, 一次性将TNBS (100 mg·kg-1)和50%乙醇溶液0.25 mL用直径2 mm、长15 cm左右的14号导尿管缓缓注入大鼠距肛门约8 cm深的肠腔内, 捏紧肛门, 倒置数分钟。正常组10只大鼠采用同样方法灌以等体积的生理盐水, 术后常规饲养。
造模适应两天后, 将大鼠按体重随机分为正常组、模型组、阳性药SASP组、HQT高、中、低剂量组, 造模3天后开始给药, HQT高、中、低组分别按20、10、5 g·kg-1灌胃给药, 阳性药SASP组按0.5 g·kg-1剂量灌胃给药, 正常组和模型组给予等量的生理盐水, 每日给药1次, 连续给药5天。
样品采集 第5天灌胃给药后禁食不禁水24 h, 眼眶取血, 以3 500 r·min-1转速离心15 min, 分离血清, 置-20 ℃冰箱冷冻保存。取血完毕后处死大鼠, 取出距肛门8 cm处结肠组织, 沿肠系膜缘剪开肠腔, 用生理盐水冲洗肠内容物, 一部分石蜡包埋进行常规病理切片及免疫组化染色, 另一部分放入-80 ℃保存。
指标检测及方法
行为学指标 造模前后及给药期间观察大鼠体征、饮食及精神状况。
生化法检测 取上述分离后血清, 按照试剂盒使用说明, 用生化仪测定血清中CAT、MPO、GSH-px、SOD含量。
ELISA法检测 取上述分离后血清, 按照试剂盒使用说明, 用酶标仪测定血清中过氧化脂(lipid peroxide, LPO)含量。
免疫组化染色 各组结肠组织按常规包埋, 切片, 厚度4 µm。采用S-P法检测大鼠结肠组织中核因子Nrf2蛋白表达。结肠组织用中性甲醛固定24 h后, 常规脱水、浸蜡、包埋、切片, 然后常规二甲苯脱蜡, 梯度酒精水化, 采用复合消化液和抗原修复液进行抗原修复, PBS洗3次, 用3% H2O2溶液孵育10 min (去除内源性过氧化氢酶活性), 滴加1:80浓度的兔抗鼠Nrf2单克隆抗体, 4 ℃过夜, PBS洗3次, 滴加聚合HRP标记抗兔IgG 37 ℃孵育50 min, PBS冲洗, DAB显色, 常规脱水, 用中性树胶封片。每张切片在高倍镜下(400×)随机选取4个视野, 以出现棕黄色染色为阳性信号, 检测Nrf2积分光密度, 得到阳性样品数。
Western blot法检测 取结肠组织, 剪碎, 加入RIPA裂解液以及PMSF, 提取总蛋白质, 测定蛋白质含量。加入SDS-PAGE蛋白上样缓冲液进行聚丙烯酰胺凝胶电泳分离, 转膜, HO-1一抗以1:1 000 5%的BSA稀释, NQO-1一抗以1:200 5%的BSA稀释一抗, 孵育过夜, HRP标记的二抗(1:5 000)孵育2 h, 显影, 用Image J图像分析图像, 进行目的条带灰度值分析。
统计学方法 数据均用SPSS20.0统计软件进行统计分析, 计量数据以x±s表示, 各组数据间比较采用one-way ANOVA进行分析, P < 0.05为差异有统计学意义, P < 0.01为差异极具统计学意义。
结果 1 行为学结果大鼠造模第1天后体重明显减轻, 第2天后体重均有所增加, 组间无明显差异, 但正常组体重明显升高于其他组。正常组大鼠仅在第1天精神稍显萎靡、懒动, 毛发晦暗稍显光泽, 便硬无明显变化, 第2天后即开始恢复正常, 体重持续上升; 而模型组即出现不同程度的便血、便稀浓黏、毛发晦暗无光泽, 给药后, SASP组和黄芩汤组上述指标出现不同程度的减轻, 大鼠饮食及体重统计结果如图 1。

|
Figure 1 Body weight and food quantity change after 2, 4, 6-trinitrobenzenesulfonic (TNBS)-induced ulcerative colitis. n = 7, x±s. Normal: Normal group; Model: Model group; SASP: Salazosulfapyridine group (0.5 g·kg-1); High: High dose of Huangqin Tang (HQT) group (20 g·kg-1); Middle: Middle does of HQT group (10 g·kg-1); Low: Low dose of HQT group (5 g·kg-1) |
肉眼观察大鼠结肠组织:正常组大鼠结肠外观正常, 未见充血, 颜色正常, 浆膜面、黏膜面和肌层未见有明显病变。模型组大鼠部分结肠内明显充血、瘀血, 肠黏膜颜色褐色, 肠黏膜及肌层明显变薄, 粪便有节段性充满肠道, 部分味恶臭。阳性药组大鼠结肠内未见明显充血、瘀血, 病变明显减轻。黄芩汤3个不同剂量组大鼠结肠未见明显充血、瘀血, 肠颜色及肌层厚度与模型组相比有不同程度减轻。
溃疡性结肠炎大鼠结肠组织HE染色结果见图 2。正常组大鼠黏膜完整, 黏膜下未见有炎症现象, 肌层结构正常。模型组大鼠结肠黏膜和直肠均有炎症, 细胞排列紊乱, 部分结肠腺体消失被浸润的炎症细胞替代, 以单核细胞、淋巴细胞、嗜酸性细胞代替了正常细胞, 个别黏膜层明显变薄, 个别肌层组织炎症较重, 失去了正常结构。阳性药组大鼠结肠和直肠黏膜炎症浸润, 肠腺溃疡, 与模型组相比病变明显减轻。黄芩汤3个不同剂量组结肠和直肠黏膜炎症浸润, 肠腺溃疡, 肌层病变与模型组相比, 病变都有明显减轻。
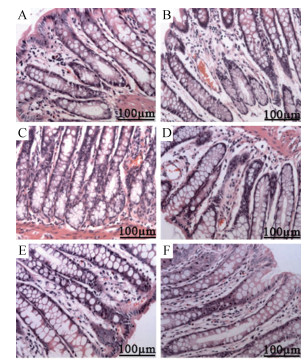
|
Figure 2 Microscopic damage of colon tissue of rats. A: Normal group; B: Model group; C: SASP groups; D: High dose of HQT group (20 g·kg-1); E: Middle dose of HQT group (10 g·kg-1); F: Low dose of HQT group (5 g·kg-1) |
大鼠造成溃疡性结肠炎模型后, 连续给药5天后血清中SOD、CAT、GSH-px、MPO含量, 结果如表 1所示。模型组血清SOD、CAT、GSH-px活性较正常组均有显著性下降, 而模型组血清MPO活性较正常组显著增加。SASP组和黄芩汤高、中、低剂量组血清中SOD活性与模型组相比有上升趋势但无显著性差异; 黄芩汤高、中剂量组中CAT活性与模型组相比有显著性差异; 黄芩汤高、中、低剂量组中GSH-px活性与模型组相比均有显著性差异; 黄芩汤高、中、低剂量组血清中MPO活性与模型组相比有降低趋势, 但均无显著性差异。
| Table 1 The effects of HQT on the SOD, CAT, GSH-px, MPO of serum induced by TNBS in rats. n = 7, x±s. *P < 0.05, **P < 0.01 vs model group; △P < 0.05, △△P < 0.01 vs normal group. CAT: Catalase; GSH-px: Glutathione peroxidase; MPO: Myeloperoxidase; SOD: Superoxide dismutase |
如图 3所示, 与正常组相比, 模型组血清中LPO的含量显著升高(P < 0.01);而与模型组相比, 黄芩汤高、中、低剂量组均能降低LPO的含量, 其中, 高剂量组和中剂量组具有统计学意义(P < 0.05)。

|
Figure 3 The effects of HQT on the lipid peroxide (LPO) levels of serum induced by TNBS in rats. n = 7, x±s. *P < 0.05, **P < 0.01 vs model group; △P < 0.05, △△P < 0.01 vs normal group |
免疫组化检测结果如图 4所示, 正常组大鼠结肠组织仅见少量黄色颗粒, SASP组和黄芩汤高、中剂量组与模型组相比, Nrf2阳细胞表达数增加, 具显著性差异, 黄芩汤低剂量组未见显著性差异。
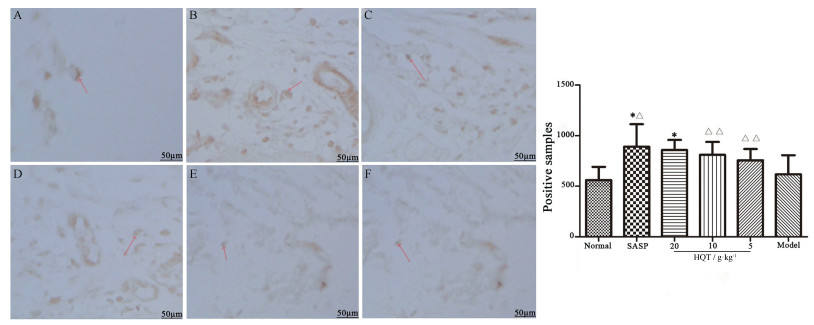
|
Figure 4 The effects of HQT on the nuclear factor erythroid-2-related factor 2 (Nrf2) levels of colons induced by TNBS in rats. A: Normal group; B: SASP group; C: High dose of HQT group (20 g·kg-1); D: Middle dose of HQT group (10 g·kg-1); E: Low dose of HQT group (5 g·kg-1); F: Model group. n = 7, x±s. *P < 0.05 vs model group; △P < 0.05, △△P < 0.01 vs normal group |
Western blot结果(图 5)显示, 与模型组相比, 黄芩汤各给药组与SASP组均能够增加组织内HO-1和NQO1的表达, 并且呈现一定的剂量依赖关系, 但无显著性差异。
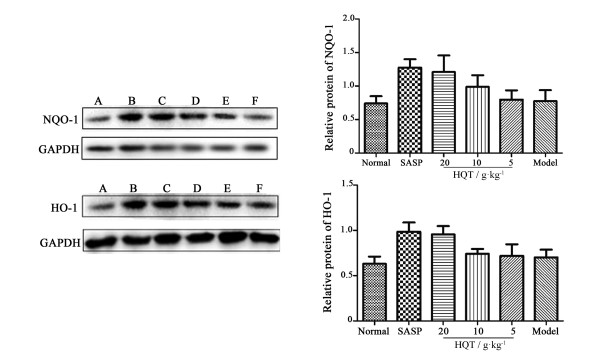
|
Figure 5 The effects of HQT on the NAD[P]H: quinone oxidoreductase 1 (NQO-1) and heme oxygenase (HO-1) expression of colon induced by TNBS in rats. A: Normal group; B: SASP group; C: High dose of HQT group (20 g·kg-1); D: Middle dose of HQT group (10 g·kg-1); E: Low dose of HQT group (5 g·kg-1); F: Model group. n = 7, x±s |
黄芩汤出自《伤寒论》, 由黄芩、芍药、甘草和大枣配伍而成, 为清热止痢、和中止痛常用方, 目前临床上广泛用于治疗溃疡性结肠炎、急性胃肠炎、细菌性痢疾等疾病[8,9]。本课题组前期研究发现了一些黄芩汤治疗UC的作用机制, 包括通过抑制TLR4蛋白表达, 影响MyD88引发信号通路下游的基因表达从而抑制NF-κB的活化, 减少COX-2及iNOS位点结合, 减少NO、PGE2及IL-17等促炎因子的释放以及机体免疫系统过度活化[10]; 抑制NF-κB p65活化进而下调复杂的促炎细胞因子网络, 减轻肠道炎性反应和黏膜损伤等。本实验从黄芩汤调控Nrf2通路入手, 通过对相应指标的检测, 从抗氧化应激的角度来对黄芩汤治疗UC的作用机制进行阐述。
正常生理状态下, 体内氧化与抗氧化处于相对平衡状态, 当机体受到外界刺激或亲电子物质侵袭时, 体内活性氧自由基(ROS)或氮自由基(RNS)分泌过多, 在机体生理环境正常时, 细胞用复杂的抗氧化防御机制来调控ROS的水平。而在病理状况下, 如慢性炎症时, 过量的活性氧自由基会导致细胞功能紊乱和重构[11], 从而引起氧化应激失衡, 导致溃疡性结肠炎的发生。
Nrf2属于cap‘n’collar (CNC)转录因子家族, 是细胞抗氧化应激体系中的关键转录因子及维持细胞内氧化还原稳态的中枢调节物质, 其信号通路是目前发现的最为重要的一条内源性抗氧化通路。正常生理状态下, Nrf2多存在于细胞浆中, 与胞质蛋白Keap-1结合, 当受到亲电子试剂或氧化刺激时, Nrf2迅速从复合物中解离出来, 活化转位进入细胞核, 进而调控下游多种抗氧化酶和Ⅱ相解毒酶如HO-1、NQO-1、CAT等的表达[12,13]。HO-1是一种可诱导的蛋白质, 当体内处于缺血、缺氧以及应激环境时, 其表达可成倍增加, 研究发现, HO-1及其代谢产物具有明显的抗氧化作用[14]。而NQO-1可通过催化醌类物质发生双电子还原反应, 阻止后者参与氧化还原反应和ROS的产生[15]。
SOD可以清除机体内产生的超氧化阴离子, 有抗氧化等重要作用, 当其含量和活力降低时, 将导致自由基的堆积; 另一方面, 自由基损害细胞膜脂质双层中的不饱和脂肪酸会产生脂质过氧化物(LPO), 它进一步与磷脂酰乙醇胺和蛋白质交联成大分子复合物导致疾病的发生, 因此通过测定SOD和LPO含量可反映机体脂质过氧化反应程度[16]。CAT是机体抗氧化系统中酶系统的重要组成部分, 可与SOD协同清除自由基, 常存在于细胞的过氧化体中, 主要功能是清除H2O2, 使其转变为H2O和氧气, 保护机体免受损害, 因而其含量可用来衡量机体的抗氧化能力[17]。而GSH-px是机体内广泛存在的过氧化氢酶, 可以保护细胞膜结构和功能免受过氧化氢的氧化损伤[18]。MPO是中性粒细胞嗜天青颗粒产生的一种重要的过氧化物酶, 主要存在于嗜中性粒细胞和单核细胞中, 其活性高低反映了中性粒细胞浸润程度[19]。
本研究结果显示, 黄芩汤可明显改善溃疡结肠炎大鼠的体征, 还能够降低血清中LPO、MPO的含量, 升高SOD、GSH-px、CAT含量, 并通过调节Nrf2调控下游抗氧化基因和Ⅱ相解毒酶的表达对溃疡性结肠炎产生一定的治疗作用, 为进一步的深入研究奠定了基础, 也为更好的临床研究提供了参考。
| [1] | Tew GW, Hanckney JA, Gibbons D, et al. Association between response to etrolizumab and expression of integrina E and granzyme a in colon biopsies of patients with ulcerative colitis[J]. Gastroenterology, 2016, 150: 477–487. DOI:10.1053/j.gastro.2015.10.041 |
| [2] | Hindryckx P, Baert F, Hart A, et al. Clinical trials in ulcerative colitis: a historical perspective[J]. J Crohns Colitis, 2015, 9: 580. DOI:10.1093/ecco-jcc/jjv074 |
| [3] | Ng WK, Wong SH, Ng SC. Changing epidemiological trends of inflammatory bowel disease in Asia[J]. Int Res, 2016, 14: 111–119. |
| [4] | Jin Y, Yang J, Lin L, et al. The attenuation of scutellariae radix extract on oxidative stress for colon injury in lipopolysaccharide induced RAW264.7 cell and 2, 4, 6-trinitrobrnzene sulfonic acid induced ulcerative colitis rats[J]. Phramacogn Mag, 2016, 12: 153–159. DOI:10.4103/0973-1296.177913 |
| [5] | Wang YW, Zhang HH, Wang YL, et al. Effect of Huangqin Tang on the regulatory NF-κB p65 signal pathway in rats with ulcerative colitis[J]. Acta Pharm Sin (药学学报), 2015, 50: 21–27. |
| [6] | Nariaki F, Jun K. Increase in prostate stem cell antigen expression in prostatic hyperplasia induced by testosterone and 17β-estradiol in C57BL mice[J]. J Steroid Biochem Mol Biol, 2016, 158: 56–62. DOI:10.1016/j.jsbmb.2016.01.011 |
| [7] | Morris GP, Beck PL, Herridge MS, et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon[J]. Gastroenterology, 1989, 96: 795–803. DOI:10.1016/0016-5085(89)90904-9 |
| [8] | Zou Y, Lin J, Li W, et al. Huangqin-tang ameliorates dextran sodium sulphate-induced colitis by regulating intestinal epithelial cell homeostasis, inflammation and immune response[J]. Sci Rep, 2016, 6: 39299. DOI:10.1038/srep39299 |
| [9] | Xi JS. The Clinical Study of Huangqin Tang on Ulcerative Colitis (黄芩汤治疗溃疡性结肠炎的临床研究)[D]. Beijing: Beijing University of Chinese Medicine, 2006. |
| [10] | Wang DF, Wang YL, Wang YW, et al. Effect of Huangqin Tang on the function of regulatory TLR4/MyD88 signal pathway in rats with ulcerative colitis[J]. Acta Pharm Sin (药学学报), 2016, 51: 1558–1563. |
| [11] | Rani V, Deep U, Singh RK, et al. Oxidative stress and metabolic disorder; pathogenesis and therapeutic strategies[J]. Life Sci, 2016, 148: 183–193. DOI:10.1016/j.lfs.2016.02.002 |
| [12] | Eve DJ, Steele MR, Sanberg PR, et al. Hyperbaric oxygen therapy as a potential treatment for post-traumatic stress disorder with traumatic brain injury[J]. Neuropsychiatr Dis Treat, 2016, 12: 2689–2705. DOI:10.2147/NDT |
| [13] | Zhang X, Wang X, Sun X, et al. Differences in cognitive function of rats with traumatic brain injuries following hyperbaric oxygen therapy[J]. Med Sci Monit, 2016, 22: 2608–2615. DOI:10.12659/MSM.899548 |
| [14] | Ayman M, Mousa O, Khalid M, et al. Commiphora molmol protects against methotrexate-induced nephrotoxicity by upregulating Nrf2/ARE/HO-1 signaling[J]. Biomed Pharmacother, 2018, 106: 499–509. DOI:10.1016/j.biopha.2018.06.171 |
| [15] | Yu J, Wu XX, Wang CX, et al. NQO1 dependent non-canonical necroptosis mediated by ROS and RIP1/RIP3 in parallel in glioma cancer cells[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2018, 32: 326–327. |
| [16] | Yang X, Guo T, Wang Y, et al. Therapeutic effect of ginsenoside Rd in rats with TNBS-induced recurrent ulcerative colitis[J]. Arch Pharm Res, 2012, 35: 1231–1239. DOI:10.1007/s12272-012-0714-6 |
| [17] | Krajka-kuźniak V, Paluszczak J, Baer-Dubowska W. The Nrf2-ARE signaling pathway: an update on its regulation and possible role in cancer prevention and treatment[J]. Pharmacol Rep, 2017, 69: 393–402. DOI:10.1016/j.pharep.2016.12.011 |
| [18] | Wang GW, Zhang XL, Wu QH, et al. The hepatoprotective effects of Sedum sarmentosum extract and its isolated major constituent through Nrf2 activation and NF-κB inhibition[J]. Phytomedicine, 2018, 53: 263–273. |
| [19] | Sarlos P, Kovesdi E, Magyari L, et al. Genetic update on inflammatory factors in ulcerative colitis: review of the current literature[J]. World J Gastrointest Pathophysiol, 2014, 5: 304–321. DOI:10.4291/wjgp.v5.i3.304 |
 2019, Vol. 54
2019, Vol. 54


