茵栀黄方由茵陈、栀子、黄芩及金银花四味药组成, 具有清热、解毒、利湿、退黄功效。实验研究及临床应用均证明此方疗效确切, 目前常用于各类急、慢性病毒性肝炎、肝细胞性黄疸、新生儿黄疸等疾病的治疗。然而, 作为一味成分复杂的复方中药, 由于其药效物质成分众多且含量极低, 研究手段及分析方法的瓶颈一直制约着其药效物质研究的发展。最近课题组已应用LC-MS/MS的动态多反应监测(dynamic multiple reaction monitoring, DMRM)技术成功进行了银杏叶片多种成分在大鼠体内的同时定量测定, 其结果表明, 相较传统MRM监测模式, 该模式可降低同一时间内的检测通道数量, 并显著延长滞留时间, 较MRM具有更高的灵敏度及重现性, 可实现多种物质的高通量监测[1]。因此, 本研究拟建立DMRM模式下的茵栀黄组分的高通量监测方法, 在此基础上进行其药效物质筛选工作。大量研究发现, 中药虽然成分极为复杂, 但只有吸收入血的成分才能发挥药效。因此, 进行机体服用中药后的血清药物成分分析, 确定其体内的作用物质, 将成为研究中药药效物质基础的有效途径[2]。此外, 现代药理学证实, 中药发挥作用的关键步骤之一是与靶细胞相结合[3], Li等[4]已应用中药孵育靶细胞系的方法捕集出药效物质组分, 并应用LC-MS/MS成功鉴定出其中的关键成分。由此, 课题组提出, 若能用含药血清孵育靶点细胞系, 并从中特异性捕集血清中与细胞结合的物质, 将直接提取出中药从吸收入血到进入治疗靶点的潜在药效物质, 从而能够高通量筛选出其中的关键成分。
由于茵栀黄退黄作用靶点在肝脏, 而肝脏内胆红素处置障碍是导致黄疸的主要原因[5], 因此, 若能建立人源性高胆红素细胞模型, 在此基础上验证茵栀黄药效, 将为茵栀黄组分的细胞疗效提供关键证据。最近已有应用胆红素孵育血管内皮细胞[6]、脱落乳牙牙髓干细胞[7]等人源性细胞系以增加细胞内胆红素含量的报道, 由此, 课题组提出研究如下:用胆红素孵育人源性肝脏HepRG细胞, 建立高胆红素肝脏细胞模型, 进行细胞水平的退黄作用评价; 用此细胞模型特异性捕集大鼠给予茵栀黄注射液后的含药血清中药效成分, 应用LC-MS/MS的DMRM技术高通量筛选出茵栀黄注射液发挥退黄作用的潜在药效物质。
材料与方法仪器 Agilent 1260高效液相色谱仪(G1322A在线脱气机、G1312C二元高压泵、G1329B自动进样器、G1316A柱温箱)、Agilent 6460三重四级杆质谱仪(美国安捷伦公司); Masshunte B.04.00分析操作软件、SHZ-Ⅲ型循环真空水泵(上海亚荣生化仪器厂); 高速离心机(深圳国华仪器厂); XW-80A漩涡混合器(上海医科大学仪器厂); LT-224S电子天平(北京赛多利斯公司)。
药品及试剂 BPMI-1640培养基、胎牛血清(美国Hyclone公司); 青霉素-链霉素混合液(美国Gibco公司); 丙磺舒(大连美仑生物技术有限公司)。胆红素、噻唑蓝(上海麦克林生化科技有限公司); 二甲基亚砜(美国MP Biomedicals公司)。茵陈提取物(批号: 13120005)、栀子提取物(批号: T1309057)、黄芩提取物(批号: TL130662-6)、金银花提取物(TL1310012-4)均购自广东一方制药有限公司。京尼平1-β-龙胆双糖苷、京尼平苷、蓟黄素、鼠李黄素、D-焦谷氨酸、L-焦谷氨酸、山栀苷B、鸡矢藤次苷甲酯、去乙酰车叶草苷酸甲酯、滨蒿内酯、异槲皮素、黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、绿原酸、绿原酸甲酯、异绿原酸、咖啡酸、茵陈色原酮、木犀草素-7-O-葡萄糖苷、白花败酱醇甙、6, 7-二羟基香豆素、京尼平酸、木犀草素均购自南京泽朗生物科技有限公司, 纯度均≥98.0%。色谱纯级甲醇、乙腈购自山东禹王实业公司禹城化工厂, 其他试剂均为国产分析纯, 去离子水为兰州大学第一医院自制。
HepaRG细胞株及动物 人源肝癌HepaRG细胞株购自美国Merck Millipore公司。雄性Wistar大鼠(200±20) g, 5~7周龄, 购自兰州大学动物实验中心, 动物许可证号: SCYK (甘) 2009-0004。本研究遵守兰州大学第一医院伦理委员会规程。
细胞培养及传代 购得HepaRG细胞株经复苏后用含10%胎牛血清及1%双抗(青霉素-链霉素混合液)的RPMI-1640完全培养基, 置37 ℃、5% CO2、95%湿度的恒温培养箱中培养。细胞每2~3天更换新鲜培养基, 当细胞密度达到80%~90%时, 用0.25%胰蛋白酶消化, 按1: 4的比例传代, 均取对数生长期细胞进行实验。
MTT实验 通过MTT实验考察胆红素对HepaRG细胞的毒性。取对数生长期的HepaRG细胞, 以每孔2×104个接种于96孔板中, 待细胞贴壁后, 将质量浓度为0、50、100、200、400 μg·mL-1胆红素分别按每孔200 μL加入96孔板, 对照组加入等体积的新鲜培养基。在培养箱中分别培养24和48 h后, 每孔加入MTT 20 μL, 继续培养4 h, 1 000 r·min-1离心5 min后弃去上清液, 每孔加入200 μL DMSO, 震摇10 min, 确保甲臜结晶完全溶解, 用酶标仪在490 nm波长处测定吸光度值(A), 并计算细胞的存活率。实验同时测定了胆红素溶剂DMSO (DMSO:培养基 = 1:20)对细胞存活率的影响。细胞存活率计算公式如下:细胞存活率(%) = (A样品组/A对照组)×100%。
胆红素干预浓度及时间筛选 取对数生长期的HepaRG细胞, 以每孔2×106个接种到6孔板中, 培养24 h, 待细胞贴壁后进行实验。根据MTT实验结果将胆红素质量浓度设定为0、20、40、60、80、100 μg·mL-1, 每个浓度3个复孔, 对照组加相同体积的完全培养基。按每孔2 mL向6孔板中分别加入上述浓度的含胆红素的培养基。避光条件下培养24 h后, 测定细胞内总胆红素(total bilirubin, TBIL)和间接胆红素(indirect bilirubin, IBIL)浓度。用胰酶消化6孔板中的细胞, 1 000 r·min-1离心5 min, 弃去上清, PBS清洗3次, 按每孔300 μL加入DMSO-纯化水混合溶液(DMSO:水 = 1:1), 用超声破碎仪破碎细胞(每次20 s, 6次), 3 000 r·min-1离心5 min, 取上清用全自动生化检测仪测定TBIL和IBIL含量。
取对数生长期的HepaRG细胞, 以每孔2×106个接种到6孔板中, 培养24 h, 用40 μg·mL-1胆红素分别干预12、24、48 h, 每个时间点3个复孔, 对照组为正常培养的HepaRG细胞。实验结束后测定细胞内TBIL和IBIL含量。
高胆红素细胞模型优化 取对数生长期HepaRG细胞, 以每孔2×106个接种到6孔板中, 分为丙磺舒组、培养基组及模型对照组。丙磺舒组及培养基组均先用40 μg·mL-1胆红素及50 μg·mL-1丙磺舒共同避光孵育HepaRG细胞12 h后, 丙磺舒组更换为丙磺舒培养基, 而培养基组更换为基础培养基, 再分别培养48 h, 移除培养基, PBS清洗3次, 弃去PBS, 收集细胞并破碎。模型对照组用40 μg·mL-1胆红素干预12 h后, 同上所述收集细胞并破碎。三组细胞破碎液均进行TBIL、IBIL含量测定。
茵栀黄注射液退黄作用研究 实验分为对照组、高胆红素组、茵栀黄组、苯巴比妥(阳性对照)组, 每组均设3个复孔。各组具体干预如下:对照组:正常培养基孵育细胞12 h; 丙磺舒组: 40 μg·mL-1胆红素和50 μg·mL-1丙磺舒孵育细胞12 h, 更换含50 μg·mL-1丙磺舒孵育24 h; 茵栀黄组: 40 μg·mL-1胆红素和50 μg·mL-1丙磺舒孵育细胞12 h, 更换含720 μg·mL-1茵栀黄注射液[7]及50 μg·mL-1丙磺舒的培养基孵育24 h; 苯巴比妥组: 40 μg·mL-1胆红素和50 μg·mL-1丙磺舒孵育细胞12 h, 更换含400 μg·mL-1苯巴比妥和50 μg·mL-1丙磺舒的培养基孵育24 h。各组孵育结束后, 移除培养基, PBS清洗3次, 弃去PBS, 收集细胞, 超声破碎, 测定细胞内TBIL、IBIL及细胞外液直接胆红素(direct bilirubin, DBIL)含量。
茵栀黄潜在药效物质筛选
色谱质谱条件 检测条件如下:色谱柱: Agilent HC-C18 column (4.6 mm×250 mm, 5 μm); 保护柱: Agilent Zorbax耐高压保护柱(4.6 mm×12.5 mm, 5 μm); 流动相:甲醇(B)-水(A)梯度洗脱, 流速为1.0 mL·min-1 (柱后分流比为1:4);柱温: 30 ℃; 进样量20 μL。正离子监测模式洗脱梯度为: 0~20 min, 10%~20% B; 20~24 min, 20% B; 24~30 min, 20%~95% B; 30~42 min, 95% B; 42.01~48 min, 10% B平衡色谱柱。负离子监测模式洗脱梯度为: 0~15 min, 20%~90% B; 15~24 min, 90% B; 24.01~30 min, 20% B平衡色谱柱。质谱监测:离子源为电喷雾离子源; 毛细管电压4 000 V (正离子监测)及3 500 V (负离子监测); 干燥气温度350 ℃; 干燥气流速9 L·min-1; 雾化气压力2.75×105 Pa; 检测方式为动态多反应监测模式(DMRM)。
茵栀黄含药血清制备 为大鼠灌胃给予临床等效剂量茵栀黄注射液(1 mL·kg-1, bid) 7天, 于末次给药30 min后乙醚麻醉, 腹主动脉采血, 收集于肝素处理过的离心管中, 14 000 r·min-1离心5 min, 吸取血浆-80 ℃冻存。
茵栀黄含药血清干预高胆红素细胞模型 40 μg·mL-1胆红素和50 μg·mL-1丙磺舒孵育细胞12 h, 更换茵栀黄含药血清及50 μg·mL-1丙磺舒的培养基孵育1、2、4、8、12 h, 预冷PBS清洗3次, 收集细胞, 加200 μL生理盐水, 超声破碎, 14 000 r·min-1离心5 min, 取上清液应用LC-MS/MS分析。
统计学方法 采用SPSS18.0 (美国SPSS Inc.公司)中t检验法比较细胞实验组间数据差异, 显著性判断标准为P < 0.05。细胞实验结果以平均值±标准差(x±s)表示。
结果 1 高胆红素HepaRG细胞系模型 1.1 胆红素细胞毒性考察本研究用0、25、50、100、200、400 μg·mL-1胆红素干预HepaRG细胞, 考察细胞存活率。结果如图 1所示, 0~100 μg·mL-1胆红素干预细胞24 h后, 对其生长无明显抑制作用; 而200~400 μg·mL-1胆红素干预24 h、100~400 μg·mL-1胆红素干预48 h后, 其细胞死亡率均明显升高。因此, 本研究拟用0~100 μg·mL-1胆红素孵育HepaRG细胞株24 h, 从中筛选高胆红素细胞模型的合适剂量。
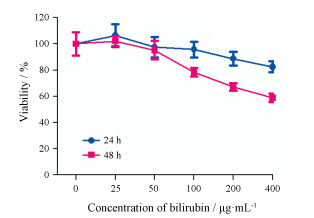
|
Figure 1 Cell viability of HepaRG cell incubated with different concentration of bilirubin for 24 and 48 h. n = 3, x ± s |
TBIL及IBIL在肝细胞中的蓄积是形成黄疸的关键因素。根据胆红素细胞毒性的结果, 实验选取0、20、40、60、80、100 μg·mL-1胆红素干预HepaRG细胞24 h, 测定细胞内TBIL和IBIL浓度。结果如图 2所示, 0~40 μg·mL-1胆红素干预细胞后, 细胞内TBIL浓度与胆红素干预浓度的增加呈正相关, 而当胆红素质量浓度在40~100 μg·mL-1时, 细胞内TBIL浓度不再随胆红素浓度发生变化, 即胆红素质量浓度在40 μg·mL-1时, 细胞对TBIL摄取、代谢及外排达到饱和, IBIL实验结果与TBIL相似。因此, 本研究选取40 μg·mL-1作为高胆红素细胞模型的造模剂量。
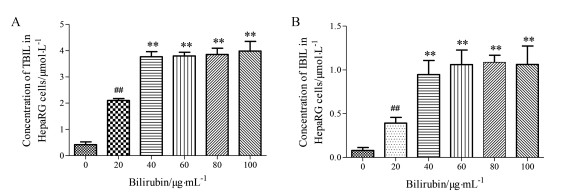
|
Figure 2 Concentration of total bilirubin (TBIL, A) and indirect bilirubin (IBIL, B) in HepaRG cells incubated with different concentrations of bilirubin for 24 h. n = 3, x±s. ##P < 0.01 vs control group; **P < 0.01 vs 20 μg·mL-1 group |
用40 μg·mL-1胆红素分别干预细胞12、24、48 h后考察细胞内TBIL及IBIL含量变化, 结果如图 3所示。随着干预时间的延长, 细胞内TBIL、IBIL含量均呈现下降趋势。胆红素干预细胞12 h后细胞内TBIL和IBIL含量最高。因此, 本研究选用40 μg·mL-1胆红素干预HepaRG细胞12 h, 制得高胆红素HepaRG细胞株模型。

|
Figure 3 Concentration of TBIL (A) and IBIL (B) in HepaRG cells. Control: cell incubation with normal culture medium. 12, 24 and 48 h: cell incubation with 40 μg·mL-1 of bilirubin for 12, 24, 48 h. n = 3, x±s. ##P < 0.01 vs control group; **P < 0.01 vs 12 h group |
丙磺舒为细胞膜转运体多药耐药相关蛋白2 (multiple resistance protein 2, MRP2)的抑制剂, 而MRP2为介导胆红素经细胞外排的关键转运体。经50 μg·mL-1丙磺舒干预后的细胞实验结果如图 4所示, 丙磺舒组细胞内TBIL、IBIL含量在48 h培养后分别比培养基组高50%及40% (P < 0.05), 而与模型对照组中TBIL、IBIL含量近似, 说明丙磺舒组可显著阻断胆红素经MRP2的细胞外排, 从而使高胆红素细胞模型在48 h内更加稳定。
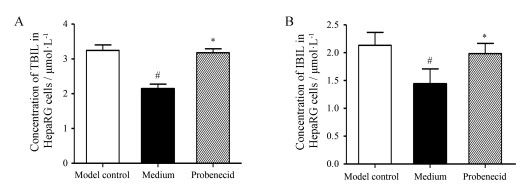
|
Figure 4 Concentration of TBIL (A) and IBIL (B) in HepaRG cells. Model control group: incubated with 40 μg·mL-1 bilirubin for 12 h. Medium group and probenecid group: incubated with 40 μg·mL-1 bilirubin and 50 μg·mL-1 probenecid for 12 h, subsequently incubated with normal medium or 50 μg·mL-1 probenecid for 48 h, respectively. n = 3, x±s. #P < 0.05 vs model control group; *P < 0.05 vs medium group |
综上所述, 本文最终选择胆红素40 μg·mL-1及丙磺舒50 μg·mL-1共同干预HepaRG细胞12 h建立高胆红素细胞模型, 更换培养基后, 采用含丙磺舒50 μg·mL-1的培养基维持48 h内细胞高胆红素状态。
2 茵栀黄提取物退黄作用评价本研究选用720 μg·mL-1茵栀黄孵育丙磺舒组模型24 h后考察茵栀黄提取物退黄作用, 并以临床常用黄疸治疗药物苯巴比妥为阳性对照, 以细胞内TBIL及IBIL及细胞外液DBIL含量作为药效评价指标。结果如图 5所示, 与对照组相比, 丙磺舒组细胞内TBIL升高25.5倍, IBIL升高23.4倍, 细胞外DBIL的含量升高8.6倍, 其升高均有统计学差异(P < 0.01);与丙磺舒组相比, 茵栀黄组细胞内TBIL降低52.4%, IBIL含量降低40%, 降低值均具有统计学差异(P < 0.01), 细胞外DBIL升高2.1倍(P < 0.01), 其趋势与苯巴比妥相似。

|
Figure 5 Concentration of TBIL (A), IBIL (B) in HepaRG cells and direct bilirubin (DBIL, C) in extracellular fluid. Control group: cell incubation with normal culture medium. Probenecid group: cell incubation with 40 μg·mL-1 bilirubin and 50 μg·mL-1 probenecid for 12 h, subsequently incubated with probenecid for 24 h. YZH group: cell incubation with 40 μg·mL-1 bilirubin and 50 μg·mL-1 probenecid for 12 h, subsequently incubated with 720 μg·mL-1 Yin-zhi-huang (YZH) injection and 50 μg·mL-1 probenecid for 24 h. Phenobarbital group: cell incubation with 40 μg·mL-1 bilirubin and 50 μg·mL-1 probenecid for 12 h, subsequently incubated with 400 μg·mL-1 phenobarbital and 50 μg·mL-1 probenecid for 24 h. n = 3, x±s. ##P < 0.01 vs control group; **P < 0.01 vs probenecid group |
应用DMRM模式可检测到53种茵栀黄注射液中的药物成分, 其检测条件如表 1所示, 该模式下茵栀黄注射液成分色谱图如图 6所示。
| Table 1 DMRM settings for YZH injection. No., C + The number of the chromatographic peak in DMRM figure (seen as Figure 6). Frag: Fragmentor; CE: Collision energy; a Compounds identified by standard material |
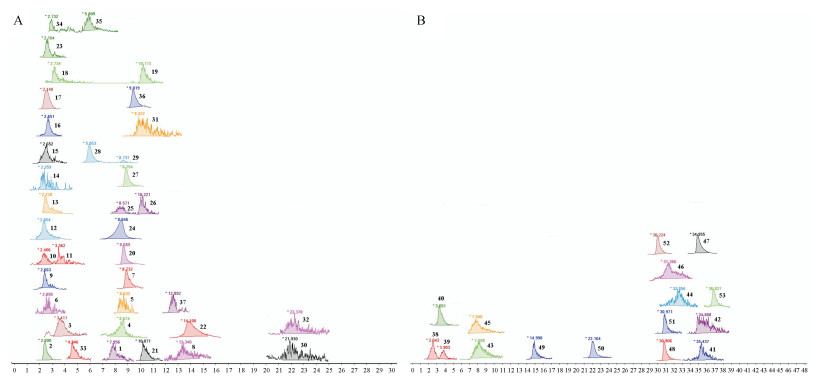
|
Figure 6 DMRM figures for 53 analytes in YZH injection. The length of the baseline of each analyte corresponds to each delta retention time. A: The YZH injection in negative mode; B: The YZH injection in positive mode |
在建立茵栀黄注射液DMRM分析方法后, 课题组用茵栀黄含药血清孵育HepaRG细胞系, 实验结果显示孵育4 h测得药物成分含量最高, 可测到其中7种单体成分。由结果可见, 3种成分可通过标准品确定其结构, 并可准确测定其在茵栀黄注射液及含药血清孵育后的细胞中的含量(表 2); 另外4种成分通过其母离子、碎片离子信息, 参照文献报道获得可能归属, 尚需进一步确证其结构(表 3)。其在茵栀黄注射液及含药血清孵育后的细胞中含量用色谱峰的信噪比表示。
| Table 2 The unambiguously identified potential pharmacodynamic substances in HepaRG cells incubated with YZH drug-containing serum |
| Table 3 The tentatively identified potential pharmacodynamic substances in HepaRG cells incubated with YZH drug-containing serum |
黄疸是一种由于体内胆红素异常升高而引发的疾病。胆红素的代谢主要在肝脏中进行, 包括肝细胞对血液中IBIL的摄取、IBIL在细胞中的运输、IBIL向DBIL的转化以及DBIL通过胆汁的外排4个相互关联的生理过程, 而这些生理过程障碍, 使胆红素在肝细胞中大量蓄积, 则会导致胆红素的体内滞留而诱发黄疸[8]。目前对于黄疸的研究多以动物模型为工具[9-11], 由于条件所限, 尚无法对人体黄疸病理状况进行研究。最近已有应用胆红素孵育人源性细胞系以增加细胞内胆红素含量的报道[6,7], 而尚未见应用胆红素孵育人源性肝脏HepaRG细胞模型的研究。为此本研究参考已有文献, 应用外源性胆红素孵育HepaRG细胞, 建立高胆红素细胞模型, 以此模拟人体黄疸病理状态下的细胞内环境, 并对胆红素细胞毒性、造模剂量、孵育时间、模型稳定性几方面进行系统考察。研究表明, 胆红素由肝脏细胞基底膜侧的有机阴离子转运多肽(organic anion transporting polypeptides, OATPs)摄取进入细胞, 在产生代谢转化后被毛细胆管膜侧的MRP2排出[12]。由于丙磺舒是MRP2经典抑制剂[13], 为此课题组提出, 在培养基中加入丙磺舒抑制MRP2功能, 可抑制胆红素的细胞内外排, 使HepaRG细胞内胆红素在一定时间内维持较高水平。本研究结果表明, 在HepaRG细胞培养基中加入50 μg·mL-1丙磺舒后可显著抑制TBIL及IBIL的细胞外排, 使高胆红素细胞模型在48 h内维持稳定状态。因此, 可应用该高胆红素细胞模型中TBIL、IBIL及细胞外液DBIL的含量测定在细胞水平上对黄疸进行评价。多年临床应用证实, 茵栀黄的退黄利胆作用疗效确切, 可显著降低患者血清胆红素水平[14]。课题组前期药效研究也表明, 大鼠在给予茵栀黄注射液后血浆中TBIL、IBIL含量明显下降, 胆汁流速显著提高[15]。由于茵栀黄降低血清胆红素疗效的靶点在肝脏细胞, 因此, 本研究应用茵栀黄孵育高胆红素HepaRG细胞, 对其细胞水平疗效进行初步考察。结果表明, 茵栀黄具有与阳性对照药物苯巴比妥相似的降低细胞内TBIL、IBIL含量并增加细胞外DBIL含量的作用, 证明茵栀黄在细胞水平具有与苯巴比妥类似的退黄作用。
在茵栀黄多组分分析研究中, 课题组首次应用DMRM模式成功建立茵栀黄注射液中53种单体成分的分析方法, 此方法灵敏、快速, 可对复杂基质中的茵栀黄组分进行高通量分析。目前, 应用LC-MS/MS进行定量的方法大多为多反应监测模式(multiple reaction monitoring, MRM)。在对复杂基质中多种成分进行定量分析时, 对检测增加, 则分配给每个检测通道的驻留时间相应减少, 若驻留时间过短, 会造成每个通道上信号采集点丢失, 因此, 其检测灵敏度及重现性会大大降低。而本研究中的DMRM可以解决此问题[16]。DMRM法仅在被分析物保留时间的一定范围内以MRM方式对分析物进行定量, 而在这段时间范围外不会运行此分析物的检测通道。在需要对多个物质进行同时分析时, 这种监测模式可降低检测通道数量, 并显著延长了每个通道驻留时间。课题组研究表明, 相较MRM模式, DMRM可显著提高待测物灵敏度及重现性[1]。课题组应用该方法对细胞捕集到的茵栀黄含药血清成分进行分析, 发现其中的7种HepaRG细胞系结合成分, 即潜在药效物质。其中, 汉黄芩素、D-焦谷氨酸、京尼平龙胆双糖苷已用标准品确证其结构, 而其余4种成分结构尚未确证, 课题组将根据其母离子、碎片离子信息, 参照已有文献推断其可能的归属, 其准确结构尚需进一步研究证实。
综上所述, 本研究以胆红素及丙磺舒干预HepaRG细胞, 建立了可模拟人体黄疸病理状态的稳定高胆红素HepaRG细胞模型, 茵栀黄注射液在此细胞模型中有显著退黄作用, LC-MS/MS检测到的细胞捕集成分即产生退黄作用的潜在药效成分。该方法简单、高效、灵敏、特异, 可为中药药效物质的高通量筛选提供一种新的研究思路。
| [1] | Rao Z, Qin HY, Wei YH, et al. Development of a dynamic multiple reaction monitoring method for determination of digoxin and six active components of Ginkgo biloba leaf extract in rat plasma[J]. J Chromatogr B, 2014, 959: 27–35. DOI:10.1016/j.jchromb.2014.03.028 |
| [2] | Dong W, Hao XJ, Wang CZ, et al. Serum pharmacochemistry of honey-fried Stemona tuberosa Lour. by UHPLC-QTOF/MS and MetaboLynx analysi[J]. Acta Pharm Sin (药学学报), 2016, 51: 1458–1463. |
| [3] | Qi LW, Zhou JL, Hao HP, et al. Biological-chemical profiling of in vitro and in vivo bioactive compounds from traditional Chinese medicines with holistic views[J]. J China Pharm Univ (中国药科大学学报), 2010, 41: 195–202. |
| [4] | Li SL, Li P, Sheng LH, et al. Live cell extraction and HPLC-MS analysis for predicting bioactive components of traditional Chinese medicines[J]. J Pharm Biomed Anal, 2006, 41: 576–581. DOI:10.1016/j.jpba.2006.01.014 |
| [5] | Chen Z, Zhang L, Zeng L, et al. Probiotics supplementation therapy for pathological neonatal jaundice: a systematic review and meta-analysis[J]. Front Pharmacol, 2017, 8: 432. DOI:10.3389/fphar.2017.00432 |
| [6] | Ziberna L, Martelanc M, Franko M, et al. Bilirubin is an endogenous antioxidant in human vascular endotheial cells[J]. Sci Rep, 2016, 6: 29240. DOI:10.1038/srep29240 |
| [7] | Yamaza H, Sonoda S, Nonaka K, et al. Pamidronate decreases bilirubin-impaired cell death and improves dentinogenic dysfunction of stem cells from human deciduous teeth[J]. Stem Cell Res Ther, 2018, 9: 303. DOI:10.1186/s13287-018-1042-7 |
| [8] | Du Y, Li X, Lv X, et al. Highly sensitive and selective sensing of free bilirubin using metal-organic frameworks-based energy transfer processes[J]. ACS Appl Mater Interfaces, 2017, 9: 30925–30932. DOI:10.1021/acsami.7b09091 |
| [9] | Yan J, Xie G, Liang C, et al. Herbal medicine Yinchenhaotang protects against α-naphthylisothiocyanate-induced cholestasis in rats[J]. Sci Rep, 2017, 7: 4211. DOI:10.1038/s41598-017-04536-5 |
| [10] | Dilektasi E, Ozmen NM, Gundogdu E, et al. The effects of obstructive jaundice on the brain: an experimental study[J]. Asian J Surg, 2016, 39: 155–163. DOI:10.1016/j.asjsur.2015.03.014 |
| [11] | Turk O, Badak B, Ates E, et al. The role of growth factors on hepatic damage in rats with obstructive jaundice[J]. Springer Plus, 2016, 5: 1274. DOI:10.1186/s40064-016-2919-5 |
| [12] | Keppler D. The roles of MRP2, MRP3, OATP1B1 and OATP1B3 in conjugated hyperbilirubinemia[J]. Drug Metab Dispos, 2014, 42: 561–565. DOI:10.1124/dmd.113.055772 |
| [13] | Liu ZH, Liu KX. The transporters of intestinal tract and their study methods[J]. Acta Pharm Sin (药学学报), 2011, 46: 370–376. |
| [14] | Wu RH, Feng S, Han M, et al. Yinzhihuang oral liquid combined with phototherapy for neonatal jaundice: a systematic review and meta-analysis of randomized clinical trials[J]. BMC Complement Altern Med, 2018, 18: 228. DOI:10.1186/s12906-018-2290-x |
| [15] | Zhang GQ, Zhou Y, Rao Z, et al. Effect of Yin-Zhi-Huang on up-regulation of Oatp2, Ntcp, and Mrp2 proteins in estrogen-induced rat cholestasis[J]. Pharma Biol, 2015, 53: 319–325. DOI:10.3109/13880209.2014.918156 |
| [16] | Rao Z, Zhang F, Zhang XY, et al. Multicomponent determination of traditional Chinese medicine preparation yin-zhi-huang injection by LC-MS/MS for screening of its potential bioactive candidates using HepaRG cells[J]. Biomed Chromatogr, 2018. DOI:10.1002/bmc.4057 |
 2019, Vol. 54
2019, Vol. 54


