脑卒中是临床上危害中老年健康与生命的常见脑血管疾病, 具有高致病率、高死亡率的特点, 严重危害公共健康, 其中缺血性脑卒中占据了很大比例[1-4]。研究表明, 在脑缺血发生时脑内释放大量谷氨酸, 导致神经元N-甲基-D-天门冬氨酸受体(N-methyl-D-aspartic acid receptor, NMDAR)持续激活, 进而促进nNOS-PSD-95复合物的形成。复合物形成及其介导的异常下游信号是造成神经元损伤甚至死亡的重要因素之一[5-10]。
nNOS和PSD-95相互作用是通过非经典的PDZ-PDZ结构域所介导, 即nNOS的PDZ结构域延伸出的β-折叠被PSD-95的PDZ1或PDZ2结构域的多肽结合口袋所识别, 其中位于nNOS β-折叠区域的62位天冬氨酸(aspartic acid, Asp)与位于nNOS-PDZ区域的121位精氨酸(arginine, Arg)构成的盐桥是nNOS-PSD-95形成的重要因素; ZL006的设计思路正是通过ZL006上的羧基与Arg121结合, 破坏Arg121-Asp62盐桥, 进而阻断nNOS和PSD-95相互作用[11]。由于ZL006亲脂性较差, 不易透过血脑屏障, 开发成药较为困难[12], 而天然植物中化合物含量丰富, 所以从中筛选ZL006类似物用于缺血性脑卒中治疗具有一定的研究意义。
目前常用的以nNOS和PSD-95相互作用为靶点的抗脑卒中药物筛选模型主要有神经元模型和动脉栓塞模型[13-15], 但是这两种模型的操作过程复杂, 在高通量筛选过程中不具有优势, 并且荧光能量共振转移[16]、等温滴定量热法[17]等测定蛋白相互作用的方法对仪器有较高的依赖。谷胱甘肽巯基转移酶(glutathione S-transferase, GST) pulldown和免疫共沉淀(co-immunoprecipitation, Co-IP)实验同样是研究蛋白质相互作用行之有效的检测方法, 本研究结合GST-pulldown和Co-IP的基本原理, 利用真核蛋白质表达体系, 通过共孵育方式获取nNOS-PSD-95复合物, 再给予解耦联剂ZL006或候选化合物, 构建无细胞体外筛选模型, 用于nNOS-PSD-95解耦联化合物的筛选。
材料与方法 材料Lipo6000转染试剂、RIPA中效裂解液购自碧云天生物技术有限公司; UNlQ-500柱式质粒DNA大量抽提试剂盒、考马斯亮蓝G-250、小鼠抗Flag抗体购自上海生工生物工程有限公司; GST亲和层析介质、高亲和Ni-NTA纯化介质购自南京金斯瑞生物科技有限公司; Protein A/G免疫沉淀磁珠购自南京福麦斯生物技术有限公司; 含有pCDH-Flag-nNOS、pcDNA3.1-PSD-95、pcDNA3.1-(His)6-nNOS1-133质粒、pGEX-4T-1-nNOS1-133质粒和PSD-95-PDZ2-GFP质粒的大肠杆菌菌种为本实验室保存; HEK-293T细胞株购自上海中国科学院细胞所; 兔抗PSD-95 (D27E11) XP®、鼠抗His-Tag (27E8)抗体购自美国Cell Signal Technology公司; 双抗、高糖DMEM培养基购自上海源培生物技术有限公司; ECL发光液购自上海天能科技有限公司; HRP标记山羊抗小鼠、兔抗体购自杭州联科生物。0.22 μm硝酸纤维素膜购自颇尔公司。戊二醛购自美国Sigma-Aldrich公司。其他试剂分别为国产及进口分析纯或以上级别试剂。
乳糖诱导GST-nNOS1-133、PSD-95-PDZ2-GFP重组蛋白的表达及提取含有pGEX-4T-1-nNOS1-133质粒和含有PSD-95-PDZ2-GFP质粒的大肠杆菌甘油菌按1:1 000加入到5 mL含有50 μg·mL-1氨苄青霉素的LB液体培养基中, 于37 ℃摇床中180 r·min-1摇菌过夜。次日将菌液按1:100加入到300 mL含有50 μg·mL-1氨苄青霉素的LB液体培养基中继续培养2.5 h, 加入乳糖诱导剂(终浓度为5 mmol·L-1), 进行蛋白诱导表达。5 h后GST-nNOS1-133重组蛋白表达进入平台期, 1 500 r·min-1离心收集细菌, 每10 g菌体重悬于100 mL菌体裂解缓冲液[(50 mmol·L-1 Tris-HCl, pH 8.0, 60 μg·mL-1溶菌酶, 0.5% Triton X-100, 10 U·mL-1 DNA酶Ⅰ, 1 mmol·L-1苯甲基磺酰氟(PMSF)]中, 反复冻融2次。4 ℃下12 000 r·min-1离心10 min, 收集上清用于后续实验。
真核细胞培养、质粒转染及Flag-nNOS、PSD-95、(His)6-nNOS1-133蛋白的提取HEK-293T细胞常规培养采用含有1%青霉素和链霉素及10%胎牛血清的DMEM培养基, 置于37 ℃恒温孵箱中, 通入含有5% CO2和95% O2的混合气。待细胞于10 cm大皿中汇合度达到70%~80%时, 利用Lipo6000转染试剂将pCDH-Flag-nNOS、pcDNA3.1-PSD-95、(His)6-nNOS1-133质粒分别转染到HEK-293T细胞中, 6 h后更换新鲜培养基。24 h后取出培养皿, 弃尽培养基, 用预冷的PBS清洗3次, 细胞刮刮下细胞, 加入3 mL RIPA裂解液重悬细胞沉淀, 置冰上裂解30 min, 12 000 r·min-1、4 ℃离心10 min后收集富含重组蛋白的上清, 用于后续实验。
GST-pulldown取120 μL谷胱甘肽树脂混悬液, 用预冷PBS清洗3遍, 与6 mL GST-nNOS1-133细菌裂解液于4 ℃颠倒混合孵育6 h, 弃上清, 加入3 mL PSD-95-PDZ2-GFP细菌裂解液于4 ℃颠倒混合孵育过夜。次日, 弃上清, 用预冷PBS清洗3遍树脂后, 均分至4个1.5 mL EP管中, 弃尽上清, 200 μL预冷PBS重悬树脂, 分别加入ZL006, 使之终浓度分别为30、60、90 μmol·L-1, 4 ℃颠倒混合孵育8 h。
考马斯亮蓝染色上述孵育8 h的树脂, 于4 ℃下4 000 r·min-1离心3 min, 小心移取190 μL上清至干净EP管中, 加入50 μL 5×蛋白上样缓冲液, 涡旋仪上涡旋30 s后100 ℃煮沸10 min, 使蛋白质充分变性, 然后进行SDS-PAGE电泳, 电泳结束后用考马斯亮蓝染液染色过夜, 次日脱色液脱色后, 拍照。
(His)6-nNOS1-133蛋白的镍柱纯化及体外解耦联实验取(His)6-nNOS1-133蛋白1 mL与清洗后的120 μL高亲和Ni-NTA纯化介质共孵育6 h后, 4 000 r·min-1离心, 弃上清, 预冷PBS清洗树脂3遍, 1 mL PBS重悬树脂, 均分至4个1.5 mL EP管中, 4 000 r·min-1离心, 弃尽上清, 200 μL预冷PBS重悬树脂, 分别加入ZL006, 使之终浓度分别为30、60、90 μmol·L-1, 4 ℃颠倒混合孵育过夜。次日, 4 000 r·min-1离心, 弃上清, 耦联树脂用预冷PBS清洗3遍, 用1×蛋白上样缓冲液洗脱蛋白, 用于蛋白分子免疫印迹实验。
基于Co-IP原理的体外解耦联实验按1:50将Flag抗体与Flag-nNOS蛋白溶液混合(总体积200 μL), 4 ℃颠倒混合1 h, 加入200 μL免疫磁珠共孵, 4 ℃颠倒混合孵育过夜。预冷PBS清洗磁珠3遍, 加入200 μL PSD-95蛋白溶液, 4 ℃颠倒混合孵育8 h, 弃上清, 预冷PBS清洗磁珠3遍, 然后将免疫磁珠复合物均分到4个1.5 mL低吸附离心管中, 200 μL PBS重悬磁珠, 加入ZL006, 使之终浓度分别为30、60、90 μmol·L-1, 4 ℃颠倒混合孵育过夜。
蛋白质免疫印迹孵育过夜的磁珠, 弃去上清, 预冷PBS清洗3遍, 加入40 μL甘氨酸溶液(100 mmol-1, pH=2.3)洗脱, 立即加入4 μL Tris溶液(1 mol·L-1, pH=8.0)中和, 移取上清, 加入10 μL 5×蛋白上样缓冲液, 涡旋仪上涡旋30 s后100 ℃煮沸10 min, 使蛋白质充分变性, 进行SDS-PAGE分离后, 转膜, 5%脱脂奶粉室温封闭2 h, 抗nNOS抗体(1:500)和抗PSD-95抗体(1:500) 4 ℃孵育过夜, PBST缓冲液洗膜5次, 加入HRP标记山羊抗小鼠抗体(1:500) 37 ℃孵育2 h, PBST缓冲液洗膜5次, ECL化学发光法显影。
Flag标签纯化磁珠的制备与保存戊二醛是一种常用的同型双功能交联剂, 它的两个醛基可通过形成Schiff碱将HRP与抗体以五碳桥连接起来[18]。本研究将Flag抗体与10%磁珠混悬液按照1:50的比例于4 ℃孵育8 h, 使Flag抗体饱和磁珠上抗体结合位点, 随后将2.5%戊二醛分10次加入饱和了Flag抗体的磁珠混悬液中, 每次10 μL, 整个过程持续2 h, 之后将磁珠转移至pH=8.0的Tris-HCl缓冲盐中中和30 min, 预冷PBS洗涤3次, 每次5 min, 短期保存在PBS溶液中, 长期保存置于20%乙醇溶液中。
数据处理所有实验重复3次以上, 蛋白质免疫印迹采用Image J进行数据收集, 数据分析采用Student's t test。
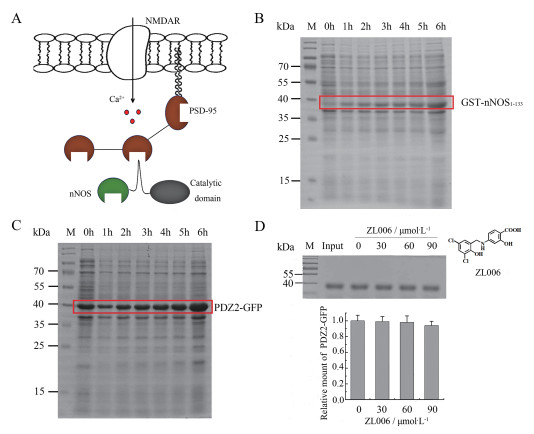
结果 1 以nNOS和PSD-95结构域相互作用为靶标的筛选模型研究表明, nNOS的N端133个氨基酸和PSD-95的PDZ2被认为是nNOS与PSD-95结合的位点[19-21] (图 1A), 由于nNOS和PSD-95均为较长的真核蛋白, 因此在本研究初始阶段拟采用原核表达的GST-nNOS1-133和PSD-95结构域片段蛋白PDZ2-GFP作为研究对象, 利用GST-pulldown技术建立解耦联剂筛选模型。图 1B和C表明已成功表达了GST-nNOS1-133和PDZ2-GFP重组蛋白, 因为重组蛋白GST-nNOS1-133 (约43 kDa)与GFP-PDZ2 (约45 kDa)分子质量接近, SDS-PAGE电泳很难将两者分开, 所以本研究通过考察解耦联后上清中游离PDZ2-GFP蛋白的量来评价解耦联效率, 图 1D为在ZL006干扰下, 不能与GST-nNOS1-133结合的上清中游离的PDZ2-GFP蛋白量。结果显示GST-nNOS1-133和PDZ2-GFP间存在蛋白质相互作用, 但是加入不同浓度的ZL006并不能有效地阻断GST-nNOS1-133和PDZ2-GFP的耦联。
|
Figure 1 Establishment of screen model targeting the domain interaction between nNOS and PSD-95. A: Mechanism of the interaction between nNOS and PSD-95; B: Induced expression of GST-nNOS1-133 in BL21(DE3) containing pGEX-4T-1-nNOS1-133; C: Induced expression of PSD-95-PDZ2-GFP in BL21(DE3) containing pET-28a-PSD-95-PDZ2-GFP; D: Uncoupling efficiency of ZL006 in the protein interaction model of GST-nNOS1-133-PDZ2-GFP. n = 3, x ± s. nNOS: Neuronal nitric oxide synthase; PSD-95: Postsynaptic density protein-95 |
在排除实验操作可能造成的偏差后, 考虑是否因为GST标签(26 kDa)较大, 导致nNOS1-133结构域的形成发生差异, 失去ZL006结合位点, 使得ZL006不能发挥解耦联效果。而组氨酸(His)标签仅有6个氨基酸组成, 影响较小, 因此本研究尝试使用组氨酸标签来作为融合蛋白。
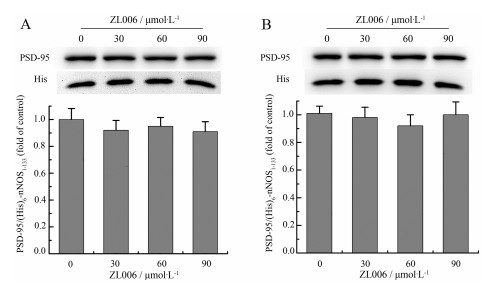
2 HEK-293T共表达(His)6-nNOS1-133和PSD-95的体外细胞筛选模型在后续实验中, 将GST标签更换为较小的His标签, 同时为了避免原核表达蛋白折叠方式与真核表达蛋白可能存在的差异, 利用真核细胞表达的(His)6-nNOS1-133进行模型建立。由于HEK-293T中基本没有nNOS的表达而存在PSD-95的表达, 因此本研究利用转染方式将(His)6-nNOS1-133质粒转入HEK-293T细胞中过表达, 并提取总蛋白, 采用镍柱纯化(His)6-nNOS1-133的同时将PSD-95捕捉到镍柱上。随后给予不同浓度的ZL006处理转染细胞12 h, 但是仍然无法阻断(His)6-nNOS1-133和PSD-95的相互作用(图 2A)。
|
Figure 2 Uncoupling efficiency of ZL006 targeting interaction of (His)6-nNOS1-133 and PSD-95. A: Uncoupling efficiency of ZL006 in HEK-293T which co-expresses (His)6-nNOS1-133 and PSD-95; B: Uncoupling efficiency of ZL006 in protein interaction model of eukaryotic expressed (His)6-nNOS1-133 and PSD-95. n = 3, x ± s |
猜测是否为细胞代谢等过程影响了ZL006的解耦联作用, 因此本研究在细胞裂解液中直接加入不同浓度的ZL006体外处理8 h, 随后用镍柱分离(His)6-nNOS1-133, 结果显示各组中(His)6-nNOS1-133和PSD-95的耦联率仍没有显著性差异(图 2B)。
3 基于全长nNOS和全长PSD-95相互作用的体外筛选模型的建立以上两种体外模型的失败使得课题组猜测, 仅仅表达nNOS与PSD-95相互作用相关的结构域虽然保留了相互作用的能力, 但可能会影响ZL006的结合位点。Bach等[22]也提出nNOS与PSD-95的相互作用虽然基于nNOS的N端片段及PSD-95的PDZ2结构域, 但是可能需要两个蛋白完整结构的共同参与, 因此本研究尝试采用真核表达的全长nNOS和全长PSD-95进行模型的建立。
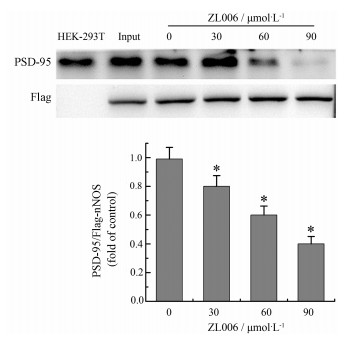
Co-IP结果表明, 在HEK-293T细胞中Flag-nNOS能与内源性PSD-95发生蛋白质相互作用, 且ZL006能够浓度依赖地解开两者的耦联(图 3), 说明ZL006能阻断全长nNOS和全长PSD-95间的相互作用, 也进一步佐证了结果1、2中两种体外模型失败的原因。
|
Figure 3 Uncoupling efficiency of ZL006 in HEK-293T which co-expresses nNOS and PSD-95. n = 3, x ± s. *P < 0.05 vs control |
由于在对候选化合物进行筛选过程中细胞持续培养和过表达较为繁琐, 并且存在扩大培养需要与候选化合物检测相配合的问题, 因此本研究尝试建立不直接依赖于真核细胞的筛选体系。通过转染, 在HEK-293T细胞中分别过表达Flag-nNOS和PSD-95, 将细胞裂解后分别获得富含Flag-nNOS和PSD-95的蛋白质溶液, 通过体外共孵育方式, 获得耦联复合物。采用戊二醛化学耦联法将Flag抗体耦联在Protein A/G磁珠上, 进而实现磁珠的重复使用。
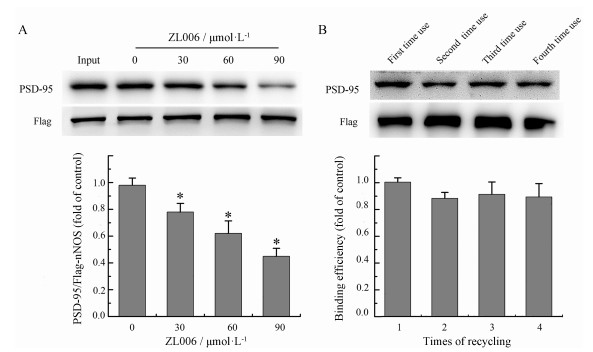
结果表明, 戊二醛耦联Flag抗体后的磁珠能够很好地识别Flag-nNOS-PSD-95复合物, 并且ZL006在一定浓度范围内能够浓度依赖地阻断nNOS和PSD-95相互作用(图 4A)。Flag标签纯化磁珠在经过pH 8.0 Tris-HCl中和、PBS清洗后, 再次用于实验, 仍然能结合Flag-nNOS, 并且过饱和结合量与回收前相近, 经过四次使用后仍具有较高的结合率(图 4B)。
|
Figure 4 Improvement of screen model. A: Uncoupling efficiency of ZL006 targeting interaction of full-length nNOS and full-length PSD-95 in vitro; B: The binding efficiency of antibody magnetic beads during recycling. n = 3, x ± s. *P < 0.05 vs control |
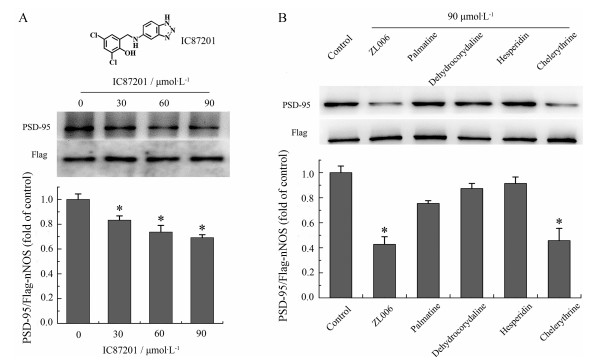
IC87201为ZL006的结构类似物, 已有文献[23, 24]报道, 其通过阻断nNOS和PSD-95的相互作用发挥神经保护作用。结果如图 5A所示, 在本研究建立的模型中, IC87201也能发挥类似ZL006的解耦联作用, 进一步佐证了模型的相对专一性。并且本实验室采用分子印迹法从中药中筛选出了4个与ZL006结构相似的化合物, 分别为巴马亭(palmatine)、脱氢紫堇碱(dehydrocorydaline)、橙皮苷(hesperidin)、白屈菜红碱(chelerythrine)。根据ZL006解耦联的浓度依赖性, 将4个化合物的工作浓度设为90 μmol·L-1进行解耦联活性评价, 结果显示白屈菜红碱具有较好的解耦联效率(图 5B)。
|
Figure 5 Uncoupling ability of IC87201 and candidate compounds. A: Uncoupling efficiency assay of IC87201. B: Uncoupling efficiency assay of candidate analogs of ZL006. n = 3, x ± s. *P < 0.05 vs control |
以上结果表明, 该模型能用于nNOS-PSD-95解耦联剂的筛选。
讨论nNOS和PSD-95的相互作用在脑卒中的发生发展中扮演着重要角色, 自发现以来, 就受到科研工作者的重视。研究表明, 干扰nNOS和PSD-95的相互作用能够很好地改善脑卒中引起的神经损伤, 并且不会因为影响两蛋白的正常生理功能而产生不良反应[25], 因此研究者将目光转向新型小分子解耦联化合物, 如IC87201[23, 24]、ZL006[11, 26]。但两种药物具有亲水性较大, 不易透过血脑屏障的缺点, 需要通过结构改造或寻找其他化合物等方法获得具有临床意义的解耦联化合物。
蛋白质的结构域是研究蛋白质相互作用的重要位点, 并且全长蛋白质不同结构域之间存在着相互影响, 而片段化后的结构域则缺少这种影响。因此, 结果1和2中模型的失败可能由于ZL006的结合位点虽然位于nNOS的PDZ结构域, 但是在缺少其他结构域的情况下不能很好地暴露或形成; 也有可能ZL006的结合位点在PDZ结构域以外, 通过变构效应影响PDZ结构域的构象, 从而影响了nNOS和PSD-95的相互作用。由于现阶段缺少完整nNOS的晶体结构数据或核磁的结构数据, 难以确定ZL006的结合模式, 还需要结合更多的结构生物学结果才能更好地解释ZL006的作用机制及研究候选化合物的干预机制。
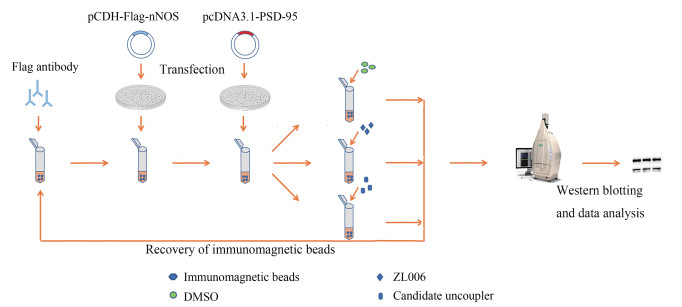
本研究基于nNOS和PSD-95相互作用建立解耦联剂筛选体系(图 6), 初始设计思路是以经典的GST-pulldown实验为基础, 希望通过GST-nNOS1-133与固相介质结合, 考察解耦联剂对GST-nNOS1-133-PDZ2-GFP复合物的解耦联效率, 但后续由于蛋白结构域完整性、大蛋白原核表达构象改变等原因, 本研究采用了与Co-IP相似的实验方案, 即通过结合在免疫磁珠上的抗体识别Flag-nNOS, 进而识别PSD-95, 获得体外耦联复合物, 再检测耦联剂共孵育后的解耦联效率。最后采用化学耦联的方法将抗体固化在磁珠上, 因此实验原理更接近于pulldown。
|
Figure 6 Schematic representation of the screening model. The nNOS-PSD-95 complex were formed by co-incubation in vivo, then ZL006 candidate uncouplers were added to disturb the interaction, and Western blotting technology was used to evaluate the uncoupling efficiency |
在实验中, 为了减少批次间的差异, 应在实验开始前大批量过表达nNOS和PSD-95蛋白, 对每一批次蛋白溶液进行蛋白定量; 通过控制nNOS与PSD-95比例以及免疫磁珠的使用量, 使nNOS-PSD-95的结合量接近于生理条件或病理条件, 从而更好地评价解耦联效果; 在每次筛选过程中, 应加入ZL006作为阳性解耦联剂, 有利于评价解耦联体系的稳定性。另外, 采用戊二醛耦联法获得的抗体耦联免疫磁珠重复利用率较高, 相较于传统的免疫共沉淀、神经元细胞模型和MACO模型, 具有省时、经济的特点。
本研究建立了nNOS-PSD-95解耦联剂筛选模型, 有助于从天然植物中初步筛选nNOS-PSD-95潜在解耦联剂, 也有助于降低成本、增加候选化合物的检出, 为后续动物实验的再次验证提供了理论和实验基础。
| [1] | Mendis S, Davis S, Norrving B. Organizational update:the world health organization global status report on noncommunicable diseases 2014; one more landmark step in the combat against stroke and vascular disease[J]. Stroke, 2015, 46: 121–122. DOI:10.1161/STROKEAHA.115.008097 |
| [2] | Flynn RW, Macwalter RS, Doney AS. The cost of cerebral ischaemia[J]. Neuropharmacology, 2008, 55: 250–256. DOI:10.1016/j.neuropharm.2008.05.031 |
| [3] | Gállego J, Mu oz R, Martínezvila E. Emergent cerebrovascular disease risk factor weighting:is transient ischemic attack an imminent threat?[J]. Cerebrovasc Dis, 2010, 27: 88–96. |
| [4] | Sevick LK, Ghali S, Hill MD, et al. Systematic review of the cost and cost-effectiveness of rapid endovascular therapy for acute ischemic stroke[J]. Stroke, 2017, 48: 2519–2526. DOI:10.1161/STROKEAHA.117.017199 |
| [5] | Arundine M, Tymianski M. Molecular mechanisms of glutamate-dependent neurodegeneration in ischemia and traumatic brain injury[J]. Cell Mol Life Sci, 2004, 61: 657–668. DOI:10.1007/s00018-003-3319-x |
| [6] | Aarts M, Liu YT, Liu LD, et al. Treatment of ischemic brain damage by perturbing NMDA receptor-PSD-95 protein interactions[J]. Science, 2002, 298: 846–850. DOI:10.1126/science.1072873 |
| [7] | Cui H, Hayashi A, Sun HS, et al. PDZ protein interactions underlying NMDA receptor-mediated excitotoxicity and neuroprotection by PSD-95 inhibitors[J]. J Neurosci, 2007, 27: 9901–9915. DOI:10.1523/JNEUROSCI.1464-07.2007 |
| [8] | Cao J, Viholainen JI, Dart C, et al. The PSD-95-nNOS interface:a target for inhibition of excitotoxic p38 stress-activated protein kinase activation and cell death[J]. J Cell Biol, 2005, 168: 117–126. DOI:10.1083/jcb.200407024 |
| [9] | Courtney MJ, Li LL, Lai YY. Mechanisms of NOS1AP action on NMDA receptor-nNOS signaling[J]. Front Cell Neurosci, 2014, 8: 252. |
| [10] | Takagi N, Logan R, Teves L, et al. Altered interaction between PSD-95 and the NMDA receptor following transient global ischemia[J]. J Neurochem, 2010, 74: 169–178. |
| [11] | Zhou L, Li F, Xu HB, et al. Treatment of cerebral ischemia by disrupting ischemia-induced interaction of nNOS with PSD-95[J]. Nat Med, 2010, 16: 1439–1443. DOI:10.1038/nm.2245 |
| [12] | Chen D, Zhao T, Ni K, et al. Metabolic investigation on ZL006 for the discovery of a potent prodrug for the treatment of cerebral ischemia[J]. Bioorg Med Chem Lett, 2016, 26: 2152–2155. DOI:10.1016/j.bmcl.2016.03.074 |
| [13] | Wu S, Yue Y, Tian H, et al. Tramiprosate protects neurons against ischemic stroke by disrupting the interaction between PSD-95 and nNOS[J]. Neuropharmacology, 2014, 83: 107–117. DOI:10.1016/j.neuropharm.2014.04.010 |
| [14] | Yu CZ, Li C, Pei DS, et al. Neuroprotection against transient focal cerebral ischemia and oxygen-glucose deprivation by interference with GluR6-PSD-95 protein interaction[J]. Neurochem Res, 2009, 34: 2008–2021. DOI:10.1007/s11064-009-9990-z |
| [15] | Yang S, He R, Zhang FY, et al. Application of cell co-culture techniques in central nervous system diseases[J]. Acta Pharm Sin (药学学报), 2016, 51: 338–346. |
| [16] | Lohse MJ, Susanne N, Carsten H. Fluorescence/bioluminescence resonance energy transfer techniques to study G-protein-coupled receptor activation and signaling[J]. Pharmacol Rev, 2012, 64: 299–336. DOI:10.1124/pr.110.004309 |
| [17] | Draczkowski P, Matosiuk D, Jozwiak K. Isothermal titration calorimetry in membrane protein research[J]. J Pharm Biomed Anal, 2014, 87: 313–325. DOI:10.1016/j.jpba.2013.09.003 |
| [18] | Wang CQ. Basics of Molecular Immunology (分子免疫学基础)[M]. Beijing: Peking University Press, 1997: 13-15. |
| [19] | Tochio H, Mok YK, Zhang Q, et al. Formation of nNOS/PSD-95 PDZ dimer requires a preformed β-finger structure from the nNOS PDZ domain 1[J]. J Mol Biol, 2000, 303: 359–370. DOI:10.1006/jmbi.2000.4148 |
| [20] | Christopherson KS, Hillier BJ, Lim WA, et al. PSD-95 assembles a ternary complex with the N-methyl-D-aspartic acid receptor and a bivalent neuronal NO synthase PDZ domain[J]. J Biol Chem, 1999, 274: 27467–27473. DOI:10.1074/jbc.274.39.27467 |
| [21] | Zhou L, Zhu DY. Neuronal nitric oxide synthase:structure, subcellular localization, regulation, and clinical implications[J]. Nitric Oxide, 2009, 20: 223–230. DOI:10.1016/j.niox.2009.03.001 |
| [22] | Bach A, Pedersen SW, Dorr LA, et al. Biochemical investigations of the mechanism of action of small molecules ZL006 and IC87201 as potential inhibitors of the nNOS-PDZ/PSD-95-PDZ interactions[J]. Sci Rep, 2015, 5: 12157. DOI:10.1038/srep12157 |
| [23] | Doucet MV, Levine H, Dev KK, et al. Small-molecule inhibitors at the PSD-95/nNOS interface have antidepressant-like properties in mice[J]. Neuropsychopharmacology, 2013, 38: 1575–1584. DOI:10.1038/npp.2013.57 |
| [24] | Lee WH, Xu Z, Ashpole NM, et al. Small molecule inhibitors of PSD-95-nNOS protein-protein interactions as novel analgesics[J]. Neuropharmacology, 2015, 97: 464–475. DOI:10.1016/j.neuropharm.2015.05.038 |
| [25] | Sattler R, Xiong Z, Lu WY, et al. Specific coupling of NMDA receptor activation to nitric oxide neurotoxicity by PSD-95 protein[J]. Science, 1999, 284: 1845–1848. DOI:10.1126/science.284.5421.1845 |
| [26] | Hu W, Guan LS, Dang XB, et al. Small-molecule inhibitors at the PSD-95/nNOS interface attenuate MPP+-induced neuronal injury through Sirt3 mediated inhibition of mitochondrial dysfunction[J]. Neurochem Int, 2014, 79: 57–64. DOI:10.1016/j.neuint.2014.10.005 |
 2019, Vol. 54
2019, Vol. 54


