艾滋病, 即获得性免疫缺陷综合征, 自20世纪80年代被发现以来, 已成为当今世界严重危害人类健康的公共卫生问题[1]。它主要是由人类免疫缺陷病毒1型(HIV-1)引起, HIV-1感染并攻击人体CD4+T淋巴细胞, 使人体丧失免疫功能进而易于感染各种疾病, 并可发生恶性肿瘤。临床上常用的高效抗逆转录病毒疗法(highly active antiretroviral therapy, HAART)虽然成功控制了HIV的感染, 但其长期使用后引发的耐药性问题显著降低了其疗效, 因此寻找新靶点和新作用机制的HIV抑制剂是当前抗艾滋病药物研究领域的重要任务[2]。
如同其他病毒一样, HIV-1在其生命周期中主要依赖于宿主细胞, 这些过程通常通过病毒和宿主蛋白的相互作用, 或同二聚体/多聚体病毒蛋白的相互作用来引发。蛋白质-蛋白质相互作用(protein-protein interaction, PPI)在HIV的侵入和复制过程中发挥着至关重要的作用。并且由于蛋白质是HIV-1复制周期的主要执行者, 任何一个环节都有赖于蛋白质功能的正确发挥, 因此对HIV复制周期中相关蛋白质的结构和功能、调控网络、以及动态变化规律的深入认识是揭示HIV-1复制规律的主要手段, 也是药物发现的生物学基础[3]。对蛋白质-蛋白质相互作用的深入理解使我们有可能通过靶向这些相互作用来开发新型抗艾滋病药物。目前已报道的通过抑制特定的蛋白质-蛋白质相互作用而开发的蛋白质-蛋白质相互作用抑制剂(protein-protein interaction inhibitors, PPIIs)主要可分为以下几类:靶向于HIV-1侵入过程的抑制剂; 逆转录酶二聚化的抑制剂; 蛋白酶二聚化的抑制剂; 人晶状体上皮源性生长因子(LEDGF/p75)与整合酶相互作用过程的抑制剂; 靶向于辅助调节蛋白Vpu的抑制剂[4]。由于目前大多数已上市的抗艾滋病治疗的药物作用方式是通过抑制HIV-1复制过程的相关酶, 因此这种新颖作用模式的HIV-1抑制剂具有广阔的研究前景。
1 靶向于HIV-1侵入过程的抑制剂在HIV病毒侵入宿主细胞的过程中, 有3种关键的蛋白质-蛋白质相互作用: gp120与CD4的结合、gp120与协同受体的结合、以及gp41在膜融合过程中的内部相互作用。靶向这些相互作用在艾滋病治疗方面具有相当大的潜力, 特别是对那些携带对上市药物具有耐药性毒株的患者。目前有两种已上市的侵入抑制剂药物(马拉维若和恩福韦地), 还有几种侵入抑制剂正在进行临床试验。
1.1 gp120-CD4相互作用抑制剂在HIV感染靶细胞的过程中, 首先是HIV包膜与靶细胞的细胞膜发生融合。HIV包膜与靶细胞膜融合主要由包膜糖蛋白gp120和跨膜亚基gp41介导, gp120蛋白与靶细胞上的CD4受体和辅助受体(趋化因子受体CCR5或CXCR4等)先后结合, 导致gp41的构型发生改变, 形成6股α-螺旋束(6-helix bundle, 6-HB)核心结构, 将病毒包膜与靶细胞膜拉近并发生融合, 完成病毒进入宿主细胞的感染过程[5]。抑制病毒与宿主细胞融合过程的第一步能在病毒感染的初级阶段起抑制病毒感染的作用, 因此可通过阻断gp120-CD4相互作用来抑制病毒侵入。
Wang等[6]于2003年报道了一种7位氮杂吲哚衍生物1 (BMS-378806), 这是首次报道的能够有效地干扰HIV包膜糖蛋白gp120和宿主细胞CD4受体相互作用的小分子病毒侵入抑制剂。研究表明化合物1通过特定的竞争性机制, 抑制gp120蛋白与CD4受体的结合从而抑制病毒进入宿主细胞。1的靶点位于gp120蛋白的CD4结合口袋内的特定区域。1的开发最终由于其在人体血浆中的暴露浓度太低而终止。随后, Wang等[7]继续对其进行结构修饰发现了新一代先导化合物2 (BMS-488043), 虽然与1的物化性质相似, 但2具有较高的膜通透性(人结肠腺癌细胞Caco-2)和代谢稳定性。然而, 相较于上一代的1, 2的水溶性下降, 人血浆蛋白结合率提高。因此, 2后续的结构优化目标是提升抗病毒活性与药代动力学性质, 在结构优化过程中发现6-氮杂吲哚系列中的C-7位是结构优化的有利位点, 最终发现了活性和药代动力学性质更优的3 (BMS-626529)[8]。为进一步增加化合物在肠道中的溶解度, 研究人员开发了一种含有膦酰基的3的口服前药即4 (BMS-663068) (图 1)。近期4在临床2b期试验中显示了其安全性和有效性, 现已进入临床Ⅲ期试验。2015年, 化合物4获得了美国FDA突破性治疗认证, 这意味着gp120是开发小分子HIV侵入抑制剂的重要靶标[9]。
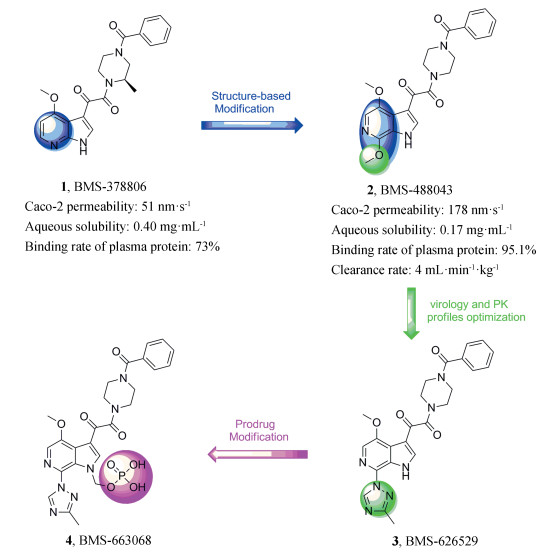
|
Figure 1 Chemical structures of representative BMS derivatives |
Debnath课题组利用计算机虚拟筛选技术发现了两种靶向于gp120-CD4相互作用过程的HIV-1侵入抑制剂: 5 (NBD-556)和6 (NBD-557)[10]。这种N-苯基-N′-(2, 2, 6, 6-四甲基哌啶)-草酸酰胺类似物在低微摩尔水平显示有效的细胞融合和病毒-细胞融合抑制活性, 且经表面等离子共振技术(surface plasmon resonance, SPR)表明其特异性地作用于gp120, 而非结合细胞受体CD4。它们具有较低的细胞毒性, 且这些化合物发挥作用与协同受体无关, 不干扰gp41六螺旋束的形成。然而后续研究发现这类化合物能增强协同受体结合的能力, 能促进病毒进入CD4--CCR5+细胞, 表明化合物的抗病毒机制可能并不完全是因为与CD4的简单竞争机制。随后为找到活性更高、毒性更低且完全避免这种不良影响的HIV进入拮抗剂, 研究者们对已发现的5进行系统地基于结构的修饰, 通过对关键的草酸酰胺中间骨架的修饰, 成功地将CD4完全激动剂(5, NBD-556)转化为CD4部分激动剂(7, NBD-09027)进而发现完全CD4拮抗剂(8, NBD-11021)[11]。研究者们将化合物8与gp120蛋白共结晶, 进一步揭示了该分子在gp120的Phe43空腔中的结合模式, 也为后续进一步的结构修饰提供生物学基础。之后, 该课题组继续以8为先导化合物, 通过合理药物设计合成了60个结构类似物, 以探讨构效关系(图 2)。在单周期抗病毒实验中, 9 (NBD-14088)和10 (NBD-14107)表现出优于先导化合物8的活性, 并通过X射线衍射论证了其结合模式, 初步成药性评价试验证明其体外ADMET性质可与目前最有效的侵入抑制剂3相媲美[12], 为NBD系列化合物的进一步研究奠定了基础。

|
Figure 2 Chemical structures of representative NBD derivatives |
HIV-1病毒吸附CD4分子后gp120发生移位, gp120构象随之改变, 进而与宿主细胞膜上的协同受体结合, 阻断gp120与协同受体的结合即可有效的阻断HIV-1侵入细胞从而发挥抗病毒作用。在所有的协同受体中, CCR5和CXCR4最为重要, 几乎所有的HIV-1病毒株都是利用两者之一或同时利用两者侵入细胞。小分子CCR5拮抗剂能够与跨膜区一些关键氨基酸残基(E283、M287、Y108、Y251、W248、T195、F109、I198及W86)组成的疏水口袋相结合, 进而诱发CCR5第二胞外环(ECL2)区域的构象发生改变, 阻止gp120与CCR5的结合, 导致HIV-1无法正常地完成侵入过程[13]。
辉瑞公司基于高通量筛选和后续结构优化发现了一种托品烷类似物11 (马拉维若), 它是第一个被批准上市的小分子CCR5拮抗剂[14]。由于马拉维若与人类趋化因子受体CCR5而非病毒蛋白结合, 因此研究人员预计由它引发获得性耐药的可能性较低。然而临床使用后结果表明耐药病毒株的gp120蛋白V3环部分的316和323位的氨基酸残基发生突变, 耐药株的出现降低了其疗效。
为解决马拉维若的耐药问题, Stupple课题组[15]在保留马拉维若的托品烷结构的基础上, 对托品烷结构中的N-和C-取代基进行修饰, 通过减小马拉维若的酰胺取代基的大小和引入更大的托品烷C-取代基设计合成了一系列咪唑并哌啶CCR5拮抗剂, 其中活性较好的化合物12 (PF-232798)具有与马拉维若相当的抗病毒活性和较好的抗耐药性(马拉维若的耐药株), 加之较低的hERG毒性和良好的代谢稳定性, 目前该化合物已进入Ⅱ期临床试验。
此外, 临床使用中发现马拉维若对CYP450的抑制能力较强(CYP3A4: IC50 = 3.1 μmol·L-1), 由此可能会引起药物之间的相互作用, 导致不良反应, 比如当与其他CYP3A4抑制剂或CYP3A4诱导物同时给药时就必须调整马拉维若的剂量。2018年, 柳红课题组[16]采用基于结构的药物设计策略, 以降低对CYP450的抑制率并提高抗病毒活性和生物利用度为目标, 设计合成了一系列1-异芳基-1, 3-丙二胺衍生物。其中化合物13具有优良的体外抗HIV活性、较低的细胞毒性和良好的药代动力学性质(图 3)。值得注意的是, 化合物13在25 μmol·L-1浓度下仍未表现出明显的抑制CYP450的作用, 从而克服了马拉维若潜在的药物之间相互作用这一缺点, 表明该化合物是一个更为安全有效的CCR5拮抗剂, 目前正在临床前研究阶段。此外, 该课题组通过X-射线共晶结构阐明了化合物13与CCR5的结合模式。
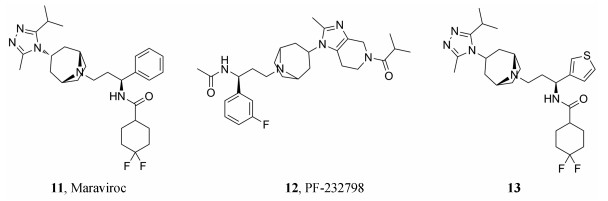
|
Figure 3 Chemical structures of CCR5 inhibitors |
HIV-1 gp41包膜糖蛋白由胞外结构域(aa511-684)、跨膜结构域(TM: aa685-705)和胞质结构域(CP: aa706-856)组成。其中, 胞外结构域包含3个重要的功能区域:融合肽(FP: aa512-527); N端七肽重复序列(NHR: aa536-590)和C端七肽重复序列(CHR: aa628-673)。两种HR主要由形成α-螺旋的疏水性残基组成, 作为gp41寡聚化过程和膜融合过程构象变化的必需结构。gp41通过形成三发夹结构来促进病毒和细胞膜的融合, gp41胞外结构域的氨基末端和羧基末端区域被聚集在一起。在此过程中, gp41的螺旋化的胞外结构域暴露出一个深而清晰的口袋, 是潜在的抗病毒靶点[17]。以gp41为靶点具有以下优点: ①目前融合态gp41的晶体结构已被解析, 可以在此生物学基础上进行相应的药物分子设计; ②与前述的gp120蛋白相比, gp41氨基酸序列更加保守, 针对这一靶点的药物的特异性更高且产生耐药性的几率较低; ③将HIV-1的感染控制在病毒与宿主细胞的融合阶段更有利于体内清除病毒。
14 (恩福韦地)是临床上第一个被批准上市用于治疗艾滋病的融合抑制剂, 它是来源于gp41的HR2区域一种包含36个氨基酸的线性肽[18]。恩福韦地通过竞争性地与HR1结合, 从而阻止膜融合所必需的六螺旋束的形成。由于其独特的作用机制, 它对大部分HIV病毒株都有很好的抑制效果。但其临床应用受到每日两次剂量90 mg /剂的限制, 生产成本高, 并且局部注射反应严重。因此, 开发口服有效的小分子HIV进入抑制剂是十分必要的。
gp41的NHR-三聚体表面凹槽的疏水性口袋容纳了3个保守疏水性氨基酸残基(W628、W631、I635), 且疏水口袋对六螺旋束(6-HB)的稳定性至关重要, 被认为是小分子HIV进入抑制剂设计的靶点。
2011年, Zhou等[19]首次报道了一类吲哚骨架的靶向gp41的HIV-1融合抑制剂, 其中有长疏水性结构的化合物15对抑制融合过程及病毒复制均表现出亚微摩尔的活性, 进一步研究发现, 具有分离的极性和非极性末端的两亲结构的小分子化合物可以提高与gp41疏水口袋的亲和力从而增加抑制活性。对化合物15进行结构优化发现了抗病毒和抑制融合过程能力更强的化合物16[20], 并探讨了构效关系[21]。在此基础上, 通过新一轮的修饰发现了一个具有开发前景的亚微摩尔水平的小分子抑制剂17, 与之前报道的同类型吲哚类抑制剂相比, 17的相对分子质量小于500且logP进一步降低(图 4)。
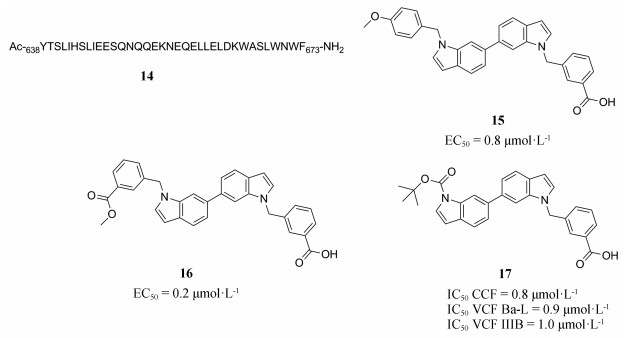
|
Figure 4 Chemical structures of gp41 inhibitors |
与基于多肽的HIV融合抑制剂相比, 针对gp41的小分子HIV进入抑制剂具有以下两方面优势:首先, 相比于多肽类制剂, 小分子抑制剂的生产成本低; 其次, 它可以制成口服制剂, 不会像多肽类制剂在肠道中易被降解, 所以体内半衰期长, 使用更加方便。因此, 迫切需要开发新的小分子HIV融合抑制剂。
2 HIV逆转录酶(RT)二聚化抑制剂HIV-1逆转录酶是一种由p66亚基(560个氨基酸残基)和p51亚基(440个氨基酸残基)组成的异二聚体。HIV-1 RT是由gag-pol多聚蛋白经过蛋白酶水解再聚合而成的, 具有聚合酶和核酸酶活性。逆转录酶对病毒的复制至关重要, 是一个非常有吸引力的抗病毒靶点。目前已上市的抗艾滋病药物大都是以逆转录酶为靶点, 然而长期使用后很容易引起耐药。由于异二聚体结构是逆转录酶发挥活性所必需, 因此抑制HIV-1逆转录酶的一个替代策略是干扰p66和p51亚基之间的蛋白质-蛋白质相互作用[22]。蛋白质-蛋白质相互作用是RT二聚化过程的快速步骤, 连接亚结构域中的6个色氨酸残基(W398、W401、W402、W406、W410、W414)在二聚化过程中起重要的作用, 主要通过p66来介导。逆转录酶的二聚化作为一个全新的靶点, 为研发新型高效、低毒、抗耐药性的抗艾滋病药物提供了新方向。目前已经证实一些小分子化合物可以抑制逆转录酶的二聚化。
2.1 肽类抑制剂由于HIV-1逆转录酶只有形成二聚体才能发挥作用, 因此从二聚体的结合面中提取出的肽段可以作为特殊的抑制剂来抑制两亚基的聚合过程从而抑制逆转录酶的活性。
Divita等[23]首次报道了一类来自于RT连接亚结构域的15-19氨基酸长寡肽, 实验结果表明一种对应于389-407序列的富含色氨酸的19氨基酸长寡肽能在微摩尔浓度下抑制逆转录酶的二聚化过程。此种长寡肽不能诱导已经形成的异二聚体的解离, 但肽类分子的浓度增加会以浓度依赖性方式降低二聚化的速率, 直至在肽类分子的高浓度下二聚化速率几乎停止。Morris等[24]还通过筛选来自于连接结构域表面的色氨酸簇的多肽, 发现了一种与RT的395-404序列相对应的10个氨基酸长度的短肽p7。p7与MPG (一种含有27个氨基酸的细胞穿膜肽, 由HIV gp41蛋白的融合蛋白结构域和猿猴空泡病毒大T抗原的核定位序列区域组成)的复合物在低浓度下(1 nmol·L-1)即可抑制细胞水平的病毒复制, 且无明显毒副作用; p7的KETWE TWWTE序列在HIV病毒中高度保守, 尚未发现其存在于除逆转录酶外的其他蛋白中, 因此p7是一种特异性的HIV抑制剂。p7序列短, 因此稳定性较高。此外, 还发现色氨酸簇是参与RT二聚化的关键结构域。该研究不仅验证了RT二聚化的概念, 还证明RT的二聚化过程是设计新型HIV抑制剂的理想靶点。
2.2 非肽类抑制剂De Clercq课题组[25]首次报道了一类2', 5'-bis-O-(tert-butyldimethylsilyl)-3'-spiro-5"-(4"-amino-1", 2"-oxathiole-2", 2"-dioxide)pyrimidine (TSAO)衍生物, 它是一种嘧啶核苷类似物, 其作用机制是通过破坏逆转录酶异二聚体的稳定性和促进p51/p66的解离, 导致DNA结合活性的丧失, 从而发挥抗病毒的作用。TSAO衍生物特异性抑制HIV-1的复制, 而不作用于HIV-2, 它对HIV-1 (IIIB)的抑制活性达到0.06~0.8 μmol·L-1的水平, 且细胞毒性很低。Sluis-Cremer等[26]通过吉布斯自由能的变化指出随着TSAO-e3T浓度的增加, 二聚体解离的吉布斯自由能(ΔGDH2O)降低, 最终p66/p51和p66/p66 RT的二聚体稳定性分别降低4.0和3.2 kcal·mol-1。TSAO-e3T促进二聚体解离的作用是特异性的, 同实验条件下的其他类型抑制剂UC781和奈韦拉平均未表现出对二聚体稳定性的影响。吉布斯自由能实验结果为TSAO-e3T影响二聚体稳定性这一假说提供了证明。在前期研究的基础上, Sluis-Cremer等[27]设计合成了64个TSAO-T衍生物, 详细探讨了TSAO-T核苷类似物的构效关系, 结果表明TSAO-T衍生物抑制RT二聚化的能力与抑制RT的DNA聚合酶活性之间具有相关性, 最有效的RT二聚化抑制剂也同时表现出了高效的抑制DNA聚合酶的活性。有趣的是, 在比TSAO-T活性更好的5个衍生物中, 其中4个衍生物的TSAO-T骨架的N3位置被亲水性或芳香性的取代基所取代(图 5)。系统的SAR研究表明可以通过合理设计提高TSAO-T衍生物的活性。最近, Das等[28]研究了RT与TSAO-T的共结晶结构, 表明TSAO-T在结合位点呈现出一种“龙”的构像, 并与许多氨基酸残基形成广泛的作用力。TSAO-T与RT的共晶结构不仅合理地解释了该类化合物构效关系, 而且表明与位于YMDD基序的保守残基Tyr183形成相互作用, 是NNRTIs结构优化的新思路。

|
Figure 5 Chemical structures of TSAO derivatives |
HIV-1蛋白酶是一种同源二聚酶, 由两个分别含有99个氨基酸残基的单体组成。蛋白酶的催化位点位于二聚体界面的空腔底部, 由两个单体二聚化形成, 每个单体提供一个Asp25催化残基。在HIV-1复制周期中, 蛋白酶的作用是将gag和gag-pol表达产生的多聚蛋白裂解, 变成具有活性的病毒结构蛋白与酶, 从而使病毒具备感染活性。目前已有多个蛋白酶抑制剂上市, 它们都是通过与PR的催化活性位点相互作用并模拟底物催化的中间体来抑制其蛋白水解活性。然而由于蛋白酶催化位点的氨基酸残基的高突变性, 导致药物临床使用后耐药性的出现, 因此迫切需要开发新作用机制的蛋白酶抑制剂。X-射线结构解析表明蛋白酶的二聚体界面是由每个单体的N端残基(HN-Pro1-Gln2-Ile3-Thr4-Leu5)和C端残基(Cys95-Thr96-Leu97-Asn98-Phe99-COOH)组成的, 其排列方式为两个C端的β链夹在两个N端β链之间。研究表明二聚体是蛋白酶完全发挥功能所必需, 抑制二聚化过程可以抑制其活性, 此外, 二聚体界面中的氨基酸残基具有高度保守性, 因此可以以二聚体界面为靶点设计抗耐药性抑制剂[29]。
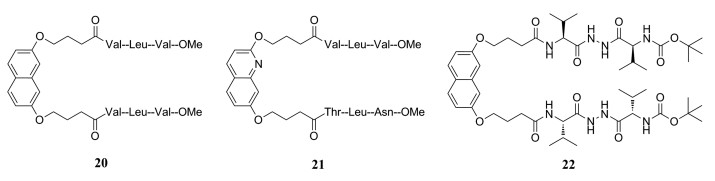
二聚体界面肽最早被报道为蛋白酶二聚化抑制剂, 此后, 研究者们对界面肽氨基酸的组成、长度及其理化性质进行修饰, 陆续开发出大量与烷基链或大体积有机取代基交联的界面肽。这些交联抑制剂的主要缺点是它们的构象自由程度较高, 导致在其与蛋白酶单体相互作用时引起不利的熵变。Bouras等[30]首次报道了一类构象限制的“分子钳”, 其结构是连接在芳香骨架上的两条肽链。化合物20 (IC50 = 2.0 μmol·L-1, Kid = 0.56 μmol·L-1)是一种以刚性萘二醇环为骨架的连接两条三肽链的“分子钳”, 表现出低微摩尔的蛋白酶二聚化抑制活性。Merabet等[31]通过合理设计合成了一类以萘或喹啉为骨架的连接双肽链或三肽链的“分子钳”, 并探讨了该类抑制剂的构效关系。结果表明: ①大部分以喹啉为骨架的“分子钳”对蛋白酶二聚化的抑制活性较高, 活性最好的化合物21 (IC50 = 5.1 μmol·L-1, Kid = 80 nmol·L-1)对酶的动力学抑制活性达到纳摩尔级水平; ②附着的三肽链一般比双肽链具有更好的抑制活性, 非对称肽链一般优于对称肽链; ③肽链的疏水性有利于增强抑制活性。Ongeri课题组[32]用一种拟肽取代了萘分子钳的一条肽链上的两个氨基酸, 以增强“分子钳”的稳定性, 耐受蛋白酶的水解, 结果表明达到了预期目的[33]。特别是化合物22对野生型和对多突变蛋白酶ANAM-11的抑制常数分别达到了50和80 nmol·L-1, 是目前活性最好的非肽分子钳(图 6)。
|
Figure 6 Chemical structures of "molecular tongs" inhibitors |
HIV-1整合酶在病毒的复制过程中负责将新生成的病毒cDNA整合到宿主细胞的染色体上, 是病毒复制所必需的酶, 是抗艾滋病药物设计的有效靶标。在感染过程中, 整合酶在多蛋白复合物的背景下执行其功能, 多蛋白复合物是指由HIV和宿主蛋白组成的前整合复合物(pre-integration complex, PIC), 这种蛋白质复合物的作用是协调复制和整合过程并协助整合酶进入细胞核。已上市的整合酶抑制剂药物在临床使用后已出现明显的耐药性, 因此寻找具有新作用机制、靶向新作用位点的分子是目前该领域研发的主要方向。整合过程是一个高度有序的多步骤过程, 需要多个宿主因子的辅助, 因此可以通过抑制整合酶与必需宿主细胞因子的相互作用来抑制病毒的整合过程。晶状体上皮源性生长因子(lens epithelium-derived growth factor, LEDGF)又名p75蛋白, 是病毒整合过程中不可缺少的细胞辅助因子, LEDFG/p75通过N端PWWP结构域与染色质结合, 通过C端结构域与整合酶结合, 它可将整合酶链合到特定的DNA序列上, 从而促进病毒DNA整合到宿主细胞染色体上。研究表明LEDFG/p75与整合酶结合后能显著提高整合酶的稳定性, 能有效防止蛋白体的降解, 并且协助预整合复合物穿过宿主细胞核的膜表面。因此通过抑制整合酶与LEDFG/p75的相互作用(IN-LEDGF/p75)过程是抑制HIV整合过程的有效途径[34]。
苯甲酸类衍生物23 (D77)是第一个被报道的阻断IN-LEDFG/p75相互作用的小分子抑制剂, 在酵母双杂交实验和哺乳动物双杂交实验中, 23均显示出对IN-LEDFG/p75相互作用的强抑制活性。采用分子对接技术、定点突变和表面等离子共振(SPR)实验证实了23与整合酶的结合模式, 其结合位点位于整合酶的催化功能区, 相关氨基酸残基包括Gln95、Thr125、Trp131和Thr174[35]。
Christ等[36]通过合理设计途径发现2-(喹啉-3-酰基)乙酸衍生物24是亚微摩尔级的HIV-1复制抑制剂, 且与两种整合酶抑制剂药物无交叉耐药性。X-射线晶体学表明该类抑制剂作用于整合酶的LEDGF/p75结合位点, 为首个报道的HIV-1整合酶的变构抑制剂。龙亚秋课题组[37]通过骨架跃迁策略发现了一种3-羟基吡啶酰胺类IN-LEDGF/p75相互作用抑制剂, 该类化合物对整合酶催化的整合反应没有显著影响, 分子模拟结果表明该类化合物与Glu170、His171、Thr174、Trp132、Ala128等变构位点残基形成氢键和疏水性相互作用, 从而破坏IN-LEDGF/p75相互作用。Neamati课题组[38]运用基于片段的药物发现策略, 采用8-羟基喹啉环优势骨架, 为克服其细胞毒性大的缺点, 对8-羟基喹啉环的C-5位和C-7位进行多样性的修饰, 发现了两个活性较高且细胞毒性较低的化合物25 (Q2-8)和26 (Q2-13) (图 7)。分子对接显示化合物可与His171形成氢键并与Ala128参与组成的疏水口袋结合。由于此类IN-LEDGF/p75相互作用抑制剂细胞毒性低且分子量小, 具有继续结构优化的空间。

|
Figure 7 Chemical structures of Integrase-LEDGF/p75 interaction inhibitors |
Vpu蛋白是仅存在于HIV-1型病毒中的一种辅助调节蛋白, 它是由Rev依赖的双顺反子mRNA编码翻译的, 其在病毒生命周期中主要发挥两种功能[39]。首先, 它通过介导内质网中新合成的CD4分子的蛋白酶体降解, 促进HIV-1诱导的CD4受体下调。其次, 它通过拮抗Tetherin (一种干扰素调节的宿主限制因子, 可直接交联宿主细胞表面的病毒粒子)来促进从感染细胞中释放后代病毒粒子。因此针对这些辅助调节蛋白进行药物设计已经成为抗艾滋病药物研究领域的热点之一。
人类BST-2通过将新生病毒粒子束缚到细胞表面来抑制HIV-1复制, HIV-1编码的Vpu蛋白通过从细胞表面下调这种限制因子来抵消BST-2的作用, 这一作用机制使得Vpu蛋白成为一种潜在的治疗靶点。Mi等[40]报道了一种小分子化合物27 (IMB-LA), 它可以拮抗Vpu蛋白的功能, 进一步的研究表明其作用机制是特异性地抑制Vpu介导的BST-2降解并恢复细胞表面BST-2的表达, 从而达到抑制HIV-1病毒复制的目的(图 8)。这项研究证明了通过小分子化合物来拮抗Vpu蛋白功能的可行性, 为后续靶向Vpu蛋白的抑制剂的研发奠定了基础。

|
Figure 8 Chemical structures of Vpu inhibitors |
目前临床上现有的抗艾滋病药物大都属于酶的催化位点抑制剂或单一位点的变构抑制剂, 但是长期使用会导致耐药株的迅速出现和严重的不良反应, 因此寻找新作用机制和不易产生耐药性的药物是当今抗艾滋病药物研究的主要任务。蛋白质-蛋白质相互作用是生命活动的基本形式, 并且具有高度的专一性, 干扰或破坏这种相互作用就会引起相应的生物学效应变化, 是设计新型治疗药物的重要靶点, 因此靶向于HIV感染过程的蛋白质-蛋白质相互作用引起了药学研究者的浓厚兴趣。一旦蛋白靶点经过验证, 便可以从小分子化合物库或通过高通量筛选来筛选出结合到该蛋白上的分子, 再通过结构优化以及基于结构的药物设计来完善该分子的结构及理化性质, 并通过X-射线晶体学、核磁共振以及同源建模的方法来获取蛋白复合物与药效团的空间结构, 最后经生物活性评价来得到先导化合物乃至候选药物。
传统酶催化中心靶点多为单个蛋白, 此类抑制剂易对相关靶点蛋白的同源蛋白起作用, 而蛋白质-蛋白质相互作用所形成的蛋白质复合物具有作用特异性; 此外单个蛋白的酶催化中心氨基酸残基易突变而导致耐药性的出现, 而蛋白质-蛋白质相互作用过程由于两个蛋白同时发生突变的可能性较低而不易出现耐药性问题。设计PPI抑制剂的挑战之处在于蛋白质相互作用的表面通常很大(750~1 500 Å), 导致较难通过合理设计找到与之相匹配的小分子抑制剂, 亟需将表型筛选、虚拟筛选等多种途径联合运用到蛋白质-蛋白质相互作用调控分子的发现中。总之, 靶向蛋白质-蛋白质相互作用过程这一靶点具有很大的前景, 将会是未来抗艾滋病药物研发的重点方向之一。
| [1] | De Clercq E, Li G. Approved antiviral drugs over the past 50 years[J]. Clin Microbiol Rev, 2016, 29: 695–747. DOI:10.1128/CMR.00102-15 |
| [2] | Huo ZP, Zuo XF, Kang DW, et al. Progress on AIDS drug targets and small molecule inhibitors[J]. Acta Pharm Sin (药学学报), 2018, 53: 356–374. |
| [3] | Tavassoli A. Targeting the protein-protein interactions of the HIV lifecycle[J]. Chem Soc Rev, 2011, 40: 1337–1346. DOI:10.1039/C0CS00092B |
| [4] | Tintori C, Brai A, Fallacara AL, et al. Protein-protein interactions and human cellular cofactors as new targets for HIV therapy[J]. Curr Opin Pharmacol, 2014, 18: 1–8. DOI:10.1016/j.coph.2014.06.005 |
| [5] | Wyatt R, Sodroski J. The HIV-1 envelope glycoproteins:fusogens, antigens, and immunogens[J]. Science, 1998, 280: 1884–1888. DOI:10.1126/science.280.5371.1884 |
| [6] | Wang T, Zhang Z, Wallace OB, et al. Discovery of 4-benzoyl-1-[(4-methoxy-1H-pyrrolo[2, 3-b]pyridin-3-yl)oxoacetyl]-2-(R)-methylpiperazine (BMS-378806):a novel HIV-1 attachment inhibitor that interferes with CD4-gp120 interactions[J]. J Med Chem, 2003, 46: 4236–4239. DOI:10.1021/jm034082o |
| [7] | Wang T, Yin Z, Zhang Z, et al. Inhibitors of human immunodeficiency virus type 1(HIV-1) attachment. 5. An evolution from indole to azaindoles leading to the discovery of 1-(4-benzoylpiperazin-1-yl)-2-(4, 7-dimethoxy-1H-pyrrolo[2, 3-c]pyridin-3-yl)ethane-1, 2-dione (BMS-488043), a drug candidate that demonstrates antiviral activity in HIV-1-infected subjects[J]. J Med Chem, 2009, 52: 7778–7787. DOI:10.1021/jm900843g |
| [8] | Wang T, Ueda Y, Zhang Z, et al. Discovery of the human immunodeficiency virus type 1(HIV-1) attachment inhibitor temsavir and its phosphonooxymethyl prodrug fostemsavir[J]. J Med Chem, 2018, 61: 6308–6327. DOI:10.1021/acs.jmedchem.8b00759 |
| [9] | Kharsany ABM, Cawood C, Khanyile D. Community-based HIV prevalence in KwaZulu-Natal, South Africa:results of a cross-sectional household survey[J]. Lancet HIV, 2018, 5: e427–e437. DOI:10.1016/S2352-3018(18)30104-8 |
| [10] | Zhao Q, Ma L, Jiang S, et al. Identification of N-phenyl-N'-(2, 2, 6, 6-tetramethyl-piperidin-4-yl)-oxalamides as a new class of HIV-1 entry inhibitors that prevent gp120 binding to CD4[J]. Virology, 2005, 339: 213–225. DOI:10.1016/j.virol.2005.06.008 |
| [11] | Curreli F, Kwon YD, Zhang H, et al. Structure-based design of a small molecule cd4-antagonist with broad spectrum anti-HIV-1 activity[J]. J Med Chem, 2015, 58: 6909–6927. DOI:10.1021/acs.jmedchem.5b00709 |
| [12] | Curreli F, Kwon YD, Belov DS, et al. Synthesis, antiviral potency, in vitro ADMET, and X-ray structure of potent CD4 mimics as entry inhibitors that target the Phe43 Cavity of HIV-1 gp120[J]. J Med Chem, 2017, 60: 3124–3153. DOI:10.1021/acs.jmedchem.7b00179 |
| [13] | Mostashari Rad T, Saghaie L, Fassihi A. HIV-1 entry inhibitors:a review of experimental and computational studies[J]. Chem Biodivers, 2018, 15: e1800159. DOI:10.1002/cbdv.201800159 |
| [14] | Guo ZR. Maraviroc, the first drug to inhibit the invasion of HIV-1 virus[J]. Acta Pharm Sin (药学学报), 2016, 51: 839–842. |
| [15] | Stupple PA, Batchelor DV, Corless M, et al. An imidazopiperidine series of CCR5 antagonists for the treatment of HIV:the discovery of N-{(1S)-1-(3-fluorophenyl)-3-[(3-endo)-3-(5-isobutyryl-2-methyl-4, 5, 6, 7-tetrahydro-1H-imidazo[4, 5-c]pyridin-1-yl)-8-azabicyclo[3.2.1] oct-8-yl]propyl}acetamide (PF-232798)[J]. J Med Chem, 2011, 54: 67–77. DOI:10.1021/jm100978n |
| [16] | Peng P, Chen H, Zhu Y, et al. Structure-based design of 1-heteroaryl-1, 3-propanediamine derivatives as a novel series of CC-chemokine receptor 5 antagonists[J]. J Med Chem, 2018, 61: 9621–9636. DOI:10.1021/acs.jmedchem.8b01077 |
| [17] | Lu L, Yu F, Cai L, et al. Development of small-molecule HIV entry inhibitors specifically targeting gp120 or gp41[J]. Curr Top Med Chem, 2016, 16: 1074–1090. |
| [18] | Matthews T, Salgo M, Greenberg M, et al. Enfuvirtide:the first therapy to inhibit the entry of HIV-1 into host CD4 lymphocytes[J]. Nat Rev Drug Discov, 2004, 3: 215–225. DOI:10.1038/nrd1331 |
| [19] | Zhou G, Wu D, Snyder B, et al. Development of indole compounds as small molecule fusion inhibitors targeting HIV-1 glycoprotein-41[J]. J Med Chem, 2011, 54: 7220–7231. DOI:10.1021/jm200791z |
| [20] | Zhou G, Sofiyev V, Kaur H, et al. Structure-activity relationship studies of indole-based compounds as small molecule HIV-1 fusion inhibitors targeting glycoprotein 41[J]. J Med Chem, 2014, 57: 5270–5281. DOI:10.1021/jm500344y |
| [21] | Zhou G, Chu S, Nemati A, et al. Investigation of the molecular characteristics of bisindole inhibitors as HIV-1 glycoprotein-41 fusion inhibitors[J]. Eur J Med Chem, 2019, 161: 533–542. DOI:10.1016/j.ejmech.2018.10.048 |
| [22] | Zhou ZX, Sun L, Kang DW, et al. Progress on HIV-1 RT inhibitors with novel mechanism of action[J]. Acta Pharm Sin (药学学报), 2018, 53: 691–700. |
| [23] | Divita G, Restle T, Goody RS, et al. Inhibition of human immunodeficiency virus type 1 reverse transcriptase dimerization using synthetic peptides derived from the connection domain[J]. J Biol Chem, 1994, 269: 13080–13083. |
| [24] | Morris MC, Robert-Hebmann V, Chaloin L, et al. A new potent HIV-1 reverse transcriptase inhibitor. A synthetic peptide derived from the interface subunit domains[J]. J Biol Chem, 1999, 274: 24941–24946. DOI:10.1074/jbc.274.35.24941 |
| [25] | Balzarini J, Pérez-Pérez MJ, San-Félix A, et al. 2', 5'-Bis-O-(tert-butyldimethylsilyl)-3'-spiro-5"-(4"-amino-1", 2"-oxathiole-2", 2'-dioxide)pyrimidine (TSAO) nucleoside analogues:highlyselective inhibitors of human immunodeficiency virus type 1 that are targeted at the viral reverse transcriptase[J]. Proc Natl Acad Sci U S A, 1992, 89: 4392–4396. DOI:10.1073/pnas.89.10.4392 |
| [26] | Sluis-Cremer N, Dmitrienko GI, Balzarini J, et al. Human immunodeficiency virus type 1 reverse transcriptase dimer destabilization by 1-[Spiro[4"-amino-2", 2"-dioxo-1", 2"-oxathiole-5", 3'-[2', 5'-bis-O-(tert-butyldimethylsilyl)-beta-D-ribofuranosyl]]]-3-ethylthy mine[J]. Biochemistry, 2000, 39: 1427–1433. DOI:10.1021/bi991682+ |
| [27] | Sluis-Cremer N, Hamamouch N, San Félix A, et al. Structure-activity relationships of[2', 5'-bis-O-(tert-butyldimethylsilyl)-beta-D-ribofuranosyl]-3'-spiro-5"-(4"-amino-1", 2"-oxathiole-2", 2"-dioxide)thymine derivatives as inhibitors of HIV-1 reverse transcriptase dimerization[J]. J Med Chem, 2006, 49: 4834–4841. DOI:10.1021/jm0604575 |
| [28] | Das K, Bauman JD, Rim AS, et al. Crystal structure of tert-butyldimethylsilyl-spiroaminooxathioledioxide-thymine (TSAO-T) in complex with HIV-1 reverse transcriptase (RT) redefines the elastic limits of the non-nucleoside inhibitor-binding pocket[J]. J Med Chem, 2011, 54: 2727–2737. DOI:10.1021/jm101536x |
| [29] | Hayashi H, Takamune N, Nirasawa T, et al. Dimerization of HIV-1 protease occurs through two steps relating to the mechanism of protease dimerization inhibition by darunavir[J]. Proc Natl Acad Sci U S A, 2014, 111: 12234–12239. DOI:10.1073/pnas.1400027111 |
| [30] | Bouras A, Boggetto N, Benatalah Z, et al. Design, synthesis, and evaluation of conformationally constrained tongs, new inhibitors of HIV-1 protease dimerization[J]. J Med Chem, 1999, 42: 957–962. DOI:10.1021/jm9803976 |
| [31] | Merabet N, Dumond J, Collinet B, et al. New constrained "molecular tongs" designed to dissociate HIV-1 protease dimer[J]. J Med Chem, 2004, 47: 6392–6400. DOI:10.1021/jm040833q |
| [32] | Bannwarth L, Kessler A, Pèthe S, et al. Molecular tongs containing amino acid mimetic fragments:new inhibitors of wild-type and mutated HIV-1 protease dimerization[J]. J Med Chem, 2006, 49: 4657–4664. DOI:10.1021/jm060576k |
| [33] | Dufau L, Marques Ressurreição AS, Fanelli R, et al. Carbonylhydrazide-based molecular tongs inhibit wild-type and mutated HIV-1 protease dimerization[J]. J Med Chem, 2012, 55: 6762–6775. DOI:10.1021/jm300181j |
| [34] | Blokken J, De Rijck J, Christ F, et al. Protein-protein and protein-chromatin interactions of LEDGF/p75 as novel drug targets[J]. Drug Discov Today Technol, 2017, 24: 25–31. DOI:10.1016/j.ddtec.2017.11.002 |
| [35] | Du L, Zhao Y, Chen J, et al. D77, one benzoic acid derivative, functions as a novel anti-HIV-1 inhibitor targeting the interaction between integrase and cellular LEDGF/p75[J]. Biochem Biophys Res Commun, 2008, 375: 139–144. DOI:10.1016/j.bbrc.2008.07.139 |
| [36] | Christ F, Voet A, Marchand A, et al. Rational design of small-molecule inhibitors of the LEDGF/p75-integrase interaction and HIV replication[J]. Nat Chem Biol, 2010, 6: 442–448. DOI:10.1038/nchembio.370 |
| [37] | Zhang FH, Debnath B, Xu ZL, et al. Discovery of novel 3-hydroxypicolinamides as selective inhibitors of HIV-1 integrase-LEDGF/p75 interaction[J]. Eur J Med Chem, 2017, 125: 1051–1063. DOI:10.1016/j.ejmech.2016.10.045 |
| [38] | Serrao E, Debnath B, Otake H, et al. Fragment-based discovery of 8-hydroxyquinoline inhibitors of the HIV-1 integrase-lens epithelium-derived growth factor/p75(IN-LEDGF/p75) interaction[J]. J Med Chem, 2013, 56: 2311–2322. DOI:10.1021/jm301632e |
| [39] | Wang SQ, Liu XY. Structure and function of HIV-1 adjuvant regulatory protein Vpu[J]. Chem Life (生命的化学), 2007, 27: 33–36. |
| [40] | Mi Z, Ding J, Zhang Q, et al. A small molecule compound IMB-LA inhibits HIV-1 infection by preventing viral Vpu from antagonizing the host restriction factor BST-2[J]. Sci Rep, 2015, 5: 18499. |
 2019, Vol. 54
2019, Vol. 54


