2. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193;
3. 黑龙江中医药大学药学院, 黑龙江 哈尔滨 150040
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China;
3. College of Pharmacy, Heilongjiang University of Chinese Medicine, Harbin 150040, China
双硫仑(DSF)是二硫代氨基甲酸酯家族的成员之一, 在临床上广泛用于抗酗酒药物[1-5]。近年来学者们通过研究发现DSF对许多的癌症类型均表现出强烈的细胞毒性, 包括直肠癌、黑色素瘤、脑胶质瘤、乳腺癌及前列腺癌等[6-10]。DSF在血液恶性肿瘤和实体瘤的抗癌作用, 已经在临床前研究中被证实[11, 12], 其作用机制涉及抑制醛脱氢酶(ALDH)活性、诱导细胞毒性、抑制多种蛋白酶体和NFkB活性、逆转机体多药耐药性等[13-15], 但难溶于水及其在血液中的半衰期短等特性, 限制了DSF抗肿瘤作用的充分发挥[16-20]。因此, 寻找一种可以解决DSF溶解性的方法并能促进其向肿瘤组织分布的载药系统很有必要[14]。
据文献报道, 双硫仑在溶液中很不稳定, 而纳米粒(NSps)包封对许多不稳定性药物可以保持其固态形式并与外界导致其不稳定的因素相对隔离, 从而提高其稳定性[17, 18]; 纳米混悬剂具有表观溶解度高、稳定性好和药物粒径小, 更重要的是粒径 < 200 nm混悬剂可以通过高通透性和滞留(EPR)效应能够更容易在肿瘤组织中富集[20], 因此, 纳米制剂是解决DSF溶解性及稳定性的一个可行方案。国内外学者们已经尝试将DSF制备成纳米粒并递送到肿瘤部位癌症, Song等[16]利用叶酸受体靶向聚乳酸-乙交酯-聚乙二醇(PLGA-PEG-FA)等包裹DSF并递送至乳腺癌肿瘤部位, 采用反溶剂沉淀法制备纳米粒(药物-聚合物=1:10), 对MCF-7细胞作用24 h后游离DSF及其NSps的IC50分别为750和250 nmol·L-1; 在急性实验中, NSps腹腔注射12.5 mg·kg-1为中毒剂量临界点; 在慢性实验中, NSps腹腔注射6 mg·kg-1为无毒剂量。通过腹腔注射及尾静脉注射将NSps注射到动物体内发现, 尾静脉给药有效抑制肿瘤生长而腹腔注射给药对肿瘤的生长没有显著影响, 这可能与NSps由腹腔入血存在屏障相关; Cvek等[15]设计了用mPEG-PLGA为载体, 掺入聚己内酯(PCL)并采用反溶剂沉淀法制备了DSF纳米制剂用于乳腺癌(4T1)的治疗(mPEG-PLGA-PCL-DSF = 4:5:1), 体外可有效保护DSF免受降解; 在荷瘤小鼠实验中, 相对于游离DSF对肿瘤几乎没有抑制作用, 纳米粒在24天内对肿瘤的抑制率达到43.2%。除了肿瘤抑制作用不足外, 该制备方法载药量较低, 制备方法复杂, 不利于产业化。本文利用大豆卵磷脂(SPC)和生育酚琥珀酸聚乙二醇酯(TPGS)作为联合载体制备DSF纳米混悬剂(DSF-NSps)可显著提高载药量、简化制备方法, 在解决DSF静脉注射给药的同时, 有望能基于EPR效应提高药物在肿瘤组织中分布从而提高其体内抗肿瘤药效。
材料与方法主要仪器 Zetasizer nano ZS型粒度仪(英国Malvern Instrμments公司); JEM-1400型透射电子显微镜(日本电子株式会社); UltiMate 3000高效液相色谱仪(美国Dionex仪器公司); Tecan Infinite M1000 PRO多功能酶标仪[力臻卓越(北京)科学仪器有限公司]; HSX-150型细胞培养箱(上海和呈仪器制造有限公司)。
药物和试剂 DSF (大连美仑生物技术有限公司, 含量 > 97%, 批号D1126A); TPGS (西安海斯夫生物科技有限公司, 批号20151203); SPC (沈阳天峰生物制药有限公司, 批号SY-SI-170401);泊洛沙姆F-68 (P-188, 中国西格玛有限公司, 批号018K0029); mPEG2000-PCL2000 (济南岱罡生物工程有限公司, 批号17031606);色谱甲醇和色谱乙腈(赛默飞世尔科技有限公司); 实验用水为经过纯水仪净化过的纯水; 其余试剂或药品均为分析级别。
动物及细胞系 健康BALB/c小鼠, 雌性, 体重20 ± 2 g, 北京华阜康生物科技股份有限公司, SPF级, 合格证号: 11401300078017, 许可证编号: SCXK (京) 2017-0020。实验符合动物实验的伦理学标准, 并获得中国医学科学院药用植物研究所实验动物伦理委员会批准; 4T1细胞购自北京协和医学院基础医学研究所细胞中心, RPMI培养基(批号AD15805337)、青霉素和链霉素双抗(批号20180105) (美国Hyclone公司); 胎牛血清(FBS, 美国Gibco公司, 批号1891605)。
HPLC分析DSF的色谱条件及标准曲线的建立
色谱条件 HPLC色谱柱选择C18反向色谱柱(Venusil XBP C18, 250 mm×4.6 mm, 5 μm), 检测波长210 nm, 流动相为乙腈-水(70:30, v/v), 流速1 mL·min-1, 柱温25 ℃, 进样量20 μL。
专属性考察 称取一定量的DSF, 用乙腈溶解, 按照上述色谱条件进行检测, 观察峰形的对称性及有无干扰峰。
标准曲线的建立 精密称取DSF 10 mg, 置于25 mL量瓶中, 加入适量色谱乙腈并充分溶解, 用乙腈定容至25 mL, 以配制400 μg·mL-1 DSF母液, 取母液适量, 用乙腈依次配制100、50、25、10、5、2.5、1和0.1 μg·mL-1 DSF溶液, 各取20 μL, 采用高效液相色谱在210 nm处检测其峰面积, 以峰面积为纵坐标, 药物的质量浓度(C, μg·mL-1)为横坐标建立DSF标准曲线, 并计算回归方程。
准确度和精密度考察 精密称取DSF 10 mg, 用乙腈溶解并配制低、中、高3个浓度的质量控制样品(1、50和100 μg·mL-1), 在0、3、6、12和24 h采用HPLC测其色谱峰(每个时间点的样品新鲜配制且每个浓度平行3份), 得日内精密度; 每日新鲜配制3个浓度质控样品, 连续3日测定, 得日间精密度。配制上述低、中、高浓度的质控样品HPLC连续测定3次, 将测得的色谱峰面积代入标准曲线方程, 计算DSF测定浓度, 与真实浓度比较得到DSF回收率。
DSF-NSps制备和稳定剂筛选 本文拟通过反溶剂沉淀法制备纳米混悬剂, 拟通过单因素考察, 称取适量载体(TPGS、PEG2000-PCL2000)与DSF共同溶于丙酮中, 在室温、250 W超声的条件下, 将混合有机溶液滴注到去离子水中, 在40 ℃下减压旋转蒸发除去有机溶剂得DSF-NSps。以P-188为载体时, 将P-188溶解到水相, DSF适量溶于丙酮中; 以SPC为载体时, 将SPC溶于乙醇, DSF溶于丙酮, 混匀后作为有机相; 以SPC和TPGS为联合载体时, 将SPC溶于乙醇, TPGS和DSF溶于丙酮, 两者混匀作为有机相。以DSF-NSps粒径大小及多分散指数(PDI)为主要考察指标, 筛选不同的药载比来优化配方。
DSF-NSps粒径和形态 选择动态光散射法测定其在25 ℃下平均粒度、zeta电位和PDI。以DSF含量计, 将DSF-NSps用去离子水稀释到100 μg·mL-1。取5 μL滴加到300目铜网上, 室温静置5 min, 滤纸吸干多余样品, 室温放置10 min, 滴加6.0 μL乙酸铀染色90 s, 室温自然晾干, 透射电镜下加速电压为120 kV观察纳米粒子的形态和大小。
载药量考察 将DSF-NSps冻干, 取冻干粉末5 mg (W)于量瓶中, 乙腈溶解并定容至100 mL (V), 13 000 r·min-1离心20 min, 取上清液200 μL, 采用HPLC测定DSF质量浓度(C), 平行3次实验。根据以下等式计算DSF-NSps的载药量(DLC): DLC (%) = V×C/W×100%
体外释放
DSF-NSps体外释放 将NSps (2 mL, 2 mg·mL-1)密封在透析袋(MWCO: 8 000~14 000)中, 浸入含有1% Tween 80的磷酸盐缓冲液(PBS, 0.01 mol·L-1, pH 7.4) 50 mL中, 37 ℃、150 r·min-1连续搅拌, 在0.5、1、2、4、6、8、10、12、24、48、72、96、120和144 h时间点取释放外液1 mL, 并补充相同体积的新鲜释放介质, 每24 h更换1次释放外液。根据释放外液中DSF的增加计算NSps的累积释放, 平行3份实验。
双硫仑混悬液体外释放 精密称取DSF 10 mg, 在超声辅助下均匀分散在0.4%羧甲基纤维素钠10 mL中, 以制备双硫仑混悬液, 用HPLC测定实际浓度, 并采用上述方法测定双硫仑混悬液的累计释放, 平行3份实验。
DSF-NSps在生理介质中的粒径稳定性的考察 配制浓度为1.8% NaCl、10%葡萄糖、2倍浓度(2×) PBS, 将DSF-NSps分别与上述生理介质等体积混合, 37 ℃孵育, 在0、2、4、6和8 h取样测定其粒径变化(平行3份实验)。
DSF-NSps在人工胃肠及血浆中稳定性考察 取DSF-NSps (1 mg·mL-1)分别与人工胃液、人工肠液、血浆(1:4, v/v)混匀, 37 ℃孵育, 于0、2、4、6和8 h取样观察, 测粒径及PDI变化(平行3份实验)。
纳米粒装载对双硫仑体外降解的影响
纯水中的降解曲线 取DSF 10 mg溶于200 μL DMSO溶液中, 用水稀释至10 mL, 取50 μL加入甲醇950 μL, 13 000 r·min-1离心10 min, 分离上清, 取200 μL, 采用HPLC测定原始浓度。剩余混悬液在37 ℃、100 r·min-1连续搅拌, 在0、6、24、48、72和96 h取样, 同上处理, 用HPLC测量DSF浓度, 与初始DSF浓度对比计算DSF剩余百分比, 对相应的时间作图, 绘制DSF在纯水中的降解曲线。以纯水为分散介质配制1 mg·mL-1 DSF-NSps, 同法绘制DSF-NSps在纯水中的降解曲线(平行3份实验)。
含10%胎牛血清的PBS中降解曲线 取DSF 10 mg溶于200 μL DMSO溶液中, 用PBS稀释至10 mL, 同上处理, 采用HPLC测量DSF原始浓度和不同时间点浓度, 绘制DSF在10%胎牛血清的降解曲线。以含10%胎牛血清的PBS配制1 mg·mL-1 DSF-NSps, 同法绘制DSF-NSps在10%胎牛血清中的降解曲线(平行3份实验)。
DSF-NSps体外细胞毒性实验 将4T1细胞培养至对数期, 制备单细胞悬液, 按细胞数1×104个/孔(150 µL)接种于96孔细胞培养板中, 置于37 ℃、5% CO2细胞培养箱中培养过夜, 倒置显微镜下观察到细胞贴壁后, 弃上清, 分别加入150 µL DSF质量浓度为100、50、25、10、5、1、0.1、0.05和0.01 µg·mL-1的DSF-NSps和游离药物(用不完全培养基稀释而成), 放入培养箱培养48 h, 每孔加入5 mg·mL-1 MTT 20 µL, 37 ℃、5% CO2继续孵育4 h, 终止培养, 弃上清, 每孔加DMSO 200 µL, 振荡, 使用酶标仪在570 nm吸收波长处测定其吸光度值(A), 计算其IC50值并计算抑制率(IR): IR (%) = (1-A给药组/A空白组)×100%。
DSF-NSps体内乳腺癌药效研究 每只小鼠右侧腋窝皮下接种4T1乳腺癌瘤细胞悬液0.2 mL (含8.0×105个细胞)。肿瘤生长至瘤体积大约为100 mm3时, 筛选出肿瘤大小相对一致的小鼠, 随机分成8组: ①生理盐水阴性对照(0.2 mL, iv); ② PTX阳性对照(8 mg·kg-1, iv); ③空白纳米粒组(Blank-NSps, iv); ④ DSF混悬液(0.4% CMC 20 mg·kg-1, ig); ⑤ DSF-NSps组(20 mg·kg-1, ig); ⑥ DSF-NSps组(20 mg·kg-1, iv); ⑦ DSF-NSps组(10 mg·kg-1, iv); ⑧ DSF-NSps组(5 mg·kg-1, iv)。每组8只小鼠, 静脉注射每两天尾静脉给药1次, 口服给药的每日给药, 连续给药2周。每日观察并记录各组小鼠的行为状态, 隔日用电子秤称量小鼠体重并用电子游标卡尺测量肿瘤长(L)和宽(W), 计算瘤体积(V)。停药后, 脱颈椎处死小鼠, 完整剥离腋窝皮下瘤体, 按公式计算抑瘤率(IR):
| $ V = L \times {W^2}/2 $ |
| $ {\rm{IR}}\left( \% \right) = \left[ {\left( {{V_{对照组}} - {V_{给药组}}} \right)/{V_{对照组}}} \right] \times 100\% $ |
静脉注射组组织分布实验 DSF中掺入少量近红外荧光探针Dir (药物与Dir质量重量比40:1), 按照DSF-NSps制备方法制备荧光标记的DSF-NSps, 在上述抗乳腺癌药效研究中高剂量DSF-NSps组最后一次给予荧光标记的DSF-NSps (20 mg·kg-1, iv)。给药24 h后处死小鼠, 取出心、肝、脾、肺、肾和肿瘤, 用小动物活体成像仪(IVIS Spectrum CT)进行拍照成像, 分析DSF-NSps荧光物质在组织中的分布。
统计学方法 使用IBM SPSS Statistics软件版本19 (IBM Corporation, Armonk, NY, USA)的单因素方差分析进行实验组间的统计分析, P < 0.05被认为具有统计学意义。
结果 1 DSF体外HPLC条件的建立 1.1 专属性由图 1可见, DSF保留时间为11.773 min且峰形良好、对称, 无其他杂质峰的干扰, 专属性良好, 满足色谱测定要求。

|
Figure 1 HPLC chromatogram of disulfiram (DSF) |
以标准溶液色谱峰面积为纵坐标, 浓度为横坐标进行线性回归, 得到标准回归曲线方程为y = 0.728 2 x + 0.145 6 (R2 = 0.999 9), 线性范围为0.1~100 µg·mL-1。
1.3 准确度与精密度考察3个质量浓度(1、50和100 µg·mL-1)回收率分别为99.60%、99.87%和99.44%, 对应的RSD值分别为1.35%、1.56%和0.92%, 平均回收率为99.64%, 在95%~105%之间, 符合体内外测定要求。
2 稳定剂筛选以TPGS、SPC、P-188、PEG2000-PCL2000和SPC/TPGS为载体制备DSF-NSps, 结果发现(表 1), 以P-188、PEG2000-PCL2000为稳定剂时, 制备过程中出现不可逆的白色絮状沉淀; 以TPGS为稳定剂制备的纳米粒放置过夜后析出不可逆的白色沉淀; 而以卵磷脂SPC为稳定剂时, 在1:2和1:1两个药载比下均可制备得到DSF-NSps, 以1:1时制备的纳米粒最小, 但提高药载比至2:1时, 未能制备成纳米混悬剂。单独以SPC为稳定剂制备的DSF-NSps, 在体内没有长循环作用, 故考虑以SPC/TPGS为联合稳定剂, 以赋予其长循环效应。如表 1所示, 当DSF:SPC:TPGS = 24:20:4 (重量比)时, 粒径较小, PDI也较为合适, 故选择该比例作为DSF-NSps的处方用于后续的研究。
| Table 1 The size, polydispersity index (PDI) and zeta potential of the resultant DSF nanosuspensions (DSF-NSps) at different ratio with the final drug concentration of 1 mg·mL-1. SPC: Soyabean lecithin; TPGS: D-Alpha tocopherol acid polyethyene glycol succinate. - Not prepared as a nanosuspension; *Irreversible white precipitate produced after overnight |
按照上述筛选的处方制备DSF-NSps, 粒径为175.0 ± 0.75 nm, PDI为0.235 ± 0.07, 电位为-14.6 mV, 粒径分布见图 2。HPLC测得DSF-NSps载药量为(45.36 ± 2.09)%, 低于理论载药量50%, 主要原因可能是因为在转移过程中药物附着而部分损失。

|
Figure 2 Particle size and distribution of DSF-NSps |
透射电镜下DSF-NSps大体上为球形且分布均匀, 目测粒径约为100 nm左右(图 3), 小于动态光散射法测定的粒径。这主要是动态光散射测定是DSF-NSps在以水为分散介质中的等效粒径, 是在湿态、具有水化层时的粒径; 而透射电镜下看到的是纳米粒在干态失去水化层后的粒径。
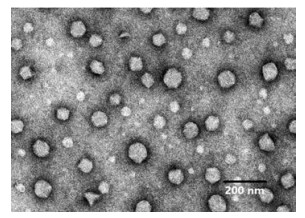
|
Figure 3 Transmission electron microscope images of DSF-NSps |
生理介质中粒径稳定性考察(图 4)结果显示, DSF-NSps在37 ℃与生理盐水、5%葡萄糖、PBS、人工胃液、人工肠液和血浆中孵育8 h均表现出粒径显著增大, PDI较为稳定, 不会与血浆成分(包括酶和血清白蛋白)相互作用产生聚集现象, 说明DSF-NSps可以调制成等渗溶液, 满足静脉注射及口服灌胃给药的要求, 为进一步体内研究奠定基础。
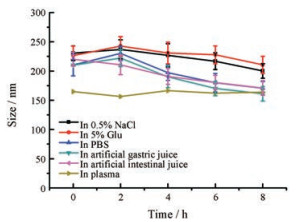
|
Figure 4 Particle size change of DSF-NSps in 0.9% NaCl, 5% glucose (Glu), phosphate buffer saline (PBS), artificial gastric juice, artificial intestinal fluid and plasma at 37 ℃ (n = 3, x ± s) |
由图 5A可知, 游离DSF在水中快速降解, 6 h后仅剩余45%, 48 h后剩余不到25%, 而DSF-NSps能显著减少药物的降解, 48 h时超过70% DSF仍然存在; 在含10% FBS的PBS溶液中(图 5B), 游离DSF 6 h后剩余43%, 48 h后剩余不到20%, 而DSF-NSps在24 h时仍有70% DSF, 24 h后DSF-NSps发生明显降解。综上, DSF-NSps在37 ℃水溶液中48 h内保持相对稳定; 在近生理条件(含10% FBS的PBS和37 ℃)下, 24 h内保持相对稳定。
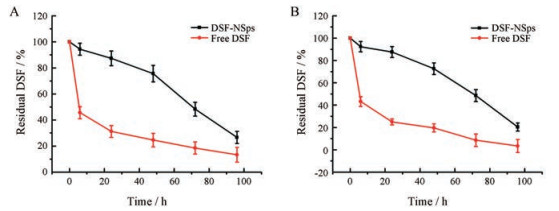
|
Figure 5 Residual DSF of free DSF and DSF-NSps in distilled water (A) and in PBS containing 10% fetal bovine serum (FBS) at 37 ℃ (B) (n = 3, x ± s) |
由图 6可知, DSF-NSps在24 h内呈相对快速释放, 累积药物释放达约25%, 之后释放趋缓慢, 在168 h累计释放(43.99 ± 3.35)%。从体外释放曲线看, DSF-NSps 7天释放不到50%, 其主要原因可能是释放到介质中DSF发生降解, 导致实测的药物量较释放出来的药物量减少, 见图 5A。DSF混悬液(0.4% CMC)释放缓慢, 在24 h累计药物释放约13.61%, 168 h累计释放仅为(15.76 ± 2.48)%, 释放率低的主要原因是DSF溶解度低, 混悬液颗粒大、溶出低, 同时释放到介质中的DSF也易发生降解。
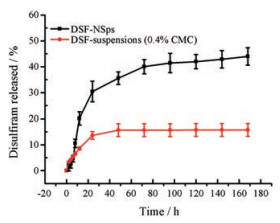
|
Figure 6 Cumulative DSF release from DSF-NSps and DSF suspensions (0.4% CMC) at 37 ℃ with in 168 h (n = 3, x ± s) |
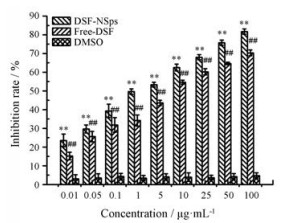
如图 7所示, 无论是游离DSF还是DSF-NSps, 对4T1细胞的生长抑制都具有剂量依赖关系。但在所有的浓度点, DSF-NSps的生长抑制作用都非常显著地高于游离DSF (P < 0.01), DSF-NSps和DSF的DMSO溶液对4T1细胞在48 h的IC50分别为1.069和5.526 μg·mL-1, 组间差异显著(P < 0.01)。说明DSF-NSps提高了DSF的体外抗肿瘤作用, 这既有纳米粒包封的保护作用减少DSF-NSps中DSF降解, 也有载药纳米粒提高细胞对药物摄取的作用。
|
Figure 7 Proliferation inhibition of DSF-NSps against 4T1 cells after 48 h of incubation. n = 3, x ± s. **P < 0.01vs free DSF, ##P < 0.01 vs dimethyl sulfoxide (DMSO) |
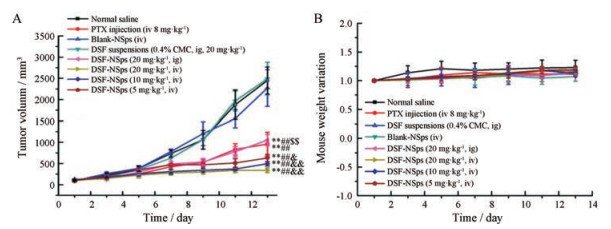
以紫杉醇注射液(8 mg·kg-1, iv)为阳性对照, 生理盐水作为阴性对照, 实验中各组荷瘤鼠的肿瘤体积随时间变化曲线见图 8A, 小鼠体重随时间变化曲线如图 8B所示, 实验结束时各组小鼠肿瘤情况见图 9。生理盐水组肿瘤体积迅速增加, 两周后达到2 500 mm3, DSF物理混悬液几乎没有观察到抗肿瘤作用(图 8A)。然而, DSF-NSps无论静脉注射还是口服给药均表现出显著肿瘤生长抑制作用(P < 0.05)。口服给药组(20 mg·kg-1)肿瘤抑制率均与紫杉醇注射液组(8 mg·kg-1)无显著差异(59.03%与55.01%), DSF-NSps静脉注射高、中、低剂量组肿瘤抑制率(80%、75.86%、69.21%)均与紫杉醇注射液(55.01%)相比具有显著性差异(P < 0.05), 并具有良好的量效关系。从体重随时间变化曲线可知, 各组小鼠平均体重比较稳定, 并略有上升。
|
Figure 8 The in vivo anti-tumor study on 4T1-bearing mice. A: Change of tumor volunm of 4T1 tumor-bearing mice with time; B: Change of relative body weight of 4T1 tumor-bearing mice with time. PTX: Paclitaxel. n = 8, x ± s. **P < 0.01 vs NaCl solution group; ##P < 0.01 vs blank group; $$P < 0.01 vs DSF suspensions group; & P < 0.05, & & P < 0.01 vs PTX group |

|
Figure 9 Tumor images of 4T1 tumor-bearing mice (n = 8, x ± s) |
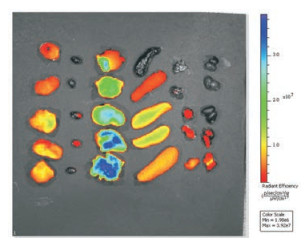
荷瘤小鼠静脉注射荧光标记DSF-NSps (20 mg·kg-1)后组织分布情况如图 10。给药24 h后, DSF-NSps在各组织中的浓度由高到低顺次为:肝 > 脾 > 肿瘤 > 肾 > 心, 可以看出NSps在小鼠体内主要集中在肝、脾和肿瘤。肿瘤/肝的荧光强度比值为(20.28±4.37)%, 说明NSps具有一定的被动靶向特性, 可以通过EPR效应到达肿瘤部位。
|
Figure 10 The distribution of Dir solution, Dir/DSF-NSps in the major organs of tumor-bearing mice at the end of the experiment (24 h) in vivo, fluorescent imaging of tumor part and other vital organs (from left to right: tumor, heart, liver, spleen, lung, kidney) (n = 5, x ± s) |
本文制备的DSF-NSps粒径为175.0 ± 0.75 nm, 可通过EPR效应将药物递送至肿瘤部位[20]; 稳定性研究表明, DSF-NSps在人工胃液、人工肠液及生理盐水、PBS、5%葡萄糖、血浆等生理介质或等渗注射介质中均能稳定存在。因此, 可将其调整为等渗溶液, 适用于口服和静脉给药。
DSF在纯水和PBS中的溶解度非常低, 故体外释放中使用含有1% Tween 80的PBS (0.01 mol·L-1, pH 7.4)作为释放介质, DSF-NSps持续释放7天, 是一种典型的持续和长时间的药物释放体系, 这与DSF的低溶解度有关, 也与药物扩散和基质侵蚀机制有关[21, 22]。DSF在水相中不稳定, 容易降解成二乙基二硫代氨基甲酸(diethyldithiocarbamic acid, DDC), 进一步降解成二硫化碳和乙胺[23]。而作为对照的DSF物理混悬液累计释放较低, 其原因首先是因为DSF溶解度低, 原料药混悬液颗粒大、溶出低、释放慢, 同时释放出来的DSF又很快发生降解。这也部分解释了为什么药效学研究中, DSF物理混悬液几乎没有表现出抗肿瘤作用。DSF物理混悬液口服没有抗肿瘤效果, 与DSF口服戒酒并不冲突, 因为发挥戒酒作用的, 并非DSF原性药物, 而是其在体内的代谢产物[24, 25]。
由于纳米包封的保护作用, 制备的纳米混悬剂显著降低DSF的降解, 这不仅利于DSF-NSps在胃肠道中的稳定性, 也易于被肠微绒毛所滞留[26], 使得从DSF-NSps中释放出来的DSF能较快被吸收入血, 减少了被降解的机会。除了有游离的DSF形式被吸收入血, 部分DSF-NSps还可通过派氏结或经由淋巴系统入血。这些可能是每天口服DSF-NSps (20 mg·kg-1)与隔天注射紫杉醇注射液具有相似抑瘤率的原因。研究结果显示, DSF-NSps可能是DSF发挥抗肿瘤作用有前景的制剂形式, 亟待对其进行更系统、深入的研究, 以便其高效、安全地惠及肿瘤患者。
结论DSF-NSps与市场上的抗肿瘤药物相比, 具有市场价格低、疗效好、耐受性高和安全性高等优点, 具有巨大市场潜力。本研究为DSF进一步研究和临床应用奠定了基础。
| [1] | Cong J, Wang YY, Zhang X, et al. A novel chemoradiation targeting stem and nonstem pancreatic cancer cells by repurposing disulfiram[J]. Cancer Lett, 2017, 409: 9–19. DOI:10.1016/j.canlet.2017.08.028 |
| [2] | Fasehee H, Ghavamzadeh A, Alimoghaddam K, et al. A comparative cytotoxic evaluation of disulfiram encapsulated PLGA nanoparticles on MCF-7 cells[J]. Int J Hematol Oncol Stem Cell Res, 2017, 11: 102–107. |
| [3] | Wang ZP, Tan J, McConville C, et al. Poly lactic-co-glycolic acid controlled delivery of disulfiram to target liver cancer stem-like cells[J]. Nanomedicine, 2017, 13: 641–657. DOI:10.1016/j.nano.2016.08.001 |
| [4] | Najlah M, Ahmed Z, Iqbal M, et al. Development and characterisation of disulfiram-loaded PLGA nanoparticles for the treatment of non-small cell lung cancer[J]. Eur J Pharm Biopharm, 2016, 12: 10–15. |
| [5] | Fasehee H, Dinarvand R, Ghavamzadeh A, et al. Delivery of disulfiram into breast cancer cells using folate-receptor-targeted PLGA-PEG nanoparticles:in vitro and in vivo investigations[J]. J Nanobiotechnol, 2016, 14: 32. DOI:10.1186/s12951-016-0183-z |
| [6] | Morrison BW, Doudican NA, Patel KR, et al. Disulfiram induces copper-dependent stimulation of reactive oxygen species and activation of the extrinsic apoptotic pathway in melanoma[J]. Melanoma Res, 2010, 20: 11–20. DOI:10.1097/CMR.0b013e328334131d |
| [7] | Zhou XZ, Lei T, Miao LL, et al. Disulfiram-loaded mixed nanoparticles with high drug-loading and plasma stability by reducing the core crystallinity for intravenous delivery[J]. J Colloid Interf Sci, 2018, 529: 34–43. DOI:10.1016/j.jcis.2018.05.057 |
| [8] | Liu P, Brown S, Goktug T, et al. Cytotoxic effect of disulfiram/copper on human glioblastoma cell lines and ALDH-positive cancer-stem-like cells[J]. Br J Cancer, 2012, 107: 1488–1497. DOI:10.1038/bjc.2012.442 |
| [9] | Cheriyan VT, Wang Y, Muthu M, et al. Disulfiram suppresses growth of the malignant pleural mesothelioma cells in part by inducing apoptosis[J]. PLoS One, 2014, 9: e93711. DOI:10.1371/journal.pone.0093711 |
| [10] | Liu P, Kumar IS, Brown S, et al. Disulfiram targets cancer stem-like cells and reverses resistance and cross-resistance in acquired paclitaxel-resistant triple-negative breast cancer cells[J]. Br J Cancer, 2013, 109: 1876–1885. DOI:10.1038/bjc.2013.534 |
| [11] | Robinson T, Pai M, Liu J, et al. High-throughput screen identifies disulfiram as a potential therapeutic for triple-negative breast cancer cells:interaction with IQ motif-containing factors[J]. Cell Cycle, 2013, 12: 3013–3024. DOI:10.4161/cc.26063 |
| [12] | Lin MH, Moses DC, Hsieh CH, et al. Disulfiram can inhibit MERS and SARS coronavirus papain-like proteases via different modes[J]. Antiviral Res, 2018, 150: 155. DOI:10.1016/j.antiviral.2017.12.015 |
| [13] | Yang H, Zonder JA, Dou QP. Clinical development of novel proteasome inhibition for cancer treatment[J]. Expert Opin Investig Drug, 2009, 18: 957–971. DOI:10.1517/13543780903002074 |
| [14] | Wang W, Xi M, Duan X, et al. Delivery of baicalein and paclitaxel using self-assembled nanoparticles:synergistic antitumor effect in vitro and in vivo[J]. Int J Nanomedicine, 2015, 10: 3737–3750. |
| [15] | Cvek B. Cytotoxic effect of disulfiram/copper on human glioblastoma cell lines and ALDH-positive cancer-stem-like cells[J]. Br J Cancer, 2013, 108: 993. DOI:10.1038/bjc.2013.18 |
| [16] | Song W, Tang Z, Lei T, et al. Stable loading and delivery of disulfiram with mPEG-PLGA/PCL mixed nanoparticles for tumor therapy[J]. Nanomedicine, 2016, 12: 377–386. DOI:10.1016/j.nano.2015.10.022 |
| [17] | Fasehee H, Zarrinrad G, Tavangar SM, et al. The inhibitory effect of disulfiram encapsulated PLGA NSps on tumor growth:different administration routes[J]. Mater Sci Eng C, 2016, 63: 587–595. DOI:10.1016/j.msec.2016.03.023 |
| [18] | Abu-Serie MM, El-Rashidy FH. In vitro collapsing colon cancer cells by selectivity of disulfiram-loaded charge switchable nanoparticles against cancer stem cells[J]. Recent Pat Anti-cancer Drug Discov, 2017, 12: 260–271. |
| [19] | Hoda M, Pajaniradje S, Shakya G, et al. Anti-proliferative and apoptosis-triggering potential of disulfiram and disulfiram-loaded polysorbate 80-stabilized PLGA nanoparticles on hepatocellular carcinoma Hep3B cell line[J]. Nanomedicine, 2016, 12: 1641–1650. DOI:10.1016/j.nano.2016.02.013 |
| [20] | Zhang L, Tian B, Li Y, et al. A copper-mediated disulfiram-loaded pH-triggered PEG-shedding TAT peptide-modified lipid nanocapsules for use in tumor therapy[J]. ACS Appl Mater Interfaces, 2015, 7: 25147–25161. DOI:10.1021/acsami.5b06488 |
| [21] | Duan X, Xiao J, Yin Q, et al. Multi-targeted inhibition of tumor growth and lung metastasis by redox-sensitive shell crosslinked micelles loading disulfiram[J]. Nanotechnology, 2014, 25: 125102. DOI:10.1088/0957-4484/25/12/125102 |
| [22] | Dinarvand R, Sepehri N, Manoochehri S, et al. Polylactide-co-glycolide nanoparticles for controlled delivery of anticancer agents[J]. Int J Nanomed, 2011, 5: 877–895. |
| [23] | Li HL, He YX, Gao QH, et al. Folate-polyethylene glycol conjugated carboxymethyl chitosan for tumor-targeted delivery of 5-fluorouracil[J]. Mol Med Rep, 2014, 9: 786–792. DOI:10.3892/mmr.2014.1917 |
| [24] | Ma BJ, Hou PY, Zeng Y, et al. Determination of related substances in disulfiram bulk drug by HPLC and investigation of its stability[J]. West China J Pharm Sci (华西药学杂志), 2015, 30: 94–96. |
| [25] | Conticello C, Martinetti D, Adamo L, et al. Disulfiram, an old drug with new potential therapeutic uses for human hematological malignancies[J]. Int J Cancer, 2012, 131: 2197–2203. DOI:10.1002/ijc.27482 |
| [26] | Ji YB, Nie FR, Zhou XX, et al. Preparation of gambogic acid naonosuspensions and their anti-tumor efficacy[J]. Acta Pharm Sin (药学学报), 2018, 53: 453–459. |
 2019, Vol. 54
2019, Vol. 54


