2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850;
3. 安徽医科大学, 安徽 合肥 230032
2. Department of Pharmaceutical Sciences, Beijing Institute of Radiation Medicine, Beijing 100850, China;
3. Anhui Medicine University, Hefei 230032, China
我国恶性肿瘤疾病中肺癌发病率和死亡率均排名第一。全球肺癌死亡人数约占全部恶性肿瘤的18.4%。非小细胞肺癌约占肺癌的80%[1]。目前肺癌治疗方式包括手术、放疗、化疗和分子靶向治疗等。化疗药多采用口服或静脉给药方式, 药物分布全身, 在肺癌组织中分布有限, 并可能对正常组织产生严重毒性[2]。
美乐托宁(melatonin, MLT), 化学名为N-乙酰基-5-甲氧基色胺, 是一种人体松果体分泌的内源性小分子, 有广泛的生理活性, 包括调节人体生理节律、抗衰老、抗氧化和免疫调节等[3]。随年龄增长, 人体内MLT分泌减少, 与老年多发恶性肿瘤趋势相同。因此MLT可能和肿瘤发生有直接关系, 补充MLT可能减少肿瘤的发生发展。近年来, 越来越多研究表明MLT具有抗肿瘤作用, 但其作用机制目前尚不完全清楚。由于MLT口服生物利用度低(< 15%)、体内半衰期短(< 30 min), 成药性差, 阻碍其进入临床应用[4, 5]。
肺部给药系统治疗肺部疾病时, 可直接将药物递送于病变组织, 减少药物的全身暴露, 可增效减毒[6, 7]。特别对于抗肺癌药物, 肺部吸入给药可能大大减少在其他正常组织的药物浓度, 有利于减毒增效。本实验室一直开展治疗肺部疾病的肺部给药系统研究, 包括治疗原发性肺癌的姜黄素脂质体粉雾剂和冬凌草甲素大多孔微粒[8, 9]。脂质体由磷脂双分子层构成, 与细胞亲和力强, 易携带药物进入细胞, 并可呈现一定靶向性, 因此可减少药物剂量, 增加药效[10, 11]。基于MLT的抗肿瘤作用, 以及肺部给药有利于肺癌治疗的特点, 可将其制备成肺吸入给药剂型用于原发性肺癌的治疗。本文制备了美乐托宁脂质体粉雾剂(liposomal melatonin dry powder inhalers, LMD), 进行物理化学性质、肺部沉积、细胞药效和毒性考察, 建立了大鼠原发性肺癌模型, 经气管喷入MLT、LMD治疗原发性肺癌, 并与吉西他滨进行对照, 考察药效及作用机制, 为肺吸入药物治疗肺癌提供新方法和思路。
材料与方法动物 雄性SD大鼠, 体重(200±20) g, SPF级, 许可证号: SCXK (京) 2016-0006, 北京维通利华实验动物技术有限公司提供, 自由给予水和食物。动物实验经伦理委员会批准且实验均按照相关指导原则和规定进行。
试剂及药物 美乐托宁(纯度≥98%, 浙江黄岩延年褪黑素有限公司); 吉西他滨(含量99.9%, 北京凯森莱医药科技有限公司); 大豆磷脂(注射用, 上海艾伟拓医药科技有限公司, 批号: 20150725);胆固醇(国药集团化学试剂有限公司, 批号: F20101215);甲醇(色谱纯, 美国Fisher Scientific公司); 碘化油注射液(13LU603A, 法国Guerbet公司); 3-甲基胆蒽(MCA, 227590, 加拿大TRC公司); N, N-二乙基亚硝胺(DEN, 22VGQ-EC, 日本Tokyo Chemical Industry公司); 甘露醇(北京凤礼精求商贸有限公司, 批号: 20131228); A549细胞(中国协和细胞库); 1640培养基(苏州赛默飞世尔公司, 批号: 8117238);胎牛血清(BSA, 浙江天杭生物科技有限公司, 批号: 20161220); HLC-8培养基(Gibco Life Technologies公司, 批号: 1886522); Annexin V-FITC试剂盒(NB14526)、大鼠血管内皮生长因子(vascular endothelial growth factor, VEGF) ELISA试剂盒(批号: R180504-103a) (欣博盛生物科技有限公司); CCK-8试剂盒(Gen-View科学公司, 批号: 7907010130)。
仪器 倒置荧光显微镜(BDS200-FL, 重庆奥特光学仪器有限责任公司); 酶标仪(ELX800, 美国伯腾仪器有限公司); 纳米激光粒度仪(Zetasizer Nano ZS, 英国马尔文公司); 激光粒度仪(BT-2001, 丹东百特仪器有限公司); 吸入药物粒度分布测定仪(next generation impactor, NGI, 英国Copley公司); MJ咽喉镜(江苏迈骏医疗科技有限公司); 冷冻干燥机(LGJ-30, 华中松源科技有限公司); 高效液相色谱仪(Agilent 1260 Infinity, 美国安捷伦公司); 细胞培养超净台(DL-CJ-ZNDI, 北京哈东联哈尔仪器制造有限公司); 二氧化碳培养箱(HF-90, 上海力康科学仪器有限公司); 流式细胞仪(美国BD公司)。
脂质体处方优化 美乐托宁脂质体(liposomal melatonin, LM)采用乙醇注入法制备, 确定影响LM包封率的3个因素和3个水平分别为:大豆磷脂与胆固醇的质量比为3:1、5:1和10:1, 磷脂与药物的摩尔比为1:1、2:1和3:1, 磷酸盐缓冲溶液(PBS)与有机相体积比为3:1、4:1和5:1。用正交设计法优化LM处方(表 1), 以MLT包封率作为优化指标, 筛选出LM最优处方, 然后以大豆磷脂和甘露醇质量比分别为1:3、1:4和1:5, 在LM混悬液中加入甘露醇后冻干, 观察冻干效果。
| Table 1 Factors and levels for the orthogonal design of liposomal melatonin (LM) formulations. MLT: Melatonin |
粉雾剂的制备 取胆固醇50 mg和大豆磷脂500 mg加入10 mL乙醇中, 水浴超声条件下完全溶解, 继续加入MLT 140 mg溶解, 用注射器吸取后, 以约1 mL·min-1速率注入到磁力搅拌的pH 7.4 PBS 50 mL中, 室温下继续搅拌12 h, 加入2 g甘露醇溶解后, 在玻璃培养皿中冷冻干燥48 h, 得到白色粉末, 过180目筛, 得到LMD。同上处方, 不含MLT, 制备得到空白脂质体粉雾剂。
包封率与载药量测定 用高效液相色谱法(HPLC)测定LM和LMD中的MLT, 条件为C18 ODS柱(250 mm×4.5 mm, 5 μm), 柱温25 ℃, 流动相是甲醇-水-三氟乙酸(45:55:0.05, v/v/v), 检测波长222 nm, 流速0.8 mL·min-1, 样品体积10 µL。MLT的甲醇溶液作为贮备液, 用流动相稀释后测定, 获得MLT标准曲线。
LM用G-25葡聚糖凝胶柱色谱法分离获得游离MLT与完全包封MLT的脂质体, 分别用流动相稀释后测定, 得到LM游离MLT量(WLM/free)和LM包封MLT量(WLM/en), 按公式(1)计算LM包封率(EE%)。
| $ {\rm{EE}}\% = \frac{{{W_{{\rm{LM/en}}}}}}{{{W_{{\rm{LM/en}}}} + {W_{{\rm{LM/free}}}}}} $ | (1) |
取适量LMD用pH 7.4 PBS复溶后, 同上操作, 分离得到LMD中游离MLT量(WLMD/free)与完全包封MLT的脂质体量(WLMD/en), 按公式(2)和(3)分别计算LMD的MLT包封率(EE%)和载药量(DL%)。
| $ {\rm{EE}}\% = \frac{{{W_{{\rm{LMD/en}}}}}}{{{W_{{\rm{LMD/en}}}} + {W_{{\rm{LMD/free}}}}}} $ | (2) |
| $ DL\% = \frac{{{W_{{\rm{LMD/en}}}}}}{{{W_{{\rm{LMD}}}}}} $ | (3) |
粒径与电位测定和电镜观察 取少量LMD, 用pH 7.4 PBS复溶, 在纳米激光粒度仪上测定粒径和zeta电位(n=3)。取5 μL复溶后的混悬液于铜网支持碳膜上, 用2%磷钨酸溶液(pH 7.0)负染, 室温下干燥, 用透射电镜(TEM)观察粒子形态。取适量MLT及LMD粉末置于双面导电胶上, 高压气体吹去未附着颗粒, 用40 mA电子束喷金20 min, 在扫描电镜(SEM)下观察粒子形态。
空气动力学粒径测定 用量筒法测定MLT、吉西他滨和LMD粉末的振实密度(n=3), 用激光粒度仪测定粒子几何粒径(De)。按公式(4)计算粉末粒子的空气动力学粒径[12]。
| $ {D_{\rm{a}}} = {D_{\rm{e}}}\sqrt {\frac{{{\rho _{\rm{p}}}}}{{{\rho _{\rm{o}}}\chi }}} $ | (4) |
其中, Da和De分别为空气动力学粒径和几何学粒径(D50); ρp为有效颗粒密度, 为振实密度的1.26倍[13, 14]; ρo为参照密度, 等于1 g·cm-3; χ为动态形态因子(球形时χ=1, 本文采用1)。因此粒子的几何粒径、密度和形状都会影响Da[15]。Da是影响药物肺部沉积部位的最主要因素。一般认为Da在1~5 μm内粒子可以到达肺细支气管[16]。
微细粒子比例的测定 分别称取MLT和LMD粉末装入3号羟丙甲纤维素胶囊, 每粒含MLT 10 mg。取10粒胶囊, 分次放入吸入器(Twister®, 美国Aptar公司), 连接NGI, 空气流速60 L·min-1, 测定微细粒子比例(fine particle fraction, FPF)。用无水乙醇冲洗NGI中装置、喉部、1级及2级室, 收集冲洗液至50 mL量瓶中, 乙醇定容; 其他级室中粉末同样冲洗和收集至25 mL量瓶中并定容, 测定MLT含量, 按公式(5)计算MLT和LMD粉末中FPF。
| $ {\rm{FP}}{{\rm{F}}_{{\rm{<8}}{\rm{.06}}\;{\rm{ \mathsf{ μ}m}}}} = \frac{{{W_{2 \sim 7}}}}{{{W_{{\rm{total}}}}}} \times 100\% $ | (5) |
其中, W2~7: 2~7级室中MLT量; Wtotal: NGI中MLT总量。
药物释放实验 分别取MLT粉末(1 mg)、LMD (含MLT 1 mg)粉末各3份于透析袋(截留分子质量3 500 Da)中, 分别加入人工肺液3 mL (表 2)[17]混悬, 密封, 放入盛有50 mL人工肺液的三角瓶中[18], 在37 ℃恒温振荡器(150 r·min-1)中振摇, 分别于1、2、3、4、5、6、8、10、12和24 h取释放液2 mL, 立刻补充2 mL人工肺液。释放液经0.22 µm滤膜过滤, 续滤液依“包封率与载药量测定”项下测定MLT, 绘制时间-累积释放率曲线。
| Table 2 Formula of simulated lung fluids[17] |
A549和BEAS-2B细胞毒性评价 用CCK-8方法测定药物对人肺癌A549细胞和人正常支气管细胞BEAS-2B细胞的毒性。两种细胞分别采用含10%胎牛血清的1640培养基和HLC-8培养基培养, 接种于96孔培养板, 每孔5×105个细胞, 在37 ℃和5% CO2条件下孵育8 h。用含0.1%二甲基亚砜的上述培养基配制MLT、LMD、吉西他滨和空白脂质体粉雾剂混悬液, 替换培养基, 与细胞共孵育24 h, 除去培养基, 每孔加入10% CCK-8溶液100 μL, 继续孵育2 h后用酶标仪测定吸光度(A, 450 nm)。10% CCK-8溶液作为空白组, 正常细胞培养组作为对照组, 其余为实验组, 按公式(6)计算细胞存活率(CL)。
| $ {\rm{CL}} = \frac{{{A_{实验组}} - {A_{空白组}}}}{{{A_{对照组}} - {A_{空白组}}}} \times 100\% $ | (6) |
流式细胞术检测细胞凋亡 将A549细胞接种于6孔板中(每孔5×106个细胞), 同上操作, 8 h后每孔分别加入含MLT或LMD的培养基1 mL, MLT终浓度为2.5 mmol·L-1, 孵育12 h后弃去培养基, 消化分散细胞并收集至5 mL离心管中, 900 r·min-1离心5 min, 弃去上清, 用pH 7.4 PBS 1 mL轻微冲洗2次, 然后每管加入fluorescein isothiocyanat (Annexin V-FITC)试剂200 µL, 混匀, 室温下避光保存10 min, 再加入碘化丙啶(propidium iodide, PI)试剂10 µL, 混匀, 1 h内用流式细胞仪检测细胞凋亡。
肺癌模型的建立 取适量MCA和DEN加入碘化油注射液中, 在70 ℃加热20 h (每3 h振摇均匀), 其中MCA均匀混悬, DEN完全溶解, 得到含100 mg·mL-1 MCA和10% DEN碘化油混悬液作为肺癌诱变剂。取0.1 mL肺癌诱变剂经气管喷入大鼠肺中, 正常饲养条件下45日后得到原发性肺癌大鼠[8]。
动物给药及处理 将5只健康大鼠作为a组(healthy), 肺部给予生理盐水0.2 mL。将25只原发性肺癌大鼠分组和肺部给药方案(每日1次, 持续4日)如下: b组(model), 生理盐水0.2 mL; c组(blank liposomes), 空白脂质体粉雾剂32.25 mg; d组(MLT), MLT粉末2 mg (10 mg·kg-1); e组(gemcitabine), 吉西他滨粉末2 mg; f组(LMD), LMD 32.25 mg (含MLT 2 mg)。给肺癌诱变剂15日后肺部给予LMD 32.25 mg (含MLT 2 mg) (每周1次, 持续4周), 用于考察LMD治疗早期肺癌, 作为g组(LMD*)。肺部给药时, 用喉镜插入大鼠口腔, 暴露气管, 将灌胃管与三通阀(内装粉末, 均经180目过筛)和2 mL注射器连接, 注射器充气加压, 打开阀门, 快速将粉末喷入肺中。
肺部外观及病理检查 大鼠末次给药(4日)后, 采用10%水合氯醛(1 mL)麻醉处死, 暴露气管和胸腔, 气管T型切口, 12号灌胃针插入左主支气管, 止血钳结扎右主支气管, 4 ℃生理盐水灌洗左肺。摘除右肺, 照相, 取上叶组织在10%甲醛溶液中固定, 常规脱水和石蜡包埋, 用苏木素-伊红(hematoxylin and eosin, H & E)染色后在显微镜下观察组织病理形态。
免疫组化检测 取组织石蜡切片依次经二甲苯、无水乙醇、蒸馏水洗涤后, 置于盛满柠檬酸抗原修复缓冲液(pH 6.0)的修复盒中于微波炉内进行抗原修复, 洗涤3次, 加入3%过氧化氢溶液, 避光孵育25 min, 加入pH 7.4 PBS, 在脱色摇床上晃动洗涤3次, 每次5 min。加用3% BSA均匀覆盖组织, 室温封闭30 min, 加一抗试剂, 湿盒内4 ℃孵育过夜, 加二抗试剂覆盖组织, 室温孵育50 min后同上操作。切片滴加DAB显色液, 在显微镜下控制显色时间, 阳性为棕黄色, 水冲洗切片终止显色, 苏木素复染3 min, 水洗, 1%盐酸酒精短暂分化, 水洗, 加氨水, 水洗, 切片经脱水处理, 中性树胶封片, 显微镜下观察和照相。上述组织切片按照Tunel检测过程处理并染色, 在荧光显微镜下观察细胞凋亡。
肺组织中标志物测定 取右肺下叶组织加1/10量的生理盐水, 匀浆, 用ELISA试剂盒检测匀浆液中VEGF和丙二醛(malondialdehyde, MDA); 用BCA Protein Assay Kit测定匀浆液中总蛋白。
统计学分析 采用SPSS 17.0软件进行数据进行统计学分析(单因素方差分析, LSD), P < 0.05表示具有差异, P < 0.01表示具有显著性差异。实验数据以均数±标准差( x ± s)表示。
结果 1 美乐托宁脂质体粉雾剂的最优处方不同处方LM的包封率显示(表 3), 大部分处方的包封率大于90%;其中A3处方(即大豆磷脂与胆固醇的质量比为10:1)的包封率接近100%, 证明脂质体膜中胆固醇的含量是影响MLT包封率的重要因素。有文献[19]证明MLT和胆固醇有一定相互作用。通过正交设计分析确定LM的最优处方为A3B2C3, 即大豆磷脂与胆固醇的质量比为10:1, 磷脂与MLT的摩尔比为2:1, PBS与有机相体积比为5:1;用该处方制备的LM包封率为98.9%。在LMD制备中, 甘露醇与磷脂的质量比大于4:1时, 冻干效果较好, 为提高载药量, 确定LMD的最优处方为甘露醇与磷脂的质量比为4:1。用此处方制备的LMD粉末休止角为30o, 流动性好, 未来有利于粉末灌装。LMD的载药量为6.2%, 复溶后的脂质体包封率未变。
| Table 3 Entrapment efficiencies of MLT according to the orthogonal design of LM formulations |
LM是呈现淡蓝色散射光的混悬液。LMD是易流动的疏松白色粉末。SEM显示MLT原料粉末是柱状晶体的聚集颗粒, 粒径较大; 而LMD粉末大部分为类球形颗粒, 粒径约为20 μm (图 1)。

|
Figure 1 Scanning electron microscopic (SEM) images of MLT powders and liposomal melatonin dry powder inhalers (LMD) |
TEM显示LMD复溶的脂质体是均匀的球形囊泡(图 2A), 其水动力学直径为(65.15±5.6) nm (n=3) (图 2B), 多分散系数PDI为0.20±0.14 (n=3), 证明其粒径小且均一, zeta电位为(-14.2±0.59) mV (n=3) (图 2C)。
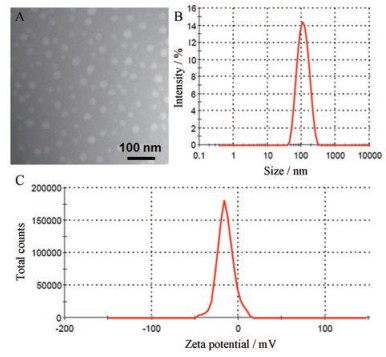
|
Figure 2 Transmission electron microscopic (TEM) images of reconstitution of LMD in phosphate buffered solutions (PBS) (A), and their particle size distribution (B), and zeta potential (C) |
MLT原料粉末、吉西他滨原料粉末和LMD的松密度分别为0.414±0.032、0.463±0.065和0.144±0.029 g·cm-3 (n=3), 均为较疏松粉末, 振实密度分别为0.601±0.013、0.572±0.082和0.296±0.064 g·cm-3, De分别为3.72±0.019、3.53±0.002和3.64±0.005 μm, Da分别为3.23±0.012、2.99±0.006和2.22±0.006 μm。3种粉末Da均在1~5 μm内, 适合肺吸入。
2.4 肺部沉积率粉末的肺部沉积率可用FPF表达。MLT原料粉末的FPF < 8.06 μm为21.9%, LMD的FPF < 8.06 μm为22.2%, 两者相近, 均较适合肺吸入给药(图 3)。
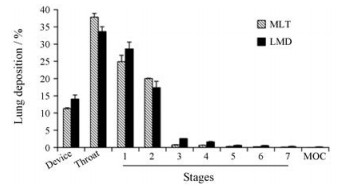
|
Figure 3 Simulated drug lung deposition of MLT powders and LMD in the different compartments of next generation impactor (NGI). n = 4, x ± s |
LMD和MLT在人工肺液中累计释放率较大(图 4)。5 h时LMD和MLT累积释放率分别为66.51%和70.39%, 二者释放率接近, 但8 h时LMD释放率为69.93%, 小于MLT释放率(84.48%), 证明脂质体中MLT有一定缓释性。这可能与MLT和脂质体中胆固醇相互作用有关[19]。12 h时LMD和MLT释放率接近, 已大部分释放, 分别为76.03%和84.92%。二者的上述释放率未见统计学差异。
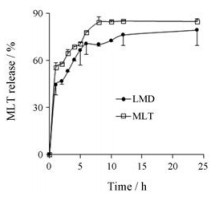
|
Figure 4 Release of MLT from the MLT powders and LMD in the simulated lung fluids. n = 4, x ± s |
BEAS-2B细胞是人正常支气管上皮细胞, 常用于肺部给药的安全性评价[20, 21]。当药物浓度小于1 mmol·L-1时, LMD、MLT和吉西他滨的BEAS-2B细胞毒性小, 细胞存活率均在80%以上(图 5A)。在高药物浓度(> 2.5 mmol·L-1)时, LMD和MLT仍保持BEAS-2B细胞低毒性, 细胞存活率超过70%, 但吉西他滨的毒性增加, 其细胞存活率和前二者呈现显著差异(图 5B, P < 0.01)。当药物浓度达到5 mmol·L-1时, LMD和MLT仍保持低的细胞毒性, 而吉西他滨组的细胞存活率仅为48.17% (图 5A)。因此, 吉西他滨的BEAS-2B细胞毒性大[22], 而MLT、LMD的细胞毒性小, 安全性好。
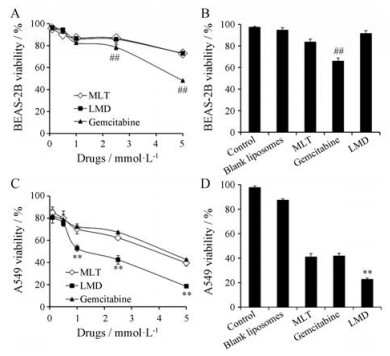
|
Figure 5 Cytotoxicity of MLT, LMD and gemcitabine on BEAS-2B cells depending on concentrations (A) and at 2.5 mmol·L-1 (B), and A549 cells depending on concentrations (C) and at 5 mmol·L-1 (D). n = 4, x ± s. **P < 0.01 vs MLT or gemcitabine; # #P < 0.01 vs MLT or LMD |
人肺癌细胞A549常用于评价抗肺癌药物活性[23]。本研究中, 低药物浓度(< 0.5 mmol·L-1)条件下, LMD、MLT和吉西他滨的A549细胞毒性接近; 当药物浓度大于1 mmol·L-1时, LMD的A549细胞毒性显著大于MLT和吉西他滨, 后二者相近(图 5C); 药物浓度为5 mmol·L-1时, 三者的细胞存活率分别为18.6%、39.6%和42.7%, 前者和后二者有显著性差异(图 5D)。三者IC50分别为1.16、4.3和6.04 mmol·L-1。空白脂质体粉雾剂无明显细胞毒性。因此MLT有较强抗肺癌细胞作用, 脂质体可显著促进MLT的抗癌作用。这与文献[24]报道脂质体制剂可增强药效的结果一致。
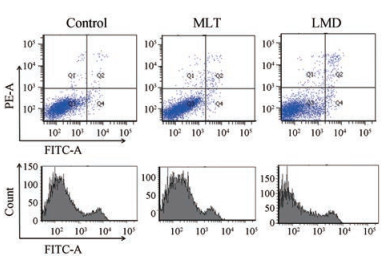
用流式细胞仪检测MLT、LMD对A549细胞作用, 凋亡率分别为4.2%和12.3% (图 6), 进一步证明了脂质体可增强美乐托宁对A549细胞早期与晚期凋亡作用。
|
Figure 6 Flow cytometric graphs of A549 cells after treatment with MLT and LMD |
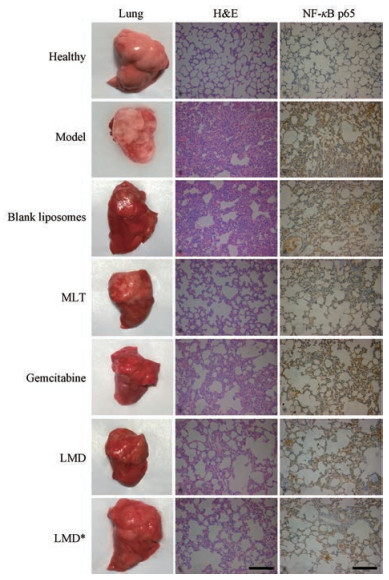
与正常肺组织比较, 肺癌模型组和空白脂质体粉雾剂组的大鼠肺组织有大量肺癌白色结节(图 7, 而各治疗组的肺组织外观结节较少。H & E染色表明健康大鼠肺泡结构清晰完整。肺癌模型组和空白脂质体粉雾剂组有大量细胞增生和炎性细胞浸润(图 7), 而各治疗组病理状态明显减轻, 其中肺癌结节显著减少, 细胞增生与炎性细胞浸润现象也显著减轻, LMD组效果最好。
|
Figure 7 Appearance of lung tissues, the images of hematoxylin and eosin (H & E, 200×) and the expression of nuclear factor kappa B p65 (NF-κB p65) (200×). The scale bars indicate 100 μm. LMD* indicates administration of LMD earlier than other regimens for the lung cancer rats treated with LMD, once a week, 15 days post-administration of carcinogen |
VEGF诱导血管生成, 促进肿瘤组织生长和高密度血管化。MLT可抑制内源性VEGF表达[3, 25, 26]。结果如图 8所示, 模型组的VEGF高度表达。药物治疗后, VEGF表达显著下降, 其中LMD组下降最明显, 接近于正常水平, 除LMD早期治疗组(LMD*组)外, 与其他组有显著性差异, 特别是与MLT组比较, 差异比与吉西他滨组更大。因此脂质体可显著增强MLT的抗肿瘤活性。LMD早期给药(LMD*组)也促进VEGF表达显著下调, 与LMD常规给药组(LMD组)无差异, 说明LMD对肿瘤早期治疗同样有较好效果。

|
Figure 8 Expression of vascular endothelial growth factor(VEGF) in the lung tissues of healthy rats (a), tumor-bearing rats without treatment (b), tumor-bearing rats treated with blank liposomes (c), MLT (d), gemcitabine (e), LMD (f), and LMD* (g). n = 4, x ± s. **P < 0.01 vs MLT or gemcitabine |
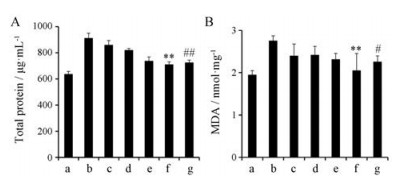
MLT具有良好的抗炎和抗氧化作用[27, 28]。肿瘤往往表现炎症反应和氧化应激水平增加。总蛋白量是炎症反应的直接标志。本研究中模型组的总蛋白量最高, 各药物治疗组的总蛋白量均显著下降, 证明炎症被显著抑制(图 9A), 其中LMD组效果最强, 与MLT组有显著差异。各药物治疗组中除MLT组外, MDA水平均显著下降(图 9B), 显示较强抗氧化作用。LMD早期给药组(LMD*组)与LMD常规给药组(LMD组)的抗炎和抗氧化作用均无显著差异, 证明LMD在肿瘤早期阶段给药同样产生强的抗炎和抗氧化作用。
|
Figure 9 Expression of total proteins (A) and malondialdehyde (MDA) (B) in the lung tissues. The meanings of a-g are referred to Figure 8. n = 4, x ± s. **P < 0.01 vs MLT (d) or tumor-bearing rats without treatment (b); #P < 0.05, # #P < 0.01 vs tumor-bearing rats without treatment (b) |
NF-κB具有明显的抑制细胞凋亡的功能, 与肿瘤的发生、生长和转移等多个过程密切相关。NF-κB持续激活会刺激细胞生长, 导致细胞增殖失控。NF-κB对肿瘤转移具有明显的促进作用, 能促进肿瘤转移相关基因ICAM-1、VCAM-1和MMP-9等表达。已有报道MLT抑制肿瘤细胞NF-κB p65表达, 发挥抗肿瘤作用[29, 30]。本研究中治疗组与模型组比较, NF-κB p65的表达明显降低(图 7), 其中MLT组、LMD组和LMD*组比吉西他滨组更显著, 说明MLT可明显下调NF-κB p65表达。
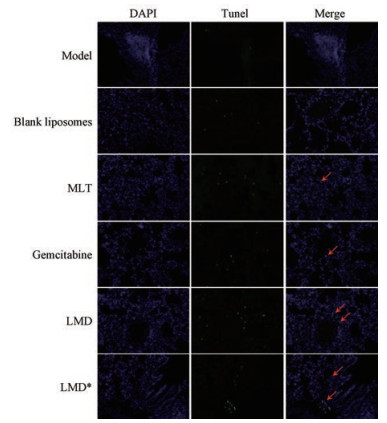
肺组织中细胞凋亡可用Tunel检测。模型组和空白脂质体组中细胞凋亡几乎没有发生, MLT组和吉西他滨组出现细胞凋亡, LMD组和LMD*组的细胞凋亡明显增多(图 10)。因此脂质体可明显增强MLT促进肿瘤细胞凋亡的效果, 并且脂质体剂型在肿瘤早期给药同样有效。
|
Figure 10 Apoptosis indicated by Tunel staining (200×). The nuclei are shown by 4', 6'-diamidino-2-phenylindole (DAPI) staining (200×). The merged images of Tunel and DAPI staining show the apoptosis in the lung cells. The group names are referred to the text and LMD* indicates administration of LMD earlier than other regimens |
目前肺癌化疗药物主要是全身给药, 易带来严重毒副作用。目前一线化疗药物如吉西他滨, 针对肿瘤细胞周期的某个阶段, 长期使用易产生耐药性[31]。MLT是人体内源性物质, 已被作为保健食品广泛使用, 其安全性已得到确认, 同时MLT具有广泛的药理作用, 越来越多的研究表明其具有明显的抗肿瘤作用, 但其口服生物利用度低, 影响了对肿瘤等疾病的治疗效果。理想的给药方式是将药物直接递送于病变组织, 可获得高效低毒的效果。本研究在分析肺癌的病理解剖特点和MLT的抗肿瘤作用后, 设计了肺吸入LMD用于治疗原发性肺癌。
MLT分子微溶于水, 虽然其原料粉末在体外释放实验中释放率较高, 但肺吸入在局部的液体量很少, 可能影响其溶解和扩散。将MLT制备成脂质体是比较好的选择, 可获得高包封率, 受肺组织液体量少的影响小, 脂质体的细胞融合性也较好, 有利于进入肿瘤细胞。本文采用乙醇注入法可得到包封率很高的LM, 这和MLT与胆固醇的相互作用相关[19]。乙醇注入法得到的脂质体浓度一般较小, 如果直接给药, 剂量难以提高, 但将其进一步制备成粉雾剂, 不存在液体稀释问题, 较容易调节给药剂量。LMD复溶后脂质体粒径小、包封率不变, 证明了粉雾剂处方和冻干工艺的优势, 有利于粉末进入肺组织后快速形成脂质体。MLT原料粉末和LMD在人工肺液中的释放率相近, 这和MLT微溶于水以及LMD快速形成脂质体的性质相关, 但脂质体和MLT比较有一定缓释作用, 可能与MLT分子和脂质体膜中胆固醇分子的相互作用有关[19], 胆固醇阻止了MLT分子从脂质体中扩散。
粉雾剂与其他肺吸入剂型如气雾剂、雾化吸入溶液比较, 更方便, 稳定性更好, 给药剂量也可较大, 适合肺癌治疗。体外模拟肺部沉积实验可评价粉雾剂在呼吸道不同部位的沉积效果。在60 L·min-1气流速度条件下, NGI撞击器的1~7级截止的粒径分别为8.06、4.43、2.82、1.66、0.94、0.55和0.34 μm, 其中1级粒径较大, 一般分布在上呼吸道; 2~7级粒子的粒径基本小于5 μm, 较易进入肺部, 并能沉积在肺深部; 而8级粒子的粒径小并较轻, 易随呼吸排除体外, 不能沉积在肺深处。因此, 选择微细粒子比例FPF < 8.06 μm代表粉雾剂肺部沉积率。LMD肺部沉积率为22.2%, 可获得有效肺部沉积, 并且遇水复溶后能快速恢复成脂质体, 粒径小、稳定性好, 其包封率没有变化, 是比较理想的肺吸入制剂。
在体外药效学和正常组织细胞安全性评价中, MLT及LMD都表达出较高抗A549肺癌细胞效果, 其中MLT和吉西他滨相当, 而LMD却表现出比它们更高的抗肿瘤效果。LMD的药效特点除了与LMD复溶后可快速在水中扩散外, 还和脂质体的细胞膜亲和性及融合有关[21]。与抗代谢药吉西他滨比较, MLT及LMD对正常肺支气管细胞表现出很高的安全性, 这与MLT作为内源性物质和保健食品的特点一致。
本文对MLT和LMD体内抗肺癌效果和作用机制进行了详细考察。在肺部给药后, 对大鼠原发性肺癌都呈现较高抗肿瘤效果, 但机制有所不同。MLT呈现出明显抑制肿瘤新生血管生成、抗炎、抗氧化和促进肿瘤细胞凋亡作用, 而大部分情况下, LMD在这几方面的作用都显著强于MLT, 进一步证明了脂质体粉雾剂的优势, 并且LMD在肿瘤早期给药同样显示出较强抗肺癌效果。文献[32]中MLT用于治疗小鼠乳腺癌的给药剂量为每日100 mg·kg-1, 连续5日, 剂量较大, 而本研究中肺吸入MLT和LMD的给药剂量为每日10 mg·kg-1, 连续4日, 剂量大大减小, 充分体现了肺吸入给药直接将药物递送至肺癌组织的优势。
文献报道MLT具有明显的抗肿瘤作用, 但在肺癌方面研究少。本文制备了MLT的脂质体粉雾剂, 通过肺部给药, 可将MLT直接递送于肺癌组织, 同时脂质体帮助药物在肺组织内分散, 促进了药物进入细胞, 增强了对肺癌的治疗效果。LMD有望成为高效安全治疗原发性肺癌的肺吸入制剂。
| [1] | Liu RW, Wei S, Chen J, et al. Mesenchymal stem cells in lung cancer tumor microenvironment:their biological properties, influence on tumor growth and therapeutic implications[J]. Cancer Lett, 2014, 353: 145–152. DOI:10.1016/j.canlet.2014.07.047 |
| [2] | Jin J, Hu KJ, Zhou YZ, et al. Clinical utility of the modified glasgow prognostic score in lung cancer:a meta analysis[J]. PLoS One, 2017, 12: e0184412. DOI:10.1371/journal.pone.0184412 |
| [3] | Song N, Kim AJ, Kim HJ, et al. Melatonin suppresses doxorubicin-induced premature senescence of A549 lung cancer cells by ameliorating mitochondrial dysfunction[J]. J Pineal Res, 2012, 53: 335–343. DOI:10.1111/jpi.2012.53.issue-4 |
| [4] | Ma ZQ, Yang Y, Fan CX, et al. Melatonin as a potential anticarcinogen for non-small-cell lung cancer[J]. Oncotarget, 2016, 7: 46768–46784. |
| [5] | Majka J, Wierdak M, Brzozowska I, et al. Melatonin in prevention of the sequence from reflux esophagitis to barrett's esophagus and esophageal adenocarcinoma:experimental and clinical perspectives[J]. Int J Mol Sci, 2018, 19: 2033. DOI:10.3390/ijms19072033 |
| [6] | Kuzmov A, Minko T. Nanotechnology approaches for inhalation treatment of lung diseases[J]. J Control Release, 2015, 219: 500–518. DOI:10.1016/j.jconrel.2015.07.024 |
| [7] | Sørli JB, Sivars KB, Da Silva E, et al. Bile salt enhancers for inhalation:correlation between in vitro and in vivo lung effects[J]. Int J Pharm, 2018, 550: 114–122. DOI:10.1016/j.ijpharm.2018.08.031 |
| [8] | Zhu L, Li M, Liu X, et al. Inhalable oridonin-loaded poly(lactic-co-glycolic)acid large porous microparticles for in situ treatment of primary non-small cell lung cancer[J]. Acta Pharm Sin B, 2017, 7: 80–90. DOI:10.1016/j.apsb.2016.09.006 |
| [9] | Zhang T, Chen Y, Ge Y, et al. Inhalation treatment of primary lung cancer using liposomal curcumin dry powder inhalers[J]. Acta Pharm Sin B, 2018, 8: 440–448. DOI:10.1016/j.apsb.2018.03.004 |
| [10] | Zhang J, Li Y, Xiang ML, et al. Preparation and pharmacodynamic study of curcumin liposome dry powder inhalation[J]. Mil Med Sci (军事医学), 2013, 37: 692–695. |
| [11] | Shen H, Wang LF, Chen WQ, et al. Tissue distribution and tumor uptake of folate receptor-targete depothilone folate conjugate, BMS-753493, in CD2F1 mice after systemic administration[J]. Acta Pharm Sin B, 2016, 6: 460–467. DOI:10.1016/j.apsb.2016.07.009 |
| [12] | Pilcer G, Amighi K. Formulation strategy and use of excipients in pulmonary drug delivery[J]. Int J Pharm, 2010, 392: 1–19. DOI:10.1016/j.ijpharm.2010.03.017 |
| [13] | Hu YZ, Li M, Zhang TT, et al. Preparation of liposomal artesunate dry powder inhalers and the effect on the acute lung injury of rats[J]. Acta Pharm Sin (药学学报), 2016, 51: 1906–1912. |
| [14] | Vanbever R, Mintzes JD, Wang J, et al. Formulation and physical characterization of large porous particles for inhalation[J]. Pharm Res, 1999, 16: 1735–1742. DOI:10.1023/A:1018910200420 |
| [15] | Depreter F, Pilcer G, Amighi K. Inhaled proteins:challenges and perspectives[J]. Int J Pharm, 2013, 447: 251–280. DOI:10.1016/j.ijpharm.2013.02.031 |
| [16] | Elversson J, Millqvist-Fureby A, Alderborn G, et al. Droplet and particle size relationship and shell thickness of inhalable lactose particles during spray drying[J]. J Pharm Sci, 2003, 92: 900–910. DOI:10.1002/jps.10352 |
| [17] | Sdraulig S, Franich R, Tinker RA, et al. In vitro dissolution studies of uranium bearing material in simulated lung fluid[J]. J Environ Radioact, 2008, 99: 527–538. DOI:10.1016/j.jenvrad.2007.08.009 |
| [18] | Zhang L, Chen F, Zheng JT, et al. Chitosan-based liposomal thermogels for the controlled delivery of pingyangmycin:design, optimization and in vitro and in vivo studies[J]. Drug Deliv, 2018, 25: 690–702. DOI:10.1080/10717544.2018.1444684 |
| [19] | Choi Y, Attwood SJ, Hoopes MI, et al. Melatonin directly interacts with cholesterol and alleviates cholesterol effects in dipalmitoylphosphatidylcholine monolayers[J]. Soft Matter, 2014, 10: 206–213. DOI:10.1039/C3SM52064A |
| [20] | Choo WH, Park CH, Jung SE, et al. Long-term exposures to low doses of silver nanoparticles enhanced in vitro malignant cell transformation in non-tumorigenic BEAS-2B cells[J]. Toxicol In Vitro, 2016, 37: 41–49. DOI:10.1016/j.tiv.2016.09.003 |
| [21] | Dai T, Jiang K, Lu W. Liposomes and lipid disks traverse the BBB and BBTB as intact forms as revealed by two-step Förster resonance energy transfer imaging[J]. Acta Pharma Sin B, 2018, 8: 261–271. DOI:10.1016/j.apsb.2018.01.004 |
| [22] | Yang S. A pooled study on combination of gemcitabine and nedaplatin for treating patients with non-small cell lung cancer[J]. Asian Pac J Cancer Prev, 2015, 16: 5963–5966. DOI:10.7314/APJCP.2015.16.14.5963 |
| [23] | Zhou QY, Gui SY, Zhou Q, et al. Melatonin inhibits the migration of human lung adenocarcinoma A549 cell lines involving JNK/MAPK pathway[J]. PLoS One, 2014, 9: e101132. DOI:10.1371/journal.pone.0101132 |
| [24] | Roursgaard M, Knudsen KB, Northeved H, et al. In vitro toxicity of cationic micelles and liposomes in cultured human hepatocyte (HepG2) and lung epithelial (A549) cell lines[J]. Toxicol In Vitro, 2016, 36: 164–171. DOI:10.1016/j.tiv.2016.08.002 |
| [25] | Kim KJ, Choi JS, Kang I, et al. Melatonin suppresses tumor progression by reducing angiogenesis stimulated by HIF-1 in a mouse tumor model[J]. J Pineal Res, 2013, 54: 264–270. DOI:10.1111/jpi.2013.54.issue-3 |
| [26] | Goradel NH, Asghari MH, Moloudizargari M, et al. Melatonin as an angiogenesis inhibitor to combat cancer:mechanistic evidence[J]. Toxicol Appl Pharmacol, 2017, 335: 56–63. DOI:10.1016/j.taap.2017.09.022 |
| [27] | Anisimov VN, Popovich IG, Zabezhinski MA, et al. Melatonin as antioxidant, geroprotector and anticarcinogen[J]. Biochim Biophys Acta, 2006, 1757: 573–589. DOI:10.1016/j.bbabio.2006.03.012 |
| [28] | Szewczyk-Golec K, Rajewski P, Gackowski M, et al. Melatonin supplementation lowers oxidative stress and regulates adipokines in obese patients on a calorie-restricted diet[J]. Oxidat Med Cell Longev, 2017, 2017: 8494107. |
| [29] | Habtemariam S, Daglia M, Sureda A, et al. Melatonin and respiratory diseases:a review[J]. Curr Top Med Chem, 2017, 17: 467–488. |
| [30] | Lu JJ, Fu LY, Tang ZP, et al. Melatonin inhibits AP-2β/hTERT, NF-κB/COX-2 and Akt/ERK and activates caspase/Cyto C signaling to enhance the antitumor activity of berberine in lung cancer cells[J]. Oncotarget, 2016, 7: 2985–3001. |
| [31] | Tsai M, Kuo Y, Chiu Y, et al. Down-regulation of rad51 expression overcomes drug resistance to gemcitabine in human non-small-cell lung cancer cells[J]. J Pharmacol Exp Ther, 2010, 335: 830–840. DOI:10.1124/jpet.110.173146 |
| [32] | Borin TF, Arbab AS, Gelaleti GB, et al. Melatonin decreases breast cancer metastasis by modulating Rho-associated kinase protein-1 expression[J]. J Pineal Res, 2016, 60: 3–15. DOI:10.1111/jpi.12270 |
 2019, Vol. 54
2019, Vol. 54


