2. 山西大学化学化工学院, 山西 太原 030006;
3. 中国医学科学院药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China
黄芩(Scutellaria baicalensis Georgi)为唇形科植物, 常以其根部入药, 药效成分主要为黄酮及其苷类[1], 具有抗菌、抗病毒、抗氧化、抗炎、神经保护等多种药理活性[2, 3], 能够提高小鼠体内抗氧化酶活性, 清除自由基, 减轻氧化损伤, 改善学习记忆能力, 保护神经细胞[4]。黄芩茎叶能够减轻氧化损伤[5], 改善大鼠学习记忆能力[6], 保护海马神经元细胞[7], 人们常采集黄芩茎叶进行加工制成黄芩茶饮用。黄芩花因缺乏利用途径, 造成了大量的资源浪费。然而, 黄芩花同样具有多种黄酮类成分[8], 但对其药理作用的研究甚少。因此, 为了综合开发黄芩药材资源, 本文对黄芩花的抗衰老作用展开研究。
衰老是机体不可逆的一个过程, 常伴随着组织、器官功能的退行性变化。机体不断产生的自由基可诱发氧化应激对细胞造成损伤, 是引起组织器官老化的主要原因之一[9]。目前, D-半乳糖加速老化模型具有与自然衰老类似的学习记忆能力下降、组织器官退行性变化等特点, 已在抗衰老研究中得到广泛应用[10]。
代谢组学是全面、定量的揭示当机体受到外界环境刺激时, 内源性代谢物变化情况的一种方法, 用以发现疾病生物标志物和阐明药物作用机制[11]。核磁共振代谢组学技术具有无偏向性、不破坏样品结构和性质、样品用量少、分析时间短和方法重现性好等优势[12], 在抗衰老的研究中得到广泛应用。许多学者通过核磁共振代谢组学技术研究衰老过程中机体内源性代谢物的变化情况, 鉴别出与衰老相关的生物标志物和代谢通路, 为筛选研发抗衰老药物和研究机体衰老的机制提供了科学依据[13, 14]。
综上, 本研究通过测定羟基自由基和超氧阴离子自由基清除率评价黄芩花体外抗氧化能力, 采用D-半乳糖致衰老大鼠模型, 观察给予黄芩花提取物(Scutellaria flower extract, SFE)后衰老大鼠自主行为的变化, 运用代谢组学技术对SFE抗衰老作用机制进行研究, 定量验证对其影响最大的谷氨酰胺和谷氨酸代谢通路, 为开发利用黄芩花资源提供了理论依据。
材料与方法仪器与试剂 Bruker 600-MHz AVANCE Ⅲ核磁共振仪(德国布鲁克公司); Sartorius BSA124S分析天平(德国Sartorius公司); TGL-16高速台式冷冻离心机(湖南湘仪离心机仪器有限公司); 磷酸二氢钠、磷酸氢二钠(分析纯, 天津光复精细化工研究所); 核磁试剂重水、D-半乳糖试剂(美国Sigma公司); 羟自由基测定试剂盒、抗超氧阴离子自由基及产生超氧阴离子自由基试剂盒(南京建成生物工程研究所); 谷氨酸、谷氨酰胺ELISA试剂盒(北京安迪华泰生物科技有限公司)。
黄芩花提取物的制备 干燥黄芩花(SFE-S1)购于山西佳辰中药材开发有限公司, 由本实验室秦雪梅教授鉴定为唇形科植物黄芩的干燥花, 保存于山西大学中医药现代研究中心。取干燥黄芩花400 g, 用10倍量的60%乙醇回流提取两次, 每次2 h, 滤过合并两次提取液, 减压浓缩, 冷冻干燥。
黄芩花提取物体外抗氧化研究 根据预实验结果制备0.25、0.5、1、2和4 mg·mL-1的SFE供试品溶液, 按照试剂盒操作说明, 测定SFE羟基自由基和超氧阴离子自由基清除率。
动物与分组 40只SPF级雄性SD大鼠(180±20 g)购于北京维通利华实验动物技术有限公司, 许可证号: SCXK (京) 2016-0011, 饲养于(25±1) ℃室温, (50±10)%湿度, 12 h光照循环的环境中, 自由摄食、饮水, 适应一周后开始实验。将大鼠随机分为对照组(control)、模型组(D-gal)、SFE低剂量组(FL, 0.4 g·kg-1)、SFE高剂量组(FH, 0.8 g·kg-1), 每组10只。分别给D-gal、FL和FH组连续7周每日腹腔注射D-半乳糖溶液300 mg·kg-1, 对照组腹腔注射等体积生理盐水。同时FL和FH组灌胃给药, 对照组与D-gal组灌胃等体积的蒸馏水。动物实验所有程序均获得山西大学伦理委员会批准。7周后用20%乌拉坦5 mL·kg-1腹腔注射麻醉大鼠, 股动脉取血, 静置0.5 h后, 于4 ℃、3 500 r·min-1离心15 min, 取上清, 置于-80 ℃冰箱储存。
大鼠旷场行为学实验 旷场行为学实验用于评价大鼠自主、探究行为与紧张度, 间接反映大鼠的衰老情况。于第6周进行旷场行为学实验, 具体操作如下:捏住大鼠尾巴放入旷场行为测试箱的中心位置, 适应2 min后观察大鼠在4 min内的直立次数和穿越格数。
代谢组学样品的制备 取血清于冰上解冻, 精密吸取450 μL置于EP管中加入D2O 350 μL, 涡旋30 s混匀, 于4 ℃、13 000 r·min-1离心20 min, 取上清液600 μL置5 mm核磁管中。
1H NMR测定与数据处理 样本于Bruker 600-MHz AVANCE Ⅲ NMR共振波谱仪采集数据(25 ℃), 采用Carr-Purcell-Meiboom-Gill (CPMG)脉冲序列。具体参数如下:检测谱宽12 019.2 Hz, 采样点32768, 延迟时间1.0 s, 扫描次数为64, 采样间隔40.5 s, 脉冲宽度(PW) 14 μs, 傅里叶变换(LB) 0.3 Hz。
血清样本核磁谱图采用MestReNova (version 11.0 Mestrelab Research, Santiago de Compostella, 西班牙)软件处理。所有谱图均进行相位、基线手动调整, 以肌酐化学位移δ 3.04 (-CH3)为标准进行校正, 以δ 0.01对δ 0.60~9.00化学位移区间进行分段积分, δ 4.67~5.2区域切除不进行积分, 以消除残余水峰的影响。将血清数据进行归一化处理, 导入Excel软件后用SIMCA-P 14.0 (Umetrics, Umea, 瑞典)软件进行主成分分析(PCA)、偏最小二乘法判别分析(PLS-DA)、正交偏最小二乘法判别分析(OPLS-DA)等多元统计分析。
统计学处理 采用GraphPad Prism 7软件进行数据分析处理, 通过单因素方差分析及t检验进行各组间差异比较, 结果用x ± s表示。
结果 1 SFE体外抗氧化能力测定羟基自由基和超氧阴离子自由基的清除能力常用来衡量植物样本体外抗氧化活性。SFE对羟基自由基和超氧阴离子自由基的清除率如表 1所示。在0.25~4 mg·mL-1内, SFE对羟基自由基有明显清除作用, 并随提取物浓度的增加其清除力随之增强。当浓度为4 mg·mL-1时对羟基自由基清除率可达85%左右。在0.25~4 mg·mL-1内, 超氧阴离子自由基清除力也随浓度的增加而增强, 当浓度为4 mg·mL-1时对超氧阴离子自由基清除率可达57%左右。结果表明, SFE具有抗氧化的作用。
| Table 1 ·OH and O2-· radical scavenging activity of Scutellaria flower extract (SFE) in vitro. n = 3, x ± s |
大鼠行为学实验结果如图 1所示, 与对照组相比, D-gal组大鼠穿越格数(图 1A)和直立次数(图 1B)均显著减少(P < 0.05、P < 0.001), 表明D-半乳糖造模会使大鼠的运动能力和自主探索能力降低, 显示出衰老特征。给予SFE后大鼠穿越格数和直立次数均有所增加(P < 0.01、P < 0.001), 表明SFE能够改善衰老大鼠自主行为。
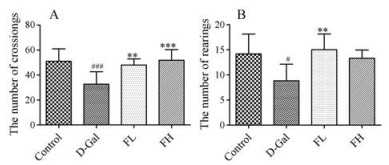
|
Figure 1 Effects of SFE on open field of aging rats. FL: SFE 0.4 g·kg-1; FH: SFE 0.8 g·kg-1. A: The number of crossings; B: The number of rearings. x ± s, n = 10. #P < 0.05, ###P < 0.001 vs control group; **P < 0.01, ***P < 0.001 vs D-gal group |
对照组大鼠血清1H NMR谱图见图 2, 结合文献[14]报道和HMDB (http://www.hmdb.ca/)、BMRB (http://www.bmrb.wisc.edu/)等数据库对图谱进行分析, 共指认出35种内源性代谢产物, 结果见表 2。
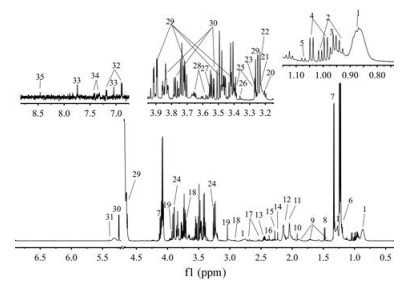
|
Figure 2 Typical 1H NMR spectrum of serum samples from control group. The numbers of peaks in the figure correspond to Table 2 |
| Table 2 1H NMR data and assignments of major metabolites in serum of rats |
PCA是一种无监督的模式识别方法, 能够反映机体受到外界干预后的整体变化趋势, 体现了数据的原始状态, 因此采用PCA识别方法对所有组血清样本的代谢轮廓进行分析。结果发现, 对照组、FL组、FH组和D-gal组明显分开, 且FL组、FH组接近于对照组。说明D-半乳糖造模后引起大鼠体内代谢物的改变, 模型复制成功, 给予SFE后, 对衰老大鼠有明显改善作用(图 3A)。
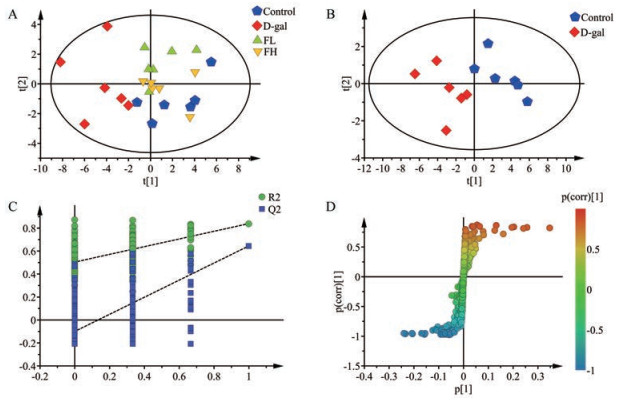
|
Figure 3 PCA scores plots (A) of serum from all rats, PLS-DA scores plot (B), corresponding validation plot (C) and corresponding S-plot (D) from control and D-gal groups |
采用有监督的PLS-DA分析方法对对照组与D-gal组间的代谢轮廓(图 3B)进行分析, 外部模型验证(图 3C) R2X = 0.74、R2Y = 0.839、Q2 = 0.645, 发现模型拟合良好, 预测有效、可信。采用有监督的OPLS-DA方法对给予D-半乳糖后大鼠内源性代谢差异物进行分析, 得到S-plot得分图(图 3D)和VIP值, 通过VIP > 1和P < 0.05筛选潜在的生物标志物, 共确定9种相对峰面积具有显著性的差异代谢物(图 4)。与对照组比较, D-gal组大鼠血清中缬氨酸、甘氨酸、牛磺酸显著降低, 乳酸、丙酮酸、丙氨酸、谷氨酰胺、谷氨酸、乙酸显著升高。给予SFE干预后, FL组能显著回调7个, FH组能显著回调9个, 表明SFE对衰老大鼠潜在生物标志物有干预作用, 且高剂量作用更明显。
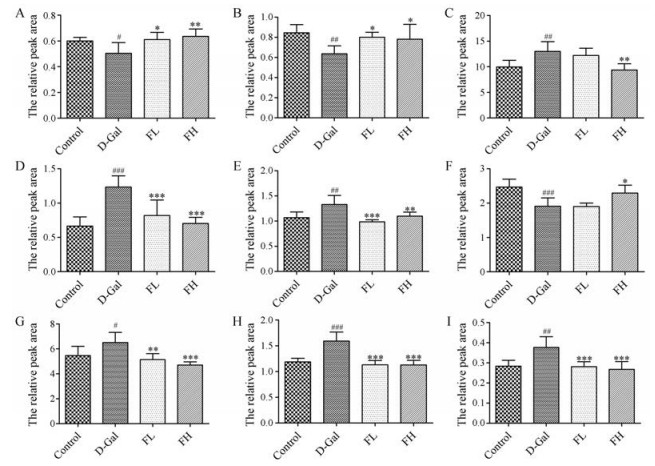
|
Figure 4 Relative peak areas of representative endogenous metabolites in serum of rats. #P < 0.05, ##P < 0.01, ###P < 0.001 vs control group; *P < 0.05, **P < 0.01, ***P < 0.001 vs D-gal group. A: Valine; B: Glycine; C: Lactate; D: Pyruvate; E: Alanine; F: Taurine; G: Glutamate; H: Glutamine; I: Acetate |
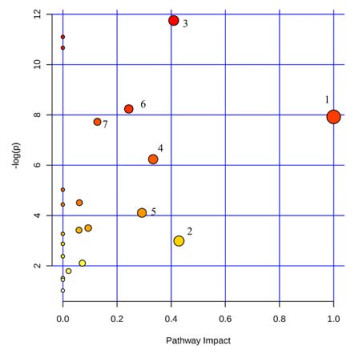
将找到的9个与衰老相关的潜在生物标志物输入metaboanalyst (http://www.Metaboanalyst.ca)数据库中进行代谢通路分析。如图 5所示, 横坐标Pathway impact表示由拓扑分析所计算出的代谢通路重要性值, 纵坐标-log P表示代谢通路富集分析的显著性水平。本研究中将代谢通路影响值大于0.10的通路视为与衰老相关的靶标代谢通路, 共筛选得到7条代谢通路, 分别为谷氨酰胺和谷氨酸代谢; 牛磺酸和亚牛磺酸代谢; 丙氨酸、天冬氨酸和谷氨酸代谢; 缬氨酸、亮氨酸和异亮氨酸生物合成; 甘氨酸、丝氨酸和苏氨酸代谢; 丙酮酸代谢; 糖酵解或糖异生。结果发现谷氨酰胺和谷氨酸代谢的通路影响值最大。
|
Figure 5 Summary diagram of pathway analysis with MetPA. 1: D-Glutamine and D-glutamate metabolism; 2: Taurine and hypotaurine metabolism; 3: Alanine, aspartate and glutamate metabolism; 4: Valine, leucine and isoleucine biosynthesis; 5: Glycine, serine and threonine metabolism; 6: Pyruvate metabolism; 7: Glycolysis or gluconeogenesis |
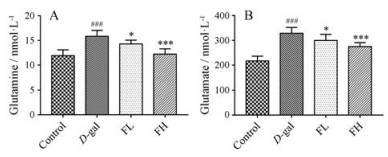
为了验证D-半乳糖诱导衰老大鼠谷氨酰胺和谷氨酸代谢通路变化, 通过酶联免疫技术测量大鼠血清中谷氨酰胺和谷氨酸含量。结果如图 6所示, 与对照组相比, D-gal组血清中谷氨酰胺含量(图 6A)和谷氨酸含量(图 6B)显著升高, 说明给予D-半乳糖造模后大鼠谷氨酰胺和谷氨酸代谢发生紊乱。SFE干预后, 大鼠血清中谷氨酰胺和谷氨酸含量降低, 说明SFE可以调节谷氨酰胺和谷氨酸代谢。
|
Figure 6 Effect of the SFE on the levels of glutamine and glutamate in the serum of rats. x ± s, n = 10. ###P < 0.001 vs control group; *P < 0.05, ***P < 0.001 vs D-gal group |
机体在正常情况下, 体内自由基处于平衡状态, 当人体抗氧化防御体系遭到破坏时, 可诱发一系列与衰老相关的疾病[15]。本实验研究表明, SFE能够清除羟基自由基、超氧阴离子自由基, 具有抗氧化活性。此外, 长期注射D-半乳糖试剂会产生类似自然衰老的现象, 影响大鼠自主探究行为与紧张度[16]。本实验研究表明, SFE能够改善衰老大鼠自主探究行为与紧张度, 具有延缓衰老的作用, 值得开发利用。机体的生理变化和病理变化往往引起血液成分的改变, 因此, 本研究通过1H NMR代谢组学技术对大鼠血清内源性代谢物进行全面分析, 从而研究SFE延缓衰老的作用机制。
代谢通路分析结果显示谷氨酰胺和谷氨酸代谢与衰老相关性较大。谷氨酸是一种重要的神经递质, 而血清中谷氨酸含量的升高可能会诱发神经毒性, 使脑神经细胞退化、神智迟滞, 导致大脑衰老[17], 谷氨酰胺又可在体内脱氨形成谷氨酸[18]。通过酶联免疫吸附测定法定量测定大鼠血清中谷氨酰胺和谷氨酸的含量。结果发现, 给予D-半乳糖后, 大鼠血清中谷氨酸、谷氨酰胺含量升高, 说明衰老大鼠谷氨酰胺和谷氨酸代谢发生紊乱, SFE干预后起到回调作用。
支链氨基酸包括亮氨酸、异亮氨酸、和缬氨酸, 是人体内丰富的必需氨基酸。目前已有证据表明支链氨基酸与胰岛素抵抗、2型糖尿病、癌症和心血管等疾病密切相关[19]。给予D-半乳糖后, 大鼠血清中缬氨酸含量显著降低, 给予SFE后血清中缬氨酸升高, 说明SFE可以改善支链氨基酸代谢紊乱。甘氨酸是人体的非必需氨基酸, 具有抗炎、调节免疫、改善氧化应激的作用[20]。与对照组相比, D-gal组大鼠血清中甘氨酸含量降低, 给予SFE后可以回调血清中甘氨酸水平。乳酸和丙酮酸是糖酵解的最终产物, 对机体能量代谢具有重要意义[21], 在无氧条件下, 葡萄糖转化为丙酮酸, 丙酮酸又可进一步转化为乳酸[22]。乙酸是多余丙酮酸有效利用的一种方式[23], 丙氨酸作为一种生糖氨基酸, 参与三羧酸循环为机体提供能量。当机体能量代谢出现障碍时, 造成血清中乳酸、丙酮酸、丙氨酸和乙酸含量增加。给予SFE后可以回调血清中乳酸、丙酮酸、丙氨酸和乙酸的水平, 说明SFE具有调节能量代谢的作用。牛磺酸具有抗细胞凋亡、抗氧化等作用, 对于延缓衰老和神经保护有重要意义[24, 25]。与对照组相比, D-gal组大鼠血清中牛磺酸含量降低, 给予SFE高剂量后具有明显回调作用。
综上, SFE具有抗氧化作用, 并且可以通过调节氨基酸代谢、能量代谢延缓大鼠衰老。对代谢通路影响值最大的谷氨酰胺和谷氨酸代谢通路进行定量测定, 发现SFE对谷氨酰胺和谷氨酸代谢有明显的调节作用。说明SFE可能通过抗氧化、调节谷氨酰胺和谷氨酸代谢起到延缓衰老的作用。
| [1] | Ji XL. A review on chemical constituents and pharmacological effects of Radix[J]. Clin J Chin Med (中医临床研究), 2017, 9: 128–129. |
| [2] | Huang WH, Lee AR, Yang CH. Antioxidative and anti-inflammatory activities of polyhydroxyflavonoids of Scutellaria baicalensis Georgi[J]. Biosci Biotechnol Biochem, 2006, 70: 2371–2380. DOI:10.1271/bbb.50698 |
| [3] | Zhang Y, Wu B, Xu JW. Research progress of pharmacological effect of Scutellariae baicalensis Georgi[J]. Med Recapitul (医学综述), 2013, 19: 1091–1093. |
| [4] | Jeong K, Shin YC, Park S, et al. Ethanol extract of Scutellaria baicalensis Georgi prevents oxidative damage and neuroinflammation and memorial impairments in artificial senescense mice[J]. J Biomed Sci, 2011, 18: 14. DOI:10.1186/1423-0127-18-14 |
| [5] | Shang YZ, Qin BW, Cheng JJ, et al. Prevention of oxidative injury by flavonoids from stems and leaves of Scutellaria baicalensis Georgi in PC12 cells[J]. Phytother Res, 2006, 20: 53–57. DOI:10.1002/(ISSN)1099-1573 |
| [6] | Cao Y, Liang L, Xu J, et al. The effect of Scutellaria baicalensis stem-leaf flavonoids on spatial learning and memory in chronic cerebral ischemia-induced vascular dementia of rats[J]. Acta Biochim Biophys Sin, 2016, 48: 437–446. DOI:10.1093/abbs/gmw024 |
| [7] | Kong X, Kong W, Miao G, et al. Pretreatment with Scutellaria baicalensis stem-leaf total flavonoid protects against cerebral ischemia/reperfusion injury in hippocampal neurons[J]. Neural Regener Res, 2014, 9: 2066–2073. DOI:10.4103/1673-5374.147933 |
| [8] | Xiao SP, He CN, Zeng Y, et al. Effects of different drying methods and harvesting time on content of flavonoids from flowers of Scutellaria baicalensis[J]. Mod Chin Med (中国现代中药), 2013, 15: 975–980. |
| [9] | Gutteridge JM. Biological origin of free radicals, and mechanisms of antioxidant protection[J]. Chem Biol Interact, 1994, 91: 133–140. DOI:10.1016/0009-2797(94)90033-7 |
| [10] | Zhao FF, Zhou YZ, Gao L, et al. Advances in the study of the rat model of aging induced by D-galactose[J]. Acta Pharm Sin (药学学报), 2017, 52: 347–354. |
| [11] | Puchades-Carrasco L, Pineda-Lucena A. Metabolomics in pharmaceutical research and development[J]. Curr Opin Biotechnol, 2015, 35: 73–77. DOI:10.1016/j.copbio.2015.04.004 |
| [12] | Xu GW, Lu X, Yang SL. Recent advances in metabonomics[J]. Acta Acad Med Sin (中国医学科学院学报), 2007, 29: 701–711. |
| [13] | Duan DD, Wang KX, Zhou YZ, et al. Baicalein exerts beneficial effects in D-galactose-induced aging rats through attenuation of inflammation and metabolic dysfunction[J]. Rejuvenation Res, 2017, 20: 506–516. DOI:10.1089/rej.2017.1919 |
| [14] | Zhao F, Gao L, Qin X, et al. The intervention effect of licorice in D-galactose induced aging rats by regulating the taurine metabolic pathway[J]. Food Funct, 2018, 9: 4814–4821. DOI:10.1039/C8FO00740C |
| [15] | Kong Y, Trabucco SE, Zhang H. Oxidative stress, mitochondrial dysfunction and the mitochondria theory of aging[J]. Interdiscip Top Gerontol, 2014, 39: 86–107. DOI:10.1159/000358901 |
| [16] | An L, Sun Y, Zhang W, et al. Walnut diets up-regulate the decreased hippocampal neurogenesis and age-related cognitive dysfunction in D-galactose induced aged rats[J]. Food Funct, 2018, 9: 4755–4762. DOI:10.1039/C8FO00702K |
| [17] | Fan WJ, Li RL, Deng JB. Glutamate receptors and neurodegenerative diseases[J]. Med Front (医学前沿), 2009, 38: 18–24. |
| [18] | Zhang M, Du CH, Li J, et al. Comparative study of Chinese medicine Gegen Qinlian Decoction Piece and boiled powder for the treatment of diabetes based on serum metabolomics[J]. Acta Pharm Sin (药学学报), 2017, 52: 1444–1451. |
| [19] | Nie C, He T, Zhang W, et al. Branched chain amino acids:beyond nutrition metabolism[J]. Int J Mol Sci, 2018, 19: 954. DOI:10.3390/ijms19040954 |
| [20] | Amin FU, Shah SA, Kim MO. Glycine inhibits ethanol-induced oxidative stress, neuroinflammation and apoptotic neurodegeneration in postnatal rat brain[J]. Neurochem Int, 2016, 96: 1–12. DOI:10.1016/j.neuint.2016.04.001 |
| [21] | Change YF. 1H NMR Based Metabonomic Study of the Anti-aging Effects of Scutellaria baicalensis Georgi (基于代谢组学的黄芩抗衰老作用评价及机制研究)[D]. Shanxi: Shanxi University, 2016. |
| [22] | Zhang S, Nagana GG, Asiago V, et al. Correlative and quantitative 1H NMR-based metabolomics reveals specific metabolic pathway disturbances in diabetic rats[J]. Anal Biochem, 2008, 383: 76–84. DOI:10.1016/j.ab.2008.07.041 |
| [23] | Coquin L, Feala JD, McCulloch AD, et al. Metabolomic and flux-balance analysis of age-related decline of hypoxia tolerance in Drosophila muscle tissue[J]. Mol Syst Biol, 2008, 4: 233. |
| [24] | Menzie J, Prentice H, Wu JY. Neuroprotective mechanisms of taurine against ischemic stroke[J]. Brain Sci, 2013, 3: 877–907. DOI:10.3390/brainsci3020877 |
| [25] | El IA, Shen CH, L'Amoreaux WJ. Neuroprotective role of taurine during aging[J]. Amino Acids, 2013, 45: 735–750. DOI:10.1007/s00726-013-1544-7 |
 2019, Vol. 54
2019, Vol. 54


