2. 天津药物研究院释药技术与药代动力学国家重点实验室, 天津 300193
2. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
糖皮质激素(glucocorticoids)是由肾上腺皮质中束状带分泌的一类甾体激素, 能够调节糖、脂肪和蛋白质的生物合成与代谢, 具有抑制免疫应答、抗炎、抗毒、抗休克等作用, 临床应用十分广泛[1, 2]。目前对于外用糖皮质激素药物的生物等效性评价主要是对研发制剂和原研制剂的血管收缩作用为药效指标的ED50数值进行比较的等效性研究[3-5], 缺乏以药物吸收、消除及系统暴露量等药代动力学指标研究替代终药效学指标的评价方法。由于糖皮质激素类药物的质谱响应高[6-10], 采用LC/MS/MS方法可以测定乳膏涂敷给药后血浆药物浓度, 计算研究系统暴露动力学的特征, 用于评价乳膏皮肤给药制剂用药后的药代动力学和皮肤仿制药制剂的体内过程一致性。
戊酸二氟可龙(图 1)乳膏是一种糖皮质激素类的皮肤外用制剂, 具有抗炎、抗增生、免疫抑制和血管收缩等药理作用, 是目前皮肤科领域中最常用的药物之一[11-16]。最先在德国上市, 随后引入亚洲[17]。有文献报道[18], 戊酸二氟可龙在全血、血浆、尿和粪等生物基质中均不稳定, 易水解生成活性代谢物二氟可龙。Teng等[18, 19]研究表明:血液中羧酸酯酶对戊酸酯类化合物水解作用最强, 该药物在血液中降解速率快, 人静脉注射给药(1 mg) 5 min后未检测到原型药物, 其活性代谢物二氟可龙的血浆浓度水平也仅为6~8 ng·mL-1。药物经皮给药后吸收进入血液的浓度远低于静脉注射给药, 故该给药途径下仅对其活性代谢物二氟可龙进行定量分析, 且灵敏度要求非常高。二氟可龙的定量分析方法及戊酸二氟可龙乳膏局部给药后的药代动力学研究均未见国内外相关文献报道。
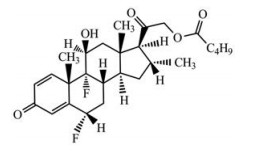
|
Figure 1 The chemical structure of diflucortolone valerate |
本文建立了一种高效、高灵敏度的LC-MS/MS分析方法测定家兔血浆中二氟可龙的浓度, 并应用于戊酸二氟可龙乳膏经皮给药后家兔体内活性代谢物二氟可龙的血浆动力学研究, 为制剂研发和皮肤外用制剂的体内过程一致性评价提供一定的非临床药代动力学数据支持。
材料与方法药品与试剂 二氟可龙对照品(含量98.7%, 来源为天津药业研究院有限公司); 戊酸二氟可龙乳膏(含量30 g/0.1%, Jenapharm GmbH & Co.KG); 乙氧苯柳胺对照品(含量100%, 中国药品食品检定研究院), 甲醇、乙腈(色谱纯, 美国Fisher, 含量不少于99.9%); 甲酸铵(分析纯, 天津市光复精细化工研究所, 含量不少于99.0%); 甲酸(色谱纯, 天津市光复科技发展有限公司, 含量不少于98.0%); 乙酸乙酯(色谱纯, 天津市康科德科技有限公司, 含量不少于99.8%); 超纯水(电阻率 > 18.2 MΩ∙cm, BM-40型纯水制备系统)
实验动物 健康日本大耳白兔6只, 雌雄各半, 体重/日龄为2.0~2.5 kg/90~120天, 由北京隆安实验动物养殖中心提供, 生产许可证号为SCXK (京) 2014-0003。在温度(22±1) ℃、相对湿度(60±5)%、光照/黑暗12 h/12 h条件下饲养, 实验动物使用许可证编号:SYXK (津) 2016-0009。本研究中动物实验方案已获得天津药物研究院新药评价有限公司实验动物管理与使用委员会的批准。
仪器 Sciex TRIPLE QUADTM 5500型三重四极杆串联质谱仪(美国AB Sciex公司), 配有电喷雾离子化源(ESI), Analyst 1.5.2工作站; Prominence 30A液相色谱仪(日本Shimadzu公司)并配有LC-30AD二元梯度泵, CTO-20A柱温箱, SIL-20AC自动进样器和DGU-20A3脱气机; XS105型电子天平(METTER TOLEDO公司); JA2003型电子天平(上海天平仪器厂); 3K15型高速冷冻型离心机(德国Sigma公司); 17R台式高速冷冻型离心机(美国Thermo Scientific公司); Turbo Vap LV型样品浓缩仪(美国Caliper公司); TARGINTM VX-II型和MINI-A型漩涡混合器(北京踏锦科技有限公司)。
储备液及工作液配制 精密称取二氟可龙对照品, 以甲醇溶解稀释配制得1 mg·mL-1二氟可龙对照/质控储备液I; 精密量取对照/质控储备液I 0.1 mL, 加入9.9 mL甲醇混匀, 配制成10 μg·mL-1对照/质控储备液II; 用甲醇分别对二氟可龙对照/质控储备液II进行梯度稀释, 配制得0.2、0.4、1、5、20、100、200 ng·mL-1的系列对照工作液和0.5、10、160 ng·mL-1的质控工作液。
精密称取乙氧苯柳胺对照品, 以甲醇溶解稀释配制成1 mg·mL-1内标储备液I; 精密量取内标储备液I 0.02 mL, 加入甲醇9.98 mL混匀配制得2 μg·mL-1内标储备液II; 精密量取内标储备液II 0.15 mL, 以甲醇稀释定容至200 mL, 配成1.5 ng·mL-1内标工作液。所有的储备液及工作液置于4 ℃冰箱保存。
液相色谱方法 色谱柱: Zorbax Eclipse XDB-C18 (50 mm×4.6 mm, 5 μm); 流动相A: 50%乙腈-甲醇溶液; 流动相B: 0.1%甲酸-5%甲醇-5 mmol·L-1甲酸铵水溶液; 流速: 0.35 mL·min-1; 柱温: 40 ℃; 梯度洗脱方案: 0~0.5 min, 50% B; 0.5~3.0 min, 50%→2% B; 3.0~7.5 min, 2% B; 7.5~7.6 min, 2%→50% B; 7.6~10.0 min, 50% B。进样量: 10 μL。
质谱方法 电喷雾离子化源(ESI), 正离子检测, 多反应监测(MRM), 喷雾电压: 4 500 V, 源温: 600 ℃, 喷雾气: 80 psi, 加热气: 60 psi, 碰撞气: 8 V, 碰撞出口电压: 30 V, 二氟可龙选择m/z 395.2→355.2进行扫描, 质谱入口电压: 4 V, 去簇电压: 140 V, 碰撞能: 13 eV, 乙氧苯柳胺(内标)选择m/z 258.1→120.9 (图 2), 入口电压: 8 V, 去簇电压: 45 V, 碰撞能: 30 eV。
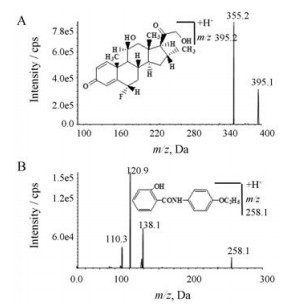
|
Figure 2 The chemical structures and product ion mass spectrum of the [M+H]+ ions of diflucontolone (A), ethoxyphenylethylamine (B, internal standard) |
血浆样品处理方法 向100 μL含药血浆中加入内标甲醇工作液50 μL和乙酸乙酯1 mL, 涡旋1 min, 4 ℃、12 000 r·min-1离心5 min, 取上层溶液800 μL, 40 ℃水浴氮气吹干, 加入100 µL复溶溶液(甲醇-甲酸-水, 80:15:5), 涡旋1 min, 全部取出置于内插管中, 4 ℃、12 000 r·min-1离心10 min。进样10 µL进行LC-MS/MS定量分析。
方法学验证
选择性/专属性 分别取6个不同来源的兔空白血浆100 μL, 不加内标和待测物(用相同体积的甲醇代替), 按照“血浆样品处理方法”处理, 进行LC-MS/MS分析。
线性、灵敏度和残留 用380 μL空白兔血浆和20 μL二氟可龙系列对照溶液(0.2、0.4、1、5、20、100和200 ng·mL-1)配制校正标样质量浓度为0.01、0.02、0.05、0.25、1、5和10 ng·mL-1, 按照“血浆样品处理方法”处理样品, 并进行LC-MS/MS分析, 每个分析批两条曲线, 3个分析批。应用Analyst 1.5.2数据处理软件, 对待测物二氟可龙和内标物乙氧苯柳胺进行积分, 得出峰面积。以待测物浓度(x)为横坐标, 待测物与内标物的峰面积比值(y)为纵坐标, 用加权最小二乘法(权重为1/x2)进行回归运算, 求得的直线回归方程即为血浆校正曲线。用同样的方法配制定量下限(lower limit of quantitation, LLOQ, 0.2 ng·mL-1)血浆样品, 浓度为0.01 ng·mL-1, 按照“血浆样品处理方法”处理后进行LC-MS/MS分析, 考察3个分析批, 每批6样本, 同时考察残留情况。
准确度和精密度 用兔空白血浆760 μL和二氟可龙质控工作液溶液(0.5、10、160 ng·mL-1) 40 μL配制血浆样品浓度为0.025、0.5、8 ng·mL-1, 按照“血浆样品处理方法”, 进行LC-MS/MS分析。用当天分析批的标准曲线, 计算质控样品的浓度, 进行准确度和精密度考察。每个浓度6样本, 考察3个分析批,
基质效应 兔空白血浆6批, 分别考察低、高两个质控浓度水平上的基质效应。
样品A:分别取浓度为0.05、16 ng·mL-1的二氟可龙水溶液50 µL, 内标溶液500 µL, 40 ℃水浴氮气吹干, 加入复溶液(甲醇-甲酸-水80:15:5) 1 250 µL复溶, 涡旋1 min, 进样10 µL。测得二氟可龙和IS峰面积。
样品B:取生物样品100 µL, 加入甲醇50 µL, 涡旋1 min后于4 ℃、12 000 r·min-1离心5 min, 取上清液800 µL于40 ℃水浴N2吹干。残留物用100 µL样品A复溶, 全部取出置于内插管中, 4 ℃、12 000 r·min-1离心10 min, 进样10 µL。测得二氟可龙和IS峰面积。
样品B测得的峰面积与相应浓度的样品A测得的峰面积比值, 即待测物和内标的基质因子; 进一步通过计算待测物的基质因子与内标的基质因子之比, 获得内标归一化的基质效应因子。
稳定性按质控样品方法配制低、高浓度的血浆或全血样品(放置后离心得血浆), 放置后按照“血浆样品处理方法”处理, 进行LC-MS/MS分析, 考察兔血浆室温放置、冻融3次及全血室温放置的稳定性, 应用新鲜制备的随行校正曲线计算稳定性样品的实测浓度。
血浆药动学研究 健康大耳白兔6只, 雌雄各半, 称取戊酸二氟可龙乳膏1 g, 皮肤涂抹, 给药面积为10 cm×10 cm, 给药保留6 h后, 用温水清洗并以酒精棉球擦净皮肤后放回兔笼中。分别在给药前及给药后1、2、4、6、7、9、12、15、24、48和72 h耳缘静脉采血约0.5 mL, 肝素抗凝, 离心取血浆, -20 ℃保存至LC-MS/MS分析。
数据处理 将给药后的血浆样品按照“血浆样品处理方法”进行处理后进行LC-MS/MS分析, 以随行校正曲线计算血浆药物浓度, 采用WinNonlin7.0软件以非房室模型统计矩法计算药代动力学参数。其中t1/2采用Best Fit法计算, Cmax、tmax采用实测值, AUC0-t、AUC0-∞采用梯形法计算。
结果 1 质谱分析待测物二氟可龙及内标乙氧苯柳胺在ESI源正离子条件下信号强度优于负离子条件。一级全扫描模式下, 待测物二氟可龙及内标主要生成准分子离子[M+H]+ m/z 395.2、258.1, 对相应的准分子离子进行CID二级质谱全扫描, (如图 2所示)待测物二氟可龙及内标生成的主要产物离子为m/z 355.2、120.9, 进一步优化相应的质谱参数及碰撞能后, 分别选取m/z 355.2、m/z 120.9作为定量分析时检测的产物离子。
2 方法学验证 2.1 选择性/专属性兔空白血浆样品的色谱图 3A; LLOQ样品分析的代表性色谱图见附图 3B; 兔皮肤给药后样品的代表性色谱图见附图 3C。二氟可龙和内标乙氧苯柳胺的色谱保留时间分别为3.56和4.07 min。兔空白血浆样品中干扰组分的响应低于当批次LLOQ待测物响应均值的20%及内标响应均值的5%, 表明兔血浆中的内源性物质不干扰分析物和内标的定量分析, 该方法具有良好的专属性。
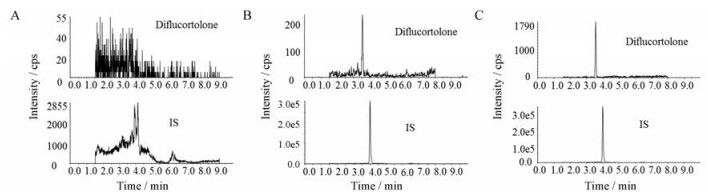
|
Figure 3 The typical chromatogram of diflucortolone in rabbit plasma. A: Blank rabbit plasma sample; B: A blank rabbit plasma sample spiked with diflucortolone and IS (LLOQ, 0.01ng·mL-1); C: A rabbit plasma sample collected at 9 h after administration spiked with IS |
二氟可龙浓度在0.01~10 ng·mL-1内线性良好, 典型校正曲线回归方程为y = 0.571 x + 0.000 378, r = 0.995 6;残留考察情况:空白兔血浆中干扰组分的响应低于该批曲线std1内标响应的1/20, 待测物响应的1/5, 表明残留不影响兔血浆样品中二氟可龙浓度的定量分析; 定量下限分析结果如表 1所示, 日内、日间精密度分别为11.0%和6.41%~9.82%, 表明该方法的灵敏度可以达到0.01 ng·mL-1。
| Table 1 The results of accuracy and precision by the proposed method. |
准确度、精密度考察结果如表 2所示, 兔血浆中二氟可龙在定量下限的批内精密度(RSD)为11.0%之间, 批间精密度在6.41%~9.82%之间, 准确度为101%;低、中、高浓度水平QC样品的准确度在92.7%~97.0%之间, 批内、批间精密度(RSD)分别在4.33%~7.40%、2.27%~7.63%之间, 均符合有关生物样品分析方法验证的要求[20, 21]。
| Table 2 The pharmacokinetic parameters of diflucortolone after dermal administration of diflucortolone valerate (0.01 g·cm-2) in rabbits. n = 6, x ± s |
二氟可龙在LQC和HQC两个浓度水平上的内标归一化的基质效应均为109%, 基质效应的RSD值小于5.14%, 说明本实验选择的样品处理方法、色谱条件及质谱条件下的基质效应不会对二氟可龙分析产生明显影响。
2.5 稳定性二氟可龙兔血浆样品室温放置24 h后稳定(准确度分别在97.3%~97.6%)。-20 ℃冻融3次循环稳定(准确度在95.9%~101%之间)。-20 ℃冻存40天稳定(准确度在95.7%~100%之间)。
2.6 药动学研究兔皮肤给药后, 6只动物平均血药浓度-时间曲线见图 4, 相应的药动学参数见表 2, 结果表明二氟可龙在兔血浆中吸收慢, tmax为6.33±1.21 h、Cmax为0.168±0.080 0 ng·mL-1; 体内暴露量低, 半衰期较长, 体内消除较慢, AUC0-72 h为3.15±0.834 ng·h·mL-1、t1/2为32.0±17.4 h, 给药后72 h浓度仅为0.014 8±0.010 3 ng·mL-1。
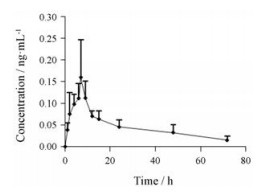
|
Figure 4 The curve of average concentration and time about diflucortolone |
戊酸二氟可龙经皮给药后, 体内二氟可龙暴露量低, 血浆中的内源性物质对其影响较大, 为建立灵敏、可靠的分析方法, 实验中主要对待测物液相条件及样品处理方式进行了优化。
考察了Symetry C8柱、Diamonsil C18柱及Zorbax Eclipse XDB-C18柱, 0.1%甲酸-50%甲醇-50%乙腈、纯甲醇、纯乙腈及50%甲醇-50%乙腈等有机相, 1 mmol·L-1、2 mmol·L-1、5 mmol·L-1的甲酸铵及含不同浓度的甲酸等水相, 以灵敏度、峰形和基质效应为衡量指标, 优化了色谱柱、流动相组成及梯度洗脱方案, 最终选择Zorbax Eclipse XDB-C18柱, 50%甲醇-50%乙腈的有机相, 5 mmol·L-1甲酸铵的水相和本文中的梯度洗脱方法进行分析。
考察了甲醇沉淀法、乙腈沉淀法和液-液萃取法等样品处理方式对本实验的影响, 结果表明液-液萃取法的灵敏度及基质效应均优于甲醇沉淀法和乙腈沉淀法。同时分别以乙酸乙酯、甲基叔丁醚和正己烷等作为提取剂, 考察了不同提取剂的液-液萃取法的灵敏度、提取回收率和基质效应, 结果表明乙酸乙酯的提取回收率、灵敏度、基质效应最优, 且可以满足本实验的要求, 故本实验最终选择了以乙酸乙酯为提取剂的液-液萃取法处理样品。
内标对于生物样品的测定至关重要, 本实验考察了卤米松、醋酸氟轻松、醋酸曲安缩松、睾酮、6-OH睾酮等同系物和去6-氟戊酸酯、双氟美松戊酸酯等结构类似物以及乙氧苯柳胺、比格列酮、爱地那非、西地那非、吲达帕胺等的质谱、色谱行为, 结果发现乙氧苯柳胺的质谱、色谱行为以及提取回收率与二氟可龙接近, 且基质效应在100%左右, 可以满足本实验样品分析测定的需求, 因而最终选择乙氧苯柳胺作为本实验的内标。
本实验建立了一种高效、灵敏的LC-MS/MS分析方法, 研究结果表明, 本实验建立的实验方法具有较高的选择性, 灵敏度较高, 准确度和精密度以及稳定性研究均符合生物样品技术指导原则[20, 21]。该方法成功应用于二氟可龙的血浆药动学研究, 且测定结果准确可靠, 可以为制剂的进一步研发提供一定的非临床数据支持。
| [1] | Qiu HY. Mechanism of action and clinical application of glucocorticoids[J]. Mod Chin Med Edu (中国中医药现代远程教育), 2010, 8: 90–91. |
| [2] | Lu CX. Rational application of glucocorticoid hormone in clinical practice[J]. J Clin Rational Use Drugs (临床合理用药杂志), 2012, 5: 90–91. |
| [3] | Wiedersberg S, Leopold CS, Guy RH. Bioavailability and bioequivalence of topical glucocorticoids[J]. Eur J Pharm Biopharm, 2008, 68: 453–466. DOI:10.1016/j.ejpb.2007.08.007 |
| [4] | Leopold CS. Pharmacokinetic analysis of the FDA guidance for industry-'topical dermatologic corticosteroids:in vivo bioequivalence[J]. Eur J Pharm Biopharm, 2003, 56: 53–58. DOI:10.1016/S0939-6411(03)00045-6 |
| [5] | Yacobi A, Shah VP, Bashaw ED, et al. Current challenges in bioequivalence, quality, and novel assessment technologies for topical products[J]. Pharm Res, 2014, 31: 837–846. DOI:10.1007/s11095-013-1259-1 |
| [6] | Earla R, Boddu SH, Cholkar K, et al. Development and validation of a fast and sensitive bioanalytical method for the quantitative determination of glucocorticoids-quantitative measurement of dexamethasone in rabbit ocular matrices by liquid chromatography tandemmass spectrometry[J]. J Pharm Biomed Anal, 2010, 52: 525–533. DOI:10.1016/j.jpba.2010.01.015 |
| [7] | Deng P. Pharmacokinetic Study of Two New Dosage Forms of Glucocorticoid Drugs (两种糖皮质激素类药物新剂型的药动学研究)[D]. Shenyang: Shenyang Pharmaceutical University, 2008. |
| [8] | Samtani MN, Jusko WJ. Quantification of dexamethasone and corticosterone in rat biofluids and fetal tissue using highly sensitive analytical methods:assay validation and application to a pharmacokinetic study[J]. Biomed Chromatogr, 2007, 21: 585–597. DOI:10.1002/(ISSN)1099-0801 |
| [9] | Goswami N, Gupta VR, Jogia HA, et al. Development and validation of a novel stability-indicating RP-HPLC method for the simultaneous determination of halometasone, fusidic acid, methylparaben, and propylparaben in topical pharmaceutical formulation[J]. Sci Pharm, 2013, 81: 505–518. DOI:10.3797/(ISSN)0036-8709 |
| [10] | Guo JF, Zhong DF, Chen XY. Identification of nine corticosteroids with high performance liquid chromatography-mass spectrometry[J]. Acta Pharm Sin (药学学报), 1999, 34: 928–932. |
| [11] | Abdel-Salama FS, Elkheshen SA, Mahmoud AA, et al. Diflucortolone valerate loaded solid lipid nanoparticles as a semisolid topical delivery system[J]. Bull Faculty Pharm, 2016, 54: 1–7. |
| [12] | Abdel-Salama FS, Ammar HO, Elkheshen SA, et al. Anti-inflammatory sunscreen nanostructured lipid carrier formulations[J]. J Drug Deliv Sci Technol, 2017, 37: 13–19. DOI:10.1016/j.jddst.2016.10.014 |
| [13] | Abdel-Salam FS, Mahmoud AA, Ammar HO, et al. Nanostructured lipid carriers as semisolid topical delivery formulations for diflucortolone valerate[J]. J Liposome Res, 2017, 27: 41–55. DOI:10.3109/08982104.2016.1149866 |
| [14] | Fayez YM, Elghobashy MR, Goda ZM, et al. Comparative study on four spectrophotometric methods manipulating ratio spectra for the simultaneous determination of binary mixture of diflucortolone valerate and isoconazole nitrate[J]. Bull Faculty Pharm, 2016, 54: 39–47. |
| [15] | Özcan I, Azizoğlu E, Şenyiğit T, et al. Enhanced dermal delivery of diflucortolone valerate using lecithin/chitosan nanoparticles:in-vitro and in-vivo evaluations[J]. Int J Nanomed, 2013, 8: 461–475. |
| [16] | Dou X, Liu LL, Zhu X. Application of topical glucocorticoids in dermatology[J]. J Clin Drug Ther (临床药物治疗杂志), 2006, 4: 32–36. |
| [17] | Hoppe G. Diflucortolone valerate Asian experience[J]. Drug, 1988, 36: 24–33. DOI:10.2165/00003495-198800365-00006 |
| [18] | Mützel VW. Pharmacokinetics and biotransformation of diflucortolonevalerate in man (author's transl)[J]. Arzneimittelforschung, 1976, 26: 1487–1492. |
| [19] | Teng X, Sun MJ. Advances in the study of carboxylate esterase[J]. Life Sci (生命科学), 2003, 15: 31–35. |
| [20] | National Food and Drug Administration. Technical Guide-lines for Nonpharmacologic Pharmacokinetics of Drugs (药物非临床药代动力学研究技术指导原则)[S]. Beijing: National Food and Drug Administration, 2014.http://www.cde.org.cn/zdyz.do?method=largePage&id=191. |
| [21] | Chinese Pharmacopoeia Commission. Guiding Principles for Quantitative Analysis of Biological Samples[S]//Pharmacopoeia of the People's Republic of China (中华人民共和国药典). 2015 Ed. Beijing: China Medical Science Press, 2015. |
 2019, Vol. 54
2019, Vol. 54


