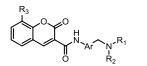
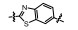
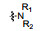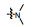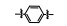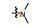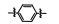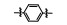从细胞凋亡的角度分析, 肿瘤是凋亡机制受到抑制而不能正常进行细胞凋亡的结果。因此, 针对细胞凋亡机制设计开发凋亡诱导类的小分子药物, 特异性激活肿瘤细胞凋亡, 已经成为增加肿瘤敏感性、提高疗效的主要研究内容。近年来, 针对细胞凋亡通路的中/上游关键蛋白, 相继报道了大量凋亡诱导类的抗肿瘤化合物, 如p53-MDM2抑制剂(tenovin-1)[1]、XIAP抑制剂(GDC-0152)[2]和Bcl-2抑制剂(GDC-0199)等[3]。然而, 当上述中/上游凋亡蛋白发生突变时, 凋亡信号将不能被正确传送至下游关键的凋亡执行蛋白上, 从而引起凋亡机制紊乱, 最终导致不能进行正常细胞凋亡。因此, 寻找小分子化合物直接作用于凋亡通路的下游关键蛋白, 能有效地克服中/上游凋亡蛋白突变带来的凋亡抑制的弊端, 重启细胞凋亡。Caspase-3作为细胞凋亡的关键执行蛋白, 在细胞凋亡机制中扮演着至关重要的作用[4-6], 正常情况下, caspase-3在胞质中以无活性的酶原(procaspase-3)形式存在, 当接收到凋亡信号后, procaspase-3被催化裂解成为caspase-3, 继而催化数百种蛋白底物的水解, 诱导细胞凋亡。目前, 研究已证实, 在很多肿瘤细胞中, 由于caspase-3受到抑制, 导致procaspase-3呈现高度表达的状态, 如:淋巴瘤[7]、白血病[8]、黑色素瘤[9]、神经母细胞瘤[10]、肝癌[11]、肺癌[12]和结肠癌[13]。更值得一提的是, caspase-3属于细胞凋亡信号通路的下游蛋白[14]。因此, 开发直接激活下游高表达的procaspase-3成为caspase-3的小分子药物, 重启肿瘤细胞凋亡, 不仅能消除中/上游凋亡蛋白突变带来的凋亡抑制作用, 同时还能提高肿瘤治疗的特异性。
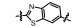
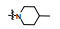
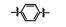
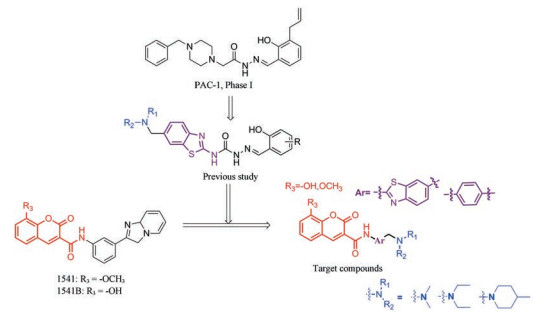
PAC-1 (procaspase-activating compound 1, 图 1)是Putt等[14]通过高通量筛选(HTS)得到的第一个直接激活procaspase-3成为caspase-3的小分子化合物, 目前, PAC-1处于临床Ⅰ期研究阶段。在前期研究中, 基于PAC-1的构效关系[15], 作者发现了一系列含苯并噻唑结构的procaspase-3激活剂(图 1), 构效关系揭示, 苯并噻唑的引入有益于提高抗肿瘤活性[16]。Wolan等[17, 18]通过对6 200个化合物进行高通量筛选, 得到了一系列具有突出procaspase-3激活活性的香豆素衍生物(1541系列), 其中化合物1541和1541B活性突出。研究表明, 1541系列能自组装形成纳米纤维与procaspase-3蛋白结合稳定活性构象, 进而诱导procaspase-3自身活化成为caspase-3, 诱导细胞凋亡。本文基于1541系列的香豆素骨架结构, 引入了实验室前期发现的苯并噻唑结构, 并采用苯基替换苯并噻唑基以考察苯并噻唑基团的重要性, 同时, 在目标化合物结构的另一端引入水溶性的小分子胺, 调节目标化合物的脂水分配系数, 共设计合成了12个含苯并噻唑/苯基片段的香豆素衍生物(图 1), 并以procaspase-3高表达的人组织细胞淋巴瘤细胞株(U937)和procaspase-3低表达的人乳腺癌细胞株(MCF-7)为测试细胞株[7], 对目标化合物进行体外抗肿瘤活性测试, 初步验证目标化合物的靶向性, 排除脱靶效应。同时, 采用荧光分析法和流式细胞术对体外抗肿瘤机制进行了初步研究。
|
Figure 1 Design of target compounds |
目标化合物的合成方法如路线1所示, 以市售的对硝基溴苄为起始原料, 分别与不同的小分子胺发生亲核取代反应制得中间体1a~1c, 再经硝基还原制得中间体2a~2c, 中间体2a~2c在溴素催化下与硫氰酸铵反应制得2-氨基-6-取代苯并噻唑中间体3a~3c。以3位不同取代的邻羟基苯甲醛为原料, 分别与麦氏酸反应制得中间体4a、4b。最后, 4a、4b分别与2a~2c或3a~3c经酰胺化反应制得目标化合物5a~5l。目标化合物的结构经1H NMR、13C NMR和ESI-MS/HR-MS确证, 具体数据见后文实验部分。
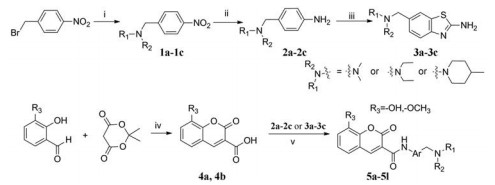
|
Scheme 1 ynthetic route of target compounds. Reagents and conditions: (ⅰ) Acetonitrile, amine, rt, 3 h; (ⅱ) 80% hydrazine monohydrate, FeCl3·H2O, activated carbon, ethanol, 65 ℃ to 78 ℃, 5 h; (ⅲ) Br2, NH4SCN, HOAc, 10 ℃ to rt, 4-6 h; (iv) H2O, 100 ℃, 1 h; (v) DIPEA, HATU, DMF, rt |
以procaspase-3高表达的人组织细胞淋巴瘤细胞株(U937)和procaspase-3低表达的人乳腺癌细胞株(MCF-7)为测试细胞株, 小分子procaspase-3激活剂PAC-1、1541和1541B为阳性对照药, 采用CCK-8法对目标化合物进行了体外抗肿瘤活性测试。如表 1所示, 与阳性对照药PAC-1、1541和1541B抗肿瘤活性相比, 含有苯并噻唑的目标化合物5a~5f表现出了中等的抑制活性。值得注意的是, 与PAC-1的抑制作用类似, 这些化合物对procaspase-3高表达的U937的抑制活性明显优于对procaspase-3低表达的MCF-7的抑制活性, 其选择性分别为1.6~4.1倍, 提示该类化合物可能是通过激活procaspase-3来发挥抗肿瘤作用。而含苯基片段的目标化合物5g~5l对U937和MCF-7均没有表现出明显的抑制活性。以上结果表明, 苯并噻唑的引入有利于提高目标化合物对肿瘤细胞株的选择性和抗肿瘤活性。此外, 还观察到阳性对照药1541和1541B对U937和MCF-7并没有表现出明显的选择性, 说明这两个化合物除了能激活procaspase-3之外, 还有可能存在其他潜在的作用机制, 值得进一步研究。进一步分析化合物5a~5f上不同取代基对抗肿瘤活性的影响, 发现R3为甲氧基的目标化合物(5b、5d、5f)对U937的抗肿瘤活性要优于R3为羟基的目标化合物(5a、5c、5e), 同时, 随着小分子胺取代基团空间体积的增大, 目标化合物的抗肿瘤活性明显增强(5e, 5f > 5c, 5d > 5a, 5b), 表明结构中这一部分的空间效应是影响抗肿瘤活性关键因素之一。
| Table 1 Antitumor activities for target compounds. a The values were an average of three separate determinations and standard deviations were shown; b Selectivity is expressed as a ratio of MCF-7/U937 |
为了进一步研究目标化合物的作用机制, 以PAC-1和1541为阳性对照药, 测试了目标化合物在U937细胞中的caspase-3激活活性。如表 2所示, 含苯并噻唑片段的目标化合物表现出了显著的激活活性, 激活率均大于50%, 其中, 抗肿瘤活性最强的化合物5f表现出了最高的激活活性, 激活率为93%。而含苯基片段的化合物无明显的激活活性, 其激活率均小于20%。值得一提的是, 目标化合物的抗肿瘤活性与caspase-3激活活性呈明显的正相关, 表明这些化合物可能主要通过激活caspase-3的方式来发挥抗肿瘤作用。
| Table 2 Caspase-3 activation activity of target compounds. a The values were an average of three separate determinations and standard deviations were shown; bND: Not determined |
为了进一步验证目标化合物是否诱导肿瘤细胞凋亡, 采用流式细胞术对化合物5f进行了细胞凋亡检测, 通过流式细胞仪检测发现, 如图 2所示, 当给药浓度分别为4.9和9.8 μmol·L-1时, 化合物5f作用U937细胞24 h后, 早期凋亡(4.9 μmol·L-1: 7.64%; 9.8 μmol·L-1: 8.75%)和晚期凋亡(4.9 μmol·L-1: 9.56%; 9.8 μmol·L-1: 17.29%)的比例都比空白对照组(3.27%; 4.88%)出现了明显的升高, 同时, 当化合物5f作用U937细胞48 h后, 早期凋亡(4.9 μmol·L-1: 8.63%; 9.8 μmol·L-1: 14.36%)和晚期凋亡(4.9 μmol·L-1: 18.41%; 9.8 μmol·L-1: 25.94%)的比例相对于作用24 h的早期凋亡和晚期凋亡比例也出现了明显的升高。以上实验结果表明, 化合物5f能够显著诱导肿瘤细胞凋亡, 并且其凋亡诱导作用呈浓度依赖性和时间依赖性。

|
Figure 2 Apoptosis in U937 cells by the treatment with 5f. U937 cells were incubated with different concentrations of 5f for 24 h and 48 h and the cells were stained with annexin V-FITC and PI, followed by flow cytometry analysis |
为了进一步了解该系列化合物的作用靶点, 选取活性较好的化合物5f, 以PAC-1和1541为阳性对照药, 测试其对procaspase-3蛋白的激活作用。测试结果表明, 相对于阳性对照药PAC-1 [(100±1.3)%]和1541 [(108.1±4.6)%], 化合物5f在10 μmol·L-1的浓度下, 表现出较好的激活作用, 激活率为68.4%±1.7%。
3 小结本文参考procaspase-3激活剂1541系列的结构, 结合前期研究基础, 设计合成了12个含苯并噻唑/苯基片段的香豆素衍生物, 体外抗肿瘤活性筛选出一系列含苯并噻唑片段的香豆素衍生物, 它们对procaspase-3高表达的人组织细胞淋巴瘤细胞株(U937)的抑制活性和选择性均优于procaspase-3低表达的人乳腺癌细胞株(MCF-7), 其中, 化合物5f抗肿瘤活性最强。进一步机制研究表明, 化合物5f可以显著激活caspase-3, 诱导肿瘤细胞凋亡, 同时, 化合物5f表现出了较好的procaspase-3激活活性, 可能为潜在的procaspase-3激活剂, 值得进一步研究。本研究对进一步设计强效的procaspase-3激活剂具有一定的指导意义和参考价值。
实验部分实验中所用的试剂及溶剂均为市售的分析纯, 核磁共振氢谱和碳谱采用Bruker ARX-400 (Bruker Bioscience, Billerica, MA, USA)核磁共振仪测定; 低分辨质谱采用Agilent 1100四级杆液质联用仪测定; 高分辨质谱采用Agilent Accurate-Mass Q-TOF 6530测定; 柱色谱硅胶(200~300目)为青岛海洋化工厂生产; 除有特别注明外, 所有试剂和溶剂均直接使用。
1 化合物的合成 1.1 4-取代硝基苯(1a~1c)的合成将对硝基溴苄(10.8 g, 0.05 mol)加入至50 mL乙腈中, 室温下搅拌。加入小分子二级胺20 mL, 室温反应3 h, 反应完毕后, 加入水, 二氯甲烷萃取(100 mL×3), 无水Na2SO4干燥有机层, 浓缩得淡黄色液体或黄色固体1a~1c。
4-(二甲胺基)甲基-硝基苯(1a) 淡黄色液体, 收率为85%。1H NMR (400 MHz, CDCl3) δ 8.18 (d, J = 8.6 Hz, 2H), 7.52 (d, J = 8.6 Hz, 2H), 3.55 (s, 2H), 2.28 (s, 6H); MS (ESI) m/z 180.5 [M+H]+。
4-(二乙胺基)甲基-硝基苯(1b) 淡黄色液体, 收率为82%。1H NMR (400 MHz, CDCl3) δ 8.17 (d, J = 8.6 Hz, 2H), 7.56 (d, J = 8.6 Hz, 2H), 3.69 (s, 2H), 2.57 (q, J = 7.2 Hz, 4H), 1.07 (t, J = 7.2 Hz, 6H); MS (ESI) m/z 208.4 [M+H]+。
4-(4-甲基哌啶基)甲基-硝基苯(1c) 黄色固体, 收率为62%。mp 53~55 ℃; 1H NMR (400 MHz, CDCl3) δ 8.22 (d, J = 8.6 Hz, 2H), 7.77 (d, J = 8.6 Hz, 2H), 3.92 (s, 2H), 3.11 (m, 2H), 2.38 (m, 2H), 1.73 (m, 2H), 1.57 (m, 3H), 0.98 (d, J = 6.2 Hz, 3H); MS (ESI) m/z 235.5 [M+H]+。
1.2 4-取代苯胺(2a~2c)的合成将1a~1c (0.05 mol)加入至100 mL 90%乙醇中, 搅拌升温至60 ℃, 加入六水合三氯化铁(2.8 g, 0.001 mol)和活性炭(0.18 g, 0.015 mol), 保持70 ℃下, 滴加水合肼(25 g, 0.5 mol), 滴毕, 回流反应5 h。反应完毕, 趁热抽滤, 浓缩滤液, 加入水200 mL, 二氯甲烷萃取(100 mL×3次), 无水Na2SO4干燥有机层, 浓缩得无色液体或白色固体2a~2c。
4-(二甲胺基甲基)苯胺(2a) 无色液体, 收率78%。1H NMR (400 MHz, CDCl3) δ 7.07 (d, J = 8.4 Hz, 2H), 6.63 (d, J = 8.4 Hz, 2H), 3.63 (s, 2H), 3.32 (s, 2H), 2.21 (s, 6H); MS (ESI) m/z 150.6 [M+H]+。
4-(二乙胺基甲基)苯胺(2b) 无色液体, 收率74%。1H NMR (400 MHz, CDCl3) δ 7.13 (d, J = 8.4 Hz, 2H), 6.66 (d, J = 8.4 Hz, 2H), 3.63 (s, 2H), 3.50 (s, 2H), 2.53 (q, J = 7.2 Hz, 4H), 1.06 (t, J = 7.2 Hz, 6H); MS (ESI) m/z 178.6 [M+H]+。
4-(4-甲基哌啶基甲基)苯胺(2c) 无色液体, 收率83%。1H NMR (400 MHz, CDCl3) δ 7.08 (d, J = 8.1 Hz, 2H), 6.63 (d, J = 8.1 Hz, 2H), 3.60 (s, 2H), 3.38 (m, 2H), 2.84 (m, 2H), 1.89 (m, 2H), 1.58 (m, 2H), 1.32 (m, 1H), 1.29~1.19 (m, 2H), 0.90 (d, J = 6.2 Hz, 3H); MS (ESI) m/z 204.5 [M+H]+。
1.3 2-氨基-6-取代苯并噻唑(3a~3c)的合成将2a~2c (0.05 mol)和硫氰酸铵(19.03 g, 0.25 mol)加入至50 mL冰醋酸中, 室温搅拌0.5 h, 降温至10 ℃以下, 保持温度低于10 ℃, 缓慢滴加溴素的冰醋酸溶液(2.82 mL, 0.055 mol), 滴毕, 10 ℃反应5 h。反应完毕, 加入温水500 mL, 氨水调pH至9, 析出固体, 继续搅拌1 h, 抽滤得黄色固体3a~3c。
2-氨基-6-(二甲胺基甲基)苯并噻唑(3a) 黄色固体, 收率65%。mp 141~143 ℃; 1H NMR (400 MHz, DMSO-d6) δ 9.51 (s, 2H), 7.99 (d, J = 1.2 Hz, 1H), 7.61 (dd, J = 8.4, 1.2 Hz, 1H), 7.55 (d, J = 8.4 Hz, 1H), 4.32 (d, J = 4.8 Hz, 2H), 2.70 (d, J = 4.8 Hz, 6H); MS (ESI) m/z 208.4 [M+H]+。
2-氨基-6-(二乙胺基甲基)苯并噻唑(3b) 黄色固体, 收率88%。mp 136~138 ℃; 1H NMR (400 MHz, DMSO-d6) δ 7.55 (s, 1H), 7.37 (s, 2H), 7.26 (d, J = 8.4 Hz, 1H), 7.14 (dd, J = 8.4, 1.2 Hz, 1H), 3.52 (s, 2H), 2.45 (q, J = 7.2 Hz, 4H), 0.97 (t, J = 7.2 Hz, 6H); MS (ESI) m/z 236.5 [M+H]+。
2-氨基-6-(4-甲基哌啶基甲基)苯并噻唑(3c) 黄色固体, 收率85%。mp 201~203 ℃; 1H NMR (400 MHz, DMSO-d6) δ 7.75 (s, 1H), 7.65 (s, 2H), 7.38 (d, J = 8.0 Hz, 1H), 7.30 (d, J = 8.0 Hz, 1H), 4.22 (s, 2H), 3.33 (m, 2H), 2.77 (m, 2H), 1.77 (m, 2H), 1.56 (m, 1H), 1.29 (m, 2H), 0.90 (d, J = 5.4 Hz, 3H); MS (ESI) m/z 262.5 [M+H]+。
1.4 8-取代香豆素-3-羧酸(4a、4b)的合成将3-取代2-羟基苯甲醛(0.05 mol)和麦氏酸(8.65 g, 0.06 mol)加入至100 mL水中, 升温至90 ℃反应2 h。反应液冷却, 抽滤得黄色固体4a、4b。
8-羟基香豆素-3-羧酸(4a) 黄色固体, 收率75%。mp 292~293 ℃; 1H NMR (400 MHz, DMSO-d6) δ 10.35 (s, 1H), 8.68 (s, 1H), 7.35~7.29 (m, 1H), 7.24~7.18 (m, 2H)。
8-甲氧基香豆素-3-羧酸(4b) 黄色固体, 收率77 %。mp 210~213 ℃; 1H NMR (400 MHz, DMSO-d6) δ 8.71 (s, 1H), 7.46~7.43 (m, 1H), 7.43~7.39 (m, 1H), 7.37~7.30 (m, 1H), 3.93 (s, 3H)。
1.5 目标化合物(5a~5l)的合成将4a~4b (0.1 mmol)、HATU (45.6 mg, 0.12 mmol)和DIPEA (33 μL, 0.2 mmol)分别加入至5 mL DMF中, 室温搅拌0.5 h后, 加入2a~2c或3a~3c (0.15 mmol), 室温反应18 h后, 加入冰水30 mL, 有固体析出, 室温继续搅拌1 h, 抽滤得黄色固体, 粗品采用二氯甲烷/甲醇体系进行柱色谱分离得纯品(5a~5l)。
N-[6-(二甲胺基甲基)苯并[d]噻唑-2-基]-8-羟基-香豆素-3-甲酰胺(5a) 淡黄色固体, 收率35 %。mp 248~250 ℃; 1H NMR (400 MHz, DMSO-d6) δ 9.01 (s, 1H), 8.17 (d, J = 1.2 Hz, 1H), 7.92 (d, J = 8.4 Hz, 1H), 7.60 (dd, J = 8.4, 1.6 Hz, 1H), 7.50~7.45 (m, 1H), 7.32 (d, J = 4.4 Hz, 2H), 4.38 (s, 2H), 2.76 (s, 6H); 13C NMR (101 MHz, DMSO-d6) δ 161.38, 160.79, 158.59, 150.04, 149.70, 145.14, 143.25, 132.60, 129.69, 126.70, 126.05, 125.19, 121.70, 121.60, 121.05, 119.76, 117.89, 60.29, 42.37; HR-MS (ESI) m/z for C20H17N3O4S [M-H]-, Calcd: 395.093 98, Found: 394.086 50。
N-[6-(二甲胺基甲基)苯并[d]噻唑-2-基]-8-甲氧基-香豆素-3-甲酰胺(5b) 淡黄色固体, 收率41%。mp 214~216 ℃; 1H NMR (400 MHz, DMSO-d6) δ 9.04 (s, 1H), 8.22 (s, 1H), 7.88 (d, J = 8.4 Hz, 1H), 7.67 (dd, J = 8.4, 1.4 Hz, 1H), 7.61~7.56 (m, 1H), 7.52 (d, J = 7.2 Hz, 1H), 7.44 (t, J = 8.0 Hz, 1H), 4.36 (s, 2H), 3.97 (s, 3H), 2.72 (s, 6H); 13C NMR (101 MHz, DMSO-d6) δ 161.24, 160.52, 158.42, 149.77, 149.56, 146.89, 143.92, 132.50, 129.76, 126.93, 125.99, 125.15, 122.06, 121.50, 119.34, 118.27, 117.60, 60.03, 56.84, 42.16; HR-MS (ESI) m/z for C21H19N3O4S [M+H]+, Calcd: 409.109 63, Found: 410.116 84。
N-[6-(二乙胺基甲基)苯并[d]噻唑-2-基]-8-羟基-香豆素-3-甲酰胺(5c) 淡黄色固体, 收率45%。mp 189~191 ℃; 1H NMR (400 MHz, DMSO-d6) δ 9.00 (s, 1H), 7.97 (s, 1H), 7.75 (d, J = 8.4 Hz, 1H), 7.49~7.45 (m, 1H), 7.45~7.41 (m, 1H), 7.31 (s, 1H), 7.30 (s, 1H), 3.68 (s, 2H), 2.58~2.51 (m, 4H), 1.02 (t, J = 7.2 Hz, 6H); 13C NMR (101 MHz, DMSO-d6) δ 161.01, 160.85, 156.99, 149.90, 148.01, 145.15, 143.24, 132.27, 127.77, 125.98, 122.00, 121.62, 120.99, 120.94, 119.79, 117.92, 57.18, 46.59, 11.94; MS (ESI) m/z 422.54 [M-H]-。
N-[6-(二乙胺基甲基)苯并[d]噻唑-2-基]-8-甲氧基-香豆素-3-甲酰胺(5d) 淡黄色固体, 收率46%。mp 171~173 ℃; 1H NMR (400 MHz, DMSO-d6) δ 9.02 (s, 1H), 8.20 (s, 1H), 7.98~7.85 (m, 1H), 7.65~7.53 (m, 2H), 7.53~7.47 (m, 1H), 7.46~7.37 (m, 1H), 4.41 (s, 2H), 3.97 (s, 3H), 3.12 (d, J = 7.0 Hz, 4H), 1.26 (t, J = 7.0 Hz, 6H); MS (ESI) m/z 436.61 [M-H]-。
N-[6-(4-甲基哌啶基甲基)苯并[d]噻唑-2-基]-8-羟基-香豆素-3-甲酰胺(5e) 淡黄色固体, 收率55%。mp 241~243 ℃; 1H NMR (400 MHz, DMSO-d6) δ 9.00 (s, 1H), 7.94 (s, 1H), 7.75 (d, J = 8.4 Hz, 1H), 7.47 (t, J = 4.8 Hz, 1H), 7.41 (dd, J = 8.4, 1.6 Hz, 1H), 7.31 (s, 1H), 7.30 (s, 1H), 3.57 (s, 2H), 2.87~2.73 (m, 2H), 2.04~1.90 (m, 2H), 1.64~1.51 (m, 2H), 1.39~1.29 (m, 1H), 1.19~1.10 (m, 2H), 0.89 (d, J = 6.4 Hz, 3H); 13C NMR (101 MHz, DMSO-d6) δ 161.04, 160.84, 157.32, 157.06, 149.90, 148.07, 145.14, 144.49, 143.25, 140.05, 132.26, 129.11, 127.98, 127.17, 125.99, 123.99, 122.26, 121.62, 121.24, 121.00, 120.93, 119.79, 118.69, 117.95, 62.72, 53.70, 34.32, 30.70, 22.27; HR-MS (ESI) m/z for C24H23N3O4S [M-H]-, Calcd: 449.140 93, Found: 448.133 28。
N-[6-(4-甲基哌啶基甲基)苯并[d]噻唑-2-基]-8-甲氧基-香豆素-3-甲酰胺(5f) 淡黄色固体, 收率61 %。mp 225~227 ℃; 1H NMR (400 MHz, DMSO-d6) δ 8.87 (s, 1H), 7.61~7.51 (m, 3H), 7.49~7.43 (m, 2H), 7.43~7.37 (m, 1H), 4.16 (s, 2H), 3.96 (s, 3H), 3.30~3.17 (m, 2H), 2.93~2.75 (m, 2H), 1.83~1.67 (m, 2H), 1.63~1.51 (m, 1H), 1.51~1.32 (m, 2H), 0.90 (d, J = 5.4 Hz, 3H); HR-MS (ESI) for C25H25N3O4S [M+H]+, Calcd: 463.552 00, Found: 465.213 22。
N-[4-(二甲胺基甲基)苯基]-8-羟基-香豆素-3-甲酰胺(5g) 淡黄色固体, 收率48%。mp 228~236 ℃; 1H NMR (400 MHz, DMSO-d6) δ 8.86 (s, 1H), 7.68 (d, J = 8.4 Hz, 2H), 7.42 (dd, J = 6.4, 2.8 Hz, 1H), 7.30 (d, J = 8.4 Hz, 2H), 7.27 (d, J = 4.2 Hz, 1H), 7.26 (s, 1H), 3.38 (s, 2H), 2.16 (s, 6H); 13C NMR (101 MHz, DMSO-d6) δ 160.92, 160.27, 148.33, 145.07, 143.03, 137.24, 135.15, 129.88, 125.73, 120.81, 120.53, 120.11, 119.92, 63.29, 45.29; HR-MS (ESI) m/z for C19H18N2O4 [M-H]-, Calcd: 338.126 66, Found: 337.119 23。
N-[4-(二甲胺基甲基)苯基]-8-甲氧基-香豆素-3-甲酰胺(5h) 淡黄色固体, 收率49%。mp 197~199 ℃; 1H NMR (400 MHz, DMSO-d6) δ 8.86 (s, 1H), 7.68 (d, J = 8.4 Hz, 2H), 7.42 (dd, J = 6.4, 2.8 Hz, 1H), 7.30 (d, J = 8.4 Hz, 2H), 7.27 (d, J = 4.2 Hz, 1H), 7.26 (s, 1H), 3.38 (s, 2H), 2.16 (s, 6H); 13C NMR (101 MHz, DMSO-d6) δ 160.68, 160.18, 148.03, 146.81, 143.66, 137.16, 135.44, 129.81, 125.71, 121.66, 120.57, 120.13, 119.55, 116.71, 63.39, 56.74, 45.39; HR-MS (ESI) m/z for C20H20N2O4 [M+H]+, Calcd: 352.142 31, Found: 353.149 31。
N-[4-(二乙胺基甲基)苯基]-8-羟基-香豆素-3-甲酰胺(5i) 淡黄色固体, 收率57%。mp 256~258 ℃; 1H NMR (400 MHz, DMSO-d6) δ 8.85 (s, 1H), 7.78 (d, J = 8.4 Hz, 2H), 7.72~7.56 (m, 2H), 7.43~7.34 (m, 2H), 7.26 (t, J = 8.0 Hz, 1H), 4.17 (s, 2H), 2.95 (s, 4H), 1.23 (s, 6H); HR-MS (ESI) m/z for C21H22N2O4 [M-H]-, Calcd: 366.157 96, Found: 365.150 55。
N-[4-(二乙胺基甲基)苯基]-8-甲氧基-香豆素-3-甲酰胺(5j) 淡黄色固体, 收率51%。mp 241~243 ℃; 1H NMR (400 MHz, DMSO-d6) δ 8.90 (s, 1H), 7.85 (d, J = 8.4 Hz, 2H), 7.58~7.53 (m, 3H), 7.49 (dd, J = 8.4, 1.2 Hz, 1H), 7.45~7.39 (m, 1H), 4.30 (d, J = 5.2 Hz, 2H), 3.97 (s, 3H), 3.19~2.96 (m, 4H), 1.24 (t, J = 7.2 Hz, 6H); 13C NMR (101 MHz, DMSO-d6) δ 160.60, 160.58, 148.28, 146.83, 143.71, 139.40, 132.34, 128.28, 125.76, 121.70, 120.55, 120.40, 119.48, 116.85, 112.63, 56.74, 55.01, 46.37, 8.92; HR-MS (ESI) m/z for C22H24N2O4 [M+H]+, Calcd: 380.173 61, Found: 381.180 49。
N-[4-(4甲基哌啶基甲基)苯基]-8-羟基-香豆素-3-甲酰胺(5k) 淡黄色固体, 收率49%。mp 210~212 ℃; 1H NMR (400 MHz, DMSO-d6) δ 8.98 (s, 1H), 7.87~7.82 (m, 1H), 7.80 (d, J = 7.0 Hz, 2H), 7.58 (t, J = 8.0 Hz, 1H), 7.48 (d, J = 7.0 Hz, 2H), 7.29~7.26 (m, 1H), 4.13 (s, 2H), 3.26~3.17 (m, 2H), 2.86~2.66 (m, 2H), 1.81~1.71 (m, 2H), 1.57 (s, 1H), 1.38~1.23 (m, 2H), 0.92 (d, J = 6.4 Hz, 3H); MS (ESI) m/z 393.68 [M+H]+。
N-[4-(4-甲基哌啶基甲基)苯基]-8-甲氧基-香豆素-3-甲酰胺(5l) 淡黄色固体, 收率57%。mp 171~173 ℃; 1H NMR (400 MHz, DMSO-d6) δ 8.90 (s, 1H), 7.84 (d, J = 8.4 Hz, 2H), 7.58~7.54 (m, 1H), 7.51 (d, J = 8.4 Hz, 2H), 7.48 (s, 1H), 7.45~7.38 (m, 1H), 4.26 (s, 2H), 3.97 (s, 3H), 3.39~3.34 (m, 2H), 3.01~2.81 (m, 2H), 1.89~1.70 (m, 3H), 1.69~1.52 (m, 2H), 1.37~1.21 (m, 2H), 0.92 (d, J = 6.4 Hz, 3H); 13C NMR (101 MHz, DMSO-d6) δ 160.62, 160.58, 148.27, 146.84, 143.72, 139.49, 132.67, 125.78, 121.71, 120.48, 119.49, 116.89, 59.33, 56.77, 52.12, 31.28, 28.58, 21.53; MS (ESI) m/z 407.60 [M+H]+。
2 CCK-8抗肿瘤活性测试待测化合物使用DMSO助溶, 使用培养基稀释至不同的浓度, 待测。DMSO终浓度应小于0.01%。在96孔板按每孔5×104个细胞接种细胞U937和MCF-7, 孵育12 h后, 先加入不同浓度的待测化合物, 使药物终浓度为2、4、8、16、32和40 μmol·L-1。控制培养基内DMSO浓度小于0.01%, 空白对照组不加药物只含培养液, 每一浓度的药物组和对照组均设有3个复孔, 24 h后, 采用细胞计数试剂盒(CCK-8)测定U937和MCF-7的细胞活力, 向每一孔板中加入CCK-8溶液10 μL, 37 ℃孵育2 h, 采用全自动酶标仪检测每孔450 nm处的吸光度。根据吸光度值计算抑制率, 根据抑制率计算化合物的IC50值。
3 Caspase-3活性测试U-937悬浮细胞培养在无酚红的RPMI-1640完全培养基(50 000细胞/孔)中, 将100 μL U937细胞悬浮液分别接种到两块96孔板中, 然后在37 ℃、5% CO2培养箱中培养15 h。化合物(12个化合物、PAC-1和DMSO)分别使用培养基配制成2倍终浓度(60 μmol·L-1, 3% DMSO), 同时向两块96孔板中对应的孔中加入化合物50 μL, 每个化合物设置6次重复。向第一块96孔板中, 加入50 μL双功能细胞裂解/半胱天冬酶活性缓冲液, 采用酶标仪, 每隔2 min读取荧光强度(ex. 400 nm, em. 505 nm), 持续读取1 h, 斜率表示caspase-3活力, 该值为化合物处理之前U937细胞的caspase活力。第二块96孔板在37 ℃、5% CO2环境下, 继续孵育15 h, 之后加入50 μL双功能细胞裂解/半胱天冬酶活性缓冲液, 同样每隔2 min读取荧光强度(ex. 400 nm, em. 505 nm), 持续读取1 h, 减去化合物处理之前细胞的caspase活力, 最终计算出化合物处理16 h时后细胞的caspase活力, 以阳性对照PAC-1的caspase活力为100%, 最终求出各个化合物相对于PAC-1的激活率百分比。
4 流式细胞凋亡检测向每孔接种U937细胞于6孔板中(设阴性对照组, 2个浓度和2个时间的实验组, 均设置3个平行实验), 37 ℃、5% CO2培养箱中, 相应孔中加入不同浓度的化合物5f, 分别作用24 h和48 h后的细胞, 用PBS洗涤细胞两次(离心1 000 r·min-1, 5 min)收集5×105细胞, 加入500 μL的Binding Buffer悬浮细胞, 加入5 μL Annexin V-FITC混匀后, 加入5 μL Propidium Iodide, 混匀, 室温、避光、反应5~15 min, 用流式细胞仪检测细胞凋亡的情况。
5 Procaspase-3酶活性测试Procaspase-3蛋白购买于R & D Systems公司, Procaspase-3蛋白加入至由20 mmol·L-1 Tris、300 mmol·L-1 NaCl、5 mmol·L-1 Dithiothreitol、5% Sucrose和0.05% CHAPS组成的缓冲溶液(pH 8.0)中, 终浓度为100 nmol·L-1。分别加入化合物5f、DMSO和PAC-1, 终浓度为10 μmol·L-1。37 ℃孵育4 h后, 加入20 μmol·L-1 Ac-DEVD-AFC, 5 min后, 采用酶标仪读取激发波长400 nm和发射波长505 nm处的荧光强度, 根据方程: (Fcompound-FDMSO)/(FPAC-1-FDMSO)×100计算化合物的激活率。
| [1] | Lain S, Hollick JJ, Campbell J, et al. Discovery, in vivo activity, and mechanism of action of a small-molecule p53 activator[J]. Cancer Cell, 2008, 13: 454–463. DOI:10.1016/j.ccr.2008.03.004 |
| [2] | Flygare JA, Beresini M, Budha N, et al. Discovery of a potent small-molecule antagonist of inhibitor of apoptosis (IAP) proteins and clinical candidate for the treatment of cancer (GDC-0152)[J]. J Med Chem, 2012, 55: 4101–4113. DOI:10.1021/jm300060k |
| [3] | Souers AJ, Leverson JD, Boghaert ER, et al. ABT-199, a potent and selective BCL-2 inhibitor, achieves antitumor activity while sparing platelets[J]. Nat Med, 2013, 19: 202–208. DOI:10.1038/nm.3048 |
| [4] | Hengartner MO. The biochemistry of apoptosis[J]. Nature, 2000, 407: 770–776. DOI:10.1038/35037710 |
| [5] | Crawford ED, Wells JA. Caspase substrates and cellular remodeling[J]. Annu Rev Biochem, 2011, 80: 1055–1087. DOI:10.1146/annurev-biochem-061809-121639 |
| [6] | Pu QH, Wu QQ, Jin XB, et al. Gleevec induces apoptosis in K562 cells through activating caspase-3[J]. Acta Pharm Sin (药学学报), 2014, 49: 1124–1129. |
| [7] | Izban KF, Wrone-Smith T, Hsi ED, et al. Characterization of the interleukin-1β-converting enzyme/Ced-3-family protease, caspase-3/CPP32, in Hodgkin's disease:lack of caspase-3 expression in nodular lymphocyte predominance Hodgkin's disease[J]. Am J Pathol, 1999, 154: 1439–1447. DOI:10.1016/S0002-9440(10)65398-9 |
| [8] | Svingen PA, Loegering D, Rodriquez J, et al. Components of the cell death machine and drug sensitivity of the National Cancer Institute Cell Line Panel[J]. Clin Cancer Res, 2004, 10: 6807–6820. DOI:10.1158/1078-0432.CCR-0778-02 |
| [9] | Fink D, SchlagbaueR-Wadl H, Selzer E, et al. Elevated procaspase levels in human melanoma[J]. Melanoma Res, 2001, 11: 385–393. DOI:10.1097/00008390-200108000-00009 |
| [10] | Nakagawara A, Nakamura Y, Ikeda H, et al. High levels of expression and nuclear localization of interleukin-1β converting enzyme (ICE) and CPP32 in favorable human neuroblastomas[J]. Cancer Res, 1997, 57: 4578–4584. |
| [11] | Persad R, Liu C, Wu TT, et al. Overexpression of caspase-3 in hepatocellular carcinomas[J]. Mod Pathol, 2004, 17: 861–867. DOI:10.1038/modpathol.3800146 |
| [12] | Krepela E, Procházka J, Liu XY, et al. Increased expression of Apaf-1 and procaspase-3 and the functionality of intrinsic apoptosis apparatus in non-small cell lung carcinoma[J]. Biol Chem, 2004, 385: 153–168. DOI:10.1515/bchm.2004.385.issue-2 |
| [13] | O'Donovan N, Crown J, Stunell H, et al. Caspase 3 in breast cancer[J]. Clin Cancer Res, 2003, 9: 738–742. |
| [14] | Putt KS, Chen GW, Pearson JM, et al. Small-molecule activation of procaspase-3 to caspase-3 as a personalized anticancer strategy[J]. Nat Chem Biol, 2006, 2: 543–550. DOI:10.1038/nchembio814 |
| [15] | Peterson QP, Hsu DC, Goode DR, et al. Procaspase-3 activation as an anti-cancer strategy:structure-activity relationship of procaspase-activating compound 1(PAC-1) and its cellular co-localization with caspase-3[J]. J Med Chem, 2009, 52: 5721–5731. DOI:10.1021/jm900722z |
| [16] | Ma J, Chen D, Lu K, et al. Design, synthesis, and structure-activity relationships of novel benzothiazole derivatives bearing the ortho-hydroxy N-carbamoylhydrazone moiety as potent antitumor agents[J]. Eur J Med Chem, 2014, 86: 257–269. DOI:10.1016/j.ejmech.2014.08.058 |
| [17] | Wolan DW, Zorn JA, Gray DC, et al. Small-molecule activators of a proenzyme[J]. Science, 2009, 326: 853–858. DOI:10.1126/science.1177585 |
| [18] | Zorn JA, Wille H, Wolan DW, et al. Self-assembling small molecules form nanofibrils that bind procaspase-3 to promote activation[J]. J Am Chem Soc, 2011, 133: 19630–19633. DOI:10.1021/ja208350u |
 2019, Vol. 54
2019, Vol. 54