瓜蒌为葫芦科植物栝楼Trichosanthes kirilowii Maxim或双边栝楼T. rosthornii Harms的干燥成熟果实, 具宽胸散结之功效, 主治胸痹心痛等症[1, 2]。药效成分或药效成分群的发现是现代中药研究的关键所在, 也是中药质量标准的瓶颈问题[3-5]。瓜蒌提取物有抗血栓形成的作用, 但哪些成分是瓜蒌提取物发挥抗血栓作用的药效成分或药效成分群, 未见相关研究。中药谱效关系研究为探讨中药药效物质基础、评价中药内在质量发挥了积极作用[6, 7], 但未见有关瓜蒌提取物谱效关系研究结果验证的相关报道。为明确瓜蒌提取物抗血栓的主要药效物质, 本研究建立瓜蒌提取物的HPLC指纹图谱, 测定瓜蒌提取物抗大鼠血栓药效学指标, 即血栓干重、血栓素B2 (thromboxane B2, TXB2)、6-酮-前列腺素F1α (6-keto prostaglandin F1α, 6-keto-PGF1α)和环磷酸腺苷(cyclic adenosine monophosphate, cAMP), 利用灰色关联度法研究瓜蒌提取物抗血栓的谱效关系并进行药效成分群的筛选, 采用大鼠动静脉旁路血栓模型验证药效成分群抗血栓效果并分析抗血栓的作用机制, 以期为中药药效成分群的筛选与验证提供思路, 为瓜蒌提取物抗血栓药效成分群的深入研究提供参考。
材料与方法仪器 岛津LC-20A高效液相色谱仪(SPD-M20A检测器, CTO-10AS柱温箱, LC-20AT四元泵) (日本岛津公司); JW-3021HR高速冷冻离心机(安徽省嘉文仪器装备有限公司); Multiskan Go全波长酶标仪(美国Thermo Fisher Scientific公司)。
药品与试剂 瓜蒌提取物(批号: yhy20171101~yhy20171110, 共10批, 皖南医学院药物制剂及质量控制课题组); 胞嘧啶(cytosine, 批号: 20141211)、尿嘧啶(uracil, 批号: 20150417)、鸟嘌呤(guanine, 批号: 20150916)、次黄嘌呤(hypoxanthine, 批号: 20140928)、黄嘌呤(xanthine, 批号: 20150707)、腺嘌呤(adenine, 批号: 20141017)、鸟苷(guanosine, 批号: 20140522)、腺苷(adenosine, 批号: 20150528) (国药集团化学试剂有限公司); 阿司匹林(aspirin, 批号: 160525, 山东新华制药股份有限公司); 血栓素B2 (thromboxane B2, TXB2)、6-酮-前列腺素F1α (6-keto prostaglandin F1α, 6-keto-PGF1α)、环磷酸腺苷(cyclic adenosine monophosphate, cAMP) (批号均为20180706, 南京建成生物工程研究所); 羧甲基纤维素钠(carboxymethylcellulose sodium, CMC-Na) (批号: 20160608, 安徽山河药用辅料股份有限公司); 甲醇为色谱纯, 水为超纯水, 其余试剂为分析纯。
实验动物 SPF级SD大鼠, 雄性, 体质量200~220 g, 济南明悦实验动物繁育有限公司, 合格证号: SCXK (鲁) 2014-0007。本实验所用动物经皖南医学院医学伦理委员会批准同意。
瓜蒌提取物溶液的制备 取10批瓜蒌提取物适量, 精密称定, 分别置于10 mL量瓶中, 用超纯水定容至刻度, 配制质量浓度为0.05 g·mL-1供试品溶液, 用于构建瓜蒌提取物HPLC指纹图谱。取瓜蒌提取物(批号: yhy20171101)适量, 精密称定, 以1% CMC-Na水溶液制备质量浓度为9、45和90 mg·mL-1瓜蒌提取物溶液, 用于瓜蒌提取物抗血栓药效学研究。取瓜蒌提取物(批号: yhy20171101)适量, 精密称定, 以水为溶剂, 制备质量浓度为45 mg·mL-1瓜蒌提取物溶液, 用于药效成分群验证的药效学研究。
阿司匹林溶液的制备 取阿司匹林适量, 精密称定, 以1% CMC-Na水溶液制备质量浓度为1 mg·mL-1阿司匹林溶液, 临用现配。
混合对照品溶液的制备 精密称定胞嘧啶、尿嘧啶、鸟嘌呤、次黄嘌呤、黄嘌呤、腺嘌呤、鸟苷和腺苷适量, 以超纯水为溶剂, 分别制备含量为5、10、125、40、125、30、40和60 μg·mL-1混合对照品溶液, 用于色谱分析。
瓜蒌提取物HPLC指纹图谱的色谱条件 色谱柱为YMC-Pack ODS-A (250 mm×4.6 mm, 5 µm), 以甲醇(A)-0.007 mol·L-1磷酸二氢钾溶液(pH 4.00) (B)为流动相, 梯度洗脱: 0~18 min, 100% B→100% B; 18~35 min, 98% B→95% B; 35~70 min, 95% B→95% B; 流速: 1.0 mL·min-1; 柱温30 ℃; 二极管阵列检测器(diode array detector, DAD), 检测波长为254 nm, 进样量10 μL。
指纹图谱的建立 采用国家药典委员会《中药色谱指纹图谱相似度评价系统》 (2012.130723版)建立瓜蒌提取物的HPLC指纹图谱并进行共有峰匹配。
瓜蒌提取物抗血栓药效学实验分组及给药剂量 50只SPF级雄性大鼠随机分组:模型组、阿司匹林组(0.01 g·kg-1, 阳性对照组)、瓜蒌提取物3个剂量组(0.09、0.45和0.9 g·kg-1), 每组10只, 模型组给予1% CMC-Na水溶液, 各组每日灌胃1次, 灌胃体积为10 mL·kg-1, 连续灌胃7天。
大鼠动静脉旁路血栓模型制备[8] 末次给药后1 h, 各组腹腔注射10%水合氯醛(3 mL·kg-1)麻醉。各组分离左颈静脉和右颈动脉。将称重后的4号手术线放入两端套接PE50导管的聚乙烯管中, 灌满生理盐水, PE50导管分别插入左颈静脉和右颈动脉, 血液回流15 min后取出手术线, 硅胶干燥器干燥48 h后称重。血栓实验结束后, 腹主动脉取血, 置于EDTA-K2抗凝的离心管中, 4 500 r·min-1, 4 ℃离心10 min得血浆, -80 ℃保存, 备用。
血栓干重及血液生化指标检测 计算血栓干重。取血浆样本, 解冻, 严格按照TXB2、6-keto-PGF1α、cAMP试剂盒说明书操作。
谱效关系的灰色关联分析原理设有n批样品, 指纹图谱共有色谱峰(以下简称色谱峰)数为m, 第k批样品的色谱峰数据为:
| $ X = \left[ {\begin{array}{*{20}{c}} {{x_{11}}}&{{x_{12}}}& \cdots &{{x_{1n}}}\\ {{x_{21}}}&{{x_{22}}}& \cdots &{{x_{2n}}}\\ \vdots&\vdots&\vdots&\vdots \\ {{x_{m1}}}&{{x_{m2}}}& \cdots &{{x_{mn}}} \end{array}} \right]\;\;Y = \left[ {\begin{array}{*{20}{c}} {{y_{11}}}&{{y_{12}}}& \cdots &{{y_{1n}}}\\ {{y_{21}}}&{{y_{22}}}& \cdots &{{y_{2n}}}\\ \vdots&\vdots&\vdots&\vdots \\ {{y_{p1}}}&{{y_{p2}}}& \cdots &{{y_{pn}}} \end{array}} \right] $ |
取X中的第1至第m行, 分别与Y构成新矩阵并对数据进行标准化处理:
| $ {\rm{XY}} = \left[ {\begin{array}{*{20}{c}} {{x_{j1}}}&{{x_{j2}}}& \cdots &{{x_{jn}}}\\ {{y_{11}}}&{{y_{12}}}& \cdots &{{y_{1n}}}\\ {{y_{12}}}&{{y_{22}}}& \cdots &{{y_{2n}}}\\ \vdots&\vdots&\vdots&\vdots \\ {{y_{1i}}}&{{y_{2i}}}& \cdots &{{y_{pn}}} \end{array}} \right]\left( {j = 1, 2, \cdots , m} \right) $ | (1) |
计算Y的均值:
对XY进行标准化处理:
| $ {\rm{X}}{{\rm{Y}}_{bz}}\left( {i, k} \right) = {\rm{XY}}\left( {i, k} \right)/{Y_{{\rm{mean}}}}\left( k \right), \left( {i = 1, 2, \cdots , p + 1;k = 1, 2, \cdots , n} \right) $ |
计算XYbz的序列绝对差DD及DD的最大值与最小值:
| $ \begin{array}{l} {\rm{DD}}\left( {i - 1, k} \right) = \left\| {{\rm{X}}{{\rm{Y}}_{{\rm{bz}}}}\left( {1, k} \right) - {\rm{X}}{{\rm{Y}}_{{\rm{bz}}}}\left( {i, k} \right)} \right\|;\left( {i = 1, 2, \cdots , p + 1;k = 1, 2, \cdots , n} \right)\\ \begin{array}{*{20}{l}} {{\rm{D}}{{\rm{D}}_{{\rm{max}}}}{\rm{ = max}}\left( {{\rm{DD}}} \right);}\\ {{\rm{D}}{{\rm{D}}_{{\rm{min}}}} = {\rm{ min}}\left( {{\rm{DD}}} \right);} \end{array} \end{array} $ |
计算X的均值及标准偏差:
| $ \begin{array}{l} {X_{{\rm{mean}}}}(k) = \frac{{\sum\limits_{j = 1}^m {{x_{jk}}} }}{m}\left( {k = 1,2, \cdots ,n} \right)\\ {s_i} = \sqrt {\frac{{\sum\limits_{j = 1}^m {{{\left( {{x_{jk}} - {X_{\mathit{mean}}}(k)} \right)}^2}} }}{{n - 1}}} \left( {k = 1,2, \cdots ,n} \right) \end{array} $ |
取X的最大和最小标准偏差:
| $ {s_{\max }} = \max \left( {{s_1},{s_2}, \cdots ,{s_n}} \right),{s_{\min }} = \min \left( {{s_1},{s_2}, \cdots ,{s_n}} \right) $ |
计算分辨系数(resolution coefficient, RC):
| $ {\rm{R}}{{\rm{C}}_1} = \frac{{{s_{\min }}}}{{{s_{\max }} + {s_{\min }}}},{\rm{R}}{{\rm{C}}_2} = \frac{{{s_{\max }}}}{{{s_{\max }} + {s_{\min }}}} $ |
计算关联系数(correlation coefficient, CC):
| $ \begin{array}{l} {\rm{CC}}\left( {i, j} \right) = \left( {{\rm{R}}{{\rm{C}}_1}\cdot{\rm{D}}{{\rm{D}}_{min}} + {\rm{R}}{{\rm{C}}_2}\cdot{\rm{D}}{{\rm{D}}_{max}}} \right)/\left( {DD\left( {i, j} \right) + {\rm{R}}{{\rm{C}}_2}\cdot{\rm{D}}{{\rm{D}}_{max}}} \right);\\ \left( {i = 1, 2, \ldots , p;j = 1, 2, \ldots , n} \right) \end{array} $ |
计算关联度(relational degree, RD)[10]:
| $ {\rm{rd}}(i) = \frac{{{\rm{C}}{{\rm{C}}_{sum}}(i)}}{n} = \frac{{\sum\limits_{j = 1}^n {{\rm{CC}}(j,i)} }}{n}\left( {i = 1,2, \cdots ,p} \right) $ | (2) |
依次从X中取第1行至第m行, 分别与Y构成新矩阵, 得公式(1), 按步骤计算至公式(2), 得到m个色谱峰与p个药效的关联度
| $ R{D_{m \times p}} = \left[ {\begin{array}{*{20}{c}} {{\rm{r}}{{\rm{d}}_{11}}}&{{\rm{r}}{{\rm{d}}_{12}}}& \cdots &{{\rm{r}}{{\rm{d}}_{1p}}}\\ {{\rm{r}}{{\rm{d}}_{21}}}&{{\rm{r}}{{\rm{d}}_{22}}}& \cdots &{{\rm{r}}{{\rm{d}}_{2p}}}\\ \vdots&\vdots&\vdots&\vdots \\ {{\rm{r}}{{\rm{d}}_{m1}}}&{{\rm{r}}{{\rm{d}}_{m2}}}& \cdots &{{\rm{r}}{{\rm{d}}_{mp}}} \end{array}} \right] $ |
统计学处理 本文实验数据以均数±标准差(x±s)表示, 用SPSS 11.5软件进行统计学处理。组间数据比较采用单因素方差分析, 两组间比较采用独立样本t检验, P < 0.05为差异有统计学意义。
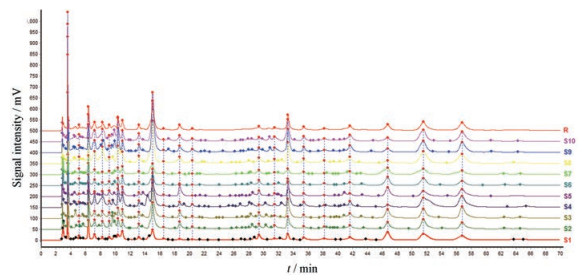
结果 1 瓜蒌提取物的HPLC指纹图谱按照色谱条件, 建立瓜蒌提取物的HPLC指纹图谱及混合对照品的色谱图(图 1)。其中1号峰为胞嘧啶, 3号峰为尿嘧啶, 7号峰为鸟嘌呤, 8号峰为次黄嘌呤, 9号峰为黄嘌呤, 10号峰为腺嘌呤, 16号峰为鸟苷, 22号峰为腺苷。采用国家药典委员会《中药色谱指纹图谱相似度评价系统》 (2012.130723版)对10批瓜蒌提取物的HPLC指纹图谱进行相似度评价。以S1为参照样品, 经Mark峰匹配, 建立瓜蒌提取物对照图谱(R), 标定22个色谱峰, 结果见图 2, 并对22个色谱峰的峰面积采用均值化法处理[11], 见表 1。与R比较, 10批瓜蒌提取物的HPLC指纹图谱平均相似度为0.96±0.03, 表明10批瓜蒌提取物的内在质量较为一致。为此, 参照文献[9]选择瓜蒌提取物(yhy20171101)进行抗血栓药效学研究和谱效关系分析。

|
Figure 1 HPLC fingerprint of Trichosanthes extract (A) and chromatogram of reference substance (B). 1: Cytosine; 3: Uracil; 7: Guanine; 8: Hypoxanthine; 9: Xanthine; 10: Adenine; 16: Guanosine; 22: Adenosine |
|
Figure 2 HPLC fingerprint of Trichosanthes extract. S1-S10: Trichosanthes extract (batch number: yhy20171101-yhy20171110); R: Control map |
| Table 1 Common peaks and peak area values of 10 batches of Trichosanthes extract |
阿司匹林阳性对照组与模型组相比, 除cAMP外各药效学指标均有统计学意义(P < 0.05或P < 0.01)。瓜蒌提取物抗血栓的药效学结果见表 2。瓜蒌提取物组(0.09、0.45和0.9 g·kg-1)与模型组比较, 除瓜蒌提取物组(0.09 g·kg-1、0.45 g·kg-1)可降低血栓干重及瓜蒌提取物组(0.09 g·kg-1)可改善TXB2、cAMP含量但无统计学意义外, 其余各组及各药效学指标均有显著性差异(P < 0.01), 说明瓜蒌提取物有较好的抗血栓作用。
| Table 2 Anti thrombotic pharmacodynamic results of Trichosanthes extract. n = 10, x±s. #P < 0.05, ##P < 0.01 vs model group. TXB2: Thromboxane B2; 6-keto-PGF1α: 6-keto Prostaglandin F1α; cAMP: Cyclic adenosine monophosphate. a: Model group; b: Positive control group (aspirin) |
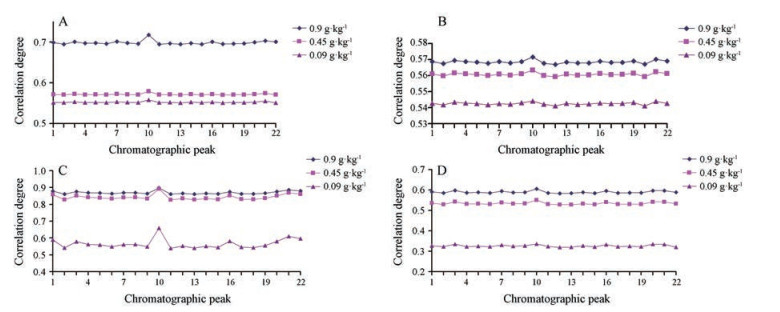
根据瓜蒌提取物色谱峰的均值化峰面积和瓜蒌提取物的药效学结果, 按照谱效关系的灰色关联分析原理, 采用Matlab 2014a语言自编谱效灰色关联程序, 计算瓜蒌提取物指纹图谱与抗血栓作用的关联度, 结果见图 3。由图 3A~D可知, 在同一药效学指标中瓜蒌提取物抗血栓的谱效关联度不同, 在不同药效学指标中瓜蒌提取物抗血栓的谱效关联度变化趋势较为相似, 说明瓜蒌提取物中各成分抗血栓作用存在差异性, 这种差异性在不同药效学指标间表现较为相似。
|
Figure 3 Correlation between Trichosanthes extract (batch No: yhy20171101) and antithrombotic efficacy. A: Dry weight of thrombus; B: TXB2; C: 6-keto-PGF1α; D: cAMP |
按瓜蒌提取物与抗血栓药效间关联度的大小, 将色谱峰排序, 组成关联序, 序号按关联度由大到小排序, 表 3中列出了不同药效学指标、不同给药剂量下的色谱峰按关联度大小的排序, 略去了关联度数据。由表 3可知, 色谱峰与不同给药剂量下的不同药效学指标间的关联序不同, 各成分对药效的贡献率不同。
| Table 3 Relational order of 22 peaks of Trichosanthes extract against thrombosis |
关联序号的大小及色谱峰在不同药效学指标、不同给药剂量中的累积出现频率反映了该成分对药效的贡献率。表 3中关联序号位于前10位的色谱峰的累积出现频率依次为: 3号峰(12次)、10号峰(12次)、16号峰(12次)、21号峰(12次)、7号峰(11次)、1号峰(10次)、20号峰(9次)、22号峰(9次)、8号峰(7次)、9号峰(6次)。除20、21号峰成分未知外, 1、3、7、8、9、10、16和22号色谱峰分别为胞嘧啶、尿嘧啶、鸟嘌呤、次黄嘌呤、黄嘌呤、腺嘌呤、鸟苷和腺苷。为此, 选取以上8种已知成分作为瓜蒌提取物抗血栓的药效成分群。取胞嘧啶等8种成分的单体化合物, 按瓜蒌提取物中各单体化合物的含量及比例制备单体化合物的混合溶液并进行抗血栓药效学研究, 以验证药效成分群抗血栓的效果。
4 药效成分群抗血栓的药效学研究 4.1 给药剂量及实验分组本课题组对瓜蒌提取物中胞嘧啶等8种成分进行了分离、鉴别及定量分析, 其中胞嘧啶含量为0.3%、尿嘧啶1.2%、鸟嘌呤1.0%、次黄嘌呤0.5%、黄嘌呤0.2%、腺嘌呤0.8%、鸟苷1.3%和腺苷1.4%。根据《中国药典》 (2015年版一部)瓜蒌的用量为成人(按60 kg计)每日15 g, 瓜蒌提取物的得率为6% (即每100 g瓜蒌可得瓜蒌提取物6 g)及瓜蒌提取物中胞嘧啶、尿嘧啶、鸟嘌呤、次黄嘌呤、黄嘌呤、腺嘌呤、鸟苷、腺苷的比例(3:12:10:5:2:8:13:14), 以水为溶剂, 制备胞嘧啶等8种单体化合物组成的药效成分群溶液, 并按混合单体化合物的总质量计为大鼠给药剂量(g·kg-1)。
36只SPF级雄性大鼠随机分组:正常组; 模型组; 瓜蒌提取物组(0.45 g·kg-1, 阳性对照组); 药效成分群低、中、高剂量组(0.006、0.03和0.06 g·kg-1), 每组6只, 正常组、模型组给予纯水, 各组每日灌胃1次, 灌胃体积为10 mL·kg-1, 连续灌胃7天。
4.2 药效成分群抗血栓的药效学结果参照瓜蒌提取物抗血栓的药效学实验方法进行造模并检测血栓干重及生化指标, 结果见表 4。与正常组比较, 模型组TXB2含量升高, 6-keto-PGF1α含量降低, TXB2/6-keto-PGF1α升高, cAMP降低, 且均有显著性差异(P < 0.01), 说明造模成功。与模型组比较, 药效成分群各组均可有效降低血栓干重(P < 0.01或P < 0.05), 升高6-keto-PGF1α含量(P < 0.01);药效成分群中、高剂量组(0.03和0.06 g·kg-1)可有效降低TXB2含量(P < 0.01或P < 0.05), 升高cAMP含量(P < 0.01)。与瓜蒌提取物组(0.45 g·kg-1)比较, 药效成分群各组均可明显改善TXB2/6-keto-PGF1α趋于正常并呈量效关系(P < 0.01)。
| Table 4 Pharmacodynamics results of effective antithrombotic ingredients group. n = 6, x±s. **P < 0.01 vs normal group; #P < 0.05, ##P < 0.01 vs model group; ΔP < 0.05, ΔΔP < 0.01 vs Trichosanthes extract group |
本研究利用灰色关联度法对瓜蒌提取物抗血栓的谱效关系进行分析, 筛选出了瓜蒌提取物抗血栓的主要药效成分群并进行了验证。结果表明, 由胞嘧啶、尿嘧啶、鸟嘌呤、次黄嘌呤、黄嘌呤、腺嘌呤、鸟苷、腺苷按3:12:10:5:2:8:13:14比例组成的药效成分群具有较好的抗血栓作用, 验证了谱效关系结果的正确性。20、21号峰位于累积出现频率第7位和第4位, 但成分未知。借助本文谱效关系分析结果, 可有目的地对20、21号峰进行分离制备与鉴定, 并进一步研究其对瓜蒌提取物的质量控制、药效学及作用机制的影响。
血栓干重、TXB2、6-keto-PGF1α及cAMP是评价血栓形成及影响血栓形成的重要指标。血栓烷A2 (thromboxane A2, TXA2)是花生四烯酸代谢产物, 可促使血小板聚集、收缩血管; 前列环素(epoprostenol, PGI2)仅在内皮细胞受刺激后合成释放, 为内皮细胞代谢产物, 可抑制血小板聚集、舒张血管。TXA2和PGI2之间的动态平衡是调整血小板聚集及血管舒缩的基础, 也是机体调控血栓形成的重要机制。由于TXA2和PGI2不稳定, 因此将TXA2和PGI2稳定的代谢产物TXB2和6-keto-PGF1α作为其含量的检测指标[12, 13]。
按照瓜蒌提取物中胞嘧啶等8种单体化合物的含量计算可知, 0.45 g瓜蒌提取物中共含有0.03 g胞嘧啶等8种单体化合物, 即按胞嘧啶等8种单体化合物含量计, 瓜蒌提取物组(0.45 g·kg-1)与药效成分群组(0.03 g·kg-1)相当。与瓜蒌提取物组(0.45 g·kg-1)比较, 药效成分群组(0.03 g·kg-1)可有效降低TXB2 (P < 0.05), 显著升高6-keto-PGF1α (P < 0.01), 使TXB2/6-keto-PGF1α更趋于平衡(P < 0.01)。药效成分群抗血栓的作用机制与抑制血小板聚集及改善血管内皮功能相关。
内皮细胞受刺激后可产生PGI2并刺激血小板产生腺苷酸环化酶, 使cAMP水平升高[14, 15]。药物激活腺苷环化酶活性, 促进cAMP合成, 或抑制磷酸二酯酶活性, 减少cAMP降解, 均可使cAMP水平增加。与药效成分群各组比较, 瓜蒌提取物组(0.45 g·kg-1) 6-keto-PGF1α含量偏低(P < 0.01), 但cAMP含量偏高(P < 0.01)。推测瓜蒌提取物升高cAMP水平的机制除激活腺苷环化酶活性外, 还可能同时抑制磷酸二酯酶活性。
| [1] | China Pharmacopoeia Commission. Chinese Pharmacopoeia: Vol Ⅰ (中华人民共和国药典: 一部)[S]. Beijing: China Medical Science Press, 2015: 112. |
| [2] | Zou CC, Yan HY, Wei ML. Study of the anti-heart failure mechanisms of compatibility of Gualou with Xiebai in basis of network pharmacology[J]. Acta Pharm Sin (药学学报), 2018, 53: 1406–1413. |
| [3] | Yang H, Qi LW, Li HJ, et al. "Bioactive equivalent combinatorial components" as defined labeled amount of active constituents for quality control of traditional Chinese medicines[J]. World Sci Technol Mod Tradit Chin Med Mat Med (世界科学技术-中医药现代化), 2014, 16: 510–513. |
| [4] | Li ZY, Duan YH, Qin XM, et al. Study of difference in quality of traditional Chinese medicines[J]. Acta Pharm Sin (药学学报), 2017, 52: 1820–1826. |
| [5] | Zhang JX, Hu Q, Yu H, et al. Rapid and intelligentized identification of the constituents in Gualoupi injection by HILIC/ESI-Orbitrap HRMS combined with Compound Discoverer software[J]. Acta Pharm Sin (药学学报), 2018, 53: 1705–1712. |
| [6] | Fan JX, Wang S, Meng XS, et al. Study of cancer cell apoptosis induced by Schizonepeta tenuifolia with microfluidic chip technology[J]. Acta Pharm Sin (药学学报), 2017, 52: 126–131. |
| [7] | Zeng LJ, Lin B, Song HT. Progress in study of spectrum-effect relationship of traditional Chinese medicine and discussions[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 1425–1432. |
| [8] | Fan HY. Antiplatelet and Antithrombotic Activities of Salvianolic Acid A (丹酚酸A抗血小板及抗血栓作用的研究)[D].Changchun: Jilin University, 2012. |
| [9] | Zou CC, Zong QN, Yan HY. Spectrum-activity relationship of trichosanthis fructus and trichosanthis fructus strip pieces for rat myocardial ischemia-reperfusion injury[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 92–99. |
| [10] | Yan HY, Zou CC, Wei ML, et al. Spectrum-effect relationship of Gualou Xiebai dropping pills on myocardial ischemia[J]. J Med Mater (中药材), 2015, 38: 1912–1918. |
| [11] | Zou CC, Hong GJ, Yan HY. Effect of different data standardization methods on spectrum-effect relationship for anticoagulation of Trichosanthis Fructus dropping pills[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 1864–1870. |
| [12] | Zhang XD. The Study of Antithrombotic Effects of Kangxian Yixin Concentrated Pill(抗纤益心浓缩丸抗血栓作用研究)[D].Zhengzhou: Henan University of Chinese Medicine, 2017. |
| [13] | Yan CH, Feng YP. Effects of butylphthalide on extracellular 6-keto-PGF1α, TXB2 and 6-keto-PGF1α/TXB2 ratio in cultured rat cortical neurons[J]. Acta Pharm Sin (药学学报), 1998, 33: 881–885. |
| [14] | Luo CY. Hemostatic Effects Study of Callicarpa nudiflora Hook (裸花紫珠的止血活性研究)[D]. Nanchang: Nanchang University, 2016. |
| [15] | Wang FQ, Chen C, Xia ZN, et al. Applications of platelets in studies on traditional Chinese medicines promoting blood circulation to remove blood stasis[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 2993–3003. |
 2019, Vol. 54
2019, Vol. 54


