2. 浙江中医药大学药学院, 浙江 杭州 310053
2. School of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou 310053, China
胰腺癌是一种恶性程度极高的消化系统肿瘤, 近年来已成为我国癌症患者死亡的第五大恶性肿瘤, 然而常规的治疗手段疗效十分有限, 急需开发新型的药物用于胰腺癌的临床治疗[1]。特异性地拮抗Hsp90功能可以同时抑制肿瘤细胞内多条关键信号通路的活性, 有望通过对肿瘤细胞特异性地“多靶点打击”诱导肿瘤细胞凋亡, 抑制肿瘤生长[2]。随着雷公藤红素(celastrol)[3]和姜黄素衍生物[4]等中药有效成分拮抗Hsp90介导肿瘤杀伤的作用机制得到详细阐明, 从传统中药中寻找新型Hsp90小分子抑制剂用于肿瘤治疗已成为研究热点之一。
苦蘵, 为茄科酸浆属植物Physalis angulata L.的全草, 《本草纲目拾遗》中记载本品具有清热解毒、利咽、化痰、利尿等作用, 被广泛用于肺热咳嗽、咽喉肿痛、湿热黄疸以及多种肿瘤等的治疗。现代药理研究报道苦蘵提取物在体内和体外对于乳腺癌、前列腺癌和肝癌等恶性肿瘤生长具有较好的抑制作用[5]。课题组前期研究显示, 苦蘵甲醇提取物可以诱导热休克因子(heat shock element, HSE)活性, 提示苦蘵抑制胰腺癌细胞生长的作用可能与其拮抗Hsp90功能有关, 但苦蘵拮抗Hsp90抑制胰腺癌生长的具体物质基础和分子机制仍不明确。
与传统中药化学提取分离技术以化合物为导向不同, 活性化合物快速发现技术以生物活性为导向, 可在中药提取分离过程中快速筛选出有价值的活性单体[6]。以双荧光素酶报告基因系统为基础的靶点筛选技术可实现靶向小分子化合物的高通量筛选[7]。通过将活性筛选与靶点筛选技术相结合, 可实现靶向活性小分子化合物快速发现, 为从传统中药中高效寻找药效物质基础提供新的方法。
本研究将体外抗肿瘤活性筛选技术、双萤光素酶报告基因技术与多元色谱分离技术相耦合, 建立了“活性+靶点”双重导向的Hsp90抑制剂快速筛选技术, 并从苦蘵中筛选得到靶向Hsp90的活性单体, 初步研究其抑制胰腺癌细胞增殖的活性以及靶向Hsp90的分子作用机制。
材料与方法材料与试剂 苦蘵粗提物(实验室自制); 人胰腺癌细胞株BXPC-3和人肾胚细胞株HEK293T (中国科学院上海细胞库提供); 质粒pGL4[HSE-luc] vector、pGL4.75[hRluc/CMV] vector、Dual-Luciferase Assay System (美国Promega公司); Lipofactmine 2000 (美国Invitrogen公司); Hsp90α/β shRNA慢病毒颗粒、对照shRNA慢病毒颗粒与Polybrene、Hsp90和β-actin一抗(美国Santa Cruz公司); 层析硅胶(100~200目, 中国青岛海洋化工厂); 色谱纯甲醇(美国Tedia公司); Opti-MEM、PRMI1640细胞培养液、胎牛血清(美国Gibco公司), 青/链霉素、0.25%胰蛋白酶/EDTA、1×PBS (中国吉诺生物技术有限公司), 噻唑蓝(美国Amersco公司); Akt一抗(美国CST公司)。
植物来源与鉴定 苦蘵于2012年11月采自广东省梅州, 经浙江中医药大学中药资源教研室陈孔融主任中药师鉴定为茄科酸浆属植物苦蘵Physalis angulata L.的干燥全草。
植物提取与分离 取苦蘵干燥全草4.0 kg, 适当粉碎, 95%乙醇渗漉, 渗漉液减压回收乙醇至无醇味, 得浸膏, 经石油醚、二氯甲烷、乙酸乙酯萃取。取其中二氯甲烷提取物用适量二氯甲烷溶解, 湿法上样; 硅胶与样品约15:1, 选用二氯甲烷-甲醇(1:0、60:1、30:1、15:1、0:1)梯度洗脱, 按照薄层检识的结果, 合并流份。采用反相高效液相色谱分析不同流份物质组成的差异, 色谱条件: Waters 1525-717-2996色谱仪; Kromasil C18色谱柱柱(4.6 mm×250 mm, 5 μm), 甲醇/水为流动相, DAD检测器, 检测波长220 nm。取活性较好且样品量较大的流份反复重结晶, 得无定型白色粉末。产物用制备反相高效液相色谱分离, 色谱条件: Waters 600-2487半制备色谱仪。Agilent XDB-C18半制备色谱柱, (9.4 mm×250 mm, 5 μm)。样品供试液:取待分离流份饱和上清液, 加甲醇-水稀释, 样品过0.45 μm微孔滤膜, 即得。
体外细胞培养 取对数生长期的人胰腺癌细胞BXPC-3细胞株或肾胚细胞株HEK293T常规贴壁生长, 传代培养于含体积分数为10%胎牛血清、100 u·L-1青霉素和100 mg·L-1链霉素的RPMI 1640培养液中, 37 ℃、5% CO2及饱和湿度的细胞培养箱中孵育, 2天换液, 3天传代1次。
MTT法测定体外细胞增殖率 取汇合度80%以上的BXPC-3细胞, 胰酶消化, 终止反应, 制成细胞悬液, 按每毫升6×104~8×104个接种于96孔培养板, 置培养箱孵育过夜。取苦蘵单体溶于DMSO, 用新鲜培养液稀释成不同药物浓度, 每个浓度5个复孔; 另设溶剂对照组, 放回培养箱培养; 待达到规定的药物处理时间, 去除含药培养液, 每孔加入新鲜配制的含0.5 mg·L-1 MTT的无血清培养液, 继续培养4 h, 吸去上清液, 每孔加入150 µL DMSO, 酶标仪在波长490 nm处检测OD值。绘制柱状图。细胞增殖率计算公式如下, 并采用中效方程计算IC50。
细胞增殖率=[(OD药物处理组-OD空白组)/(OD对照组-OD空白组)]×100%。
双荧光素酶报告基因法检测HSE活性 取汇合度80%以上HEK293T细胞, 胰酶消化, 终止反应, 制成细胞悬液, 按每毫升5×105个接种于24孔培养板, 放回培养箱孵育24 h。将培养液换成Opti-MEM, 平衡30 min。取适量pGL4[HSE-luc] vector质粒、pGL4.75[hRluc/CMV] vector质粒与lipofectamine 2000用Opti-MEM稀释, 混合均匀, 静置20 min, 取该混合物加入到HEK293T细胞中, 质粒终浓度为每孔0.5 µg, 置培养箱中继续孵育4~6 h。换成新鲜培养液孵育24 h, 弃去原培养液。取苦蘵单体适量溶于DMSO, 用新鲜培养液稀释成适当药物浓度, 加入各培养孔, 每个浓度3个复孔, 另设溶剂对照组, 置培养箱; 待达到规定的药物处理时间, 去除含药培养液。用Dual-Luciferase Assay System试剂盒检测每个处理组的萤火虫萤光素酶活性(Fluc)与海肾萤光素酶活性(Rluc), Fluc/Rluc即为转染效率线性化的萤火虫萤光素酶活性, 绘制柱状图。
蛋白免疫印迹实验 取对数生长期BXPC-3细胞, 以每皿2×106个接种于100 mm细胞培养皿中。待细胞贴壁后, 分别用不同种类的药物处理24~48 h, 溶剂对照组加入相同体积溶剂。RIPA裂解液裂解细胞, 采用BCA法测蛋白含量。取适量细胞裂解液加入适量SDS-PAGE上样缓冲液。各处理组取等量蛋白, 经SDS-PAGE电泳分离, 转印至PVDF膜, 封闭1 h, 按一定稀释比例分别加入相应一抗, 4 ℃孵育过夜, HRP标记二抗, BeyoECL Plus化学发光试剂盒显影, Bio-rad ChemiDoc XRS凝胶成像系统曝光并分析蛋白表达水平。为研究Hsp90蛋白二聚体, 采用非还原性SDS-PAGE。BXPC-3细胞经药物处理后, 弃去含药培养液, 用含40 mmol·L-1碘乙酰胺的冰PBS孵育5 min, RIPA裂解液裂解细胞, 取细胞裂解液加入适量非还原性的SDS-PAGE上样缓冲液, 再按上述步骤进行蛋白免疫印迹实验。
shRNA干扰Hsp90基因表达实验 取对数生长期BXPC-3细胞, 以每孔5×105个接种于12孔细胞培养板中, 孵育过夜。待细胞贴壁后, 将原培养液换成Opti-MEM培养液, 平衡30 min。取适量Hsp90α/β shRNA慢病毒颗粒(终浓度10 μL·mL-1)或对照shRNA慢病毒颗粒(终浓度5 μL·mL-1)与Polybrene (终质量浓度6 μg·mL-1)用Opti-MEM稀释, 混合均匀。向每孔中加入1 mL含慢病毒颗粒和Polybrene的Opti-MEM替代原培养液, 孵育过夜。弃去培养液, 向各孔中加入1 mL PRMI 1640完全培养液, 孵育过夜。各组细胞按1:2传代, 继续培养48 h。弃去培养液, 向各孔中加入含8 μL·mL-1嘌呤霉素盐酸盐培养液, 继续培养7天, 每3天更换一次含嘌呤霉素盐酸盐培养液, 直至形成稳定表达shRNA的BXPC-3细胞克隆。蛋白免疫印迹实验验证细胞克隆的Hsp90蛋白表达。
细胞克隆形成实验 取生长有稳定表达shRNA_ Hsp90 α/β和对照shRNA的BXPC-3细胞克隆的12孔细胞培养板。向稳定表达shRNA_Hsp90 α/β的各孔细胞克隆中分别加入5 μmol·L-1 withanolide E (WE)与4β-hydroxywithanolide E (HWE), 对照组和表达对照shRNA细胞克隆组加入等体积DMSO, 孵育48 h。取一部分药物处理后的细胞采用结晶紫溶液染色。简要实验流程如下, 弃去各孔培养液, PBS清洗2次, 10%甲醛固定5 min, 弃去甲醛, 各孔加入0.05%结晶紫溶液染色30 min, 流水洗去多余结晶紫溶液, 倒置于室温中使干燥。拍照获取各孔细胞克隆形成数量。向各孔加入1 mL甲醇, 室温震荡10 min, 使各孔结晶紫完全溶解于甲醇, 移取100 μL至一新的96孔板, 酶标仪在波长540 nm处检测OD值, 绘制柱状图。另一部分细胞样本提取总蛋白, 蛋白免疫印迹法检测Hsp90和Akt蛋白表达, β-actin为内参。每次实验重复3次。
统计学方法 所有实验至少独立重复3次。用SPSS12.0软件分析实验数据, 数据以均数±标准误(x±s)表示, 多组间样本比较用单因素方差分析(one-way ANOVA), 组间样本两两比较用student's t-test, 以P < 0.05为差异有显著统计学意义, 以P < 0.01为差异有极显著统计学意义。
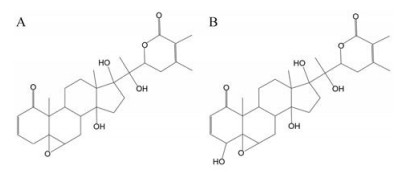
结果 1 苦蘵二氯甲烷部位流份分离、鉴定与活性筛选苦蘵二氯甲烷部位经二氯甲烷-甲醇梯度洗脱, 按照薄层检识的结果, 合并流份, 经高效液相色谱分析, 共得到9个不同的流份。进一步检查这9个流份的体外抑制胰腺癌细胞BXPC-3的活性以及诱导肾胚细胞HEK293T的热休克效应活性。结果如表 1所示, 3~6号流份具有较强的体外抑瘤活性, 其中4号流份还具有较强的诱导热休克效应活性, 故下一步将重点研究4号流份的物质组成。采用甲醇反复重结晶, 反向高效液相色谱分析, 发现4号流份共有5个峰。反相制备液相收集其中主峰A与B, 得A约11 mg, 得B约26 mg。经质谱、1H NMR与13C NMR鉴定其结构, 与文献数据比对分别为内酯类麦角甾烷化合物WE[8]和HWE[9] (图 1), 均为已知化合物, 但在酸浆属植物苦蘵中鲜有报道。
| Table 1 The activity screening results of dichloromethane fractions from Physalis angulata L.in BXPC-3 cells. n=3, x±s. #P < 0.05, ##P < 0.01 vs DMSO group. IC50: Half maximal inhibitory concentration |
|
Figure 1 The chemical structures of withanolide E (WE, A) and 4β-hydroxywithanolide E (HWE, B) |
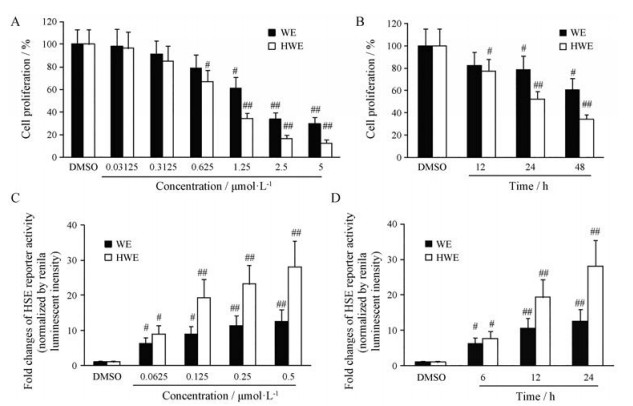
为了证实所分离得到的苦蘵中单体WE与HWE的活性, 本研究测定了这两种化合物体外杀伤BXPC-3细胞系的半数抑制率(IC50)以及其诱导HSE萤光素酶活性。结果如图 2所示, HWE和WE可以显著抑制BXPC-3细胞体外增殖, 且呈现浓度(图 2A)与时间(图 2B)依赖效应。HWE和WE处理BXPC-3细胞48 h的IC50分别为0.71±0.03 μmol·L-1和1.23±0.10 μmol·L-1。WE和HWE都可显著增强HEK293T细胞HSE萤光素酶报告基因活性(P < 0.05, P < 0.01), 且随着浓度和处理时间增加, 萤光素酶活性相应增强, 呈现出一定的量效(图 2C)与时效(图 2D)关系。其中0.5 μmol·L-1 WE和HWE分别处理BXPC-3细胞24 h可诱导HSE活性上调12.5±3.4倍与28.1±3.4倍。提示WE和HWE的肿瘤杀伤作用可能与诱导肿瘤细胞热休克效应有关。
|
Figure 2 The anti-proliferation and heat shock induction activity of compounds from Physalis angulata L. A: The percentage of cell proliferation of BXPC-3 cells after exposing to different concentrations of WE and HWE for 48 h; B: The percentage of cell proliferation of BXPC-3 cells after exposing to 1.25 μmol·L-1 WE and HWE for 12, 24 and 48 h; C: The fold changes of heat shock element (HSE) reporter activity in HEK293T cells for the treatment of WE and HWE (0.062 5, 0.125, 0.25, 0.5 μmol·L-1) for 24 h; D: The fold changes of HSE reporter activity in HEK293T cells for the treatment of 0.125 μmol·L-1 WE and HWE for 6, 12 and 24 h. n = 3, x±s. #P < 0.05, ##P < 0.01 vs DMSO group |
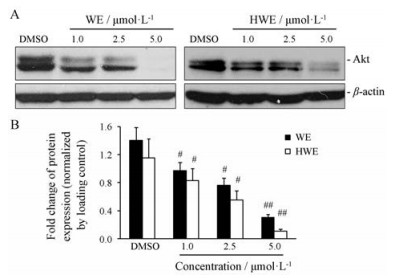
由于WE和HWE具有诱导肿瘤细胞热休克效应的能力, 本研究进一步研究了WE和HWE是否可以抑制Hsp90活性并进而造成其调控下游原癌基因的蛋白失稳。结果如图 3所示, WE和HWE可显著下调BXPC-3细胞Hsp90客户蛋白Akt水平(P < 0.05), 且呈一定的量效关系。其中5 μmol·L-1 WE和HWE分别处理48 h, 可使Akt蛋白表达水平下调至DMSO组的21.7%±2.8%和9.8%±1.4% (P < 0.01)。接下来采用非还原凝胶电泳检测WE和HWE对胞内Hsp90蛋白凝聚的影响。结果如图 4所示, 与DMSO组相比, 5 μmol·L-1 WE与HWE分别处理BXPC-3细胞48 h可诱导Hsp90二聚体表达上调6.5±1.3和11.8±2.0倍(P < 0.01), 但Hsp90单体表达无明显变化。
|
Figure 3 The inhibitory effect of WE and HWE on Hsp90 client protein Akt expression. A: The Akt protein expression in BXPC-3 cells after exposure to WE and HWE for 48 h; B: Quantitative analysis of Akt expression. n = 3, x±s. #P < 0.05, ##P < 0.01 vs DMSO group |

|
Figure 4 WE and HWE induced Hsp90 to aggregate dimer formation. A: The dimer, monomer and total expression of Hsp90 after exposure to 5 μmol·L-1 WE and HWE for 48 h; B: Quantitative analysis of Hsp90 dimer and total protein expression. n = 3, x±s. ##P < 0.01 vs DMSO group |
为了进一步阐明WE和HWE抑制Hsp90蛋白活性与其杀伤胰腺癌细胞作用之间的关联性, 本研究采用shRNA干扰细胞的Hsp90基因表达, 接着检测WE和HWE对表达shRNA细胞克隆的体外杀伤作用, 以及Hsp90和Akt蛋白表达。如结果所示(图 5), 与对照组相比, shRNA慢病毒颗粒显著抑制BXPC-3细胞增殖, 并显著降低Hsp90蛋白表达(图 5A和B左侧两列)。Hsp90基因敲低的BXPC-3细胞经5 μmol·L-1 WE和HWE处理48 h, 结果显示WE和HWE虽仍可杀伤部分肿瘤细胞, 但与Hsp90基因敲低细胞的DMSO组相比无显著性差异(图 5A和C)。蛋白免疫印迹结果显示, Hsp90基因敲低后WE和HWE也不能抑制Hsp90客户蛋白Akt表达(图 5B)。

|
Figure 5 shRNA knockdown Hsp90 blocked the anti-proliferation activity of WE and HWE. BXPC-3 cells were pre-treated with scramble shRNA or Hsp90α/β shRNA. Then the Hsp90 knockdown clones were exposed to 5 μmol·L-1 WE and HWE or DMSO for 48 h, respectively. The clones expressed scramble shRNA were serviced as control. A: The clone formation of each group was assessed by crystal violent staining assay; B: The Hsp90 and Akt protein levels. β-Actin was loading control for Western blot assay. C: The percentage of cell proliferation. n = 3, x±s. ##P < 0.01 vs DMSO group |
传统植化提取分离以得到尽量多的化合物为首要目的, 但其中多数都不具有活性, 导致活性化合物筛选效率较低。目前从天然产物中发现活性化合物的研究已越来越多采用以靶点为导向的提取分离方式, 并辅以体外活性筛选技术, 以期从植物中得到针对某种特定靶点的活性组分[10]。如有研究以迈克尔受体反应为靶点从中药蜘蛛香中分离得到具有STAT3抑制活性的环氧环烯醚萜酯类有效成分[11]。本研究以体外抑瘤活性与诱导热休克效应双重机制作为筛选条件, 充分利用MTT法和萤光素酶报告基因技术简单、快速、直观、适合高通量筛选的特点, 实现筛选与分离紧密结合。相比其他以单一抑瘤活性为基础的筛选模式, 该方法能够更加快速地从大量流份中锁定目标产物。
本研究从苦蘵二氯甲烷部位中分离得到9个不同流份, 发现其中4号与5号流份具有较强的胰腺癌杀伤活性并且可以增强HSE萤光素酶活性。其中4号流份物质量较大, 活性更强, 提示该流份中可能含有靶向热休克蛋白且杀伤胰腺癌细胞的有效成分。进一步从4号流份分离得到5个化合物, 经鉴定其中A与B化合物分别为内酯类麦角甾烷化合物WE和HWE。WE和HWE属于醉茄内酯类甾体化合物, 多分布于Solanum cilistum[12]和Withania somnifera[13]等茄科植物, 在酸浆属植物苦蘵中鲜有发现。研究显示WE可通过增强TRAIL诱导的细胞凋亡抑制肾癌细胞增殖[14]; HWE可通过抑制组蛋白修饰和Hsp90客户蛋白表达诱导细胞凋亡[15], 从而杀伤肿瘤细胞增殖。体外活性筛选实验显示WE和HWE均可显著增强HSE萤光素酶活性, 提示这两个化合物可能是苦蘵二氯甲烷部位中靶向Hsp90蛋白的活性成分, 然而WE和HWE靶向Hsp90蛋白的分子机制尚不明确。
分子机制研究显示, WE和HWE可诱导Hsp90形成无功能的二聚体, 并下调Hsp90客户蛋白Akt表达。WE和HWE分子在甾体母核A环含有α, β-不饱和羰基结构, 被称为“迈克尔反应”受体, 具有该类结构的分子容易与Hsp90蛋白分子C端丰富的半胱氨酸残基形成共价键结合[16]。如同样含有“迈克尔反应”受体的醉茄内酯类化合物tubocapsenolide A[17]和withaferin A[18]可与Hsp90蛋白分子催化活性位点直接共价结合从而抑制其活性。因此, WE和HWE可能也是通过其α, β-不饱和羰基结构与Hsp90蛋白分子的半胱氨酸残基形成共价键结合, 从而诱导Hsp90分子形成无活性二聚体结构[19]。在肿瘤细胞中, Hsp90蛋白主要通过与众多客户蛋白以及分子伴侣形成超分子复合体, 起到修复客户蛋白活性的作用[20]。原癌基因Akt是Hsp90重要的客户蛋白之一, 也是Hsp90信号通路下游重要的生物标志物[21]。若Hsp90与小分子化合物结合形成无活性二聚体结构, 则无法与客户蛋白Akt和分子伴侣形成超分子复合体结构, 从而导致Akt蛋白无法修复而经蛋白酶体途径降解[18]。
为了进一步验证WE和HWE靶向Hsp90蛋白与抑制胰腺癌细胞增殖直接相关, 采用shRNA敲低BXPC-3细胞的Hsp90表达。由于Hsp90为肿瘤细胞生长的关键激酶, 干扰Hsp90表达可显著抑制客户蛋白表达以及肿瘤细胞增殖[22]。此时再用WE和HWE处理BXPC-3细胞, 虽仍可少量抑制肿瘤细胞增殖, 但与仅敲低Hsp90的对照组相比无显著性差异, 且未见Hsp90客户蛋白Akt表达进一步显著下调。该结果提示, WE和HWE抑制胰腺癌细胞增殖的作用至少部分与其抑制Hsp90蛋白直接相关。
综上, 本研究采用“靶点+活性”双重导向快速发现技术成功从苦蘵中筛选得到具有较强热休克诱导效应和杀伤胰腺癌细胞BXPC-3活性的单体化合物, 经结构鉴定为已知醉茄内酯类化合物WE和HWE, 该两个化合物在苦蘵中均少见报道。初步分子机制研究显示WE和HWE可能通过靶向Hsp90, 诱导其形成无活性二聚体, 并抑制客户蛋白分子Akt表达杀伤胰腺癌细胞。WE和HWE的体内抑瘤活性, 其靶向Hsp90蛋白的特异性结合位点以及抑制Hsp90蛋白活性的具体分子机制还有待下一步研究。
| [1] | Zhang SR, Jing W, Liu L, et al. New progress in basic research and diagnosis and treatment of pancreatic cancer in 2017[J]. Chin Oncol (中国癌症杂志), 2018, 28: 1–10. |
| [2] | Shrestha L, Bolaender A, Patel HJ, et al. Heat shock protein (HSP) drug discovery and development:targeting heat shock proteins in disease[J]. Curr Top Med Chem, 2016, 16: 2753–2764. DOI:10.2174/1568026616666160413141911 |
| [3] | Ding QH, Cheng Y, Chen WP, et al. Celastrol, an inhibitor of heat shock protein 90beta potently suppresses the expression of matrix metalloproteinases, inducible nitric oxide synthase and cyclooxygenase-2 in primary human osteoarthritic chondrocytes[J]. Eur J Pharmacol, 2013, 708: 1–7. DOI:10.1016/j.ejphar.2013.01.057 |
| [4] | Fan YJ, Liu Y, Zhang L, et al. C0818, a novel curcumin derivative, interacts with Hsp90 and inhibits Hsp90 ATPase activity[J]. Act Pharm Sin B, 2017, 7: 91–96. DOI:10.1016/j.apsb.2016.05.014 |
| [5] | Fang JJ, Zheng XL, Xia H, et al. Study on the chemical constituents and cytotoxic activity of Physalis angulata L[J]. Chin Trad Herb Drugs (中草药), 2017, 48: 1080–1086. |
| [6] | Hu YJ, Wang YQ, Wang YP, et al. Discussion on the selection, compatibility and quality control of the medicinal componens in traditional Chinese medicine[J]. Chin Trad Herb Drugs (中草药), 2016, 47: 2965–2971. |
| [7] | Pang WQ, Gao L, Dou YY, et al. Screening of natural small molecule IDO-1 inibitors with anti-tumor role[J]. Acta Pharm Sin (药学学报), 2017, 52: 1416–1423. |
| [8] | Joshi P, Misra L, Siddique AA, et al. Epoxide group relationship with cytotoxicity in withanolide derivatives from Withania somnifera[J]. Steroids, 2014, 79: 19–27. DOI:10.1016/j.steroids.2013.10.008 |
| [9] | Maldonado E, Alvarado VE, Torres FR, et al. Androstane and withanolides from Physalis cinerascens[J]. Planta Med, 2005, 71: 548–553. DOI:10.1055/s-2005-864157 |
| [10] | Quan NH, Kang YJ, Li DH, et al. Research progress of high-throughput screening technology for active ingredients of Chinese herbal medicine[J]. J Analy Sci (分析科学学报), 2017, 33: 741–746. |
| [11] | Yang B, Shen JW, Zhou DH, et al. Precise discovery of a STAT3 inhibitor from Eupatorium lindleyanum and evaluation of its activity of anti-triple-negative breast cancer[J]. Nat Prod Res, 2017, 31: 1–9. DOI:10.1080/14786419.2016.1166493 |
| [12] | Zhu XH, Ando J, Takagi M, et al. Six new withanolide-type steroids from the leaves of Solanum cilistum[J]. Chem Pharm Bull (Tokyo), 2001, 49: 161–164. DOI:10.1248/cpb.49.161 |
| [13] | Zhang H, Samadi AK, Cohen MS, et al. Anti-proliferative withanolides from the Solanaceae:a structure-activity study[J]. Pure Appl Chem, 2012, 84: 1351–1367. |
| [14] | Henrich CJ, Brooks AD, Erickson KL, et al. Withanolide E sensitizes renal carcinoma cells to TRAIL-induced apoptosis by increasing cFLIP degradation[J]. Cell Death Dis, 2015, 6: e1666. DOI:10.1038/cddis.2015.38 |
| [15] | Park EJ, Sang-Ngern M, Chang LC, et al. Induction of cell cycle arrest and apoptosis with downregulation of Hsp90 client proteins and histone modification by 4beta-hydroxywithanolide E isolated from Physalis peruviana[J]. Mol Nutr Food Res, 2016, 60: 1482–1500. DOI:10.1002/mnfr.201500977 |
| [16] | Nardai G, Sass B, Eber J, et al. Reactive cysteines of the 90-kDa heat shock protein, Hsp90[J]. Arch Biochem Biophys, 2000, 384: 59–67. DOI:10.1006/abbi.2000.2075 |
| [17] | Chen WY, Chang FR, Huang ZY, et al. Tubocapsenolide A, a novel withanolide, inhibits proliferation and induces apoptosis in MDA-MB-231 cells by thiol oxidation of heat shock proteins[J]. J Biol Chem, 2008, 283: 17184–17193. DOI:10.1074/jbc.M709447200 |
| [18] | Yu Y, Hamza A, Zhang T, et al. Withaferin A targets heat shock protein 90 in pancreatic cancer cells[J]. Biochem Pharmacol, 2010, 79: 542–551. DOI:10.1016/j.bcp.2009.09.017 |
| [19] | Sarkar S, Dutta D, Samanta SK, et al. Oxidative inhibition of Hsp90 disrupts the super-chaperone complex and attenuates pancreatic adenocarcinoma in vitro and in vivo[J]. Int J Cancer, 2013, 132: 695–706. DOI:10.1002/ijc.v132.3 |
| [20] | Xue NN, Jin J, Chen XG. Co-chaperones:regulated action in conformational functions of HSP90 and their actions in cancer[J]. Acta Pharm Sin (药学学报), 2017, 52: 1085–1090. |
| [21] | Belalcazar A, Shaib WL, Farren MR, et al. Inhibiting heat shock protein 90 and the ubiquitin-proteasome pathway impairs metabolic homeostasis and leads to cell death in human pancreatic cancer cells[J]. Cancer, 2017, 123: 4924–4933. DOI:10.1002/cncr.v123.24 |
| [22] | Yamada-Kanazawa S, Kajihara I, Fukushima S, et al. Inhibition of heat shock protein 90 exerts an antitumour effect in angiosarcoma:involvement of the vascular endothelial growth factor signalling pathway[J]. Br J Dermatol, 2017, 177: 456–469. DOI:10.1111/bjd.2017.177.issue-2 |
 2019, Vol. 54
2019, Vol. 54


